Bir görüntüleme mikroplakasında önceden dökülmüş poli (etilen glikol) (PEG) hidrojeller kullanılarak vaskülarize osteojenik kemik iliği nişinin basit bir şekilde kurulması
Bu Makalede
Özet
Kemik iliği vasküler nişinin in vitro bir modeli, mezenkimal ve endotel hücrelerinin önceden dökülmüş 3D PEG hidrojelleri üzerine tohumlanmasıyla oluşturulur. Nişlerin endotel ağları, ECM bileşenleri ve ALP aktivitesi kullanılan büyüme faktörüne bağlı olarak değişir. Platform, gelişmiş kanser modelleri için kullanılabilir.
Özet
Kemik ve kemik iliği oldukça vaskülarize ve yapısal olarak karmaşık organlardır ve kanser ve metastaz oluşumu için bölgelerdir. İlaç taraması ile uyumlu, vaskülarizasyon da dahil olmak üzere kemik ve kemik iliğine özgü fonksiyonları özetleyen in vitro modeller oldukça arzu edilir. Bu tür modeller, basit, yapısal olarak alakasız iki boyutlu (2D) in vitro modeller ile daha pahalı, etik açıdan zorlu in vivo modeller arasındaki boşluğu doldurabilir. Bu makalede, vaskülarize, osteojenik kemik iliği nişlerinin üretimi için mühendislik poli(etilen glikol) (PEG) matrislerine dayanan kontrol edilebilir üç boyutlu (3D) bir ko-kültür testi açıklanmaktadır. PEG matris tasarımı, kapsülleme gerektirmeyen basit bir hücre tohumlama adımı ile 3D hücre kültürlerinin geliştirilmesine izin verir, böylece karmaşık ortak kültür sistemlerinin geliştirilmesini sağlar. Ayrıca, matrisler şeffaftır ve cam tabanlı 96 delikli görüntüleme plakalarına önceden dökülür, bu da sistemi mikroskopi için uygun hale getirir. Burada tarif edilen tahlil için, insan kemik iliği kaynaklı mezenkimal stromal hücreler (hBM-MSC'ler), yeterince gelişmiş bir 3D hücre ağı oluşana kadar önce kültürlenir. Daha sonra, GFP eksprese eden insan umbilikal ven endotel hücreleri (HUVEC'ler) eklenir. Kültür gelişimini parlak alan ve floresan mikroskobu takip eder. hBM-MSC ağının varlığı, aksi takdirde oluşmayacak ve en az 7 gün boyunca stabil kalan vasküler benzeri yapıların oluşumunu destekler. Vasküler benzeri ağ oluşumunun kapsamı kolayca ölçülebilir. Bu model, kültür ortamını, ko-kültürün 4. ve 7. günlerinde artmış alkalen fosfataz (ALP) aktivitesi ile değerlendirildiği gibi, hBM-MSC'lerin osteojenik farklılaşmasını teşvik eden kemik morfogenetik protein 2 (BMP-2) ile destekleyerek osteojenik bir kemik iliği nişine doğru ayarlanabilir. Bu hücresel model, çeşitli kanser hücrelerini kültürlemek ve kemik ve kemik iliğine özgü vasküler nişlerle nasıl etkileşime girdiklerini incelemek için bir platform olarak kullanılabilir. Ayrıca, otomasyon ve yüksek içerikli analizler için uygundur, yani yüksek oranda tekrarlanabilir kültür koşulları altında kanser ilacı taramasına olanak tanır.
Giriş
Kemik ve kemik iliği, insan sağlığının merkezinde yapısal ve fonksiyonel olarak karmaşık organlardır. Bu, hematopoez ve kemik bakımını düzenleyen farklı nişlerin varlığı ile yansıtılmaktadır1. Sağlıklı kemik iliğinde, hematopoetik ve iskelet kök hücrelerinin yanı sıra soylarının korunması ve genişlemesinin farklı nişler tarafından kontrol edildiği artık yaygın olarak kabul edilmektedir. Bu nişler, osteosoy hücreleri, mezenkimal kök hücreler, endotel ve perivasküler hücreler, nöronal ve glial hücreler, adipositler, osteoklastlar, makrofajlar ve nötrofiller2 dahil olmak üzere çeşitli hücre tiplerini içerir. Şaşırtıcı olmayan bir şekilde, bu çoğunlukla vaskülatürle ilişkili nişler, çeşitli lösemi 3 tiplerinin gelişiminde de roloynar ve farklı kanserler için metastaz bölgesidir4. Kemik oluşumu, yeniden şekillenme ve kemik (kemik iliği) bakımındaki spesifik rolleri nedeniyle, kemikle ilişkili vaskülatür, vücudun başka yerlerinde bulunan vaskülatürden farklı farklı özel yapılara sahiptir 5,6,7. Bu nedenle sistemik olarak uygulanan anti-anjiyojenik veya vaskülatür modüle edici ilaçların bu özel ortamlarda farklı etkileri olabilir8. Bu nedenle, kemik ve kemik iliği fizyolojik özelliklerinin, kemik ve kemik iliği rejenerasyonunun ve terapötik tedavilere yanıtların korunmasında rol oynayan moleküler mekanizmaları araştırmak için modeller oldukça arzu edilir.
Klasik iki boyutlu (2B) doku kültürleri ve hayvan modellerini kullanan in vivo araştırmalar, kemik ve kemik iliği gelişiminde rol oynayan farklı hücrelerin ve moleküler oyuncuların rolleri hakkında paha biçilmez bir fikir vermiştir 9,10. İlgili insan hücreleriyle yüksek verimli deneylere izin veren modeller, bu son derece karmaşık sistemlerde seçilen parametrelerin nasıl modüle edileceğine dair anlayışımızı geliştirebilir.
Son on yılda, doku mühendisliğinden türetilen ilkeler 3D doku modelleri oluşturmak için kullanılmıştır11,12. Bunlar çoğunlukla, 3D mono veya ko-kültürler oluşturmak için dokuyla ilgili hücrelerin biyomateryallere kapsüllenmesine dayanıyordu13. En çok kullanılan biyomateryaller arasında fibrin 14, kollajen15 ve Matrigel16,17 bulunur ve bunların hepsi biyouyumludur ve birçok hücre tipinin büyümesi için uygun koşulları sağlar. Bu biyomalzemeler, in vivo18'de bulunan farklı vasküler nişlerin kilit yönlerini özetleyen in vitro modeller üretme yeteneğine sahiptir. Ayrıca, perfüze edilmiş vasküler kemik ve kemik iliği modelleri üretmek için mikroakışkan cihazların kullanılması, daha yüksek karmaşıklığa sahip in vitro modellerin üretilmesine katkıda bulunmuştur 19,20,21,22.
Doğal olarak oluşan biyomalzemelerin bileşimini kontrol etme ve özelliklerini mühendislik mühendisliği yapmadaki zorluk, öngörülebilir fiziksel, kimyasal ve biyolojik özelliklerle rasyonel olarak tasarlanabilen sentetik analogların geliştirilmesine ilham vermiştir23,24. Hücre bağlanmasını ve yeniden şekillenmesini kolaylaştırmak için RGD peptitleri ve matris metalloproteaz (MMP) bölünme bölgeleri ile işlevselleştirilen tam sentetik faktör XIII (FXIII) çapraz bağlı poli (etilen glikol) (PEG) bazlı hidrojeller geliştirdik25,26. Bu biyomalzemelerin modüler tasarımı, 3D vaskülarize kemik ve kemik iliği modellerinin oluşumu için koşulları optimize etmek için başarıyla kullanılmıştır27,28.
Daha fazla sayıda farklı kültür koşullarının ve yeni terapötiklerin test edilmesi için, daha yüksek verim kapasitesine sahip modeller gereklidir. Son zamanlarda, PEG hidrojelimizin FXIII çapraz bağlanmasının, elektrokimyasal bir işlemle kontrol edilebileceğini ve böylece derinlemesine bir hidrojel sertlik gradyanı oluştuğunu gösterdik29. Hücreler bu tür hidrojellerin üzerine eklendiğinde, iç kısımlara doğru göç ederler ve yavaş yavaş birbirine bağlı 3D hücresel ağlara dönüşürler30. Hücreleri, genellikle diğer 3D iskelelerde bulunan hidrojelin içine kapsülleme ihtiyacının ortadan kaldırılması, sadece deneysel tasarımı basitleştirmekle kalmaz, aynı zamanda karmaşık ortak kültür sistemleri oluşturmak için farklı zaman noktalarında farklı hücre tiplerinin sıralı olarak eklenmesine izin verir. Bu hidrojeller, cam tabanlı 96 delikli görüntüleme plakalarına önceden dökülmüş olarak mevcuttur, böylece 3D kültürlerin kurulmasını manuel ve otomatik hücre tohumlama protokolleri ile başarılabilir hale getirir. PEG hidrojellerinin optik şeffaflığı, platformu mikroskopi ile uyumlu hale getirir.
Burada, bu kullanıma hazır, sentetik tak ve çalıştır platformunda vaskülarize osteojenik nişlerin oluşturulması ve karakterizasyonu için basit bir yöntem sunuyoruz. İn vitro osteogenezi indüklemek için yaygın olarak kullanılan bir büyüme faktörü olan kemik morfogenetik protein-2 (BMP-2) ile vasküler ağların gelişiminin uyarılabileceğini, osteojenik farklılaşmanın ise fibroblast büyüme faktörü 2 (FGF-2) takviyesi ile önlenebileceğini gösterdik27,31. Oluşan ağlar, FGF-2 ile uyarılmış ağlara kıyasla genel görünüm, hücre ve ECM dağılımı açısından farklıdır. Ayrıca, osteojenik indüksiyonu belirteç olarak alkalen fosfataz kullanarak izledik. Bu belirtecin zaman içinde artan ekspresyonunu gösteriyoruz ve ifadeyi nitel ve nicel yöntemler kullanarak FGF-2 uyarılmış ağlardakiyle karşılaştırıyoruz. Son olarak, bu modelin oluşturulan nişlerinin iki potansiyel uygulama için uygunluğunu gösteriyoruz. İlk olarak, önceden oluşturulmuş nişlere bevacizumab ekleyerek ve varlığında vasküler ağların bozulmasını izleyerek kavram kanıtı ilaç duyarlılığı testi gerçekleştirdik. İkincisi, MDA-MB-231 meme kanseri ve U2OS osteosarkom hücrelerini önceden oluşturulmuş osteojenik nişlere ekledik ve nişlerin kanser hücreleri ile çevreleri arasındaki etkileşimleri incelemek için kullanılabileceğini gösterdik.
Protokol
Şekil 1'de aşağıdaki protokol bölümleri özetlenmektedir.
1. 3D stromal monokültürün kurulması
- hBM-MSC hücre süspansiyonunu hazırlayın.
- HBM-MSC'leri, 37 ° C'de bir inkübatörde% 10 FBS,% 1 penisilin-streptomisin ve 5 ng / mL FGF-2 ve nemlendirilmiş bir atmosferde% 5 CO2 ile desteklenmiş MEMa'da% 70-90'lık bir birleşme seviyesine yükseltin. Hücreler 6. pasaja kadar kullanılabilir.
- Hücreleri PBS ile yıkayın ve 37 ° C'de 3-5 dakika boyunca% 0.05 Tripsin-EDTA kullanarak ayırın. Bazal ortamla (MEMa% 10 FBS ve% 1 penisilin-streptomisin ile desteklenmiş) yıkayarak ayrılma işlemini durdurun. Asılı hücreleri 50 mL'lik bir konik santrifüj tüpünde toplayın.
- Bir hematositometre veya otomatik bir hücre sayacı kullanarak hücreleri sayın ve süspansiyondaki toplam hücre sayısını belirleyin.
- Hücreleri 5 dakika boyunca 200 x g'de santrifüjleme ile peletleyin. Supernatan'ı dikkatlice çıkarın.
- 1 x 107 hücre / mL stok çözeltisi konsantrasyonu elde etmek için hücreleri uygun bir bazal ortam hacminde yeniden askıya alın.
- İlgili büyüme faktörleri (FGF-2 ve BMP-2 gibi tanımlanmış konsantrasyonlarda, örneğin 0 ng/mL, 25 ng/mL, 50 ng/mL, 100 ng/mL veya 200 ng/mL) ile desteklenmiş gerekli bazal ortam hacmini içeren 50 mL konik santrifüj tüpleri hazırlayın. Kuyu başına 200 μL gereklidir. Hücre tohumlaması otomatik bir sıvı işleyici kullanılarak gerçekleştirilecekse, cihazın ölü hacmini de göz önünde bulundurun. Manuel hücre tohumlaması için,% 10'luk bir hacim fazlalığı yeterlidir.
- 1.5 x 105 hücre/mL'lik bir konsantrasyon elde etmek için hBM-MSC'leri stok çözeltisinden 1:66.67'lik bir seyreltmede ekleyin.
- Plakayı tohumlama için hazırlayın.
- 96 delikli hidrojel plakayı kaplayan polipropilen yapışkan filmi çıkarın.
- Hidrojelleri kaplayan depolama tamponunu dikkatlice aspire edin. Bu görev için bir mikroplaka yıkayıcı kullanın; ancak, manuel kullanım mümkündür.
- Manuel aspiratör veya çok kanallı pipet kullanırken, ucu kuyunun duvarına yaslayın ve tamponu aspire ederken yavaşça iç kuyucuğun kenarına doğru hareket ettirin. Bu, hidrojel yüzeyine zarar vermekten kaçınacaktır.
- Otomatik plakalı bir yıkayıcı kullanırken, aspirasyon nozullarını plaka taşıyıcısından en az 3,8 mm uzağa (bu, hidrojel plakanın iç halkasından 0,8 mm'ye karşılık gelir) ve kuyunun kenarına doğru ayarlayın. Daha ayrıntılı talimatlar ve 96 delikli hidrojel plakanın plaka çizimlerini edinmek için üreticinin el kitabına bakın.
- Hücrelerin homojen olarak dağıldığından emin olmak için iyice karıştırdıktan sonra adım 1.1.7'de hazırlanan hücre süspansiyonunun 200 μL / kuyucuğunu ekleyin. Tohumlama sırasında, substratın bir bölgesindeki hücrelerin düzensiz çökelmesini önlemek için, plakayı eğmeyin. Manuel tohumlama için, karışımı homojen tutmak için hücre süspansiyonunu (üç kuyucuk tohumladıktan sonra) periyodik olarak karıştırın. Otomatik tohumlama için, eşit sayıda hücre içeren hacimleri dağıtmak için dağıtmadan hemen önce serolojik bir pipetle karıştırın.
- Kültürleri nemlendirilmiş bir atmosferde 37 °C ve% 5 CO2'de tutun.
- Kültürlerin gelişimini, istediğiniz gibi 5x hedefle parlak alan mikroskobu ile izleyin. Eklenen hücre sayısını değerlendirmek için tohumlamadan yaklaşık 30 dakika sonra referans görüntüler alın.
2. 3D stromal-endotelyal hücre ko-kültürünün oluşturulması
- GFP-HUVEC hücre süspansiyonunu hazırlayın.
- 37 °C'de 30 dakika boyunca 0.02 M asetik asit içinde 150 μg / mL sıçan kuyruğu kollajen I'den oluşan bir çözelti ile kaplayarak HUVEC kültürü için şişeler hazırlayın. Kullanmadan önce PBS ile bir kez durulayın.
- GFP-HUVEC'leri EGM-2'de %80-%100 birleşme seviyesine yükseltin, 37 ° C'de bir inkübatörde %10 FBS ve nemlendirilmiş bir atmosferde %5 CO2 ile desteklenin. Hücreler 7. pasaja kadar kullanılabilir.
- Hücreleri PBS ile yıkayın ve 37 ° C'de 2-3 dakika boyunca% 0.05 Tripsin-EDTA kullanarak ayırın. Bazal ortamla (MEMa% 10 FBS ve% 1 penisilin-streptomisin ile desteklenmiş) yıkayarak ayrılma işlemini durdurun. Asılı hücreleri 50 mL'lik bir konik santrifüj tüpünde toplayın.
- Bir hematositometre veya otomatik bir hücre sayacı kullanarak hücreleri sayın ve süspansiyonda bulunan toplam hücre sayısını belirleyin.
- Hücreleri 5 dakika boyunca 200 x g'de santrifüjleme ile peletleyin. Supernatan'ı dikkatlice çıkarın.
- 1 x 107 hücre / mL stok çözeltisi konsantrasyonu elde etmek için hücreleri uygun bir bazal ortam hacminde yeniden askıya alın.
- Adım 1.1.6'da hBM-MSC'ler için açıklandığı gibi, ilgili büyüme faktörleri (FGF-2 ve BMP-2, örneğin 0 ng/mL, 25 ng/mL, 50 ng/mL, 100 ng/mL veya 200 ng/mL) ile desteklenmiş gerekli bazal ortam hacmini içeren 50 mL konik santrifüj tüpleri hazırlayın.
- GFP-HUVEC'leri, adım 1.1.7'de hBM-MSC'ler için açıklandığı gibi, 1,5 x 105 hücre/mL'lik bir konsantrasyon elde etmek için stok çözeltisinden 1:66,67'lik bir seyreltmede ekleyin.
- Ortamı, adım 1.2.2'de tampon çıkarma için açıklandığı gibi, stromal monokültürü içeren plakadan aspire edin.
- Adım 1.3'teki hBM-MSC ilavesi için açıklandığı gibi, adım 2.1.8'de hazırlanan GFP-HUVEC hücre süspansiyonunun 200 μL/kuyusunu ekleyin.
- Nemlendirilmiş bir atmosferde 37 °C ve% 5 CO2'de inkübe edin. Ortamı her 3-4 günde bir değiştirin.
- İstediğiniz gibi 5x objektif kullanarak parlak alan ve floresan mikroskobu ile kültürün gelişimini izleyin. Kültürleri, sırasıyla erken veya ara karakterizasyonlar için veya istenildiği gibi ortak kültürün 4. veya 7. gününe kadar koruyun.
3. Karakterizasyon prosedürü 1: Endotel hücre ağı oluşumunun ölçülmesi
- İstenilen zaman noktalarında, GFP-HUVEC'lerden GFP sinyalini, niceleme için uygun ayarları kullanarak floresan mikroskobu ile elde edin (yani, daha büyük görüş alanları için en iyi odak, yüksek kontrast ve düşük büyütme [örneğin, 5x]).
- Kontrastı daha da artırmak için aynı gün elde edilen tüm görüntüleri eşit şekilde önceden işleyin (örneğin, Fiji32 kullanarak). GFP sinyalinin kültür zamanı ile daha sönük hale gelebileceğini unutmayın; Bu nedenle, farklı günlerde elde edilen görüntülerin farklı işlemlere ihtiyacı olabilir.
- Fiji veya ImageJ kullanıyorsanız, aynı zaman noktasındaki tüm GFP kanal görüntülerini açın ve Parlaklık ve Kontrast menüsünü açın. Bir ara koşulu temsil eden bir görüntü seçin (en sönük ve en parlak sinyal değil) ve Otomatik seçeneğini belirleyerek kontrastı otomatik olarak ayarlayın. Ayarla'yı seçin ve Diğer Tüm Açık Görüntülere Yay'ı işaretleyin.
- Otomatik olarak seçilen aralığın geçerli zaman noktasının tüm görüntülerine uyup uymadığını görsel olarak değerlendirin ve gerektiğinde tüm görüntülere manuel olarak yeniden ayarlayın ve yeniden yayınlayın.
- Ayarlanan görüntüleri TIF dosyaları olarak kaydedin ve alınan diğer zaman noktaları için adım 3.2.1 ve adım 3.2.2'yi tekrarlayın.
- Aşağı yönde yapı tanımayı önlemek ve böylece doğru ağ tanımlamasını kolaylaştırmak için tüm görüntülere bir medyan bulanıklık filtresi (ör. 2048x2048 görüntüler için yarıçap 3) uygulayın. Gruplama (2x2) yaparak boyutu küçültün ve önceden işlenmiş tüm görüntüleri niceleme için gri tonlamalı RGB Color TIF dosyaları olarak bir klasöre kaydedin. Bu adımlar, yazarların istek üzerine paylaşacakları makrolar kullanılarak manuel olarak veya toplu iş modunda yapılabilir.
- ImageJ33 için Anjiyogenez Çözümleyicisi'ndeki Toplu İşlem modunu kullanarak 3.1-3.3 adımlarında oluşturulan klasördeki tüm görüntüleri analiz edin. Görüntülerin boyutuna ve kullanılabilir çalışma belleğine bağlı olarak, bu işlemin görüntü başına birkaç dakika sürebileceğini unutmayın.
- Tanınan yapıların ve orijinal görüntülerin bindirmelerini inceleyerek niceleme sonuçlarını doğrulayın. Algoritma, orijinal görüntüde yalnızca birkaç hücrenin görülebildiği veya hiç görülmediği yapay yapıları tanırsa, ön işleme parametrelerini ayarlayın ve orijinal görüntüleri yeniden analiz edin veya bu tür sorunlu alanları hariç tutun ve / veya görüntüleri analizden çoğaltın.
- Her bir numunenin değerlerini, analiz edilen alanın 1mm2'ye oranı ile çarparak elde edilen değerleri 1mm2'lik bir alana normalleştirin. Bu adım, farklı boyutlarda görüntüler kullanılıyorsa özellikle önemlidir.
- Toplam ağ uzunluğu, kavşak sayısı, segment sayısı, izole segment sayısı, dallanma aralığı ve ortalama ağ boyutu gibi çeşitli ağ parametrelerini analizden çıkarın ve bunları endotel ağını farklı zaman noktalarında ve farklı kültür koşullarında karakterize etmek için kullanın.
4. Karakterizasyon prosedürü 2: ECM birikiminin değerlendirilmesi
- İstenilen bitiş zaman noktalarında, immünofloresan kullanarak ECM birikimini değerlendirin. Aşağıda açıklandığı gibi, kültürün son 6 saati boyunca veya fiksasyondan sonra kültür ortamının 100 μL'sinde çeşitli ECM moleküllerine karşı birincil antikorlar ekleyin.
- Kültürleri bir kez RT'de 5 dakika boyunca 200 μL / PBS kuyusu ile yıkayın ve RT'de 30 dakika boyunca kimyasal bir duman davlumbazının altında 100 μL / kuyu% 4 paraformaldehit ile sabitleyin. Sabit kültürleri RT'de her seferinde 5 dakika boyunca üç kez 200 μL / PBS kuyusu ile yıkayın ve 200 μL / PBS kuyusunda 4 ° C'de saklayın veya hemen bir sonraki adıma geçin.
- Fiksasyondan sonra ECM moleküllerine karşı primer antikorlarla inkübe etmeden önce, sabit kültürleri RT'de 30 dakika boyunca bloke edici bir çözelti olarak PBS'de 200 μL/kuyu% 1 BSA ile inkübe edin.
- Bloke edici çözeltiyi aspire edin ve PBS'de %1 BSA'da 100 μL/kuyu birincil antikor çözeltisi ile 4 °C'de bir gecede inkübe edin. RT'de sırasıyla 5 dakika, en az 3 saat ve 5 dakika boyunca üç kez 200 μL / PBS ile yıkayın.
NOT: Uzun yıkama adımı, bağlanmamış antikorun hidrojelden tamamen difüzyonu için gereklidir.
- Bloke edici çözeltiyi aspire edin ve PBS'de %1 BSA'da 100 μL/kuyu birincil antikor çözeltisi ile 4 °C'de bir gecede inkübe edin. RT'de sırasıyla 5 dakika, en az 3 saat ve 5 dakika boyunca üç kez 200 μL / PBS ile yıkayın.
- Hücre içi karşı boyalar da dahil olmak üzere ikincil boyama çözeltisinin penetrasyonunu kolaylaştırmak için, kültürlerin hücresel yoğunluğuna bağlı olarak, RT'de 30-90 dakika boyunca PBS'de% 0.3 Triton X-100 ve% 1 BSA kullanarak kültürleri geçirgenleştirin.
NOT: Hücre içi moleküllerin antikor bazlı boyanması için, bu adım, adım 4.1.2'de açıklanan birincil antikor ile inkübasyondan önce gerçekleştirilmelidir. - İlgili ikincil antikorları ve karşı boyaları içeren ikincil boyama çözeltilerini istediğiniz gibi hazırlayın (örneğin, DAPI gibi bir nükleer leke ve faloidin-rodamin gibi bir sitoiskelet boyası).
- PBS'de %0,1 Triton X-100, %1 BSA ve karşı boyalardan (örneğin, 1 μg/mL DAPI ve 1:4.000 faloidin-rodamin) oluşan bir boyama tamponu hazırlayın ve önerilen seyreltmelerde ilgili ikincil antikorları ekleyin.
- 100 μL/kuyucuk ikincil boyama çözeltisi ekleyin ve gece boyunca 4 °C'de inkübe edin. Birincil antikor inkübasyonundan sonraki prosedüre benzer şekilde, RT'de sırasıyla 5 dakika, en az 3 saat ve 5 dakika boyunca üç kez 200 μL / kuyucuk PBS ile yıkayın.
- Yapıların 3D çözümlenmesi için, cam tabandan başlayarak 2,5 μm'lik bir z-adımıyla 500 μm'lik bir son yüksekliğe ulaşan konfokal yığınlar elde edin, 10x objektif ve 0,75x dijital zoom kullanın. Fiji'de GFP ve F-aktin sinyalinin 3B yeniden yapılandırılmasını oluşturmak için, bir kompozit oluşturmadan ve Fiji 3D Görüntüleyici'yi kullanarak yeniden yapılandırmayı oluşturmadan önce her kanalı ayrı ayrı eşikleyin.
- İmmün boyamalardan biriken ECM'nin görselleştirilmesi için, 5 μm'lik bir z adımı, 10x objektif ve 1.5x dijital yakınlaştırma ile 100 μm yüksekliğinde konfokal yığınlar elde edin. Maksimum yoğunluk projeksiyonları oluşturun ve bir kompozit oluşturmadan önce Fiji'de her kanal için parlaklığı ve kontrastı ayrı ayrı ayarlayın.
- Hücre dışı ortamın doğrudan renk lekelerini gerçekleştirin.
- Paraformaldehit ile sabitlenmiş kuyucuklara 200 μL / kuyu Picrosirius Kırmızı boyama çözeltisi ekleyin ve RT'de 1 saat inkübe edin.
- Daha sonra, lekeli kuyucukları damıtılmış suyla beş kez yıkayın, ardından numune renk temizliğini izlerken 3-4 gün boyunca günde iki kez veya her iki günde bir yıkayın. Uzun yıkama adımları sırasında plakaları 4 ° C'de tutun (yani, 6 saati aşan herhangi bir şey).
- Renkli bir kamerayla donatılmış parlak alan mikroskobu kullanarak lekeli örneklerin görüntülerini elde edin ve koşullar arasında eşit beyaz dengesini koruyun. Numunelerin genel bakışını elde etmek için, tüm kuyucuğu taramak üzere düşük bir büyütme oranı (ör. 2,5x) kullanın. Mikroskop otomatik dikişi destekleyen bir yazılımla birlikte gelmiyorsa, manuel olarak yapın (örneğin, Fiji34'te Çift Yönlü Dikiş kullanarak).
NOT: Daha önce immünofloresan için kullanılan kuyucuklar, floresan görüntü alımının tamamlanması koşuluyla bunun için kullanılabilir. - Alizarin Kırmızısı boyama, yıkama ve görüntüleme işlemlerini gerçekleştirmek için 4.2.1-4.2.3 adımlarında Picrosirius Kırmızı boyama için açıklanan adımları izleyin.
5. Karakterizasyon prosedürü 3: ALP aktivitesini izleyerek osteojenik farklılaşmanın değerlendirilmesi
- Farklı kültür bitiş zaman noktalarında (örneğin, ko-kültürün 4. günü ve 7. günü), 5-bromo-4-kloro-3-indolil fosfat (BCIP) / nitro mavi tetrazolyum (NBT) boyaması kullanarak ALP aktivitesini kantitatif olarak değerlendirin.
- Üreticinin talimatlarını izleyerek hazırlanması gereken BCIP/NBT substrat çözeltisi ile inkübe etmeden önce kültürleri 200 μL/kuyucuk PBS ile bir kez yıkayın. Renk gelişimini periyodik olarak izlerken 37 ° C'de inkübe edin. Renk osteojenik olmayan koşullarda gelişmeye başladığında, adım 4.1.1'de açıklandığı gibi% 4 paraformaldehit ile sabitlemeden önce hemen 200 μL / PBS kuyusu ile bir kez yıkayın.
- Picrosirius Kırmızı boyama için adım 4.2.3'te açıklandığı gibi lekeli örneklerin renkli görüntülerini alın.
- Farklı kültür bitiş zaman noktalarında (örneğin, ortak kültürün 4. günü ve 7. günü), hücre lizatlarındaki ALP aktivitesini ölçün.
- 37 ° C'de 200 μL / % 0.25 Tripsin-EDTA kuyusu ile inkübe etmeden önce kültürleri 200 μL / PBS kuyusu ile üç kez yıkayın. Her 10 dakikada bir, sindirimi kolaylaştırmak için yukarı ve aşağı kuvvetli bir şekilde pipetleyerek kültürleri çalkalayın ve standart bir hücre kültürü mikroskobu ile kültür morfolojisini izleyin.
- Kuyucuklarda uzun hücresel yapılara sahip olmayan sıvı, tek hücreli bir süspansiyon elde edildikten sonra (tipik olarak 20-30 dakika sonra), numuneleri 2 mL tüplere aktarın, Tripsin'i inhibe etmek için 200 μL MSC bazal ortam ekleyin ve alınan hücreleri pelet haline getirmek için 5 dakika boyunca 500 x g'de santrifüj yapın. Süpernatanı boşaltın ve peletleri -80 ° C'de dondurun veya doğrudan adım 5.2.3'e geçin.
- Adım 5.2.2'de elde edilen hücre peletlerini çözün ve buz üzerinde 30 dakika boyunca 0.56 M 2-Amino-2-metil-1-propanol,% 0.2 Triton X-100, pH 10'dan oluşan 500 μL lizis tamponu ile inkübe edin. Daha sonra, 4 ° C'de 10 dakika boyunca 16.100 x g'de santrifüj yapın ve numuneleri buz üzerinde tutun. Adım 5.2.7'de açıklanan ölçümlerden sonra, numuneleri -20 ° C veya -80 ° C'de dondurun veya adım 5.2.8'de açıklandığı gibi doğrudan DNA nicelemesine devam edin.
NOT: Lizis tamponu önceden hazırlanabilir, steril filtrelenebilir ve 4 °C'de saklanabilir. - Lizis tamponunda 20 mM, 4-Nitrofenil fosfat, disodyum tuzu, hekzahidrat ve 4 mMMgCl2'den oluşan ALP reaktifini hazırlayın.
NOT: Bu çözeltiyi niceleme gününde taze olarak hazırlamak en iyisidir. - Herhangi bir peletlenmiş kalıntıyı rahatsız etmeden, adım 5.2.3'te hazırlanan hücre lizat süpernatantının 50 μL'sini, standart, şeffaf, doku kültürü 96 delikli bir plakanın kuyucuklarına kopyalar halinde dağıtın. Lizis tamponunu boş kontroller olarak iki kuyucuğa ekleyin.
- Çok kanallı pipetle, adım 5.2.5'te doldurulan kuyucuklara 50 μL/kuyucuk ALP reaktifi ekleyin. Plakayı kısaca çalkalayın ve ışıktan korunan 10 dakika boyunca 37 ° C'de inkübe edin. ALP aktivitesi daha yüksek olan kuyular sarı görünecektir. Çok kanallı pipet kullanarak 100 μL/kuyucuk 1 M NaOH ekleyerek reaksiyonu durdurun.
- Bir plaka okuyucu kullanarak optik yoğunluğu 410 nm'de okuyun. Teknik kopyaların ortalamasını alın ve boş denetimlerin ortalamasını çıkarın.
- Önceki adımlarda belirlenen ALP aktivitesini toplam hücre sayısına karşı normalleştirmek için DNA nicelleştirmesi yapın. Burada, floresan ölçümlerine dayanan bir yöntem açıklanmaktadır, ancak hücre lizatlarında DNA niceliği için başka herhangi bir yöntem tahlil ile uyumludur. DNA nicelemesi için gerekli reaktifleri ve DNA standartlarını, üreticilerin talimatlarına göre ticari olarak temin edilebilen kitleri kullanarak hazırlayın.
NOT: DNA standartlarının hazırlanmasında lizis tamponunun kullanılması önerilir. - Adım 5.2.3'te açıklanan ALP ölçümü için kullanılan numuneler dondurulmuşsa, bunları çözün, 4 ° C'de 2 dakika boyunca 16.100 x g'de santrifüj edin ve buzun üzerine yerleştirin. Herhangi bir pelet döküntüsünü rahatsız etmeden, hücre lizat süpernatantının 50 μL'sini siyah 96 delikli bir plakanın kuyucuklarına kopyalar halinde dağıtın. Numuneleri -20 °C veya -80 °C'de dondurun ve gerekirse ALP ve DNA nicelemelerini tekrarlayın. DNA standartlarını kopyalar halinde ekleyin.
- Çok kanallı pipetle, 50 μL DNA boyama maddesi ekleyin, inkübe edin ve üreticinin talimatlarına göre floresan yoğunluğunu okuyun. Standart eğri değerlerini kullanarak, ölçülen yoğunluk değerlerinin DNA konsantrasyonlarına dönüşümünü belirleyin ve uygulayın.
- Adım 5.2.7'de elde edilen ALP değerlerini, her bir numunenin ilgili DNA konsantrasyonuna bölerek normalleştirin.
6. Uygulama 1: İlaç duyarlılık tahlillerinin yapılması
- Endotel ağları tamamen geliştiğinde (tipik olarak stromal-endotelyal hücre ko-kültürlerinin 4. gününde), taze kültür ortamındaki kültürlere bevacizumab gibi anti-anjiyojenik bileşikler ekleyin ve aktivitelerini zaman içinde ve farklı koşullar altında test edin (örneğin, farklı FGF-2 veya BMP-2 konsantrasyonları).
- Bu noktaya kadar ilgili kültürler için kullanılan aynı büyüme faktörlerini içeren taze kültür ortamı hazırlayın.
- İlgili bileşiğin seyrelticinden oluşan bir kontrol çözeltisi hazırlayın (örneğin, bevacizumab için: 60 mg / mL α-trehaloz dihidrat, 0.4 mg / mL Tween20, 5.8 mg / mL sodyum fosfat, monobazik ve monohidrat ve 1.2 mg / mL sodyum fosfat dibazik, susuz) ve steril filtreleyin.
- İlgili bileşiği istenen konsantrasyonda (örneğin, 10 μg / mL bevacizumab) ve kontrol çözeltisinin eşit hacmini, sırasıyla test ve kontrol koşulları için belirlenen kültür ortamına ekleyin.
- Bu noktaya kadar ilgili kültürler için kullanılan aynı büyüme faktörlerini içeren taze kültür ortamı hazırlayın.
- Ortamı kültürden aspire edin ve adım 6.1.1'de taze hazırlanmış ortamın 200 μL / kuyusunu ekleyin. Test edilecek bileşik için uygun bir süre boyunca inkübe edin (örneğin, bevacizumab için: 2 gün). Kültür gelişimini izleyin ve endotel ağlarını bölüm 3'te açıklandığı gibi karakterize edin. GFP görüntülerini ve adım 3.7'de açıklanan analizden çıkarılan kantitatif ağ parametrelerini kullanarak bileşiğin anjiyogenezi inhibe etmede veya önceden oluşturulmuş yapıları ablatlamadaki etkinliğini değerlendirin.
7. Uygulama 2: Çeşitli kanser hücresi tipleri ile gelişmiş ko-kültür sistemlerinin kurulması
- Ko-kültürün 4. gününde, endotel ağları çoğunlukla kurulduğunda, taze kültür ortamındaki kültürlere MDA-MB-231 veya U2OS kanser hücreleri gibi diğer hücre tiplerini ekleyin.
- Kanser hücrelerini, GFP etiketli HUVEC'lerden ve ortak kültürlerdeki etiketli olmayan hBM-MSC'lerden ayırt edebilmek için üreticinin talimatlarına göre hücre uyumlu bir canlı boya kullanarak etiketleyin.
- Bu noktaya kadar ilgili kültürler için kullanılan aynı büyüme faktörlerini içeren taze kültür ortamında 1.5 x 104 hücre / mL konsantrasyonunda kanser hücrelerinin bir süspansiyonunu hazırlayın.
- Kültür gelişimini ve kanser hücresi lokalizasyonunu istediğiniz gibi izleyin.
NOT: Kanser tipine, aktivitesine ve çevresine bağlı olarak, stromal-endotel hücre ko-kültürlerinde vasküler yapılara ulaşmaları birkaç gün sürebilir (örneğin, MDA-BM-231 ve U2OS için 2 gün). Bu nedenle, kanser-vasküler hücre etkileşimlerini görselleştirmek için hızlandırılmış görüntüleme buna göre zamanlanmalıdır.
Temsili Sonuçlar
Vasküler niş kültürler, hBM-MSC'lerin ve GFP-HUVEC'lerin 96 delikli bir görüntüleme plakası içinde sertlik gradyanı olan önceden dökülmüş PEG bazlı hidrojeller üzerine sırayla tohumlanmasıyla oluşturulmuştur (Şekil 1). Kültürler canlı epifloresan mikroskopi ile uzunlamasına izlendi ve seçilen zaman noktalarında daha da karakterize edildi. Hücre dışı kompartman direkt renk boyamaları ve antikor bazlı boyamalar ile değerlendirildi. ALP aktivitesi, üretilen nişlerden hücrelerin alınması ve lize edilmesinden sonra ölçüldü. Ayrıca, bu platformun anti-anjiyojenik ilaç duyarlılık testleri için uygunluğunu ve kanser ko-kültür modellerinin temelini oluşturuyoruz.
hBM-MSC'lerin ve GFP eksprese eden HUVEC'lerin ko-kültürleri, protokolde açıklandığı gibi, büyüme faktörlerinin yokluğunda veya 50 ng / mL'de FGF-2 veya BMP-2 varlığında 3 x 104 hücre / kuyu tohumlanarak oluşturulmuştur. Erken bir zaman noktasından itibaren, kültürler arasındaki farklılıklar hem parlak alan hem de sadece GFP-HUVEC'leri gösteren floresan görüntülerden gözlemlenebilir (Şekil 2A). Aynı alanları uzunlamasına gözlemleyerek, FGF-2'nin varlığında daha hızlı bir gelişme gibi kültürlerin gelişimindeki farklılıklar not edilebilir. Genel olarak, kültürler herhangi bir büyüme faktörünün yokluğunda, her iki tipte de daha az hücrenin yayılması ve hücresel alanların varlığı ile daha az gelişmiş görünüyordu. Buna karşılık, parlak alan görüntüleri BMP-2'nin varlığında en yoğun kültürleri gösterdi. Bununla birlikte, hem büyüme faktörü içeren koşullarda vasküler benzeri ağlar oluşmuş hem de en yaygın ve birbirine bağlı ağlar FGF-2 ile oluşturulmuştur. Gözlemlenen bu farklılıklar, ImageJ için Anjiyogenez Analizörü kullanılarak da ölçülebilir. Gerçekten de, toplam ağ uzunluğu FGF-2 varlığında en yüksek, büyüme faktörlerinin yokluğunda en düşüktü (Şekil 2B). Ağlardaki dallanma noktalarını gösteren kavşakların sayısı, toplam uzunlukla aynı eğilimi izlemiştir (Şekil 2C). Tersine, her iki büyüme faktörü içeren koşul, herhangi bir büyüme faktörü olmayan duruma göre daha yüksek karşılıklı bağlantıya işaret eden önemli ölçüde daha az izole segmente sahipti (Şekil 2D). Ek olarak, 3D konfokal görüntüleme, FGF-2 ile uyarılmış durumda derinlik açısından daha güçlü endotel hücre penetrasyonu ortaya koymuştur (Şekil 2E).
hBM-MSC / GFP-HUVEC ko-kültürleri, ECM bileşenleri için sabitlenmeden ve boyanmadan önce FGF-2 veya BMP-2 varlığında 7 gün boyunca muhafaza edildi. Konfokal lazer tarama mikroskobu ile takip edilen immünositokimyasal boyamalar, büyüme faktörü takviyesinin tipine bağlı olarak kültür morfolojisinde çarpıcı farklılıklar göstermiştir (Şekil 3A). FGF-2 ile kültür, hem endotel hem de mezenkimal hücrelerde yoğun olan yoğunlaştırılmış mikrovasküler benzeri yapılar halinde organize edilirken, BMP-2'nin varlığında, hBM-MSC'ler, daha geniş F-aktin-pozitif ve GFP-negatif alanlardan da anlaşılacağı gibi, çok daha geniş bir alana yayıldı. ECM proteinleri fibronektin ve kollajen I benzer şekilde lokalize edilirken, laminin ve kollajen IV endotel yapıları etrafında daha yoğunlaşmıştır. Bununla birlikte, endotel yapıları etrafındaki bu artan konsantrasyon, FGF-2 varlığında BMP-2 varlığından çok daha belirgindi. Antikor bazlı boyamalara ek olarak, ECM'nin genel fibrotik durumunu değerlendirmek için doğrudan renk boyamaları yapıldı (Picrosirius Kırmızı boyama; Şekil 3B) ve ECM'de Ca'nın birikmesi (Alizarin Kırmızı boyama; Şekil 3C) oluşan nişlerden. Picrosirius Kırmızı boyama, BMP-2 ile kültürlenen nişlerde daha güçlü ve daha kapsamlıydı ve Alizarin Kırmızısı boyama da aynı eğilimi izledi.
Daha sonra, kültürler erken osteojenik bir belirteç olarak ALP aktivitesi değerlendirilerek osteojenik potansiyelleri açısından karakterize edildi. Ko-kültürün 4. ve 7. günlerinde, hidrojelleri Tripsin ile sindirerek nişlerden hücreler alındı. ALP aktivitesini ölçmek için, alınan hücreler lize edildi ve bir pNPP testi yapıldı. Elde edilen değerler, koşullar arasında hücre sayılarındaki potansiyel farklılıkları hesaba katmak için her bir numune için toplam DNA'ya karşı normalleştirildi. Gerçekten de, koşulların DNA içeriği arasındaki küçük farklılıklar gözlemlenebilir ve en az hücre, herhangi bir büyüme faktörü olmadan (gösterilmemiş) durumdan alınmıştır. Bununla birlikte, normalleştirilmiş ALP aktivitesi, daha yüksek BMP-2 konsantrasyonları ve 100 ng / mL'de bir plato ile artan aktivite eğilimi ile koşullar arasında büyük ölçüde değişmiştir (Şekil 4A, B). En düşük aktivite seviyeleri 50 ng/mL FGF-2 içeren durum için belirlendi. Değerlendirilen her iki zaman noktası için de benzer eğilimler gözlemlenebilirken, kültürde tüm değerler zaman içinde 4. günden 7. güne kadar önemli ölçüde artmıştır. Kantitatif analize ek olarak, ALP aktivitesi, BCIP / NBT substrat dönüşümüne dayanan doğrudan renk boyama kullanılarak kalitatif olarak görselleştirilebilir. BMP-2 varlığında FGF-2'ye kıyasla daha yaygın ve daha yoğun mor boyanma gözlendi (Şekil 4C).
Karakterize osteojenik nişlerin iki potansiyel uygulamasını göstermek için, bir kavram kanıtı ilaç duyarlılığı çalışması ve kanser ko-kültürleri yapılmıştır. İlaç duyarlılığı testi için, taze BMP-2 içeren kültür ortamına bevacizumab veya bevacizumab formülasyonunun seyrelticisinden oluşan bir kontrol çözeltisi ilave edildi. 4. günde, 50 ng / mL BMP-2 varlığında kurulan ağlar oluşturulduğunda, düzenli ortam değişimi sırasında kontrol çözeltisi veya bevacizumab içeren ortam eklendi ve kültürler floresan görüntüleme kullanılarak izlendi. 10 μg / mL bevacizumab ilavesi, daha önce oluşturulmuş ağın geri çekilmesine veya ablasyonuna yol açarken, kontrol koşulu orta değişimden 2 gün sonra hala geniş ağlara sahipti (Şekil 5A, B). Bu değişiklikler, günlük olarak elde edilen floresan görüntüleri üzerinde ImageJ için Anjiyogenez Analizörü kullanılarak ağların toplam uzunluğunun izlenmesiyle de ölçülebilir (Şekil 5C). Alternatif olarak, bevacizumab veya başka bir bileşik, ağların oluşumu üzerindeki etkilerini değerlendirmek için ortak kültürün başlangıcından itibaren de eklenebilir. Bevacizumab durumunda, bu endotel ağlarının oluşumunu tamamen engelledi (gösterilmedi).
İkinci uygulama için, MDA-MB-231 meme kanseri veya U2OS osteosarkom hücreleri, 50 ng / mL BMP-2 içeren taze kültür ortamında 1.5 x 103 hücre / kuyu yoğunluğunda 4. gün ko-kültürlerine eklendi. Onları GFP etiketli HUVEC'lerden ve etiketlenmemiş hBM-MSC'lerden ayırmak için, kanser hücreleri osteojenik nişlere tohumlamadan hemen önce CellTrace FarRed ile inkübe edildi. Kültürler floresan mikroskobu ile izlendi; Başlangıçta, kanser hücrelerinin çoğu substratın yüzeyine yakın lokalize oldu, ancak 2 gün sonra, vasküler ko-kültürleri içeren katmanlara daha yakın bir yerde bulunabilirler. Böylece, 2. gün, kanser hücreleri ile vasküler niş içindeki hücreler arasındaki etkileşimlerin dinamiklerini göstermek için hızlandırılmış mikroskopinin başlangıç noktası olarak seçildi. İlginçtir ki, MDA-MB-231 hücreleri endotel yapılarına hem yaklaşırken hem de onlardan uzaklaşırken görülebiliyordu ve bu nedenle muhtemelen çevrelerini araştırıyor veya yeniden şekillendiriyorlardı (Şekil 5D). CellTrace FarRed'i kanser hücreleri için bir etiket, GFP'yi HUVEC'ler için bir etiket olarak ve F-aktin için ek boyama kullanarak, tüm hücre tipleri konfokal lazer tarama mikroskobu kullanılarak ayırt edilebilir (Şekil 5E).
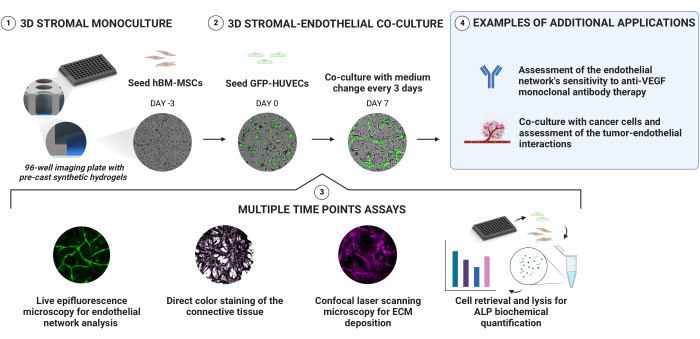
Şekil 1: Vaskülarize, osteojenik nişlerin güvenilir üretimi için basit bir yaklaşım. Derinlemesine sertlik gradyanına sahip önceden dökülmüş sentetik hidrojeller, doğrudan kapsüllemeye gerek kalmadan sıralı hücre tohumlaması yoluyla 3D kültürlerin üretilmesine izin verir. hBM-MSC'ler, GFP eksprese eden HUVEC'ler eklenmeden önce 3 gün boyunca önceden kültürlenir. Kültürler uzunlamasına parlak alan ve GFP sinyalleri alınarak izlenir. Seçilen zaman noktalarında, nişler ECM birikimi ve osteojenik durumları için daha fazla değerlendirilir. Alkalen fosfataz aktivitesi, doğrudan renk boyama yoluyla ve nişlerden hücreleri alarak ve hücre lizatları üzerinde bir pNPP testi yaparak değerlendirilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
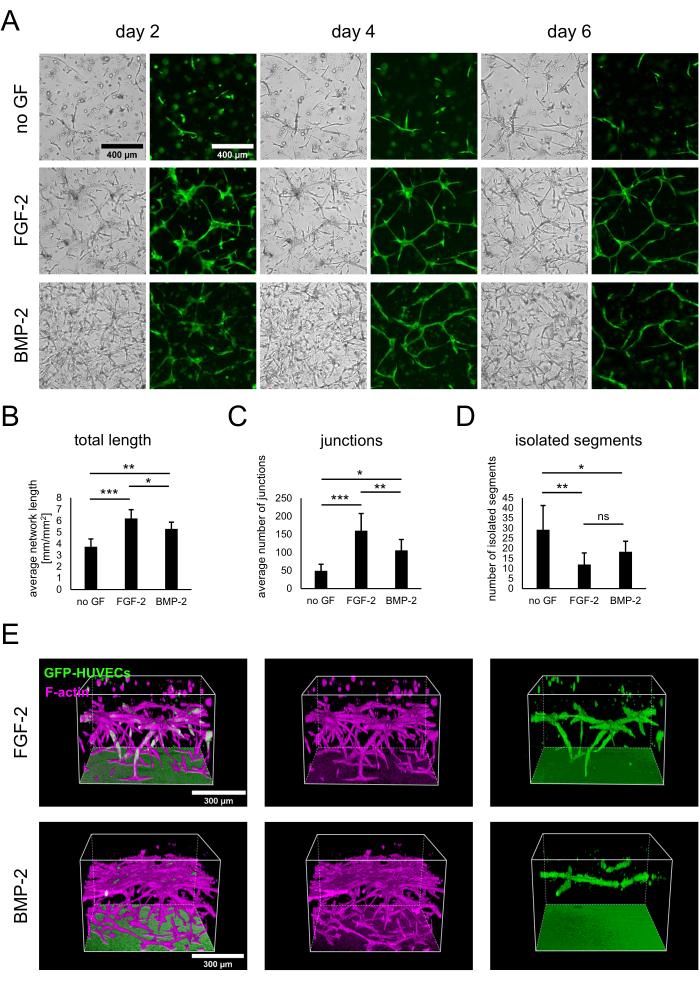
Şekil 2: FGF-2 veya BMP-2 ile vasküler benzeri ağların uyarılması. (A) Parlak alan ve floresan (GFP) görüntüleri, büyüme faktörlerinin yokluğunda veya FGF-2 veya BMP-2 varlığında yetiştirilen hücrelerin ko-kültürünün 2. gününde, 4. gününde ve 6. gününde, her ikisi de 50 ng / mL'de elde edildi. Ölçek çubuğu: 400 μm. (B-D) GFP-HUVEC ağlarının niceliklendirilmiş parametreleri, ortak kültürün 4. gününde görüntülendi, ImageJ için Anjiyogenez Analizörü kullanılarak analiz edildi. Veriler ortalama ± standart sapma olarak temsil edilir. İstatistiksel analiz GraphPad Prism 9.5.1 kullanılarak yapıldı. Dunnett'in çoklu karşılaştırma testi ile sıradan bir tek yönlü ANOVA, n ≥ 4 ile gerçekleştirildi; * P < 0.05; ** P < 0,01; P < 0.001. (E) FGF-2- (üst sıra) ve BMP-2- (alt sıra) uyarılmış koşullar için GFP ve F-aktin sinyallerinin konfokal yığınlarından (toplam yükseklik: 547.5 μm; z-adımı: 2.5 μm) üretilen üç boyutlu rekonstrüksiyonlar. Ölçek çubuğu: 300 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
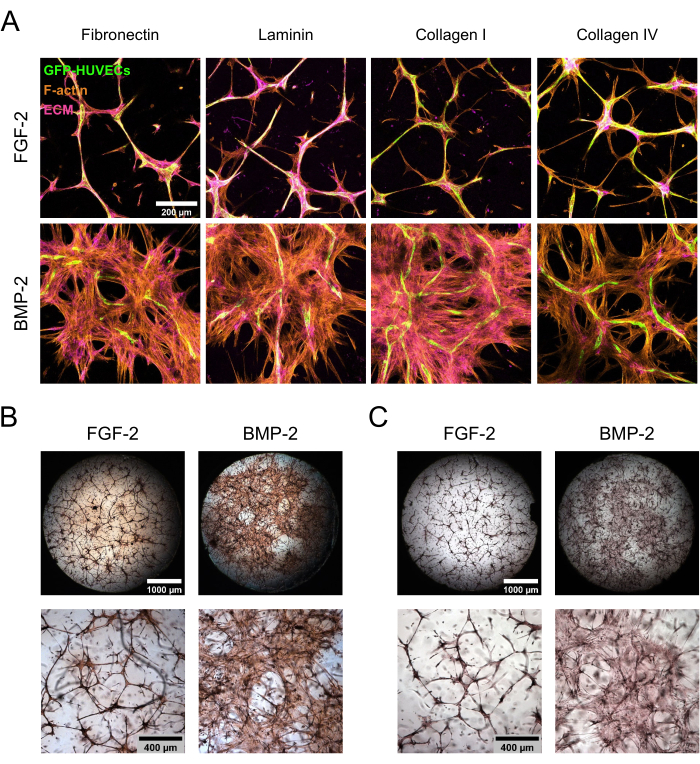
Şekil 3: BMP-2 ile lokalize olmayan hBM-MSC yayılımının ve ECM birikiminin indüksiyonu. (A-C) FGF-2 veya BMP-2 varlığında yetiştirilen 7 günlük ko-kültürler (A) immünofloresan veya (B,C) doğrudan renk boyamasına tabi tutuldu. (A) Kültürler F-aktin ve ECM proteinleri fibronektin, laminin, kollajen I ve kollajen IV için boyandı. Görüntüler, konfokal yığınların maksimum yoğunluk projeksiyonlarını göstermektedir (toplam yükseklik: 100 μm; z-adımı: 5 μm). Ölçek çubuğu: 200 μm. (B,C) Kültürler (B) Picrosirius Kırmızısı ve (C) Alizarin Kırmızısı kullanılarak boyandı. Üst sırada, 2,5x büyütmede (ölçek çubuğu: 1.000 μm) elde edilen görüntülerin dikişli, bütünsel genel bakışları, alt sıra ise 5x büyütmede (ölçek çubuğu: 400 μm) elde edilen bir görüş alanı gösterilmektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
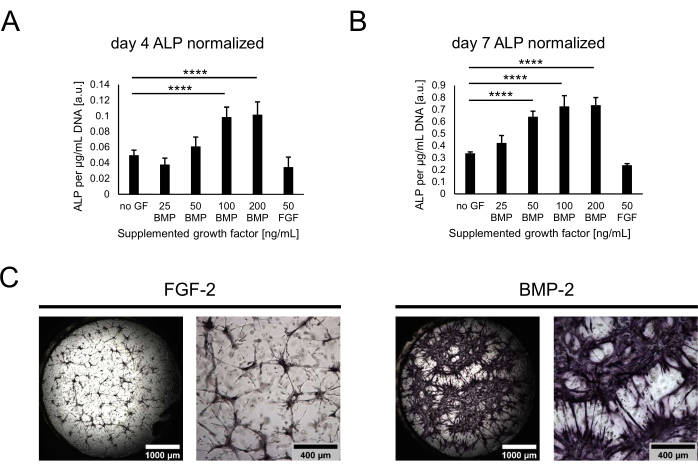
Şekil 4: BMP-2 kaynaklı ALP aktivitesinin doğrudan renk boyama yoluyla biyokimyasal değerlendirmesi. (A,B) ALP aktivitesi, büyüme faktörlerinin yokluğunda veya farklı konsantrasyonlarda BMP-2 varlığında veya (A) 4 gün boyunca 50 ng / mL'de FGF-2 varlığında yetiştirilen kültürlerin hücre lizatlarında belirlendi. (B)) 7 günlük ortak kültür. ALP aktivitesi, her lizat örneğinin DNA içeriğine normalleştirilmiş olarak gösterilir. Veriler ortalama ± standart sapma olarak temsil edilir. İstatistiksel analiz GraphPad Prism 9.5.1 kullanılarak yapıldı. Dunnett'in çoklu karşılaştırma testi ile sıradan bir tek yönlü ANOVA, n = 5 ile gerçekleştirildi; P < 0.0001. (C) 7 günlük ko-kültür için 50 ng/mL FGF-2 veya BMP-2 varlığında yetiştirilen nişlerde ALP aktivitesinin doğrudan renk boyaması. Sol taraftaki görüntüler, 2,5x büyütmede (ölçek çubuğu: 1.000 μm) elde edilen görüntülerin dikişli tüm iyi genel bakışlarını gösterirken, sağ taraftaki görüntüler 5x büyütmede (ölçek çubuğu: 400 μm) elde edilen bir görüş alanını göstermektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
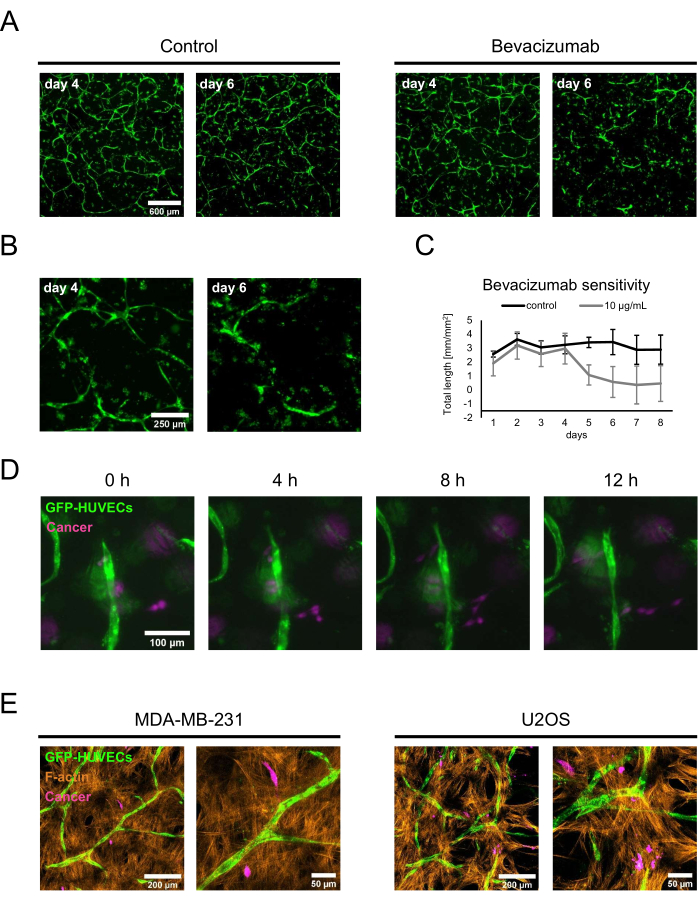
Şekil 5: İleri kanser modellerinde osteojenik, vaskülarize nişlerin kullanımı . (A) BMP-2 varlığında yetiştirilen kültürlerin GFP sinyalleri, 2 gün boyunca bir kontrol çözeltisi (solda) veya 10 μg / mL'de (sağda) bevacizumab eklenmeden önce eş-kültürün 4. gününde görüntülendi, ardından kültürler tekrar görüntülendi (ortak kültürün 6. günü). Ölçek çubuğu: 600 μm. (B) Bevacizumab ile muamele edilmiş kültürlerin daha yüksek büyütme görüntüleri A'da gösterilmiştir. Ölçek çubuğu: 250 μm. (C) A'da gösterildiği gibi endotel ağlarının toplam uzunluğu, günlük olarak elde edilen görüntülerden ImageJ için Anjiyogenez Analizörü kullanılarak ölçülmüştür; n ≥ 3. (D) BMP-2 varlığında yetiştirilen 4 günlük ko-kültürlere CellTrace FarRed etiketli MDA-MB-231 meme kanseri hücreleri eklenmiş ve kanser hücresi ilavesinden 2 gün sonra başlayarak hızlandırılmış görüntüler elde edilmiştir. Ölçek çubuğu: 100 μm. (E) D'de tanımlandığı gibi üretilen ve F-aktin için sabitlenmiş ve boyanmış üçlü eş-kültürlerin konfokal yığınlarının (toplam yükseklik: 70 μm; z-adımı: 2,4 μm) maksimum yoğunluk projeksiyonları. Solda: MDA-MB-231 meme kanseri hücrelerini içeren nişler; sağda: U2OS osteosarkom hücrelerini içeren nişler. Soldaki görüntüler için ölçek çubukları: 200 μm; Sağdaki görüntüler için ölçek çubukları: 50 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Burada, kemik ve kemik iliği biyolojisi araştırmalarında, doku mühendisliğinde ve kanser araştırmalarında çeşitli uygulamalara sahip olan tamamen sentetik ve kontrol edilebilir 3D PEG tabanlı bir matriste yüksek vaskülarize kemik ve kemik iliği nişlerinin in vitro bir modelinin kurulması için bir protokol açıklıyoruz. Bu model, RGD peptitleri ve MMP bölünme bölgeleri ile işlevselleştirilen sentetik bir PEG bazlı hidrojel üzerine kuruludur ve cam tabanlı 96 kuyucuklu görüntüleme plakaları30 üzerinde derinlemesine bir yoğunluk gradyanı ile dökülür. Bu tak ve çalıştır platformunun, hücreleri hidrojelin içine kapsüllemeye gerek kalmadan yüksek oranda birbirine bağlı 3D hücresel ağların kurulmasına izin verdiği gösterilmiştir. Daha önce tarif edilen hücre kapsülleme protokolüne benzer şekilde, bu çalışmada, hücre tipine özgü bir mikro ortam oluşturmak için substratın hücreye özgü bir ECM28 tarafından yeniden şekillendirilmesini gösteriyoruz. Böylece, bu yöntemle, ilaç tarama testleri ve yüksek içerikli analizler, yüksek oranda tekrarlanabilir, organotipik 3D kültür koşulları altında kolayca gerçekleştirilebilir. Cam tabanlı 96 delikli plakalar ve optik olarak şeffaf hidrojeller, platformu sıvı taşıma otomasyonu ve yüksek verimli mikroskopi ile uyumlu hale getirir.
Osteojenik vasküler kemik iliği nişi oluşturmanın ilk adımı, PEG hidrojel üzerinde en az 3 gün boyunca hBM-MSC'lerin ön kültürüdür. Bu süre zarfında, hidrojele bağlanırlar, nüfuz ederler ve hücre-hücre temasları ve ECM birikimi kurmaya başlarlar. hBM-MSC'leri tohumlamadan önce, depolama arabelleği çıkarılmalıdır. Hidrojel, 96 kuyucuklu görüntüleme plakasının standart kuyucuğu içindeki bir iç kuyunun içine yerleştirildiğinden, aspirasyon ucunu iç kuyu halkasına dokunana kadar kuyunun kenarına yerleştirmek güvenlidir. Bir vakum pompası, mümkün olan en düşük emme kuvvetine ayarlanmışsa aspirasyon için kullanılabilir. Alternatif olarak, tamponu hidrojel plakasından aspire etmek için nozul yüksekliği iç kuyucuk halkasının en az 0,8 mm yukarısına ayarlanmış otomatik bir plakalı yıkayıcı kullanılabilir. Sıvı elleçleme için otomasyonun kullanılması, hidrojel yüzeyine verilen hasarı en aza indirebilir ve elde edilen kültürlerin daha yüksek tekrarlanabilirliğine yol açabilir. Hidrojel yüzeyindeki küçük kusurlar, hücreler hidrojel üzerine yerleştikten sonra görünür hale gelir ve kusurlu hidrojel alanlarında daha düşük bir odak düzleminde görünür. Bu nedenle, 0. günde referans görüntülerin elde edilmesi, hücre tohumlama homojenliği ve hidrojel yüzey bütünlüğü için iyi bir kalite kontrolü görevi görür. Küçük hidrojel yüzey kusurları, kuyunun daha fazla kullanılmasını engellemezken, hücreler kusurlu alanlarda kümelenme eğilimindedir ve temsili olmayan desenlere dönüşebilir veya daha hızlı bir şekilde tek katmanlı hale geldikleri alt cama ulaşabilir. Bu kuyular kullanılırken/değerlendirilirken bu eserlere dikkat edilmelidir. Benzer hususlar, tahlilin tüm süresi boyunca gerçekleştirilen herhangi bir ortam değişikliği için de geçerlidir.
Protokolün ikinci adımı, GFP-HUVEC'lerin önceden oluşturulmuş hBM-MSC monokültürüne (ortak kültürün 0. günü) eklenmesini içerir. hBM-MSC tarafından biriktirilen ECM, endotel hücrelerinin büyümesi için büyük bir iskele sağlar; bu çalışmada, hBM-MSC şartlandırılmış ortamın varlığında bile, hidrojeller üzerinde sadece yuvarlak hücre kümeleri oluşturabilir (gösterilmemiştir). HBM-MSC kültürlerinde tohumlama üzerine, HUVEC'ler hücre kapsüllemesi27,28 tarafından üretilen ortak kültürlerde gözlenenlerle karşılaştırılabilir mikrodamar benzeri yapıları bütünleştirir ve oluşturur. Tipik olarak, iyi gelişmiş 3D mikrovasküler benzeri ağlar, ortak kültürden sonraki 4 gün içinde oluşur ve bu, GFP etiketli HUVEC'lerin kullanımı ile uzunlamasına izlenebilir. Bu yapılar kültürde en az 7 gün boyunca korunabilir, yani anti-anjiyojenik ilaçların taranması gibi tedavilere yanıt olarak vasküler ağ organizasyonundaki değişiklikleri takip etmek için yeterli zaman vardır. Endotel ağının morfolojik elemanları, GFP görüntülerini ImageJ33'ün Anjiyogenez Analizörü eklentisi gibi iyi kurulmuş araçlar kullanılarak bölümlere ayırarak toplu modda ölçülebilir ve parametreleri, örneğin ilaç etkinliğini ve farmakodinamiği değerlendirmek için kullanılabilir.
Birçok potansiyel uygulama için tarif edilen hücresel modelin önemli bir avantajı, plastisitesidir. Kültür ortamını farklı büyüme faktörleriyle desteklemek, ortak kültürün görünümünü değiştirebilir. Örneğin, mono ve ko-kültür dönemi boyunca BMP-2'nin varlığı, artmış ALP aktivitesi, hücre dışı kalsiyum birikimi, ECM montajı ve birikimi gösteren osteojenik bir vasküler niş oluşturur. Aksine, FGF-2 varlığında, osteojenik belirteçler yoktur ve ko-kültür daha az lateral hücre ilişkisi oluşturur, ancak daha belirgin 3D hücre büyümesi gösterir. FGF-2'nin ALP aktivitesini baskıladığı, BMP-2'nin ise büyüme faktörü tedavisine kıyasla daha güçlü ALP aktivitesi ortaya çıkardığı gerçeği, önceki gözlemlerle uyumludur27. Yine de, hBM-MSC stromal bileşenindeki bu büyük farklılıklara rağmen, mikrovasküler ağın kapsamı, bu çalışmada iki büyüme faktörü ile tedavi edilen koşullar için çok benzerdi. Kontrol kültürlerinde, belki de zayıf vaskülarize bir kemik iliği nişini temsil eden sadece birkaç kısa vasküler ağ oluşmuştur. Bu, kültür ortamına eklenen büyüme faktörlerinin tipine, konsantrasyonuna ve zamanlamasına basitçe değiştirilerek, karşılaştırmalı çalışmalar için gerekli olduğu gibi, iyi tanımlanmış bir dizi vaskülarize kemik iliği nişinin üretilebileceğini düşündürmektedir. Bununla birlikte, tekrarlanabilir sonuçlar elde etmek için, kültür ilerlemesinin ve morfolojisinin, kullanılan hücrelerin geçmişine (örneğin, rutin kültür bakımı sırasında kullanılan geçiş sayısı ve ayrılma yöntemi) bağlı olarak değişebileceğini ve tahlil tasarımı sırasında bu faktörlerin kontrol edilmesi önerilir.
Burada, bu modelin ilk uygulaması olarak, mühendislik mikrovasküler ağlarının 10 μg / mL bevacizumab ile tedaviye duyarlılığını gösteriyoruz. Özellikle, kullanılan algoritmanın endotel ağını doğru bir şekilde tanıyabildiğini doğrulamak önemlidir, çünkü eserler genellikle zayıf gelişmiş ağlara sahip görüntülerde üretilir. Bu durumda, görüntü işleme için kullanılan parametrelerin (segmentasyondan önce ve segmentasyon sırasında) genellikle deneme yanılma temelinde ince ayarlanması gerekir.
İkinci bir uygulama olarak, mezenkimal, endotel ve kanser hücrelerinin sıralı tohumlanması ile oluşturulan gelişmiş bir ko-kültür modeli sunuyoruz. Bu model, metastaz sırasında önemli faktörler olabilecek kanser hücreleri, stroma ve kemik iliğinin vaskülatürü arasındaki etkileşimleri incelemeye izin verir. Ek olarak, bu model ilaç tarama uygulamaları ve anjiyogenezin ötesinde hedefleri olan bileşikleri test etmek için kullanılabilir.
2B kültürlerde, hücreler fizyolojik mikroçevresel sinyaller almazlar, doğal olarak oluşan hücre morfolojileri elde etmezler ve sonuç olarak, doğal 3B ortamlardaki hücrelere kıyasla farklı şekilde farklılaşırlar35. Mühendislik ürünü 3D hidrojellerde yetiştirildiğinde, hücreler erken dönemde yapışma bölgeleri sağlayan ve aktif olarak yeniden şekillendirilebilen doğal bir ECM biriktirir28,36. Burada, tarama uygulamaları için basitleştirilmiş bir 3D model oluşturmak için, damar oluşturan hücreler mühendislik hidrojellerinin yüzeyine tohumlandı ve perfüzyon yokluğunda vasküler ağlar kurmasına izin verildi. Görüntülemeye dayalı değerlendirmeler, vasküler yapılara katkıda bulunan endotel hücrelerinin 2D projeksiyonları üzerinde yapıldı. Bununla birlikte, sadece konfokal görüntüler, FGF-2 ile uyarılmış örneklere kıyasla, BMP-2 ile uyarılmış örneklerdeki 3D vasküler ağların daha az belirgin büyümesini ortaya koymuştur. Bu, oluşan vasküler yapıların uzunluğunun hafife alındığını, bağlantılarının ise abartıldığını göstermektedir. Ek olarak, perivasküler ve endotel hücreleri ile vasküler lümen oluşumu arasındaki etkileşimler araştırılmamıştır. Bu hususlar, özellikle ilaç tedavisine yanıtlar açısından, daha fazla dikkat gerektirecektir. Son olarak, ilk önce kapsamlı 3D vasküler ağlar kurmak ve ancak daha sonra osteojenik farklılaşmalarını indüklemek için rafine protokoller, daha fazla fizyolojik kemik ve kemik iliği modeli üretmek için arzu edilir.
Genel olarak, burada sunulan model çok yönlüdür ve belirli uygulamalara göre kolayca uyarlanabilir. Örneğin, farklı kaynaklardan gelen mezenkimal ve endotel hücreleri kullanılabilir. Yağ dokusu MSC'lerinin ve umbilikal kord MSC'lerinin BM-MSC'lere göre farklı anjiyojenik faktörler eksprese ettikleri ve alternatif stromal komponent olarak kolaylıkla ikame edilebildikleri bilinmektedir37. Daha önce tanımlanmış kemik iliği nişlerinden izole edilen endotel hücreleri de HUVEC'ler yerine kullanılabilir. Kişiselleştirilmiş tıp uygulamaları için hasta kaynaklı, eşleşen kemik iliği mezenkimal ve endotel hücreleri ile ko-kültür de kurulabilir, son zamanlarda vaskülarize kas ko-kültürleri için önerildiği gibi38. Ek olarak, hidrojel plakanın tasarımı, kültürün hem parlak alan hem de floresan mikroskobu ile uzunlamasına izlenmesini sağlar, böylece kullanıcıya uygulamaya bağlı olarak kültür süresini kısaltma veya uzatma imkanı sunar. Alternatif olarak, tohumlama için kullanılan hücre yoğunlukları, bu protokoldekilerden daha kısa veya daha uzun gözlem sürelerine ihtiyaç duyulursa, hücre ağının oluşumunu hızlandırmak veya geciktirmek için buna göre ayarlanabilir. Her durumda, hidrojelin büzülmesine ve nihayetinde hücre ayrılmasına yol açabilecek tabaka benzeri yapılara hücre aşırı büyümesini önlemek için dikkatli olunması gerekir.
Son olarak, bu model kullanılarak çok çeşitli tahliller yapılabilir. Canlı veya sabit kültürlerde yapılan immünofloresan ve mikroskopiye ek olarak, 3D kültürler enzimatik olarak sindirilebilir ve hücreler alınabilir ve her türlü biyokimyasal tahlile tabi tutulabilir. Burada, kolorimetrik / florometrik tahliller kullanarak hücre lizatlarında ALP aktivitesinin ve DNA içeriği niceliğinin belirlenmesini gösteriyoruz, ancak sistem PCR, RNAseq ve proteomik dahil olmak üzere diğer birçok teknikle uyumludur. İstenilen tahlilin hassasiyeti çok yüksek değilse, tahlil için mevcut numune miktarını artırmak için birden fazla kuyudan numuneler toplanabilir. İstenilen uygulama daha hızlı jel çözünmesi gerektiriyorsa, plakanın orbital sallanması, plakadaki tüm kuyucukların bu şekilde kullanılacağı varsayılarak, kuyucuklarda vorteks oluşumunu sağlamak için daha küçük hacimlerde sindirim çözeltisi ile birlikte uygulanabilir (canlı kültürler bu tür sert işlemlere karşı hassastır). Özetle, burada, tarif edildiği gibi kullanıldığında, osteojenik vasküler nişlerin temel yönlerini özetleyen, ancak aynı zamanda özel uygulamalar için değiştirilebilecek kadar çok yönlü olan bir in vitro modelin oluşturulmasını garanti eden bir protokol sunuyoruz.
Açıklamalar
Ectica Technologies AG, 3DProSeed hidrojel kuyu plakasının üreticisidir ve ticari çıkarları vardır. Benjamin R. Simona ve Martin Ehrbar, Ectica Technologies AG'nin hissedarlarıdır.
Teşekkürler
Yazarlar, sıvı taşıma cihazlarıyla ilgili teknik yardım için Riccardo Urbanet'e ve epifloresan mikroskobu ile ilgili destek için Rodi Odabaşı'na teşekkür eder. Bu çalışma İsviçre Ulusal Bilim Vakfı (hibe numaraları 310030E_202429 ve 205321_204318) ve Ectica Technologies AG tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
Referanslar
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır