Yetişkin Otoimmün Ensefalomiyelit Farelerinden Başlıca Merkezi Sinir Sisteminde Yerleşik Hücre Tiplerinin Eşzamanlı İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bugüne kadar, tüm ana merkezi sinir sisteminde yerleşik hücre tiplerinin aynı fareden eşzamanlı izolasyonu için protokoller karşılanmamış bir taleptir. Protokol, nöroinflamasyon sırasında karmaşık hücresel ağları araştırmak ve aynı anda gerekli fare sayılarını azaltmak için naif ve deneysel otoimmün ensefalomiyelit farelerinde uygulanabilir bir prosedürü göstermektedir.
Özet
Deneysel otoimmün ensefalomiyelit (EAE), multipl skleroz (MS) için en yaygın murin modelidir ve MS'in hala bilinmeyen etiyolojisini daha fazla aydınlatmak ve yeni tedavi stratejileri geliştirmek için sıklıkla kullanılmaktadır. Miyelin oligodendrosit glikoprotein peptidi 35-55 (MOG35-55) EAE modeli, bağışıklamadan sonraki 10 gün içinde artan felç ile kendi kendini sınırlayan bir monofazik hastalık seyrini yeniden üretir. Fareler, klinik bir puanlama sistemi kullanılarak günlük olarak incelenir. MS, belirli bir zamansal paterne sahip farklı patomekanizmalar tarafından yönlendirilir, bu nedenle hastalığın ilerlemesi sırasında merkezi sinir sistemi (MSS) yerleşik hücre tiplerinin rolünün araştırılması büyük ilgi görmektedir. Bu protokolün benzersiz özelliği, yetişkin EAE ve sağlıklı farelerde uygulanabilen tüm ana CNS'de yerleşik hücre tiplerinin (mikroglia, oligodendrositler, astrositler ve nöronlar) eşzamanlı izolasyonudur. Beynin ve omuriliğin yetişkin farelerden ayrılmasını, mikroglia, oligodendrositler, astrositler ve nöronları izole etmek için manyetik olarak aktive edilen hücre sınıflandırması (MACS) takip eder. Saflaştırılmış tek hücreli süspansiyonların kalite analizlerini yapmak için akış sitometrisi kullanıldı, hücre izolasyonundan sonra canlılığı doğruladı ve her hücre tipinin saflığını yaklaşık %90 olarak gösterdi. Sonuç olarak, bu protokol, sağlıklı ve EAE farelerinde karmaşık hücresel ağları analiz etmek için kesin ve kapsamlı bir yol sunar. Ayrıca, dört hücre tipinin tümü aynı farelerden izole edildiğinden, gerekli fare sayıları önemli ölçüde azaltılabilir.
Giriş
Multipl skleroz (MS), santral sinir sisteminin (SSS) demiyelinizasyon, aksonal hasar, gliozis ve nörodejenerasyon ile karakterize kronik inflamatuar otoimmün bir hastalığıdır. Bu alandaki çok sayıda araştırma yaklaşımına rağmen, MS'in patofizyolojisi hala tam olarak anlaşılamamıştır 1,2,3,4. MS'i araştırmak için en yaygın hayvan modeli, klinik ve patofizyolojik özelliklerinin çoğunu paylaşan miyelin oligodendrosit glikoprotein peptidi 35-55 (MOG35-55) ile indüklenen deneysel otoimmün ensefalomiyelittir (EAE) 5,6,7,8,9 . Bağışıklık sisteminin inflamasyona, demiyelinizasyona ve nöroaksonal dejenerasyona yol açan CNS'ye özgü antijenlere karşı tepkisine dayanır. Deneysel otoimmün ensefalomiyelit (EAE), MS'de bulunan nöroinflamatuar yolakların ve sinyal kaskadlarının araştırılması için uygun bir modeldir.
MS için mevcut tedavi seçenekleri sadece kısmen etkilidir ve öncelikle hastalığın ilk inflamatuar fazına odaklanır. Bununla birlikte, MS'in nörodejeneratif bileşeni, uzun vadeli terapötik yaklaşımlar için en büyük zorluk gibi görünmektedir. Bu nedenle, otoimmün hastalıklarda moleküler ve hücresel mekanizmaların kapsamlı bir şekilde araştırılması için tekrarlanabilir ve hassas hücre izolasyon protokollerine ihtiyaç vardır. Tek bir hücre tipinin izolasyonu için bazı protokoller mevcut olsa bile 10,11,12,13,14,15, aynı anda birkaç CNS'de yerleşik hücre popülasyonunun aynı anda izolasyonu için karşılanmamış bir ihtiyaç vardır. CNS'de yerleşik hücrelerin izolasyonu için önceki protokoller, hücresel işlevselliği ve saflığı korumada eksiktir, bu da komşu hücrelerle birlikte yetiştirme 16,17,18 veya hücre içi ağların ex vivo19,20,21,22 karmaşık analizleri için uygun olmama ile sonuçlanır.
Bu protokolün amacı, yetişkin, sağlıklı ve EAE farelerinde uygulanabilen tüm ana CNS'de yerleşik hücre tiplerinin saf, canlı, tek hücreli süspansiyonlarının eşzamanlı izolasyonu için tekrarlanabilir ve kapsamlı bir yöntem oluşturmaktı. Farklı hücre tipleri, manyetik olarak aktive edilen hücre sıralaması (MACS)23 kullanılarak izole edildi. Hücre ayrımı, pozitif seleksiyonla, yani hücre tipine özgü yüzey işaretleyicilerinin manyetik olarak etiketlenmesiyle veya biyotinilasyon ve tüm istenmeyen hücrelerin tükenmesi yoluyla negatif seleksiyonla gerçekleştirilebilir. İzole edilmiş tek hücreli süspansiyonların %90'ın üzerinde bir saflık ve en az %80'inin canlılığını sağlamak için akış sitometrisi uygulandı.
Sonuç olarak, ana amaç, sağlıklı ve EAE farelerinde karmaşık hücresel ağların ve biyokimyasal sinyal kaskadlarının kapsamlı ve kesin bir analizini sunan nöroinflamatuar yolların araştırılması için çok yönlü bir araç olarak tüm ana CNS'de yerleşik hücre tiplerinin eşzamanlı izolasyonu için bir protokol oluşturmaktı.
Protokol
Tüm EAE deneyleri, 10-12 haftalıkken dişi C57BL/6J farelerde indüklendi ve yerel yetkililer (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen) tarafından onaylandı. Deneylerin herhangi bir zamanında Alman ve AB hayvan koruma yasasına uygunluk da sağlandı. Tüm fareler ayrı ayrı havalandırılan kafes hayvan barınağı koşullarında tutuldu.
NOT: Aşağıdaki reaktif hacimleri, aşağıda CNS hücre süspansiyonu olarak adlandırılan ve yaklaşık 20 mg ila 500 mg ağırlığında olan bir yetişkin murin beyni ve omuriliğini ifade eder. Birden fazla CNS hücre süspansiyonunun ayrışması planlanıyorsa, tüm reaktif hacimleri ve malzemeleri buna göre ölçeklendirilmelidir. Dulbecco'nun fosfat tamponlu salininin (D-PBS; 1x) kalsiyum ve magnezyum içeren, 1 g/L glikoz ve 36 mg/L sodyum piruvat ile desteklenmiş) tüm deney boyunca sürekli olarak buz üzerinde saklanması önerilir. Hücre ekimi daha sonra planlanıyorsa, tüm adımları steril koşullar altında davlumbaz kullanarak gerçekleştirin. Aksi takdirde, aşağıdaki protokol bölümlerinden hiçbirinin bir başlık altında gerçekleştirilmesi gerekmez. Tamponları buz üzerinde saklayın. Yalnızca önceden soğutulmuş çözeltiler kullanın ve tüm deney boyunca girdap oluşmasını önleyin. Genel iş akışı için Şekil 1'e bakın.
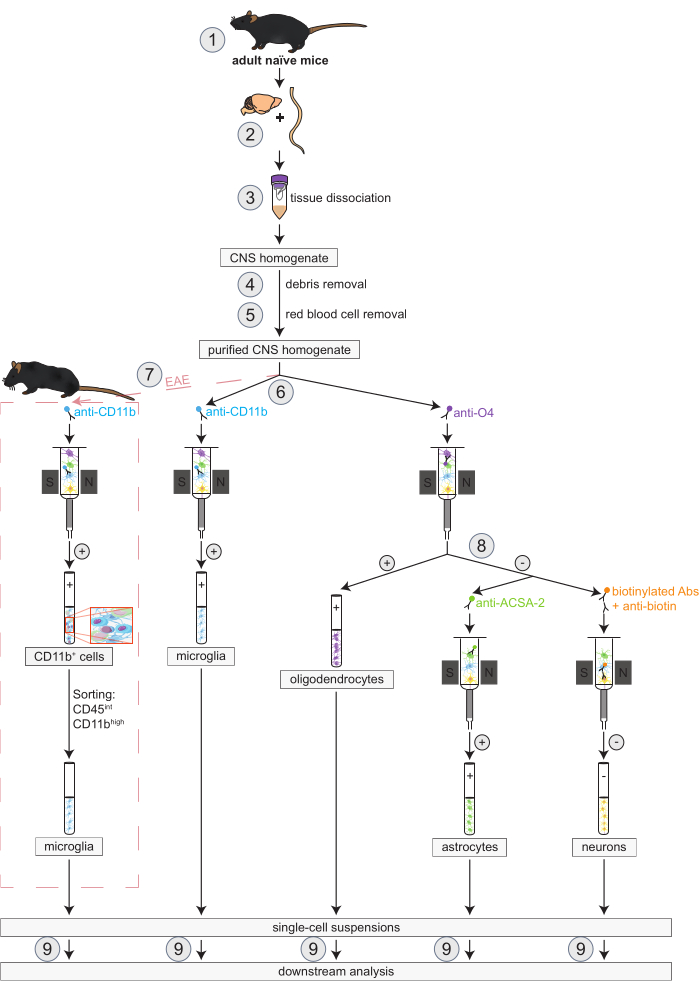
Şekil 1: Naif ve EAE farelerde oligodendrositlerin, mikrogliaların, astrositlerin ve nöronların eşzamanlı izolasyonu için iş akışı. İş akışının ilk adımları hem saf hem de EAE fareler için aynıdır. Bir EAE kopyası ile çalışmak isteniyorsa, EAE indüksiyonu önceden yapılmalıdır (1). Protokol kısaca, murin beyni ve omuriliğinin diseksiyonu (2) ve ayrışması (3) ile başlar, ardından enkaz (4) ve kırmızı kan hücrelerinin (5) çıkarılması ile devam eder. Daha sonra, elde edilen saflaştırılmış CNS hücre süspansiyonu, oligodendrositlerin ve mikroglia'nın MACS yoluyla eşzamanlı izolasyonu için iki fraksiyona bölünür (6). Mikroglia, anti-CD11b mikro boncuklar aracılığıyla tespit edilirken, oligodendrositler anti-O4 mikro boncuklar (pozitif seçimler) kullanılarak izole edilir. Oligodendrositlerin (8) negatif akışından astrositler, anti-ACSA-2 mikro boncukları (pozitif seçim) ve nöronlar, biyotin etiketlemesi ve tüm nöronal olmayan hücrelerin tükenmesi (negatif seçim) yoluyla izole edilir. EAE farelerinde, CD11b+ hücrelerinin izolasyonunu, makrofajlar, dendritik hücreler, monositler, granülositler ve EAE seyri sırasında nöroinflamasyon süreçlerine katıldığı bilinen doğal öldürücü hücreler gibi diğer CD11b+ bağışıklık hücrelerini ortadan kaldırmak için CD45intCD11byüksek hücrelerinin floresanla aktive edilen hücre sınıflandırması takip eder (7)27,28,48. Farklı CNS'de yerleşik hücre tiplerinin izolasyonundan sonra saflık analizleri yapılabilir (9). Kısaltmalar: Abs = antikorlar; ACSA-2 = astrosit hücre yüzeyi antijeni-2; CD11b = sikline bağımlı kinaz 11B; CD45 = reseptör tipi tirozin-protein fosfataz C; CNS = merkezi sinir sistemi; EAE = deneysel otoimmün ensefalomiyelit; MACS = manyetik olarak aktive edilen hücre sıralaması; O4 = oligodendrosit belirteci O4. Bu rakam49'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Aktif EAE'nin indüksiyonu
- Reaktiflerin hazırlanması
- Hücre ayrımı için: PB tamponunu hazırlayın ve 2-8 °C'de en fazla 1 hafta saklayın. Stok çözelti hazırlamak için, takviyesiz 475 mL 1x PBS (pH 7.2) + 25 mL% 0.5 sığır serum albümini (BSA) ekleyin. BSA'da hazırlanmış 1:20 seyreltme kullanın.
- Akış sitometrisi ve floresanla aktive edilen hücre sınıflandırması (FACS) için: FACS tamponunu, PBS'yi %2 fetal buzağı serumu (FCS) ve 2 mM EDTA ile hazırlayın ve 2-8 °C'de saklayın. Hazırlamak için, takviyeler olmadan 500 mL 1x PBS ve 10 mL FCS + 2 mL EDTA (0,5 M EDTA stoğundan) ekleyin
- Bittner ve ark. 5. Kısaca, 200 μg MOG35-55 peptid ve 200 μg Mycobacterium tuberculosis içeren 200 μL tam Freud adjuvanı içeren bir emülsiyonun subkutan enjeksiyonu ile EAE'yi indükleyin.
- İzofluran buharlaştırıcılı bir anestezi odası kullanarak fareyi %2 izofluran ile uyuşturun. Anestezi altındayken kuruluğu önlemek için hayvanın gözlerine veteriner merhemi kullanın.
- 2 saat sonra, Huntemann ve ark.24'ün protokolüne göre 100 μL 1x PBS içinde çözülmüş 100 ng Boğmaca toksini (PTx) intraperitoneal enjeksiyonu enjekte edin. Bağışıklamadan sonraki 2. günde PTx enjeksiyonunu tekrarlayın.
DİKKAT: Sternal yaslığı korumak için yeterli bilinci yeniden kazanana kadar her hayvanı gözlemleyin. Enjeksiyon prosedürlerinden geçen fareler, tamamen iyileşene kadar diğer farelerin şirketine iade edilmez. Mycobacterium tuberculosis ve PTx için: Solumaktan, yutmaktan ve cilt ve gözlerle temasından kaçının. Mycobacterium tuberculosis , doğuştan gelen bağışıklık sisteminin bir aktivatörüdür. PTx'in birçok biyolojik etkisi vardır. - Ağırlığı izleyen ve fareleri klinik olarak inceleyen iki kör araştırmacı tarafından gerçekleştirilen EAE ilerlemesini günlük olarak izleyin.
- Bu amaçla derece 0-EAE klinik bulgusu yok, evre 1-parsiyel kuyruk parezi, evre 2-tam kuyruk parezi, derece 3-orta derecede arka ekstremite güçsüzlüğü, grade 4-tam arka ekstremite güçsüzlüğü ve ataksik yürüyüş, grade 5-hafif paraparezi, grade 6-paraparezi, grade 7-parapleji, grade 8-tetraparezi, grade 9-kuadripleji, ve 10. sınıf ölüm.
- Deneye daha fazla katılım için aşağıdaki dışlama kriterlerini kullanın: klinik puan > 7 veya başlangıç vücut ağırlığının% 20'sini aşan bir kilo kaybı.
- Beynin ve omuriliğin diseksiyonu için, EAE farelerini EAE indüksiyonundan sonraki 16. günde ötenazi yapın ve hastalık maksimumunu temsil edin.
2. CNS doku hazırlığı (Süre: fare başına yaklaşık 10 dakika)
- Fareleri karbondioksit ile feda ettikten sonra, her farenin 20 mL 1x PBS ile transkardiyal perfüzyonu ile başlayın. Perfüzyonu 20 mL 1x PBS ile tekrarlayın.
- Fareyi sırtüstü pozisyona getirin ve uzuvları kanüllerle sabitleyin. Hayvanın ön gövdesine% 75 etanol uygulayın. Bu noktada daha fazla sterilite önlemi gerekli değildir.
- Bir makas yardımıyla cilt ve fasyadan uzunlamasına bir kesit yaparak karın ve göğüs boşluğunu açın.
- Kaburgaları yanal olarak kesin ve kalbe serbest erişim sağlamak için göğüs kafesi katlayın. Yukarı doğru katlanmış toraksı kanüllerle sabitleyin.
- Makas kullanarak sağ atriyumu açın. Kanı kesilen sağ atriyumdan dışarı atmak için bir kanül ile sol ventriküle 20 mL 1x PBS uygulayın.
- Uzunlamasına bir bölümden murin kafasının üstündeki cildi keserek kafatasını ortaya çıkarın ve bir forseps kullanarak cildi başın etrafında kaydırın. Kafatasını sagital sütür boyunca bir makas yardımıyla kesin.
- Kalotte'u açmak için bir forsepsin ucunu insizyon hattı boyunca sokun. Beynin tamamen açığa çıkması için kalaotun kalan kısımlarını forseps ile çıkarın.
- Beyni dikkatlice çıkarın ve bir murin beyin matrisine yerleştirin. Bir tıraş bıçağı kullanarak beyni 1 mm kalınlığında sagital dilimler halinde kesin.
- Şırınganın omurilik kanalına yerleştirilebilmesi için vertebral kolonu iliak krestin hemen üstünden makas yardımıyla kesin.
NOT: Omuriliği çıkarmanın en kolay yolu, onu PBS ile omurilik kanalından dışarı atmaktır. Aksi takdirde omur kemerlerinin makasla tek tek açılması gerekir ve ardından omurilik çıkarılabilir. - 1x PBS içeren 20G iğne ile 20 mL'lik bir şırınga kullanarak omuriliği kaudalden kraniyal kanaldan dışarı atın. Omuriliği bir neşter kullanarak 0,5 cm uzunluğunda parçalara ayırın.
- Beyin ve karşılık gelen omurilikten oluşan her bir CNS hücre süspansiyonunu, yaklaşık 3 mL soğuk D-PBS ile doldurulmuş fare başına ayrı bir Petri kabında saklayın. Bulaşıkları daha fazla işlenene kadar buz üzerinde saklayın.
3. CNS doku ayrışması (Süre: CNS hücre süspansiyonlarının sayısına bağlı olarak yaklaşık 1-1.5 saat)
NOT: Yetişkin farelerden alınan nöral doku, mekanik ayrışmanın hücre dışı matrisin enzimatik bozunması ile birleştirilmesiyle ayrıştırılır. Böylece yapısal bütünlük korunur ve hücre süspansiyonu daha ileri hücre izolasyon prosedürleri için kullanılabilir.
- CNS hücre süspansiyonu başına 50 μL P enzimi ve 1.900 μL tampon Z'den oluşan uygun hacimde enzim karışımı 1 hazırlayın. Her iki reaktif de yetişkin beyin ayrışma kitine aittir.
- CNS hücre süspansiyonu başına 10 μL enzim A ve 20 μL tampon Y'den oluşan uygun hacimde enzim karışımı 2 hazırlayın. Her iki reaktif de yetişkin beyin ayrışma kitine aittir.
- 1.950 μL enzim karışımı 1'i C tüpüne aktarın ve daha sonra bir CNS hücre süspansiyonunun doku parçalarını ekleyin. Fare başına bir C tüpü kullanın.
- Her C tüpüne 30 μL enzim karışımı 2 ekleyin. C tüplerini sıkıca kapatın ve ısıtıcılarla hücre ayrıştırıcının manşonuna baş aşağı takın.
- 37C_ABDK_01 adlı uygun programı çalıştırın (30 dakika sürer). Tüm tüplerin aynı hızda döndüğünden emin olmak için programın en az ilk 5 dakikasına uyun. Çalışma sırasında hataların oluşması mümkündür. Ardından, 6. adıma geçin.
- Programın son 2 dakikasında, her ayrışmış CNS hücre süspansiyonu için 50 mL'lik bir tüpe 70 μm'lik bir süzgeç yerleştirin. Bu süzgeçleri 2 mL D-PBS ile önceden nemlendirin.
- Programın sonlandırılmasından sonra, C tüplerini ayrıştırıcıdan takın ve bir santrifüje yerleştirin. Numuneyi tüpün dibinde toplamak için numuneleri 300 x g ve 4 °C'de 1 dakika santrifüjleyin.
- Numuneyi tekrar süspanse edin ve önceden nemlendirilmiş süzgecin üzerine uygulayın. Boş C tüpüne 10 mL soğuk D-PBS ekleyin ve kapatın. Hafifçe sallayın ve süspansiyonu ilgili süzgecin üzerine uygulayın.
- Süzgeçleri atın ve 50 mL'lik tüpleri kapatın. Hücre süspansiyonunu 300 x g ve 4 °C'de 10 dakika santrifüj edin. Daha sonra, tüm süpernatanı çok dikkatli bir şekilde aspire edin.
4. Enkaz kaldırma (Süre: CNS hücre süspansiyonlarının sayısına bağlı olarak yaklaşık 1.5-2 saat)
NOT: Doku ayrışması genellikle aşağı akış analizini bozabilecek miyelin ve hücre kalıntılarına yol açar. Bir enkaz temizleme çözümü ekleyerek, bu kalıntı CNS hücre süspansiyonundan verimli bir şekilde çıkarılabilir.
- Her CNS hücre süspansiyonu için hücre peletini 3.100 μL D-PBS ile dikkatlice yeniden süspanse edin. Girdap yapmayın.
- Birden fazla CNS hücre süspansiyonu ile çalışıyorsanız, bir koşuldan veya deney grubundan türetilen maksimum iki CNS hücre süspansiyonunu bir 15 mL'lik tüpte toplayın.
- Yetişkin beyin ayrışma kitinden bir CNS hücre süspansiyonuna 900 μL enkaz giderme solüsyonu veya iki havuzlanmış CNS hücre süspansiyonuna 1.800 μL enkaz giderme solüsyonu ekleyin.
- Tüpü ters çevirin ve süspansiyonu karıştırın. Daha sonra, 4 mL soğuk D-PBS ile çok nazikçe kaplayın. Net bir gradyan görünür olmalıdır (Şekil 2A).
- Tüpleri 10 dakika boyunca 3000 x g ve 4 °C'de tam hızlanma ve frensiz olarak santrifüjleyin.
- Ayırma amaçlandığı gibi gerçekleşirse, üç faz oluşur (Şekil 2C). En üstteki iki fazı tamamen aspire edin (Şekil 2C-1,2) ve atın. Geride miyelin kalıntısı kalmaması önemlidir (Şekil 2E).
NOT: Gradyan işe yaramadıysa ve hücrelere acilen ihtiyaç duyuluyorsa, en üstteki iki fazı emmeyin. Bunun yerine, 15 mL'lik tüpü 15 mL'ye kadar soğuk D-PBS ile doldurun ve birkaç kez ters çevirin. 1000 x g'de 10 °C'de 4 dakika boyunca tam hızlanma ve frensiz olarak tekrar santrifüj edin. Süpernatanı emdirin ve 4.1-4.4 adımlarını tekrarlayın. - Tüpü 14 mL'ye kadar soğuk D-PBS ile doldurun ve kapatın. Hücre peleti tüpün altından ayrılana kadar tüpü çalışma tezgahında güçlü bir şekilde ters çevirin. Girdap yapmayın.
- Numuneyi 1000 x g ve 4 °C'de 10 dakika boyunca tekrar santrifüj edin. Tam hızlanma ve tam fren ayarlayın. Süpernatanı dikkatlice ve tamamen aspire edin.

Şekil 2: Enkaz kaldırma sırasında yapılması ve yapılmaması gerekenler. (A) 4 mL PBS ile bindirildikten sonra gradyan için pozitif örnek. 4 mL PBS'den oluşan üst faz, enkaz giderme solüsyonu ile CNS hücre süspansiyonundan oluşan alt fazdan açıkça ayırt edilebilir. (B) 4 mL PBS ile üst üste bindirildikten sonra gradyan için negatif örnek. Gradyan, PBS ile aşağıdaki hücre süspansiyonu arasında net bir ayrımdan yoksundur. PBS'nin bir kısmı hücre süspansiyonuna yayılır. (C) Santrifüjlemeden sonraki gradyan için pozitif örnek. Üç ayrı faz kolayca ayırt edilebilir. Gradyanın üst (1) veya alt fazında (3) miyelin kalıntısı görünmez. Orta faz tüm miyelini içerir (2). Hücre peleti 15 mL'lik tüpün dibinde görülebilir. (D) Santrifüjlemeden sonra gradyan için negatif örnek. Mümkün olan üç faz arasında kesin bir ayrım yoktur. Bazı miyelin kalıntıları, gradyanın üst (1) ve alt fazında (3) görülebilir. (E) İki üst fazı aspire ettikten sonra gradyan için olumlu örnek. Elde edilen numune sadece hücre peletini ve yukarıda berrak bir süpernatant içerir. Geride miyelin kalıntısı kalmaz. (F) İki üst fazı aspire ettikten sonra gradyan için negatif örnek. Numune hala bazı miyelin kalıntıları (siyah ok) içeriyor. Kısaltmalar: CNS = merkezi sinir sistemi; PBS = fosfat tamponlu salin Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Kırmızı kan hücresi çıkarılması (Süre: CNS hücre süspansiyonlarının sayısına bağlı olarak yaklaşık 1 saat)
NOT: Bu adım, daha sonra kırmızı kan hücreleri tarafından kontaminasyonu önler ve CNS dokusundan izole edilen diğer hücre tipleri üzerinde minimum etki ile eritrositlerin optimal bir şekilde parçalanmasını sağlar. Aşağıdaki hacimler, iki yetişkin fare beynine ve omuriliğine karşılık gelen 100 mg ila 1 g nöronal dokudan türetilen hücre süspansiyonları için endikedir. İkiden fazla CNS hücre süspansiyonu ile çalışıyorsanız, tüm reaktifleri ve toplam hacimleri buna göre ölçeklendirin.
- Kırmızı kan hücresi çıkarma çözeltisinin (RBCRS) hazırlanmasıyla başlayın: havuzlanmış iki CNS hücre süspansiyonu başına. 1:10'luk bir nihai seyreltmeye ulaşmak için yetişkin beyin ayrışma kitinden 100 μL kırmızı kan hücresi çıkarma stok solüsyonunu (10x) 900 μLddH2Oiçinde seyreltin.
- RBCRS'yi kullanana kadar 2-8 °C'de saklayın. Günün sonunda kullanılmayan kalıntıları atın.
- RBCRS'nin 1 mL'sinde iki CNS hücre süspansiyonuna kadar hücre peletini yeniden süspanse edin. Girdaptan kaçının. Çözeltiyi 4 °C'de 10 dakika inkübe edin.
- İki havuzlanmış hücre süspansiyonuna 10 mL soğuk PB tamponu ekleyin. Numuneyi 300 x g ve 4 °C'de 10 dakika santrifüjleyin ve daha sonra süpernatanı tamamen aspire edin.
- Her bir hücre peletini bir CNS hücre süspansiyonundan 80 μL PB tamponunda yavaşça yukarı ve aşağı pipetleyerek yeniden süspanse edin. Buna göre, iki CNS hücre süspansiyonundan türetilen hücre peletlerini yeniden süspanse etmek için 160 μL kullanın.
- Aynı deneysel koşuldan birkaç CNS hücre süspansiyonu ile çalışırken, tüm bu hücre süspansiyonlarını bir araya getirin.
- Hücre sayısını belirleyin, örneğin gelişmiş bir sayım odası kullanarak. Hücre süspansiyonları genellikle PB tamponunda 1:50 oranında seyreltildi, ardından %0.4 tripan mavisi çözeltisinde 1:10'luk bir seyreltme daha yapıldı.
6. Naif ve EAE farelerde manyetik boncuk protokolü (Süre: Yaklaşık 1 saat)
- Farklı CNS hücre tiplerini, yüzey antijenlerine özgü MicroBeads ile manyetik olarak etiketleyin. Ardından, hücre süspansiyonunu sütuna yerleştirin ve sütun içinde tutulan etiketli hücreleri ve içinden geçen etiketsiz hücreleri manyetik olarak ayırın.
- Kolonu manyetik alandan çıkardıktan sonra, manyetik olarak etiketlenmiş hücreleri, pozitif olarak seçilmiş hücre fraksiyonu olarak kolondan bir tüpe boşaltın.
NOT: Manyetik etiketleme işlemi için hacimler, toplam 1 x 107 hücreye kadar hesaplanır. Daha fazla hücre elde edilirse, tüm reaktifleri ve toplam hacimleri buna göre ölçeklendirin. Hücre yüzeyinde antikorların kapanmasını ve spesifik olmayan hücre etiketlemesini önlemek ve izole hücre popülasyonlarının yüksek canlılığını sağlamak için hızlı çalışılması ve sadece önceden soğutulmuş solüsyonların kullanılması önerilir. Kolonların kurumaması için kolon haznesi boşalır boşalmaz PB tamponu eklenerek yıkama adımlarının gerçekleştirilmesi de önemlidir. - Saflaştırılmış seyreltilmemiş CNS hücre süspansiyonunu, aşağıdaki mikroglia ve oligodendrosit izolasyonları için iki fraksiyona bölün. Her iki fraksiyonun oranı, her hücre tipinin istenen hücre sayısına bağlıdır.
NOT: Daha fazla ayrıntı (inkübasyon süresi, ayrıntılı protokol adımları, hacimler, reaktifler ve hücre sayımı yöntemi) Tablo 1'de belirtilmiştir.
Tablo 1: Saf ve EAE farelerinden oligodendrositlerin ve mikrogliaların eşzamanlı manyetik etiketlemesi ve izolasyonu için iş akışı. Her iki hücre tipi de pozitif bir seçim yoluyla izole edilir. Aynı satırda listelenen adımların bir kerede gerçekleştirileceği belirtilir. Kısaltmalar: CD11b = siklin bağımlı kinaz 11B; EAE = deneysel otoimmün ensefalomiyelit; FcR = Fc reseptörü benzeri protein; O4 = oligodendrosit belirteci O4. Bu Tabloyu indirmek için lütfen buraya tıklayın.
7. Protokol değişikliği: EAE farelerinde mikroglia izolasyonu için ek sıralama (Süre: Yaklaşık 1.5-2 saat)
NOT: EAE fareleri ile çalışırken, mikroglia dışındaki CD11b + hücre popülasyonlarını (örneğin, monositler, makrofajlar, doğal öldürücü hücreler, granülositler veya dendritik hücreler) CD11b + hücre fraksiyonundan çıkarmak için MACS tabanlı hücre izolasyon protokolünü FACS ile tamamlamak gerekir. Aksi takdirde, bu adım göz ardı edilebilir.
- CD1b FITC (klon M1/70, 1:50) ve CD45 APC/Cy7 (klon 30-F11, 1:200) ile desteklenmiş 1x PBS içeren boyama ana karışımını hazırlayın. 5 x 106 hücre başına 100 μL boyama ana karışımı kullanın. Kullanmadan önce tüm antikorları vorteksleyin.
- Mikroglia hücre süspansiyonunu 300 x g ve 4 °C'de 10 dakika santrifüjleyin ve süpernatanı dikkatlice aspire edin.
- Hücre peletini 5 x 106 hücre başına 100 μL hazırlanmış boyama ana karışımı ile yeniden süspanse edin. Karanlıkta oda sıcaklığında (RT) 15 dakika inkübe edin.
- 500 μL PBS ekleyerek reaksiyonu durdurun ve numuneyi 300 x g ve 4 °C'de 10 dakika boyunca tekrar santrifüj edin.
- Süpernatanı dikkatlice aspire edin ve hücre peletini 10 μg/mL DNAse ile desteklenmiş 1x PBS ile yeniden süspanse ederek mL başına 1 x 107 hücrelik bir nihai konsantrasyona ulaşın. Hücreleri sıralama başlayana kadar 4 °C'de saklayın.
- Hücre süspansiyonunu, sıralamaya başlamadan hemen önce yeni bir FACS tüpüne yerleştirilmiş 100 μm'lik bir süzgecin üzerine uygulayın.
- Akış hızını saniyede 1000 olaya ayarlayın ve 100 μm nozulu kullanın. CD45intCD11byüksek hücrelerinin istenen hücre popülasyonunu, RT'de 1x PBS ile hazırlanan yeni bir 15 mL'lik tüpe sıralayın.
8. Nöronların ve astrositlerin izolasyonu için oligodendrositlerin negatif akışının hazırlanması (Süre: Yaklaşık 1 saat)
NOT: Adım 6'dan oligodendrositlerin negatif akışı, nöronların ve astrositlerin daha fazla izolasyonu için toplanır. Bu amaçla, hücre süspansiyonu iki parçaya bölünür. Oligodendrositlerin CNS hücre süspansiyonundan önceki izolasyonu nedeniyle, aksi takdirde gözlemlenecek olan O4+ hücreleri tarafından kontaminasyon en aza indirilir.
- Oligodendrositlerin negatif akışını 300 x g ve 4 ° C'de 10 dakika santrifüjleyin ve süpernatanı dikkatlice aspire edin.
- Hücre peletini, daha önce oligodendrosit pozitif fraksiyonunun izolasyonu için kullanılan havuzlanmış CNS hücre süspansiyonu başına 80 μL PB tamponunda yeniden süspanse edin.
- Hücreleri sayın. Hücre süspansiyonunu PB tamponunda 1:50 oranında seyrelttikten ve ardından %0.4 tripan mavisinde 1:10 seyrelttikten sonra geliştirilmiş bir sayma odası kullanarak O4- olduğu varsayılan hücrelerin sayımını gerçekleştirin.
- Saflaştırılmış seyreltilmemiş hücre süspansiyonunu, nöronların ve astrositlerin aynı anda izolasyonu için iki fraksiyona bölün. Her iki fraksiyonun oranı, her hücre tipinin tercih edilen miktarına bağlıdır.
NOT: Daha fazla ayrıntı (inkübasyon süresi, ayrıntılı protokol adımları, hacimler, reaktifler ve hücre sayımı yöntemi) Tablo 2'de belirtilmiştir.
Tablo 2: Saf ve EAE farelerinden nöronların ve astrositlerin eşzamanlı manyetik etiketlemesi ve izolasyonu için iş akışı. Her iki hücre tipi de oligodendrositlerin negatif akışından izole edilir. Astrositler, anti-ACSA-2 mikro boncukları yoluyla pozitif bir seleksiyon olarak ayrılırken, nöronlar, negatif bir seleksiyon olarak tüm nöronal olmayan hücrelerin biyotinilasyonu ve tükenmesi yoluyla saflaştırılır. Aynı satırda listelenen adımların bir kerede gerçekleştirileceği belirtilir. Kısaltmalar: Anti-ACSA-2 = astrosit hücre yüzeyi antijeni-2; EAE = deneysel otoimmün ensefalomiyelit; FcR = Fc reseptörü benzeri protein; MACS = manyetik olarak etkinleştirilen hücre sıralaması. Bu Tabloyu indirmek için lütfen buraya tıklayın.
9. İzole CNS'de yerleşik hücre tiplerinin saflık analizleri (Süre: Yaklaşık 2 saat)
NOT: Saflıklarını ve canlılıklarını ölçmek ve karşılaştırmak için izole edilmiş dört CNS'de yerleşik hücre popülasyonunun tümünün akış sitometrisinin yapılması önerilir. Bu nedenle, tüm hücre tiplerini florofor ile etiketlenmiş bir antikorla boyamak gerekir. Canlı/ölü hücre boyama, sabitlenebilir bir canlılık boyası (1:10.000) kullanılarak uygulanır.
- Saflık paneli - hücre dışı boyama protokolü
- Boyama başına 50 μL PBS içinde çözülmüş 1 x 105 hücre kullanın.
- Hücre tipine özgü yüzey belirteçlerini hedefleyen aşağıdaki florokrom konjuge monoklonal antikorlardan oluşan% 2 FCS / 2 mM EDTA ile PBS içinde çözülmüş boyama ana karışımını hazırlayın: CD11b FITC (klon 1/70, 1:100)25,26,27,28, Biotin-PE (klon Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (klon REA-969, 1:200)33,34,35, O4 APC (klon REA-576, 1:400) ve CD45 BV510 (klon 30-F11, 1:150)36,37. Fc reseptörünü bloke etmek için 1 x 106 hücre başına 1 μg anti-CD16/32 ekleyin3 8,39. Kullanmadan önce tüm antikorları vorteksleyin.
- Hücre süspansiyonunu 540 x g ve 4 °C'de 5 dakika santrifüjleyin ve süpernatanı dikkatlice aspire edin.
- Hücre peletini ilgili ana karışımın 100 μL'sinde yeniden süspanse edin ve numuneyi karanlıkta RT'de 15 dakika inkübe edin.
- Hücreleri %2 FCS/2 mM EDTA ile 500 μL 1x PBS ile yıkayın ve numuneyi 540 x g ve 4 °C'de 5 dakika santrifüjleyin.
- Süpernatanı aspire edin ve hücre peletini %2 FCS/2 mM EDTA ile 70 μL 1x PBS ile yeniden süspanse edin.
- Hücre peletini tamamen ayırmak için numuneyi vorteksleyin. Daha sonra, numune akış sitometrisi analizi için hazırdır.
- Saflık paneli - NeuN ile hücre içi boyama protokolü
- Nörona özgü bir nükleer belirteç olan NeuN'nin hücre içi boyanması için her hücre popülasyonundan 1 x 105 hücre kullanın 40,41. Bu, canlı nöronları boyamanın ek bir yoludur.
- Her hücre popülasyonunun 1 x 105 hücresini bir FACS tüpüne aktarın. Tüp başına% 2 FCS / 2 mM EDTA ile 1 mL PBS ekleyin. Tüpleri 540 x g ve 4 °C'de 5 dakika santrifüjleyin.
- Bu arada, hücre tipine özgü yüzey belirteçlerini hedefleyen aşağıdaki florokrom konjuge monoklonal antikorlardan oluşan %2 FCS/2 mM EDTA ile PBS'de çözünmüş ana karışımı hazırlayın: CD11b FITC (klon M1/70, 1:100)25,26,27,28, Biotin-PE (klon Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (klon REA-969, 1:200)33,34,35 ve CD45 BV510 (klon 30-F11, 1:150)36,37.
- Süpernatanı aspire edin ve hazırlanan ana karışımın 100 μL'lik hücrelerinde hücreleri yeniden süspanse edin ve numuneyi karanlıkta RT'de 10 dakika inkübe edin.
- Hücreleri %2 FCS/2 mM EDTA ile 100 μL PBS ile yıkayın ve 540 x g ve 4 °C'de 5 dakika boyunca tekrar santrifüj edin.
- Bu arada, 200 μL fiksasyon/geçirgenleştirme çözeltisi hazırlayın: 1:4'lük bir nihai seyreltmeye ulaşmak için 150 μL fiksasyon/geçirgenleştirme seyrelticisine 50 μL konsantre fiksasyon/geçirgenleştirme konsantresi stoğu ekleyin.
- Süpernatanı aspire edin ve hücreleri 100 μL 1x fiksasyon / geçirgenleştirme çözeltisinde yeniden süspanse edin. Numuneyi 4 °C'de 30 dakika inkübe edin.
- Bu arada, 1:10'luk bir nihai seyreltmeye ulaşmak için 900 μL ddH2O'ya 100 μL geçirgenleştirme tamponu stoğu ekleyerek 1 mL 1x geçirgenleştirme/yıkamatamponu hazırlayın.
- Hücreleri 1 kez 100 μL 1x geçirgenleştirme/yıkama tamponu ile yıkayın ve numuneyi 540 x g ve 4 °C'de 5 dakika santrifüjleyin.
- Bu arada, Fc reseptörünü bloke etmek için sadece NeuN (NeuN AF647, klon EPR12763, 1:200) ve 106 hücre başına 1 μg anti-CD16/32'den oluşan 1x geçirgenlik/yıkama tamponunda başka bir ana karışım hazırlayın.
- Süpernatanı aspire edin. Sabit ve geçirgen hücreleri ikinci ana karışımın 50 μL'sinde yeniden süspanse edin ve 4 ° C'de 30 dakika inkübe edin.
- Numuneyi 100 μL 1x geçirgenleştirme/yıkama tamponu ile yıkayın ve 540 x g ve 4 °C'de 5 dakika santrifüjleyin.
- Süpernatanı atın ve hücre peletini %2 FCS / 2 mM EDTA ile 70 μL PBS'de yeniden süspanse edin. Daha sonra, numune akış sitometrik analizi için hazırdır.
- Akış sitometresinde paneli kurduktan sonra, bir akış sitometrisi analiz yazılımı kullanarak saflık analizi için hücreler edinin.
10. İstatistiksel analiz
- Grafiksel analiz programı ile istatistiksel analizler yapın ve grafikler tasarlayın. Veriler ortalama ± SEM olarak sunulmuştur.
Temsili Sonuçlar
Mevcut protokol, tüm ana CNS'de yerleşik hücreleri, yani mikroglia, oligodendrositler, astrositler ve nöronları tek bir CNS replikasyonundan aynı anda izole etme imkanı sunar. Bu, bu tür deneyler için gerekli olan fare sayısının azaltılması ve moleküler ve biyokimyasal analizlerin hücresel düzeyde karşılaştırılabilirliğini sağlamak için önemlidir. Bireysel hücre tipleri farklı CNS kopyalarından izole edilirse, hücresel etkileşimler doğru bir şekilde haritalanamaz ve izolasyon işlemleri sırasındaki potansiyel teknik sapmalar, daha sonraki aşağı akış analizlerini önyargılı hale getirebilir. Ek olarak, her hücre tipinden elde edilen moleküler ve biyokimyasal bulgular, aynı EAE bağlamından türetilmedikleri için birbirleriyle karşılaştırılamaz. Ticari bir sistem/kit kullanan önceden var olan bir MACS protokolü, yukarıda belirtilen hücre tiplerinin eşzamanlı izolasyonunu sağlamak için uyarlanmıştır.
Mikroglia izolasyonu anti-CD11b mikro-boncuklar kullanılarak gerçekleştirildi, oligodendrositler anti-O4-beads ile izole edildi (Tablo 1) ve astrositleri izole etmek için anti-ACSA-2 mikro-boncuklar kullanıldı (Tablo 2). Buna karşılık, nöronların izolasyonu negatif bir seçimi temsil eder ve tüm nöronal olmayan hücrelerin biyotinilasyonu ve manyetik etiketlemesi ile gerçekleştirilmiştir (Tablo 2). Kan hücreleri dışındaki tüm nöronal olmayan hücreler (örneğin, oligodendrositler, mikroglia, astrositler, endotel hücreleri ve fibroblastlar), özellikle bu nöronal olmayan hücrelerde eksprese edilen bir yüzey antijenine karşı yönlendirilmiş bir biyotin konjuge antikor kullanılarak manyetik olarak etiketlenebilir (Tablo 2). Bu manyetik olarak etiketlenmiş nöronal olmayan hücrelerin tükenmesiyle, oldukça saf ve canlı nöronal hücre popülasyonları üretilebilir 30,42,43.
Üretilen tek hücreli süspansiyonların saflık analizleri için iki yeni akış sitometri paneli tasarlandı. Burada, canlı/ölü hücre ayrımı ile birlikte hücre tipine özgü yüzey ve nükleer belirteçler kullanıldı.
Fare ve hücre tipi başına elde edilen hücre verimleri (Şekil 3A) analiz edildi ve ortalama 8'e yol açtı. 4 x 105 ± 3 x 104 mikroglia, 3.23 x 106 ± 1 x 105 oligodendrosit, 8.6 x 105 ± 2 x 104 astrosit ve 4.5 x 105 ± 1 x 104 nöron.
Nöroinflamasyonun hastalık modellerini araştırmak amacı bağlamında, protokol EAE'nin bir fare modeline de uygulanmıştır. Fareler, EAE indüksiyonundan sonra 16. günde ötenazi yapıldı ve hastalık maksimumunu temsil edildi. Bu EAE ortamında yaklaşık 2.9 x 106 ± 6.7 x 105 oligodendrosit, 5.2 x 105 ± 9 x 104 astrosit ve 4.4 x 105 ± 4 x 104 nöron izole edildi. Mikroglia hücre verimi, MACS adımlarından sonra ek hücre sıralaması nedeniyle EAE faresi başına yaklaşık 1.7 x 105 ± 4 x 104 mikrogliaya düşürüldü (Şekil 3A).
İzolasyondan sonra, akış sitometrisi yoluyla farklı hücre popülasyonlarının fenotipik karakterizasyonları, tüm ana CNS'de yerleşik hücre tipleri için yaklaşık% 90 saflığa sahip canlı tek hücreli süspansiyonların elde edilebileceğini kanıtladı (Şekil 3B). Mikroglia, literatürde tanımlandığı gibi CD45intCD11byüksekliğinde 44,45,46,47 olarak tanımlandı.
EAE'de, mikroglia, nöroinflamasyon sırasında CNS'ye göç eden monositler, nötrofiller, doğal öldürücü hücreler, granülositler ve makrofajlar gibi diğer CD11b+ bağışıklık hücrelerinden ayırt etmek için tüm CD11b+ hücrelerinden ayrılmak zorunda kaldı 27,28,48. Bu nedenle, mikroglialar CD11b+ hücre süspansiyonundan CD45intCD11yüksek hücreleri olarak sınıflandırıldı. Tüm mikroglia sıralama stratejisi Şekil 4'te gösterilmektedir. Saf farelerde, mikroglia popülasyonu tüm canlı tek hücrelerin% 91.16'sıydı (toplam CD11b + popülasyonunun% 96'sı) (Şekil 4A). EAE farelerinde, mikroglia popülasyonu tüm canlı tek hücrelerin% 46.85'i idi (toplam CD11b + popülasyonunun% 55'i) (Şekil 4B). Hem MACS hem de FACS prosedürleri tek hücrelere mekanik stres uygulasa da, sıralanan saflaştırılmış mikrogliaların %75.41 ± %8.63'ü yaşayabilirdi (Şekil 3B).
İlk CNS hücre süspansiyonundan doğrudan izole edilen astrositler ve nöronlar, oligodendrositlerle ilgili kontaminasyon gösterdi, bu da nöronların ve astrositlerin oligodendrositlerin negatif akışından eşzamanlı izolasyonunun bu kontaminasyonu önleyebileceği varsayımına yol açtı. Akış sitometrisi analizleri, oligodendrositlerin negatif akışından izole edilen astrositlerin %89.23 ± %2.78 saflıkta olduğunu ve %80.56 ± %1.41 canlılık gösterdiğini doğruladı. Bu sonuçlara benzer şekilde, O4 hücre fraksiyonundan izole edilen nöronların saflığı %81.25 ± %3.31 ve canlılığı %83.90 ± %2.61 idi (Şekil 3B). Bu bulgular ayrıca, bu iki hücre tipinin eşzamanlı izolasyonunun, ancak oligodendrositlerin izolasyonundan sonra, canlı fonksiyonel hücrelerin miktarı üzerinde hiçbir etkisi olmadığını doğrulamaktadır.
İzole edilmiş tek hücreli süspansiyonların canlılığı ve saflığı ile ilgili sonuçlar, EAE farelerinde, saf farelerde alınanlara kıyasla çok benzerdi ve bu protokolün EAE bağlamında olduğu kadar sağlıklı fareler için de uygun olduğunu doğruladı (Şekil 3B).
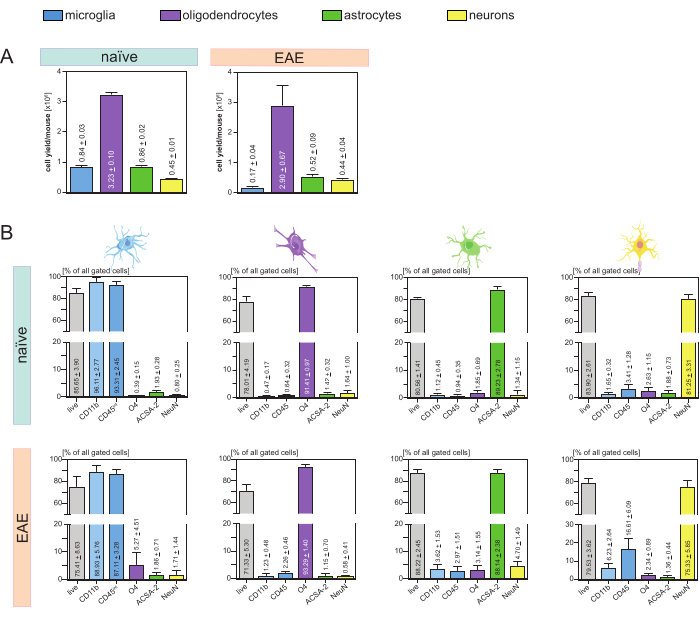
Şekil 3: İzole edilmiş CNS'de yerleşik hücrelerin hücre verimleri ve akış sitometrisine dayalı doğrulaması. (A) Saf ve EAE farelerde CNS'de yerleşik hücrelerin izolasyonundan sonra fare ve hücre tipi başına hücre verimi. Çubuk grafikler, sunulan protokolün uygulanmasından sonra fare ve hücre tipi başına hücre verimi miktarını görselleştirir. Saf farelerde sonuçlar için beş biyolojik kopya işlendi ve EAE farelerinde dört biyolojik kopya analiz edildi. İlgili araçlar ± SEM'ler tasvir edilmiştir. (B) Saflaştırılmış hücre fraksiyonlarının karşılık gelen saflık ve canlılık analizleri. Çubuk grafikler, hücre tipine özgü belirteçlerin ekspresyonlarına dayalı olarak ortaya çıkan tek hücreli süspansiyonların canlılığını ve saflığını gösterir. NeuN, nöronlar için hücre tipine özgü bir nükleer belirteç olarak kullanıldı. Hem sağlıklı hem de EAE fareleri için her hücre tipi için beş biyolojik kopya elde edildi ve karşılaştırıldı. İlgili araçlar ± SEM'ler belirtilmiştir. Kısaltmalar: Anti-ACSA-2 = astrosit hücre yüzeyi antijeni-2; CD11b = sikline bağımlı kinaz 11B; CD45 = reseptör tipi tirozin-protein fosfataz C; CNS = merkezi sinir sistemi; EAE = deneysel otoimmün ensefalomiyelit; MACS = manyetik olarak aktive edilen hücre sıralaması; NeuN = RNA bağlayıcı protein tilki-1 homolog 3; O4 = oligodendrosit belirteci O4; SEM = ortalamanın standart hatası. Bu rakam49'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
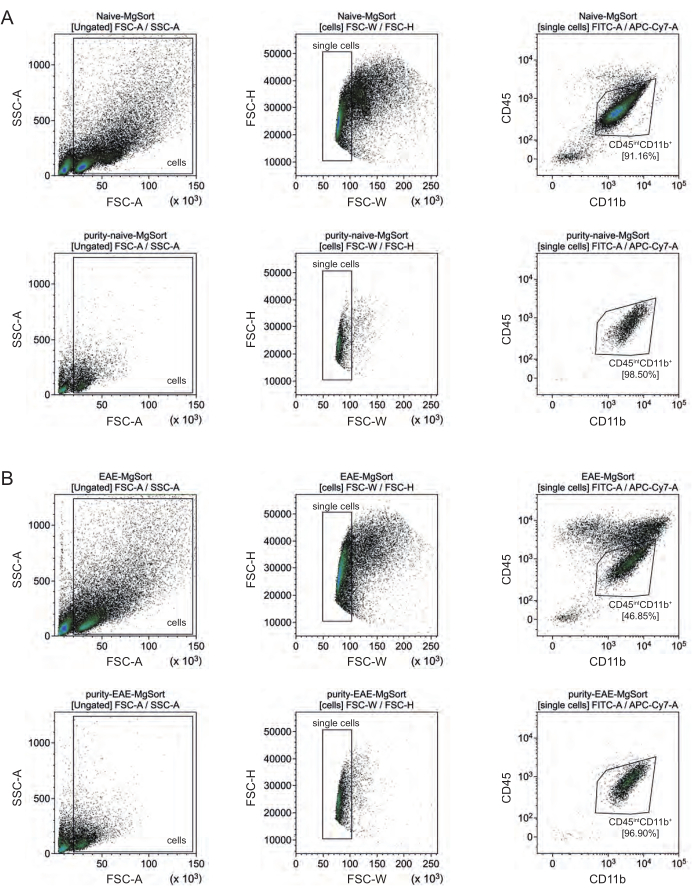
Şekil 4: CD11b+ hücrelerinin izolasyonundan sonra mikroglia'nın hücre sıralaması için geçit stratejisi. (A) Saf ve (B) EAE farelerinde geçit stratejisi. Her panelin üst satırı, sıralamadan önce nokta grafiklerini ve sıralamadan sonra alt satırı gösterir. Canlı (SSC-A/FSC-A) ve tek hücreli (FCS-H/FSC-W) hücre seçiminden sonra, CD45intCD11b+ hücre popülasyonu mikroglia popülasyonu olarak sınıflandırıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Şimdiye kadar, kütle spektrometresi ve RNA dizilimini birleştirerek CNS'de yerleşik hücreleri ex vivo haritalama yöntemleri, sağlık ve hastalıkta çok hassas bir hücresel profilleme sunmaktadır, ancak bu alanda iddialı teknik bilgi ve uzmanlık gerektirmektedir50,51. Ayrıca, fonksiyonel analizlere izin vermezler ve çok pahalıdırlar. Bunun yanı sıra, mikroakışkan çip üzerinde beyin sistemleri, hastalık mekanizmaları için hızlı ve uygun maliyetli bir tarama ve hücre büyümesi ve göçünün kısıtlanması ile yeni terapötik yaklaşımların test edilmesini sağlar 52,53,54,55. CNS organoidleri, gelecekte hücresel modelleme, hücreler arası bağlantılar ve hastalık seyri sırasındaki etkileşimlerin araştırılması için eşdeğer bir alternatifi temsil edebilir 56,57,58,59. Bununla birlikte, floresan ve manyetik ile aktive olan hücre sınıflandırması, şu anda saf ve canlı tek hücreli süspansiyonlar ex vivo 35,60,61 üretmek için en etkili yöntemlerdir. CNS'de yerleşik hücre tiplerinin izolasyonu için diğer yerleşik üretim protokolleri, manyetik izolasyonun bireysel adımları ve önceki hücre ayrışması ile ilgili olarak benzer olsa bile, her hücre tipi için ayrı ayrı gerçekleştirilmeleri amaçlanmıştır. Buna karşılık, mevcut protokol, her CNS'de yerleşik hücre tipi için farklı izolasyon yöntemlerini mantıksal bir bağlama entegre eder, böylece aynı anda ve tek bir CNS hücre süspansiyonundan gerçekleştirilebilirler (Tablo 1, Tablo 2). Böylece, tek bir CNS hücre süspansiyonundan multi-omik analizlere ve nihayetinde karmaşık nöronal ağların keşfine olanak tanır. Bu protokolü gerçekleştirmek için birden fazla hayvandan birkaç dokuyu bir araya getirmek bir zorunluluk olmasa bile, bu havuzlama, daha fazla aşağı akış analizi için yeterli sayıda izole hücre sağlar. Tek hücre tiplerinin izolasyonu için farklı farelerin kullanılması, potansiyel hücresel etkileşimleri analiz etme olasılığını dışlayacaktır. Bunun yanı sıra, tümü önceki bir CNS ayrışmasını takip eden farklı CNS hücre tipleri için bireysel izolasyon yöntemlerinin birleştirilmesi, sonraki tüm manyetik izolasyon adımları için bir ayrışmış CNS hücre süspansiyonu kullanarak malzeme maliyetlerinden tasarruf sağlar. Ek olarak, farklı farelerin kullanımından kaynaklanan olası bir teknik önyargı en aza indirilir.
Protokolün bir sınırlaması, dişi C57BL / 6J farelerinin neredeyse özel kullanımı olabilir. EAE bağışıklama protokolü dişi fareler için tasarlanmış ve oluşturulmuştur, bu nedenle bu hücre izolasyon protokolü dişi C57BL / 6J farelerinde de uygulanmıştır. Bununla birlikte, bu protokolün geliştirilmesi sırasında, ortaya çıkan hücre sayısı veya saflıkları üzerinde herhangi bir etki tanınmadan, saf erkek fareler de kullanılmıştır. Başka bir kısıtlama, nöronların manyetik hücre izolasyonunu etkiler, çünkü pozitif bir seçim açısından nöronların izolasyonu için spesifik bir mikro boncuk yoktur. Biyotin etiketlemesi ve tüm nöronal olmayan hücrelerin tükenmesi yoluyla saf bir tek hücreli süspansiyonun elde edilebileceği varsayılmıştır (Tablo 2). Bu varsayım, NeuN'nin söz konusu akış sitometrisi saflık paneline entegre edilmiş nöronlar için spesifik bir nükleer belirteç olarak kullanılmasıyla doğrulandı. Diğer bir sınırlama, EAE farelerinde mikroglia izolasyonu ile ilgilidir. Burada elde edilen hücre verimleri, MACS protokolünden sonra ek sıralama adımı nedeniyle diğer hücre tiplerine göre azalır. Ayrıca, sıralamanın diğer hücre popülasyonlarına kıyasla mikroglia'nın mekanik stresini arttırdığı iddia edilebilir. Bireysel sıralama stratejileri, farklı miktarlarda hücre verimine yol açabilir. İzole hücre sayısı beklenenden veya istenenden azsa, geçit kurulumunun ayarlanması ve/veya canlı/ölü ayrımının iyileştirilmesi önerilir.
Protokoldeki kritik bir adım, enkazın kaldırılmasını temsil eder. İstenen üç ayrı fazı oluşturmak için gradyan çok yavaş ve nazikçe katmanlanmalıdır (Şekil 2A). Sadece iki üst fazdaki miyelin ve diğer kalıntı kalıntıları tamamen çıkarılırsa (Şekil 2E), saf tek hücreli süspansiyonlar üretilebilir ve daha fazla kontaminasyon azaltılabilir. Ortaya çıkan hücre süspansiyonları saflıktan yoksunsa, bu muhtemelen tüm mikro boncukların doğru kullanımının güvencesinin yanında ilk önce iyileştirilmesi gereken protokolün bölümüdür.
Bu tür deneylerde saflık ve canlılıkta yüksek seviyeler elde etmek zor olabilir. Sorun giderme için bazı öneriler şunlardır:
-Farklı mikro boncukların kontaminasyonunu önlemek ve özellikle sonraki yetiştirme için tekrarlanan kullanımı sağlamak için steril koşullar altında çalışmak zorunludur.
-Karışıklıkları önlemek için her tüpün etiketlenmesi şiddetle tavsiye edilir.
-Soğutulmamış reaktiflerin/tamponların kullanımından kaçının. Yüksek canlılık sağlamak için tüm deney boyunca tüm hücre süspansiyonlarını buz üzerinde saklayın.
-Farklı çalışma adımları arasındaki süreyi mümkün olduğunca kısa tutun. Protokolde denemenin duraklatılmasının önerildiği belirli bir bölüm yoktur.
-Belirtilen kuluçka sürelerine uymak son derece önemlidir.
Sonuç olarak, tüm ana CNS'de yerleşik hücre tiplerinin bir CNS replikasyonundan eşzamanlı izolasyonu için bu mevcut protokol, karmaşık nöronal ağları ve nöroinflamatuar yolları ex vivo olarak bir CNS hücre süspansiyonundan analiz etme imkanı sunar. Bu nedenle, CNS'de yerleşik hücreler, hastalık seyrinin farklı aşamalarında, örneğin nöroinflamasyon, nörodejenerasyon ve / veya EAE'de remisyon sırasında araştırılabilir. Ayrıca, hücre-hücre etkileşimleri ve biyokimyasal yollar bireysel düzeyde incelenebilir ve deney grupları içindeki değişkenlik azaltılabilir. Ayrıca, daha fazla fonksiyonel tahlil ve doğrulama için izole edilmiş CNS hücrelerinin fraksiyonlarını monokültürlerde yetiştirme fırsatı da vardır. Hepsi bir arada, bu protokol klinik öncesi ve klinik araştırma yaklaşımlarını potansiyel olarak etkileyen önemli ilerlemeler sunar.
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışması olmadığını beyan eder.
Teşekkürler
Figürler Adobe Illustrator (sürüm 2023) ve Servier Medical Art (https://smart.servier.com) kullanılarak oluşturulmuştur. Antonia Henes, Jürgen Manchot Stiftung tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
Referanslar
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır