Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Aşil Tendonu Sıkışmasının Mekanobiyolojisini İncelemek için Murin Hind Limb Eksplant Modeli
Bu Makalede
Özet
Tendon sıkışmasının mekanobiyolojisini keşfetmek için uygun bir model sağlayarak, sürekli hücre canlılığı ile murin arka ekstremite eksplantlarında Aşil tendonu insokulasyonunun sıkışmasının neden olduğu fibrokartilajinöz değişikliği yeniden yaratan özel bir deneysel platform ve doku kültürü protokolü sunuyoruz.
Özet
Tendonun kemiğe çarpması, glikozaminoglikan (GAG) açısından zengin matris birikimi ve kollajen ağının yeniden şekillenmesi ile karakterize lokalize bir fibrokartilaj fenotipi ortaya çıkaran, belirgin şekilde yükselmiş enine kompresyon gerilmesi ile çok eksenli bir mekanik gerilme ortamı oluşturur. Fibrokartilaj, sağlıklı tendonların sıkışmış bölgelerinde normal bir özellik iken, aşırı GAG birikimi ve kollajen ağının düzensizliği tendinopatinin ayırt edici özellikleridir. Buna göre, sıkışma klinik olarak tendinopatinin başlamasında ve ilerlemesinde önemli bir ekstrinsik faktör olarak kabul edilmektedir. Bununla birlikte, tendon sıkışmasının altında yatan mekanobiyoloji yeterince çalışılmamıştır. Tendon sıkışmalarına hücresel yanıtı aydınlatmaya yönelik önceki çabalar, hücrelere tek eksenli kompresyon uygulamış ve tendon eksplantlarını in vitro olarak eksize etmiştir. Bununla birlikte, izole hücreler, mekanoyanıt için çok önemli olan üç boyutlu bir hücre dışı ortamdan yoksundur ve hem in vitro hem de eksize edilmiş eksplant çalışmaları, sıkışan bölgenin anatomik özelliklerine bağlı olarak in vivo tendon sıkışması tarafından üretilen çok eksenli gerilme ortamını özetlemekte başarısız olur. Ayrıca, in vivo tendon sıkışma modelleri, mekanik gerilme ortamı üzerinde kontrolden yoksundur. Bu sınırlamaların üstesinden gelmek için, Aşil tendonu sıkışmasının mekanobiyolojisini incelemek için uygun yeni bir murin arka uzuv eksplant modeli sunuyoruz. Bu model, lokal anatomiyi korumak için Aşil tendonunu yerinde tutar ve hücreleri doğal ortamlarında tutarken, pasif olarak uygulanan ayak bileği dorsifleksiyonu sırasında Aşil tendonunun kalkaneus üzerine sıkışmasının oluşturduğu çok eksenli gerilme ortamını yeniden üretir. Bu modelin ayrılmaz bir parçası olan bir doku kültürü protokolünü tanımlıyoruz ve 7 gün boyunca sürekli eksplant canlılığını belirleyen verileri sunuyoruz. Temsili sonuçlar, artmış histolojik GAG boyaması ve sıkışmaya sekonder azalmış kollajen lif dizilimi olduğunu gösterir, bu da artmış fibrokartilaj oluşumunu düşündürür. Bu model, farklı mekanik yükleme rejimlerini araştırmak için kolayca uyarlanabilir ve sıkışmaya yanıt olarak Aşil tendonundaki fenotipik değişime aracılık eden mekanizmaları tanımlamak için ilgilenilen moleküler yolların manipülasyonuna izin verir.
Giriş
Aşil tendonu ve rotator manşet tendonları da dahil olmak üzere çok sayıda tendon, normal anatomik konumlandırma nedeniyle kemik sıkışması yaşar1,2,3,4. Tendon sıkışması, uzunlamasına lif eksenine enine yönlendirilmiş basınç gerilimi oluşturur5,6,7. Tendon sıkışma bölgeleri, büzülmüş, yuvarlak hücrelerin (fibrokondrositler) belirgin şekilde artmış glikozaminoglikan (GAG) içeriğine sahip düzensiz bir kollajen ağı içine gömüldüğü benzersiz bir fibrokartilaj fenotipi gösterir2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. Önceki çalışmalar, tendon sıkışması tarafından üretilen farklı mekanik ortamın, altta yatan mekanizmalar belirsiz olsa da, büyük agrega eden proteoglikanların, özellikle de agreganın birikmesini sağlayarak bu GAG açısından zengin matrisi sürdürdüğünü göstermektedir1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. Fibrokartilaj, sağlıklı tendonların sıkışmış bölgelerinde normal bir özellik iken, aşırı fibrokartilaj oluşumu ile ilişkili anormal proteoglikan metabolizması, kronik olarak sıkışan tendonlarda orantısız bir şekilde ortaya çıkan yaygın ve zayıflatıcı bir hastalık olan tendinopatinin ayırt edici bir özelliğidir1,40,41,42,43,44,45,46,47,48,49. Buna göre, tendon sıkışması, rotator manşet hastalığı ve insersiyonel Aşil tendinopatisi (IAT) dahil olmak üzere en yaygın tendinopatilerin birçoğunu tetikleyen önemli bir ekstrinsik faktör olarak klinik olarak kabul edilmektedir50,51,52. Günümüzde tendinopati tedavisi yetersizdir. Örneğin, ÖÇT'li hastaların yaklaşık% 47'si başarısız konservatif tedaviden sonra cerrahi müdahaleye ihtiyaç duyar ve postoperatif sonuçlar değişkendir53,54,55,56. Sıkışma ve tendinopati arasındaki belirgin ilişkiye rağmen, sıkışan tendondaki hücrelerin mekanik ortamlarını algıladıkları ve tepki verdikleri mekanobiyolojik mekanizmalar yetersiz tanımlanmıştır, bu da tendinopati patogenezinin anlaşılmasını engellemekte ve yetersiz tedaviye neden olmaktadır.
Eksplant modelleri, tendon mekanobiyolojisi57,58 çalışmasında yararlı araçlardır. Tendon sıkışmasının mekanobiyolojisini anlamaya yönelik ilk adım olarak, daha önce yapılan birkaç çalışma, hücrelere basit tek eksenli kompresyon uygulanmasını veya eksize edilentendon eksplantlarını takiben hücresel yanıtı araştırmıştır 27,29,30,31,32,33,34,39. Bununla birlikte, in vitro hücreler, gerinim transferini kolaylaştıran, mekanik deformasyonla salınan önemli büyüme faktörlerini ve sitokinleri tutan ve mekanotransdüksiyonda rol oynayan fokal yapışma kompleksleri için substrat sağlayan hücre dışı ve periselüler matrislerden yoksundur57,59. Ek olarak, hem in vitro hem de eksize edilmiş eksplant çalışmaları, sıkışan bölgeninanatomik özelliklerine bağlı olarak in vivo tendon sıkışması tarafından üretilen çok eksenli mekanik gerilme ortamını özetlemekte başarısız olmaktadır 5,6. Sıkışan Aşil tendonu girişi bağlamında, bu, retrokalkaneal bursa ve Kager yağ yastığı 60,61,62,63 gibi çevre dokuları içerir. Tersine, tendon sıkışmasının in vivo modelleri 25,28,36,37,38,64,65,66, doğrudan tendona uygulanan yükün büyüklüğü ve sıklığı üzerinde minimum kontrole izin verir, bu da tendon mekanobiyolojisini incelemek için in vivo modellerin iyi bilinen bir sınırlamasıdır 57,58,67,68,69,70. Tendon gerilmesinin in vivo olarak ölçülmesindeki zorluklar göz önüne alındığında, bu modellerde üretilen iç gerinim ortamı genellikle zayıf bir şekilde karakterize edilir.
Bu yazıda, bu doku kültürü protokolü ile eşleştirildiğinde, eksplant kültüründe 7 gün boyunca canlılığı koruyan ve tendon sıkışmasının biyolojik sekellerinin incelenmesine izin veren, tüm murin arka uzuv eksplantları içinde kalkaneus üzerine Aşil tendonu girişinin sıkışmasını yeniden oluşturan özel bir deneysel platform sunuyoruz. Platform, kulpların tutturulması için temel sağlayan 3D baskılı bir polilaktik asit (PLA) tabanı ve 3D baskılı PLA hacim azaltma eki üzerine inşa edilmiştir. Tutamaklar, üst bacak ve dizini Aşil miyotendinöz bileşkesine proksimal, arka bacak kaudal yönü yukarı bakacak şekilde sıkıştırmak için kullanılır ve Aşil tendonunun bir ultrason probu veya ters mikroskop kullanılarak yukarıdan görüntülenmesine izin verir (Şekil 1A). Hacim azaltma eki, tabandaki bir iz boyunca kayar ve gerekli doku kültürü ortamı hacmini azaltır. Arka pençenin etrafına sarılmış örgülü bir çizgi, taban tasarımı ve 3D baskılı bir PLA klipsi kullanılarak platformdan dışarı yönlendirilir. İpi çekerek, arka pençe dorsiflekse edilir ve Aşil tendonu girişi kalkaneusa çarparak enine basınç gerilmesininartmasına neden olur 5,6 (Şekil 1A). Platform, doku kültürü ortamına batırılmış arka bacak eksplantlarını koruyan akrilik bir banyo içinde bulunur. Gergin ipin yapışkan bantla banyonun dışına sabitlenmesi, Aşil tendonu girişinin statik sıkışmasını sağlamak için ayak bileği dorsifleksiyonunu korur. 3D baskılı bileşenler için CAD dosyaları, deneysel ihtiyaçlara uyacak şekilde değişiklik için bir dizi ticari ve ücretsiz, açık kaynaklı CAD yazılımına içe aktarmaya izin veren birden fazla formatta (Ek Dosya 1) sağlanır. İmalat için 3D yazıcılara erişim mevcut değilse, CAD dosyaları, parçaları düşük maliyetle basacak ve gönderecek çevrimiçi 3D baskı hizmetlerine sağlanabilir.
Daha da önemlisi, triceps surae-Achilles kas külotendinöz kompleksi hem diz hem de ayak bileği eklemlerini kapsar 71,72,73. Sonuç olarak, Aşil tendonundaki gerilme gerilmesi diz fleksiyonundan etkilenir. Diz ekstansiyonu Aşil tendonunu gergin hale getirirken, diz fleksiyonu gerginliği azaltır. Önce dizi uzatarak ve daha sonra ayak bileğini pasif olarak dorsiflekse ederek, sıkışan yerleştirmedeki basınç gerilmeleri, gerilme gerilmelerinin üzerine bindirilebilir. Tersine, diz bükülmüş durumdayken ayak bileğini pasif olarak dorsiflekse ederek, gerilme gerilmesi azalır ve basınç gerilmesi kalır. Mevcut protokol bu tür üç koşulu araştırıyor. 1) Statik sıkışma için, gerginliği azaltmak için diz bükülürken, girişi sıkıştırmak için ayak tibiaya göre < 110°'ye kadar dorsifleks edilir. 2) Başlangıç gerginlik grubu için, ayak bileği diz uzatılmış olarak 145 ° dorsifleksiyonun üzerine uzatılır ve yerleştirmede ağırlıklı olarak gerilme gerilimi oluşturur. 3) Yüksüz grup için, eksplantlar, dışarıdan uygulanan yükün yokluğunda diz ve ayak bileği nötr pozisyonlarda olacak şekilde bir Petri kabında kültürlenir. Yukarıda belirtilen açılar, ayak ve kaval kemiğinin 180°'lik bir açıyla paralel ve 90°'lik bir açıyla dik olduğu bir koordinat sistemine göre fotoğrafik olarak ölçülür.
Protokolün temel adımları şunları içerir: 1) arka bacak eksplantlarının diseksiyonu ve cildin ve plantaris tendonunun dikkatli bir şekilde çıkarılması; 2) 48 saatlik bir deksametazon ön işlemini takiben eksplant kültürü; 3) doku kesiti ve histolojik boyama; ve 4) fibrokartilaj oluşumunu değerlendirmek için renkli görüntü analizi. Diseksiyonu takiben, her bir arka ekstremite eksplantı, deksametazon74 ile takviye edilmiş kültür ortamında 48 saat boyunca ön işleme tabi tutulur. Her fareden alınan kontralateral uzuvlar, biyolojik değişkenliği kontrol etmeye yardımcı olan ikili karşılaştırma için ayrı deney gruplarına atanır. Ön işlemden sonra, eksplantlar yukarıda tarif edildiği gibi platformlara yerleştirilir ve 7 gün daha kültürlenir (Şekil 1B). 48 saatlik ön işlemden hemen sonra eksplantların çıkarıldığı bir ön işlem görmüş (0. gün) grubuna ek karşılaştırmalar yapılır.
Eksplant kültüründen sonra, arka bacaklar kesilir, formalin sabitlenir, kireçten arındırılır ve parafine gömülür. Sagital oryantasyonda seri kesitleme, Aşil tendonunun miyotendinöz bileşkeden kalkaneal girişe kadar görselleştirilmesini sağlarken, kesit derinliğinin tüm tendon boyunca izlenmesine izin verir. Terminal deoksinükleotidil transferaz (TdT) aracılı dUTP X-nick etiketleme (TUNEL), apoptoza sekonder DNA hasarını görselleştirmek ve canlılığı değerlendirmek için kullanılır. GAG boyamasındaki değişiklikleri ölçmek için toluidin mavisi histolojisi ve özel renkli görüntü analizi yapılır. Toluidin mavisi boyalı doku kesitleri daha sonra kollajen lif organizasyonundaki değişiklikleri karakterize etmek için SHG görüntülemesi için kullanılır (Şekil 1B).
Sağlanan temsili sonuçlar, GAG'den zengin matrisin histolojik olarak boyanmasının değiştiğini ve model içinde 7 günlük statik sıkışma ile oluşturulan hücre dışı kollajen ağının düzensizliğini göstermektedir. Bu model, sıkışmaya bağlı fibrokartilajinöz değişimin altında yatan moleküler mekanizmaları araştırmak için kullanılabilir.
Protokol
Tüm hayvan çalışmaları, Rochester Üniversitesi Hayvan Kaynakları Komitesi tarafından onaylandı.
1. Doku kültürü ortamının hazırlanması
- Dulbecco'nun Modifiye Kartal Ortamında (1x DMEM) tüm eksplantları 37 °C ve% 5 CO2'de bir inkübatörde %1 v / v penisilin-streptomisin ve 200 μM L-askorbik asit ile kültürleyin. İlk 48 saatlik ön işlem için, her bir eksplantın 100 nM deksametazon74 ile desteklenmiş 70 mL kültür ortamında kültürlenmesi. Ön tedaviden sonra, her 48-72 saatte bir ortam değiştirerek, deksametazon olmadan 7 gün daha kültür uzuvları.
NOT: Kültür ortamına fetal sığır serumu gibi serumların eklenmesi, Wunderli, Blache ve Snedeker57 tarafından sağlanan önerilere uygun olarak tavsiye edilmez. Kısaca, serumsuz koşullar, in vivo olarak var olan avasküler, besin açısından fakir tendon mikro ortamını daha iyi temsil eder. Ayrıca, serum takviyesi, belirli kültür koşulları altında doku bozulmasınıteşvik edebilir 75 ve tendon patolojisinin57 her iki özelliği olan hücre proliferasyonunu ve doku dışına göçü uyarabilir. - Yüksüz grup için, her bir eksplantı 70 mL besiyerinde kültürleyin. Temel gerilim ve statik çarpma grupları için, her platform, uzvu su altında tutmak için yaklaşık 125 mL kültür ortamı gerektirir. Bu hacim, üst bacağın tutamaklardaki konumuna ve başta dolgu yoğunluğu olmak üzere 3D baskı parametrelerine bağlı olarak değişebilir.
2. Eksplant diseksiyon ve deksametazon ön tedavisi
- Fareleri CO2 inhalasyonu ve sekonder servikal çıkık yoluyla veya kurumsal yönergelere göre ötenazi yapın. Bu protokol, 1 yaşından küçük C57BL/6 fareleri kullanır. Arka uzuv boyutu yaşla birlikte artacaktır ve tutamaklara sığması zorlaşabilir.
- Diseksiyondan önce, 70 mL önceden ısıtılmış (37 °C) kültür ortamını steril bir biyolojik güvenlik kabininde (BSC) 100 mm (çap) x 25 mm (yükseklik) Petri kabına aktarın. 100 nM çalışma konsantrasyonu elde etmek için deksametazon ekleyin.
- Diseksiyonlar, arka ekstremite eksplantlarını BSC'ye aktarmadan önce diseksiyon boyunca hızlı bir şekilde çalışarak, emici alt pedler kullanılarak tezgah üzerinde gerçekleştirilebilir. Pürüzsüz, düz, ince uçlu forseps içeren bu diseksiyon için gerekli cerrahi aletleri bir araya getirin; tırtıklı dişlere sahip düz, ince uçlu forseps; ve düz, keskin, ince makas.
- Arka bacak eksplantlarının diseksiyonu için, fareyi sırtüstü pozisyona getirin ve kalça eklemini tanımlayın. İnce makas kullanarak, üst bacağın proksimal ve anterior (kraniyal) yönünü kaplayan deriden küçük (5-10 mm) bir kesi yapın.
- Genişletmek için kesiği ayırın, açıkta kalan üst bacağı parmaklarınızı kullanarak sıkıştırın ve arka uzuvu ayak bileği seviyesine çıkarmak için cildi dikkatlice distal olarak çekin. Bir makas bıçağını ayağın dorsal yönü boyunca derinin altına nazikçe sokun ve ayak parmaklarına uzanan bir kesi yapın. Tamamen çıkarmak için cildi distal olarak çekmeye devam edin.
- Aşil tendonunun ayak bileğine yakın kalkaneusun arka (kaudal) yönüne yerleştirilmesini görselleştirmek için fareyi konumlandırın. Aşil tendonu girişinin proksimalinde, plantaris tendonu doğrudan Aşil tendonunun medial sınırına bitişik olarak uzanır ve kalkaneusun arka yönünden geçerek ayağın plantar yönüne doğru distal olarak uzanır.
- Plantaris tendonunu çıkarmak için, pürüzsüz, ince uçlu forsepslerin bir ucunu iki tendon arasına dikkatlice yerleştirin ve ucu plantaris tendonunun altından medial olarak uzatın. Ucu proksimal olarak çizin ve plantaris kasını yırtın. İnce uçlu, tırtıklı forseps kullanarak, plantaris tendonunun ayrılmış proksimal ucunu tutun ve çıkarmak için distal olarak çekin.
- Kalça ekleminde, pelvisi kesmek ve arka bacakları izole etmek için ince makas kullanın. Kalan pelvisi kaldırmak ve femur başını ortaya çıkarmak için makası kullanın.
- Arka bacak eksplantını BSC'ye ve deksametazon içeren hücre kültürü ortamı içeren tabağa aktarın. Çanağı inkübatöre taşıyın ve 48 saat boyunca ön işlemden geçirin.
3. Eksplant kültürü ve yükleme platformları
- 48 saatlik ön işlem sona erdiğinde, yeterli miktarda kültür ortamını önceden ısıtın (bölüm 1). Bu noktadan itibaren, kültür ortamına deksametazon eklenmeyecektir. Şu anda, ön işlem görmüş (0. gün) grubundaki uzuvlar sabitlenebilir, kireçten arındırılabilir ve gelecekteki kesit, boyama ve analiz için parafine gömülebilir.
- Yüksüz grup için, ön işlem ortamını aspire edin ve eksplantları taze Petri kaplarına aktarın, her birine 70 mL kültür ortamı ekleyin ve inkübatöre geri dönün.
- Temel gerilim ve statik çarpma grupları için eksplant platformları hazırlayın. Kavrama plakalarına benzer boyutta zımpara kağıdı parçaları kesin. Statik çarpma grubu için, yaklaşık 18 inç uzunluğunda örgülü ip parçalarını kesin ve hattın uzunluğu boyunca yarıya kadar gevşek bir el üstü düğümü önceden bağlayın. Her akrilik banyoyu kaplayacak şekilde alüminyum folyo parçalarını yırtın ve %70 etanol (EtOH) püskürtün. Hazırlıkları BSC'ye aktarın.
- Her platform bir akrilik banyo, taban, hacim azaltma eki, klips ve kulplar içerir. Her tutamak, iki merdane ve tutamakları tabana bağlayan bir M5 x 0,8 mm diş x 10 mm uzunluğunda vida dahil olmak üzere üç farklı tipte vida içerir; kulpları sıkıştırmak için plakaları uzatan iki M6 x 1 mm diş x 20 mm uzunluğunda vida; ve dört sıkıştırma yayı ile birlikte kulpları açmak için plakaları geri çeken dört adet M3 x 0,5 mm diş x 14 mm uzunluğunda vida.
- Tüm bileşenleri, bir sızıntı durumunda tüm kültür ortamlarını yakalayabilen ikincil kaplara yerleştirin. % 10'luk ≥ çamaşır suyu çözeltisine batırın ve en az 1 saat bekletin. Çamaşır suyu solüsyonunu musluk suyuyla durulayın (gerektiğinde otoklav) ve BSC'ye geçin.
NOT: Kirlenmeyi gidermek için tüm musluk suyunu otoklavlamayı veya arıtılmış su kullanmayı düşünün. Kontaminasyonu ele alırken ek ipuçları için Tartışma'ya bakın. - Merdaneleri tutamaklara takmak için M3 vidaları ve sıkıştırma yaylarını kullanın, M5 vidayı kullanarak tutamakları tabana sabitleyin ve M6 vidaları merdanelere oturana kadar takın. Zımpara kağıdını plakalara yapıştırmak için çift taraflı bant kullanın, ardından zımpara kağıdının plakalara yapışmasını sağlamak için tutamakları kapatın. Tüm platformlar için tekrarlayın.
- Bir platform yüklemeye hazır olduğunuzda, tutamakları tamamen açın ve forseps kullanarak, üst bacağı ve dizini Aşil tendonunun yüzeysel yüzeyi yukarı bakacak şekilde plakaların arasına yerleştirin (Şekil 1A). Yavaşça yerinde tutmak için tutamakları gevşek bir şekilde kapatın.
- Açıkta kalan femur başını veya ayağını tutmak için forseps kullanın ve yerine sabitlemek için tutamakları kademeli olarak kapatırken diz fleksiyon açısını manipüle edin. Başlangıç gerginlik grubu için, diz eklemini daha önce açıklandığı gibi uzatın. Diz uzatıldığında kavramalar sıkılaştıkça, ayak bileği doğal olarak uzamalıdır. Statik sıkışma grubu için, diz eklemini daha önce açıklandığı gibi tutamaklar arasında esnetin.
- Statik çarpma grubu için, ipin üst düğümünü distal pençenin etrafına yerleştirin ve sıkın. İpi, eksplantın altında bulunan tabandaki bir yuvadan ve klips deliğinden geçirin. Tabanı akrilik banyoya yerleştirin ve klipsi banyonun üst kenarına sabitleyin (Şekil 1A).
- Ayağı kaval kemiğine göre en az 110° dorsiflex yapmak için ipi çekin ve ipi klipsten çıkarken işaretlemek için kalıcı bir işaretleyici kullanın. Daha sonra dorsifleksiyon açısını ölçmek için bu pozisyonda eksplantın bir fotoğrafını çekin (Şekil 1A).
- Tabanı çıkarın ve tabandaki bir ray boyunca kaydırarak hacim azaltma ekini takın. Tabanı (şimdi hacim azaltma ekine takılı) akrilik banyoya geri yerleştirin ve klipsi üst kenara yeniden yerleştirin. İşaretli ipi kılavuz olarak kullanarak orijinal dorsifleksiyon açısına dönmek için ipi çekin ve statik dorsifleksiyonu korumak için ipi banyonun dışına bantla sabitleyin.
- Temel gerginlik grubu için, eksplant tutamaklar arasına yerleştirildikten sonra hacim azaltma eki olan tabanı akrilik banyoya yerleştirin ve dorsifleksiyon açısının ölçülmesi için bir fotoğraf çekin.
- Eksplantları daldırmak için her platforma 125 mL önceden ısıtılmış (37 °C) kültür ortamı ekleyin. Banyonun üstünü alüminyum folyo ile örtün, ikincil bir kaba koyun ve inkübatöre taşıyın. 7 ek gün boyunca kültür, her 48-72 saatte bir medya değiştirme.
NOT: Banyonun üst kısmına yerleştirilen bant, PLA parçalarının yüzmesini önleyebilir.
4. Fiksasyon, dekalsifikasyon ve parafin gömme
- Eksplant kültürünü takiben, ayak tırnaklarını/distal ayak parmaklarını kesmek için makas kullanın ve Aşil miyotendinöz bileşkesinin proksimalindeki üst bacağı kesin. Kesilen her ayak bileği eklemini köpük biyopsi pedleriyle kaplı bir işleme kasetine yerleştirin. Ayak bileğini yaklaşık 90° dorsifleksiyonda konumlandırmak için ayak bileğini kaset köşesine itin ve yerinde tutmak için kaseti kapatın.
- % 10 nötr tamponlu formalin (NBF) içinde 3 gün boyunca sabitleyin ve pH'ı 7.4-7.6'ya ayarlanmış pH'ı 7.4-7.6'ya ayarlanmış damıtılmış suda (diH2O) çözülmüş% 14 etilendiamentetraasetik asit (EDTA) içinde 2 hafta boyunca kireçten arındırın.
- Tuzları çıkarmak için, numuneleri her iki 1x fosfat tamponlu salin (PBS) ve ardından diH2O, her biri 5 dakika içinde üç kez iyice durulayın. Parafin histolojisi için rutin numune işleme gerçekleştirin: dereceli bir dizi EtOH ile dehidre edin, ksilen içinde temizleyin ve parafin mumu ile sızın. Aşağıdaki bölüm 5'te açıklandığı gibi medial-lateral ilerlemede Aşil tendonu boyunca sagital doku kesitleri elde etmek için örnekleri parafine yönlendirin ve gömün (Şekil 1B).
5. Doku kesiti
- Bir mikrotomla, bölümler blok yüzüne paralel olana kadar numuneyi dikkatlice kesin. Eklemin medial yönünden ayak bileğine kaba bir şekilde kesin, Aşil tendonu girişinin medial sınırına ulaşmadan önce durun.
- Sıcaklığı ve hidrasyonu ayarlamak için numuneyi bir buz bloğuna aktarın ve bıçakları değiştirin (veya mevcut bıçağın yeni bir bölümüne geçin). Numuneye 10 μm kalınlığında kesit almaya devam edin ve parlak alan mikroskobu ile Aşil tendonu girişine girişi dikkatlice belirleyin. Tanımlandıktan sonra, tüm Aşil tendonu yerleştirme boyunca seri kesit izleme bölüm numarasını (yani doku derinliği) gerçekleştirin.
6. Deparafinizasyon/rehidrasyon ve lam seçimi
- Aşağıdaki her bir tahlil için, her bir kontralateral uzuv çiftinden seviye uyumlu doku kesitleri seçin. Boyamadan önce, bir sürgülü rafa yerleştirin ve her biri 5 dakika olmak üzere 3 ksilen değişimi, 2 değişiklik %100 EtOH, 2 değişiklik %95 EtOH ve 1 değişiklik %70 EtOH ile hareket edin. diH2O'da rehidrasyonu bitirin.
7. Aşil tendonu canlılığını değerlendirmek için TUNEL
- TUNEL etiketleme için üreticinin protokolüne göre lekeleyin. 20 μg / mL proteinaz K içinde oda sıcaklığında 20 dakika inkübe edin ve diH2O'da durulayın. 50 μL TUNEL leke çözeltisinde (5 μL enzim çözeltisi, 45 μL etiket çözeltisi) 37 ° C'de 1 saat inkübe edin. diH2O'da durulayın. DAPI ve lamel içeren antifade reaktifi ile monte edin.
- Aşil tendonu yerleştirmesini 4x objektif lensli bir floresan mikroskobu kullanarak görüntüleyin. Tüm çekirdekleri görselleştirmek için bir DAPI kanalı (uyarma/emisyon dalga boyları = 360/460 nm), apoptotik çekirdekleri görselleştirmek için bir TUNEL (TMR Red) kanalı (uyarma/emisyon dalga boyları = 540/580 nm) ve mümkünse bir parlak alan kanalı ekleyin.
- Görüntü analizi için, görüntüleri FIJI/ImageJ veya MATLAB gibi ROI tabanlı işlemeye uygun bir görüntü analiz yazılımına aktarın. Görünümdeki tüm Aşil tendonunu özetleyen bir ilgi alanı (ROI) tanımlayın (Şekil 2A), kültüre yerleştirildiğinde diseksiyon ve çevresel koşullardaki ani değişikliklerin neden olduğu ölüme oldukça duyarlı olan epitenondaki hücreler hariç.
- Bunu yapmak için, parlak alan görüntüsünü içe aktararak ve tendonun sınırlarını izlemek ve çevrelemek için drawpolygon() işlevini kullanarak MATLAB'de ROI seçimini gerçekleştirin. MATLAB, ROI için bir Polygon nesnesi oluşturur ve bu nesne daha sonra yalnızca Aşil tendonu içindeki çekirdekleri analiz etmek için createMask() kullanarak ROI dışındaki piksel yoğunluğu verilerini maskelemek için DAPI ve TUNEL kanal görüntülerine uygulanabilir.
- DAPI ve TUNEL kanal görüntülerini içe aktarın ve doku bölümünde tesadüfen yakalanan kemik, kas veya yağ gibi cansız dokulardaki apoptotik çekirdeklerin maksimum floresan yoğunluğuna normalleştirerek apoptotik (TUNEL+) çekirdekleri tanımlamak için bir floresan yoğunluğu eşiği belirleyin. Görüntüler maskelendikten sonra, Aşil tendonu içindeki apoptotik çekirdeklerin (TUNEL+ çekirdek/DAPI çekirdekleri) fraksiyonunu hesaplayın.
8. Fibrokartilaj oluşumunu karakterize etmek için toluidin mavisi histolojisi
- Yeniden sulandırıldıktan sonra (Bölüm 6), kontralateral eksplant çiftlerinden seviye uyumlu doku kesitlerine sahip kayar rafı, buzlu asetik asit kullanılarak pH'ı 4.0'a ayarlanmış 0.1 M sodyum asetat tamponunda %0.4 w/v Toluidin mavisi O'ya aktarın. Oda sıcaklığında 10 dakika inkübe edin, ardından her biri 30 saniye boyunca diH2O'da 3x durulayın.
- %95 EtOH'lik üç değişiklik ve %100 EtOH'lik iki değişiklikle, her biri 30 saniye ile dehidre edin. Her biri 1 dakika olmak üzere üç ksilen değişikliği ile temizleyin. Ksilen bazlı montaj ortamına sahip lamel
- Aşil tendonu yerleştirmesinin 24 bit Kırmızı-Mavi-Yeşil (RGB) renkli görüntülerini elde edin. Örneğin, bu protokol için, bir dijital renkli kamerayı 4x objektifli basit bir parlak alan mikroskobunun göz merceğine bağlamak için bir adaptör kullanın.
- Aşil tendonu yerleştirmesinde basınçlı tendon fibrokartilajı (CTF)16 içindeki Toluidin mavisi boyamadaki farklılıkları ölçmek için (Şekil 3A,B), RGB görüntülerini birden fazla ROI'yi tanımlayabilen ve yönetebilen bir görüntü analiz yazılımına aktarın. Seçenekler arasında FIJI/ImageJ'deki seçimler ve ROI yöneticisi araçları veya MATLAB'deki görüntü işleme araç kutusu bulunur. Piksel/uzunluk ölçeğini ayarlayarak başlayın.
NOT: Yazılım seçimi araştırmacının takdirine bırakılmıştır ve kesinlikle MATLAB veya FIJI/ImageJ ile sınırlı değildir. Yazarlar MATLAB kodu (Ek Dosya 2), uygulamayı açıklayan belgeler (Ek Dosya 3) ve örnek bir görüntü (Ek Dosya 4) sağlamıştır. Araştırmacıları, gerektiğinde veya tercih edilen diğer yazılımlarda kullanmak üzere bu kodu alternatif programlama dillerine çevirmeye teşvik ediyoruz. - Tercih edilen yazılımda görüntülenen görüntü ile, derin tendon sınırının kalkaneus ile kesişimini belirleyin. Buradan, CTF'nin derin sınırını oluşturmak için derin tendon sınırı boyunca proksimal olarak 800 μm izleyin. Örneğin, RGB görüntüsünün üzerine etkileşimli olarak bir çoklu çizgi çizmek için MATLAB'deki drawpolyline() işlevini kullanın. MATLAB, çizginin köşelerini içeren, işlenebilen ve 800 μm uzunluğa kadar kırpılabilen bir Polyline nesnesi oluşturur.
- Bu konumdan, lokal lif oryantasyonuna dik olan yüzeysel tendon sınırına bağlanan bir çizgi parçası çizerek CTF'nin proksimal sınırını oluşturun.
- Derin tendon sınırı ile kalkaneusun kesişme noktasına geri dönün ve CTF'yi bağlanma bölgesi fibrokartilajından (AZF) ayıran belirgin gelgit işareti boyunca yüzeysel tendon sınırına bağlanan bir çizgi parçası çizerek CTF'nin distal sınırını tanımlayın16 (Şekil 3A,B). Son olarak, yüzeysel tendon sınırını çevrelemek için izleyerek CTF'nin yüzeysel sınırını oluşturun.
- Yerleştirme boyunca GAG boyamadaki uzamsal varyasyonları tanımlamak için, toplam CTF'yi 4 çeyreğe bölün (Şekil 3A,B). Distal/proksimal bir sınır oluşturmak için derin ve yüzeysel CTF sınırlarının orta noktasını bir çizgi parçasıyla birleştirin. Bu sınırın orta noktasından geçerek, yüzeysel/derin bir sınır oluşturmak için distal ve proksimal CTF sınırlarının orta noktalarını fiber oryantasyonu boyunca birleştirin.
- Bu 6 sınır, CTF'nin tamamını temsil eden yatırım getirisini ve aynı zamanda CTF'yi alt bölümlere ayıran 4 kadranı tanımlamak için kullanılabilecek bilgiler sağlar. Örneğin MATLAB'de, her bir ROI'nin (CTF, 1-4 arasındaki çeyrekler) sınırlarını tanımlayan köşeleri vektörler halinde derleyin ve her ROI için kapalı Polygon nesneleri oluşturmak için images.roi.Polygon() kullanın.
- ROI'ler tanımlandığında, FIJI'deki renk transformatörü eklentisini, MATLAB'daki rgb2hsv() işlevini veya uygun dönüştürme denklemlerini76 uygulayan diğer yazılımları kullanarak RGB piksel verilerini Ton-Doygunluk-Değeri (HSV) renk uzayına dönüştürün. HSV verileri daha sonra, her bir ton ve doygunluk kombinasyonunun benzersiz bir rengi kodladığı 2B renk tonu doygunluk alanına yansıtılabilir (Şekil 3C).
- Her ROI içinde, ROI'deki ortalama leke rengini tanımlayan ortalama tonu ve doygunluğu hesaplayın. Bu, MATLAB'de, örneğin, özellikle her bir ROI içinde renk doygunluğu piksel verilerini analiz etmek için createMask() kullanarak görüntüyü maskelemek için her bir ROI'yi tanımlayan Polygon nesneleri kullanılarak elde edilebilir.
- Periosteal fibrokartilaj (PF)16 içinde başka bir küçük ROI tanımlayın (Şekil 3A, B) ve ortalama renk tonu ve doygunluğu hesaplayın. Ardından, CTF'nin her bir ROI'sindeki ortalama rengi PF'ninkine ayıran Öklid mesafesini hesaplayın (Şekil 3C).
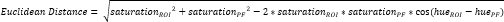
NOT: Öklid mesafesi hesaplaması, ROI'nin ortalama rengi ile mükemmel bir fibrokartilajinöz dokuolan PF'ninki arasındaki benzerlik derecesini tanımlar 16,17,77. Daha küçük bir Öklid mesafesi, görünüşte daha fibrokartilajinöz olan bir ROI rengini gösterir. - ROI rengi PF rengiyle aynıysa maksimum değerin 1 olduğunu ve ROI ve PF rengi renk tonu doygunluğu renk alanı içinde maksimum ayrıma ulaşırsa minimum -1 değerini varsayan fibrokartilaj skorunu hesaplamak için bu mesafeyi kullanın.
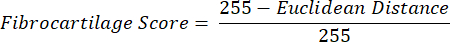
- Her bir uzuvdan doku kesitleri arasında her bir ROI içindeki ton, doygunluk ve fibrokartilaj skoru için ortalama veriler. Kontralateral uzuv grupları arasında eşleştirilmiş istatistiksel karşılaştırmalar yapın.
9. Kollajen ağ organizasyonundaki değişikliği araştırmak için SHG görüntüleme
- 20x nesne mercekli yetenekli bir mikroskop sistemi kullanarak Toluidin mavisi lekeli bölümlerin SHG görüntülemesini gerçekleştirin. Kesit kalınlığı boyunca z-yığınları elde edin ve Aşil tendonu girişini tam olarak yakalamak için gerektiğinde karo taraması yapın.
- SHG görüntülerini tercih edilen bir görüntü analiz yazılımına aktarın ve bölüm 8'de Toluidin mavi görüntü analizi için açıklandığı gibi Aşil tendonu girişinde CTF'yi kapsayan ve alt bölümlere ayıran ROI'leri tanımlayın (Şekil 4A, B).
- SHG görüntüleri MATLAB'a aktarılırsa, bölüm 8'de belirtildiği gibi MATLAB'de CTF ROI'lerini tanımlama yaklaşımını kullanın. ROI'leri tanımladıktan sonra, ROI köşelerini MATLAB'dan .txt dosyaları olarak dışa aktararak ve Dosya > İçe Aktarma > XY Koordinatlarını kullanarak FIJI'ye aktararak ROI koordinatlarını FIJI'ye aktarın. Seçimi üst üste bindirin ve analiz için ROI yöneticisine gönderin.
- Kollajen organizasyonunu ölçmek için, bir ROI'yi kapsayan küçük pencerelerde fiber oryantasyonlarının dağılımlarını hesaplamak için Fourier spektrum analizi yapan FIJI'deki Directionality eklentisini kullanın. Dispersiyon olarak adlandırılan bu dağılımın yayılması, fiber hizalaması ile ters orantılıdır.
NOT: Kollajen lifleri, hizalama/organizasyon eksikliğinden ziyade tendonun brüt eğriliği nedeniyle CTF boyunca farklı pencerelerde değişken yönelimler alabilir. Kollajen organizasyonundaki değişiklikleri, yerleştirme sırasında tendonun brüt eğriliğinden daha iyi ayırt etmek için, daha küçük ROI'leri tanımlamak gerekir. - SHG görüntülerini FIJI'ye aktarın ve piksel/uzunluk ölçeğini ayarlayın. Maksimum piksel yoğunluğu verilerini 2B bileşik görüntüye yansıtın ve ROI Manager'a ROI'ler ekleyin. Her bir CTF ROI'yi sırayla görüntünün üzerine yerleştirin ve ROI içinde tutarlı boyutta 10 küçük alt ROI çizin ve alt ROI'leri ROI yöneticisine ekleyin.
- Her alt ROI içinde, fiber dağılımını hesaplamak için FIJI'deki yönlülük eklentisini çalıştırın. Her bir CTF ROI içindeki alt ROI'ler arasındaki ortalama dağılım verileri ve her bir eksplanttan bölümler arasında her bir CTF ROI içindeki ortalama dağılım verileri. Kontralateral uzuv grupları arasında eşleştirilmiş istatistiksel karşılaştırmalar yapın.
Sonuçlar
TUNEL boyalı doku kesitlerinin temsili görüntüleri, deney gruplarında 7 günlük eksplant kültüründen sonra Aşil tendonunun gövdesinde minimal apoptotik çekirdekleri göstermektedir (Şekil 2A). Bu görüntülerin nicelleştirilmesi, doku kültürü protokolünün, yükleme koşulları boyunca 7 günlük eksplant kültüründen sonra Aşil tendonu içinde ortalama %78'e kadar canlılığı koruduğuna dair kanıt sağlar (Şekil 2B).
Tartışmalar
Bu çalışmada tarif edilen doku kültürü protokolü ile eşleştirilmiş deneysel murin arka ekstremite eksplant platformu, Aşil tendonu girişinde sıkışmaya bağlı fibrokartilaj oluşumunun mekanobiyolojisini incelemek için uygun bir model sağlar. Bu eksplant modelinin faydası, 7 günlük statik sıkışmadan sonra Toluidin mavisi boyamasında önemli ve mekansal olarak heterojen bir değişiklikle birlikte hücre canlılığının korunmasını gösteren temsili sonuçlarla gösterilmiştir. Bu bulgular, di...
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Yazarlar, Rochester Üniversitesi Kas-İskelet Araştırmaları Merkezi'nin Histoloji, Biyokimya ve Moleküler Görüntüleme (HBMI) Çekirdeği'nden Jeff Fox ve Vidya Venkatramani tarafından sağlanan ve kısmen P30AR06965 tarafından finanse edilen destek ve yardım için minnettardır. Ek olarak, yazarlar multifoton mikroskobu ile ilgili yardımları için Rochester Üniversitesi Tıp Merkezi'ndeki Işık Mikroskobu ve Nanoskobu Merkezi'ne (CALMN) teşekkür eder. Bu çalışma R01 AR070765 ve R01 AR070765-04S1'in yanı sıra 1R35GM147054 ve 1R01AR082349 tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
Referanslar
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır