Hastalık ve Onarımda Hücresel Karışmayı Araştırmak için Mühendislik Tendon Toplulukları
Bu Makalede
Özet
Burada, yük taşıyan tendon çekirdek dokusu ile hastalık ve yaralanma ile aktive olan hücre popülasyonlarını içeren bir dışsal bölme arasındaki tendon hücresel karışmasını taklit etmek için bir asambloid model sistemi sunuyoruz. Önemli bir kullanım durumu olarak, sistemin dışsal endotel hücrelerinin hastalıkla ilgili aktivasyonunu araştırmak için nasıl konuşlandırılabileceğini gösteriyoruz.
Özet
Tendonlar, kas kuvvetlerini kemiklere aktararak hareketi sağlar. Kollajen lifleri ve stromal hücre popülasyonlarından oluşan sert bir tendon çekirdeğine güvenirler. Bu yük taşıyan çekirdek, dışsal tendon bölmesini içeren sinovyal benzeri bir doku tabakası tarafından kuşatılır, beslenir ve onarılır. Bu sofistike tasarıma rağmen, tendon yaralanmaları yaygındır ve klinik tedavi hala fizyoterapi ve cerrahiye dayanmaktadır. Mevcut deneysel model sistemlerinin sınırlamaları, yeni hastalık modifiye edici tedavilerin ve nüksü önleyici klinik rejimlerin geliştirilmesini yavaşlatmıştır.
İn vivo insan çalışmaları, sağlıklı tendonları onarım cerrahisi sırasında örneklenen son dönem hastalıklı veya rüptüre dokularla karşılaştırmakla sınırlıdır ve altta yatan tendon hastalığının uzunlamasına çalışmasına izin vermez. İn vivo hayvan modelleri ayrıca opak fizyolojik karmaşıklık, hayvanlar üzerindeki etik yük ve kullanımlarıyla ilişkili büyük ekonomik maliyetler ile ilgili önemli sınırlar sunar. Ayrıca, in vivo hayvan modelleri, ilaçların ve çok hücreli, çok dokulu etkileşim yollarının sistematik olarak araştırılması için uygun değildir. Daha basit in vitro model sistemler de yetersiz kalmıştır. Bunun en önemli nedenlerinden biri, tendon hücrelerini ve işlevlerini anlamlı bir şekilde incelemek için gerekli olan üç boyutlu mekanik yüklemenin yeterince kopyalanamamasıdır.
Burada sunulan yeni 3D model sistemi, murin kuyruğu tendon çekirdek eksplantlarından yararlanarak bu sorunların bazılarını hafifletir. Daha da önemlisi, bu eksplantlara tek bir fareden çok sayıda kolayca erişilebilir, hücresel düzeyde 3D yerinde yükleme modellerini korur ve in vivo benzeri bir hücre dışı matrise sahiptir. Bu protokolde, tendon çekirdeği eksplantlarının, kas kaynaklı endotel hücreleri, tendon kaynaklı fibroblastlar ve kemik iliği kaynaklı makrofajlarla yüklü kollajen hidrojeller ile nasıl artırılacağına dair adım adım talimatlar verilmiştir. Ortaya çıkan tendon topluluklarının, hastalık ve yaralanma sırasında ortaya çıkan çok hücreli karışmayı araştırmak için mekanik olarak veya tanımlanmış mikroçevresel uyaranlar yoluyla nasıl zorlanabileceği gösterilmiştir.
Giriş
Hareketi sağlamak için kas kuvvetlerini kemiklere aktarma işlevlerinde, tendonlar insan vücudunda meydana gelen en aşırı mekanik streslerden bazılarıyla karşı karşıyadır 1,2,3. Yaşlanan toplumlar, artan obezite prevalansı ve mekanik olarak zorlu spor aktivitelerinin artan popülaritesi nedeniyle, gelişmiş ülkelerde tendon hastalıkları ve yaralanmalarının prevalansının artacağı tahmin edilmektedir 4,5,6. Bu artışla mücadele etmek için yeni kanıta dayalı ve hastalık değiştirici tedavi rejimlerinin geliştirilmesi, şu anda mevcut olan model sistemlerinsınırlamaları nedeniyle engellenmiştir 1,7,8.
İdeal olarak, hastalık ve yaralanma onarım modelleri, hedef organın tanımlanmış bir dizi girdi parametresini (hastalık tetikleyicilerini taklit ederek, Tablo 1) ölçülebilir çıktı parametrelerine (hastalık ayırt edici özelliklerini temsil eden, Tablo 2) nasıl işlediğinin incelenmesine izin verirken, kafa karıştırıcı faktörleri kontrol eder. Bu tür model sistemleri kullanan çalışmalar daha sonra hastalık ve yaralanma onarımının altında yatan (pato-) fizyolojik süreçleri tanımlayabilecek ve kliniklerde hastalık ve yaralanma özelliklerini önlemek veya azaltmak için kullanılabilecek bilgileri edinebilecektir. Bu prensibi tendonlara uygulayarak, yararlı bir model sistemi, aşağıdaki ayırt edici özellikleri kapsayan hastalık ve yaralanmaya in vivo tendon yanıtının merkezi kısımlarını özetlemelidir: mikro hasar, inflamasyon, neovaskülarizasyon, hipersellülarite, hızlandırılmış matris döngüsü ve dekompartmantalizasyon 9,10,11,12,13,14,15 . Bu ayırt edici özellikleri temel alarak, başarılı bir tendon hastalığı ve yaralanma onarım modeli sistemi için aşağıdaki gereksinimler çıkarılabilir.
Mekanik aşırı yüklenmenin tendon hasarı ve hastalık patogenezinde merkezi bir faktör olduğu varsayılmaktadır ve bu nedenle mikro hasar oluşturmak için yaygın olarak kullanılan deneysel bir yaklaşımdır16. Bu nedenle, kontrol edilebilir mekanik yüklenebilirlik, tendon hastalığı ve yaralanma onarım modelleri için birincil ön koşuldur. İdeal olarak, model sistemi üç ana modu etkinleştirir: tek esneme-hasar yükleme, yorulma yükleme ve boşaltma 8,17,18. Mekanik deformasyon üzerine, dokuda yerleşik hücreler, boşaltma sırasında veya entezin yakınında meydana gelen çekme kuvvetleri, kesme kuvvetleri (hücreleri çevreleyen kollajen liflerinin kayması nedeniyle) ve sıkıştırma kuvvetlerinin karmaşık bir kombinasyonunu yaşar19,20. Model sistemleri, bu karmaşık yükleme düzenlerini mümkün olduğunca yakın bir şekilde yeniden oluşturmalıdır.
Matris mikro hasarını ortaya çıkarmanın alternatif bir yolu, (pro-) inflamatuar sitokinler, oksidatif stres veya yüksek glikoz konsantrasyonları gibi tendon hastalığı ve yaralanması için sistemik yatkınlıkları taklit eden biyokimyasal stres faktörlerinden yararlanmaktır 21,22,23. Sonuç olarak, kontrol edilebilir bir niş mikroçevre, bir tendon hastalığı ve yaralanma onarım modeli sistemi için avantajlıdır.
Model sistemlerin inflamasyonu, neovaskülarizasyonu ve hiper hücreselliği özetleyebilmesi için ortak bir ön koşul, bu süreçleri yönlendiren hücre popülasyonlarının seçici varlığıdır24. Enflamatuar süreçler için, bu popülasyonlar nötrofilleri, T hücrelerini ve makrofajları içerirken, neovaskülarizasyonu incelemek için endotel hücrelerine ve perisitlere ihtiyaç duyulacaktır 25,26,27,28,29. Tendon fibroblastları sadece tendon onarımı için hayati öneme sahip olmakla kalmaz, aynı zamanda proliferatif ve göç eden hücreler olarak tendon hastalığında gözlenen lokal hiperselülaritedende kısmen sorumludur 30,31,32,33,34,35,36.
Yerleşik hücre popülasyonlarındaki değişikliklerin yanı sıra, tendon matriksi bileşimi tendon hastalığı ve hasarında da değişir 7,37,38,39,40. Hastalıkla ilgili doğru mikroçevresel ipuçlarını sunmak için, model sistemler, örneğin kollajen-1, kollajen-3 ve hücresel fibronektin41'in ilgili orantılı kombinasyonlarını etkinleştirerek, hedeflenen hastalık veya yaralanma aşamasına uygun bir hücre dışı matris bileşimini entegre edebilmelidir.
Sağlıklı tendonların tendon çekirdeğine ve dışsal bölmelere (yani endotenon, epitenon ve paratenon) bölümlere ayrılması, işlevlerinin merkezinde yer alır ve genellikle hastalıklı veya yaralı tendonlarda bozulur 1,42,43,44,45,46,47 . Bu nedenle, 3D tendon bölümlendirmesinin tendon model sistemlerine dahil edilmesi, yalnızca bölümlere ayırma ve yeniden bölümlendirmenin altında yatan süreçleri daha yakından simüle etmek için gerekli değildir, aynı zamanda sitokinlerin ve besinlerin doğru uzay-zamansal gradyanlarının oluşturulmasına da yardımcı olur48,49.
Son olarak, modülerlik, model sistemlerin bir başka merkezi varlığıdır ve araştırmacıların, araştırılan süreçler sırasında daha önce tanımlanan stres faktörlerinin doğru göreceli katkısını ve etkileşimini birleştirmelerine olanak tanır 8,17.
Optimum girdi modalitelerini seçmenin yanı sıra, ortaya çıkan çıktıdaki değişiklikleri ölçebilmek, gözlemleyebilmek ve izleyebilmek önemli bir adımdır. Model sistemin mekanik özellikleri (yani, ayak bölgesi uzunluğu, doğrusal elastik modül, maksimum gerilme gerilmesi, maksimum gerilme gerilmesi, yorulma mukavemeti ve gerilme gevşemesi), tendonun ana işlevini50,51,52 karakterize ettikleri için burada merkezidir. Bu fonksiyonel değişiklikleri doku düzeyindeki değişikliklerle ilişkilendirmek için, yapısal matris hasarını tespit eden (kollajen) ve hastalık ve onarımla ilgili hücre popülasyonlarının proliferasyonunu ve alımını izleyen yöntemlerin etkinleştirilmesi önemlidir 30,53,54,55,56,57,58,59,60.
Ortaya çıkan hücre-hücre ve hücre-matris karışmasını incelemek için, proteinlerin miktar tayini için yeterli miktarlarda izole edilebilmesi veya işaretlenebilmesi gerekir (yani, ELISA, proteomik, immünohistokimya, akış sitometrisi)14,21,61,62. Popülasyona veya en azından bölmeye özgü gen ekspresyon analizi de mümkün olmalıdır (yani, floresanla aktive edilen hücre sıralama [FACS], tek hücreli/toplu RNA dizileme ve gerçek zamanlı kantitatif polimeraz zincir reaksiyonu (RT-qPCR))21,24,27,63. Model sistemi, yukarıda belirtilen çıktı parametrelerinin çoğunun aynı numune üzerinde ve birden fazla numune üzerinde, yüksek verimli çalışmaların kilidini açacak kadar hızlı bir şekilde ölçülmesine izin vermelidir.
İnsan tendon hastalığı ve yaralanma onarımını incelemek için şu anda mevcut olan model sistemler arasında, insan vücudunun kendisi elbette en temsili olanıdır. Aynı zamanda deneysel müdahale ile en az uyumlu olanıdır. Akut tendon yaralanması olan hastalar klinik çalışmalar için bol miktarda bulunurken, erken tendinopatisi (en yaygın tendon hastalığı) olan hastalar büyük ölçüde semptomsuzdur ve genellikle daha ciddi değişiklikler ortaya çıkana kadar klinik olarak tespit edilmez 14,64,65. Bu, tendon homeostazının raydan çıktığı kritik anı ve bu raydan çıkmanın arkasındaki mekanizmalarıbelirlemeyi zorlaştırır 16,66,67,68,69. Ek olarak, sağlıklı tendonlardan biyopsi çıkarmak, kalıcı hasara neden olabileceğinden etik olarak zordur. Ön çapraz bağ rekonstrüksiyonu cerrahisinden elde edilen hamstring tendon kalıntıları genellikle sağlıklı kontroller olarak kullanılır, ancak tendon hastalığı ve yaralanmasından yaygın olarak etkilenen rotator manşet, Aşil ve patellar tendonlara kıyasla işlev, mekanik özellikler, hücre popülasyonları ve matris bileşimi açısından tartışmalı bir şekilde farklılık gösterir 70,71,72,73.
İn vivo hayvan modelleri daha erişilebilir ve izlenebilirdir, ancak kullanımları hayvanlar üzerinde önemli bir etik yük ve araştırmacılar üzerinde ekonomik maliyet getirmektedir. Ek olarak, popüler model hayvanların çoğu ya kendiliğinden tendinopatik lezyonlar geliştirmez (yani sıçanlar, fareler, tavşanlar) ya da içinde yer alan çok hücreli iletişim yollarını izlemek için gerekli primerlerden ve genetiği değiştirilmiş suşlardan yoksundur (yani atlar, tavşanlar).
Basit 2D in vitro model sistemleri, karmaşıklık/izlenebilirlik spektrumunun diğer tarafındadır ve daha kontrol edilebilir bir dizi tetikleyiciye yanıt olarak belirli hücreler arası iletişim yollarının kontrollü, zaman açısından verimli çalışmasına daha iyi izin verir 8,74. Bununla birlikte, bu basitleştirilmiş sistemler genellikle tendon işlevselliğinin merkezinde yer alan çok boyutlu mekanik yüklemeyi (yani gerilim, sıkıştırma ve kesme) özetlemekte başarısız olur. Ek olarak, doku kültürü plastiğinin (çok) yüksek sertlikleri, ilgilenilen hastalık durumunu taklit etmesi amaçlanan kaplamalar tarafından sağlanan herhangi bir matris ipucunu geçersiz kılma eğilimindedir75,76.
Bu dezavantajın üstesinden gelmek için, bileşimi en azından kısmen istenen hastalık durumu77,78,79 ile eşleştirilebilen yüklenebilir bir matris sağlamak için giderek daha karmaşık doku mühendisliği 3D model sistemleri geliştirilmiştir. Yine de, bu sistemler sadece kompleksi doğru bir şekilde kopyalamakla kalmaz in vivo hücre dışı matris bileşimleri ve hücresel yükleme paternleri aynı zamanda genellikle uzun vadeli yüklenebilirlikten ve tendon hastalığını ve yaralanma onarımını koordine eden bölümler arası iletişim yollarını incelemek için gereken bölmeli arayüzlerden yoksundur 48,49,80.
Ex vivo tendon eksplant model sistemleri, periselüler nişler, çapraz bölmeli bariyerler ve ayrıca uzay-zamansal sitokin/besin gradyanları içeren ve gerildiğinde karmaşık yükleme modellerini özetleyen yerleşik bir in vivo benzeri matris bileşiminin belirgin avantajına sahiptir8. Boyuta bağlı besin difüzyon sınırlarının bir sonucu olarak, daha büyük hayvan modellerinden (yani atlardan) elde edilen eksplantların, tendon hastalığı ve yaralanma onarımının uzun süreli çalışması için canlı tutulması zordur 81,82,83. Bu arada, murin türlerinden (yani Aşil tendonu, patellar tendon) daha küçük eksplantların tekrarlanabilir şekilde kenetlenmesi ve mekanik olarak yüklenmesi zordur. Boyutları ayrıca, numuneleri bir araya getirmeden ve verimi düşürmeden hücre, protein ve gen düzeyinde okumalar için toplanabilecek malzeme miktarını da kısıtlar. Bu anlamda, murin kuyruğu tendon fasikülleri, tek bir fareden büyük miktarlarda kolayca temin edilebildikleri, kompleks in vivo periselüler matris bileşimini korudukları ve hücresel yükleme modellerini özetledikleri için tendon hastalığı ve yaralanma onarımının yüksek verimli çalışmasının kilidini açma potansiyeli sunar. Bununla birlikte, ekstraksiyon işlemi sırasında, dışsal bölmelerinin çoğunu kaybederler ve bunlarda, şimdi tendon hastalığını tetiklediği ve onardığı düşünülen vasküler, immün ve fibroblast popülasyonları bulunur 8,18.
Bu boşluğu doldurmak için, murin kuyruğu tendonundan türetilen kor eksplantlarının avantajlarını 3D hidrojel bazlı model sistemlerin avantajlarıyla birleştiren bir model sistem geliştirilmiştir. Bu model sistem, kuyruk tendonu eksplantları84,85 etrafına dökülen hücre yüklü (kollajen-1) bir hidrojelden oluşur. Bu yazıda, endotel hücre yüklü tip-1 kollajen hidrojel (dış bölme) içinde çekirdek eksplantlarının (iç bölme) birlikte kültürlenmesiyle elde edilebilecek faydalı okumaların yanı sıra gerekli üretim adımları ayrıntılı olarak verilmiştir.
Protokol
Burada açıklanan tüm yöntemler sorumlu makamlar tarafından onaylanmıştır (Zürih Kantonu lisans numaraları ZH104-18 ve ZH058-21). Şekil 1'de genel bir bakış sunulmaktadır.
1. 12-15 haftalık farelerden tendon asambleoid bileşenlerinin izolasyonu (yani, B6 / J-Rj)
- Fareleri COyoluyla ötenazi yapın 2 gaz kaynaklı boğulma. Verimi en üst düzeye çıkarmak için, bir seferde 3'ten fazla fareyi işlemeyin ve ötenaziden hemen sonra hücre izolasyonuna devam edin.
- Pnömotoraksın bilateral indüksiyonu ile ölümü sağlayın.
- Fare derisini %80 etanol ile sterilize edin ve fareyi steril bir biyogüvenlik başlığına taşıyın.
- Kuyruk tendonu çekirdek eksplantlarını izole edin.
- Kuyruğu tabanından keserek fareden ayırmak için bir neşter (No. 21) kullanın.
- Kuyruğun ucundan başlayarak cımbızla kavrayın ve cildi kırmak için kıpırdatın. Ardından, tendon çekirdeği eksplantlarını ortaya çıkarmak için cımbızı yavaşça kuyruktan uzaklaştırın.
- Tendon çekirdeği eksplantlarını standart kültür ortamına yerleştirin (DMEM/F12 + %10 FBS + %1 penisilin/streptomisin + %1 amfoterisin + %1 esansiyel olmayan amino asitler) ve taze bir neşter bıçağı (No. 21) kullanarak çekilen kuyruk kısmından ayırın.
- 1.4.2 adımlarını tekrarlayın. ve 1.4.3. tüm kuyruk işlenene ve tendon eksplantları 25 mm'den kısalana kadar.
- İzole edilmiş çekirdek eksplantlarını yeni bir neşter bıçağı (No. 21) kullanarak 25 mm uzunluğunda parçalar halinde kesin.
- Takılabilir bir dijital C-mount kamera aracılığıyla bir görüntü analiz yazılımına bağlı bir ışık mikroskobu ile karot eksplantlarının ortalama çapını ölçün.
- Sağ taraftaki çizgi ölçüm aracını seçmek için işaretle ve tıkla'yı kullanın.
- Eksplant çapını üç farklı yerde ölçün ve ortalama çaplarını hesaplayın.
- Daha sonra kenetlemeyi ve mekanik testi kolaylaştırmak için, yalnızca ortalama çapı 100 μm'den büyük olan karot eksplantları ile devam edin.
- Standart kültür koşullarına (37 ° C,% 20 O2, serum takviyesi) maruz kalma ile birlikte boşaltma, izolasyondan sonraki 6 saat içinde gen ekspresyonunu değiştirir ve 7 gün içinde bozulmaya neden olur21. Yarı homeostatik bir durumla başlamak için, tendon topluluklarını üretin ve tendon çekirdeği izolasyonundan hemen sonra deneylere başlayın.
- Deney düzeneğine bağlı olarak, kontrol grubu olarak devitalize tendon çekirdek eksplantları gereklidir. Tendon çekirdeği eksplantlarını devitalize etmek için, cımbız kullanarak 5 saniye boyunca sıvı nitrojenle dolu küçük bir kapta dondurun ve ardından oda sıcaklığında (RT) 5 saniye boyunca çözdürün. Bu donma-çözülme döngüsünü 3 kez tekrarlayın ve 4. adıma ("Çekirdek eksplantların kenetlenmesi") devam edin.
DİKKAT: Sıvı nitrojen soğuk yanıklara, boğulmaya neden olabilir ve birçok sıradan malzemeyi gevrekleştirebilir. Yalnızca düşük sıcaklıktaki sıvılar için tasarlanmış kaplar kullanın ve koruyucu giysiler (örn. yüz siperi, uygun eldivenler, üstü kapalı ayakkabılar) giyin.
- Tendon fibroblastlarını izole edin.
- Farenin ayağının ortasında enine bir kesi yapmak için bir neşter (No. 21) kullanın. Bu kesiğin her iki ucundan arka ayakların yanları boyunca ve kalçalara kadar ayağa dik iki kesim yapın.
- Kesilen deri kapağını ayağa sabitlemek için cımbız kullanın ve baldır kaslarını kaplayan deriyi soyun. Endotel hücrelerini aynı fareden izole ederken, bunun yerine tüm cildi çıkarın.
- Aşil tendonunu kalkaneus kemiğinden yeni bir neşter bıçağıyla ayırın (No. 21). Aşil tendonunun gevşek ucunu cımbızla sabitleyin ve diğer ucunu gastroknemius kasından ayırın.
- Aşil tendonunu PBS'de bir kez yıkayın ve sadece beyaz tendon dokusu kalana kadar kalan tüm kas dokusunu çıkarmak için neşteri (No. 21) kullanın. Endotel hücreleri aynı fareden izole edilmişse, Aşil tendonunu PBS'de bırakın ve adım 1.6 ile devam edin. birinci.
- Bir hayvandan Aşil tendonlarını 10 mL tendon sindirim ortamı (DMEM / F12 +% 1 penisilin / streptomisin +% 1 amfoterisin + 2 mg / mL kollajenaz 1) içeren 15 mL'lik bir plastik tüpe toplayın ve 15 rpm'de düşük hızlı bir orbital çalkalayıcı kullanarak yavaş, sabit çalkalama altında 37 ° C'de 6-8 saat sindirin.
- Sindirilmiş tendon çözeltisini RT'de 5 dakika boyunca 500 x g'da santrifüjleyin, süpernatanı aspire edin ve 8 mL standart kültür ortamında (DMEM / F12 +% 10 FBS +% 1 penisilin / streptomisin +% 1 amfoterisin +% 1 esansiyel olmayan amino asitler) yeniden süspanse edin ve standart kültür koşulları altında (37 ° C,% 20 O2) bir T25 kültür şişesinde ortam değişikliği olmadan 7 gün boyunca kültürleyin. Bundan sonra, medyayı haftada bir kez değiştirin.
- Hücreleri% 80 birleşimde bir T150 kültür şişesine (1: 6) bölün. Hücreleri, iki adet 1.5 mL kriyotüpe dağıtılan 2 mL steril filtrelenmiş dondurma ortamında (%70 DMEM/F12 + %20 FBS + %10 DMSO) 2. geçişte dondurun ve daha fazla kullanıma kadar -80 °C'de tutun. Hücreleri doku kültürü plastiğinden çıkarmak için tripsin kullanın.
- Kas kaynaklı endotel hücrelerini izole edin.
- Tendon fibroblastları aynı fareden izole edilmemişse, 1.5.1 ve 1.5.2 adımlarıyla başlayın.
- Kalça eklemini keserek arka ayakları vücuttan ayırmak için makas kullanın.
- Arka ayakları bir kez soğuk PBS'de (~ 4 °C) yıkayın, kasları (kuadriseps femoris, ekstansör digitorum longus, soleus ve gastroknemius) bir neşter (No. 21) ile çıkarın ve kasları buz üzerinde bir Petri kabına yerleştirin.
- Petri kabını buz üzerindetutarken kas dokusunu 1 mm3'ten daha küçük parçalara ayırmak için yeni bir neşter bıçağı (No. 21) kullanın.
- Her iki arka bacaktan kıyılmış kas dokusunu 12.5 mL kas sindirim ortamı (PBS + 2 mg / mL kollajenaz IV + 2 mg / mL dispas II + 2 mM CaCl2) içeren 50 mL'lik plastik bir tüpe toplayın.
- Plastik tüpü 10 dakika boyunca 37 °C'lik bir su banyosuna yerleştirin. Çözeltiyi kuvvetlice çalkalayın ve 10 dakika daha geri koyun. Çözelti homojen görünene ve sadece (beyaz) tendon ve fasya parçaları kalana kadar tekrarlayın (yaklaşık 4 x 10 dakika). Bu arada, tendon fibroblast izolasyonu veya makrofaj izolasyonu ile devam edin.
- Sindirimi durdurmak için plastik tüpe 12,5 mL soğuk PBS +% 10 FBS ekleyin.
- Süspansiyonu plastik tüpten aspire etmek için 50 mL pipetle donatılmış pille çalışan bir pipet tutucu kullanın. Plastik tüpü 400 μm'lik bir hücre süzgeci ile donatın ve kalıntıları temizlemek için süspansiyonu filtreleyin. İşlemi 100 μm hücre süzgeci ile tekrarlayın.
- Filtrelenmiş süspansiyonu RT'de 5 dakika boyunca 400 x g'da santrifüjleyin. 10 mL soğuk PBS +% 10 FBS'de yeniden süspanse edin ve tekrar santrifüjleyin.
- 8 mL endotel kültür ortamında (1: 1 DMEM / F12 karışımı ve endopan 3 kiti + 10 U / mL heparin +% 20 FBS +% 1 penisilin / streptomisin +% 1 amfoterisin + 30 mg / mL endotelyal büyüme takviyesi) popülasyon seçimi için puromisin (4 mg / mL) ile desteklenmiştir.
- Hücreleri, bir fareden, daha önce 37 ° C'de 2 saat boyunca 2 mL steril% 0.2 jelatin çözeltisi ile kaplanmış ve daha sonra fazla çözeltiyi çıkardıktan sonra gece boyunca RT'de kurutulan bir T25 kültür şişesine tohumlayın. Şişeleri izolasyondan bir gün önce hazırlayın.
- Standart kültür koşullarında (37 ° C,% 20 O2) 24 saat sonra, puromisin takviyesi ortamını çıkarın, bağlı hücreleri bir kez PBS ile yıkayın ve 8 mL endotel kültür ortamında kültürleyin.
- Hücreleri 1:5 oranında %80 birleşimde jelatin kaplı şişelere geçirin ve P2'ye kadar deneylerde kullanın. Hücreleri doku kültürü plastiğinden çıkarmak için tripsin (Malzeme Tablosu) dışında bir hücre ayırma solüsyonu kullanın ve dondurmayın.
- Kemik iliği kaynaklı makrofajları izole edin.
- Tendon fibroblastları veya endotel hücreleri aynı fareden izole edilmemişse, önce 1.5.1, 1.5.2, 1.6.2 ve 1.6.3 adımlarını uygulayın.
- Cildi, tendonu ve kas dokularını çıkardıktan sonra, kalan kemikleri (femur ve tibia) soğuk PBS'de (~ 4 ° C) bir kez yıkayın.
- Kemikleri taze soğuk PBS'ye (~ 4 ° C) yerleştirin ve kemik iliği açığa çıkana kadar epifizleri kademeli olarak kesmek için bir neşter (No. 21) kullanın. Kemiğin her iki yanında kırmızı bir nokta olarak görünür.
- Bir şırıngayı 0,4 mm x 25 mm (G27) enjeksiyon iğnesi ile donatın ve 10 mL makrofaj kültür ortamı (DMEM/F12 + %10 FBS + %1 penisilin/streptomisin +%1 amfoterisin + %1 esansiyel olmayan amino asitler) ile doldurun.
- Bir kemiği birbiri ardına 50 mL'lik plastik bir tüp üzerinde tutun, enjeksiyon iğnesini üstteki açıkta kalan kemik iliğine yaklaşık 1 mm derinliğe sokun ve şırıngayı boşaltarak kemik iliğini yıkayın. Temizlenmiş kemik iliği, ortamda asılı kaldığında kırmızımsı tüp benzeri bir yapı olarak görünür.
- Kemik iliğini, 1 mL'lik bir pipet ucu kullanarak tekrar tekrar hafifçe yukarı ve aşağı pipetleyerek çözün. Hücre süspansiyonunu 100 μm'lik bir hücre süzgecinden 50 mL'lik plastik tüpe geri filtrelemek için 50 mL'lik bir pipetle donatılmış pille çalışan bir pipet tutucu kullanın ve RT'de 5 dakika boyunca 350 x g'da santrifüjleyin.
- Süpernatanı çıkarın, peleti 10 mL kırmızı kan hücresi (RBC) lizis tamponunda yeniden süspanse edin ve oda sıcaklığında 10 dakika boyunca 350 x g'da tekrar santrifüjleyin.
- Peletin 5 mL makrofaj kültür ortamında (DMEM/F12 + %10 FBS + %1 penisilin/streptomisin + %1 amfoterisin + %1 esansiyel olmayan amino asitler) yeniden süspanse edilmesi ve 100 mm çapında (5-8 x 10çanak başına 6 hücre) işlenmemiş Petri kaplarına tohumlanması.
- 4 saat sonra, 20 ng / mL m-CSF'lik bir nihai konsantrasyona ulaşmak için m-CSF (1: 1 karışımı) içermeyen hücre kültürü ortamına 40 ng / mL makrofaj koloni uyarıcı faktör (m-CSF) ile desteklenmiş 5 mL makrofaj kültürü ortamı ekleyin.
- 6 gün sonra, hücreleri deneylerde kullanın veya daha fazla kullanılana kadar dondurun. Hücreleri doku kültürü plastiğinden çıkarmak için tripsin (Malzeme Tablosu) dışında bir hücre ayırma solüsyonu kullanın.
NOT: İzole edildikten sonra hücreler artık genişlemez. Burada açıklanan hücre izolasyon yöntemleri, belirtilen yaş aralığının dışındaki fareler ve sıçanlarla da çalışır.
- İzole edilmiş hücre popülasyonlarının fenotipini akış sitometrisi ile doğrulamak için adım 6.3.4 ile devam edin.
2. Wistar veya Sprague-Dawley sıçanlarından kollajen izolasyonu
- 86 başka bir yerde ayrıntılı olarak açıklanan izolasyon protokolünü izleyin. Aynı zamanda, çok daha düşük bir verimle de olsa farelerle de çalışır.
- Elde edilen çözeltinin konsantrasyonunu bir hidroksiprolin testi ile belirleyin, saflığı SDS-page ile değerlendirin ve çözeltiyi deneylerde kullanılana kadar 4 ° C'de saklayın.
3. Kültür sistemi bileşenlerinin üretimi
- Kelepçe tutucuları, montaj istasyonunu ve hazne kalıplarını 3D yazdırın.
- Kelepçe tutucular, montaj istasyonu ve hazne kalıpları için ekteki .stl dosyasını (Ek Dosya 1) dilimleme yazılımına yükleyin. Nesne numaralarını gerektiği gibi uyarlamak için, nesneleri seçmek için işaretle ve tıklat'ı ve çarpmak için kopyala ve yapıştır özelliğini kullanın.
- G kodunu oluşturmak için G kodunu dışa aktar (Ctrl-R) tuşuna basın ve ardından dışa aktarın (Ctrl-G).
- G kodunu bir 3D yazıcıya yükleyin.
- Baskı işlemi için renksiz, biyouyumlu filamentler kullanın (yani polilaktik asit).
- Bir diş kesici kullanarak vidaları taşıyacak kelepçe tutucunun deliklerine 3 mm'lik dişler kesin (Ek Dosya 2 ve Ek Dosya 3, delikler 1 ve 3).
- Paslanmaz çelik dübel pimlerini kelepçe tutucunun arkasındaki deliğe yerleştirin (Ek Dosya 2 ve Ek Dosya 3, delik 4).
- cl'yi sterilize edinamp tutucular ve montaj istasyonu kullanımdan önce en az 1 saat UV ışığı ile. 3D baskılı kelepçe tutucuları tekrar kullanmayın.
- Alternatif olarak, daha pahalı olan ancak daha iyi sterilizasyon yöntemlerine (yani otoklavlama) ve tekrarlanan kullanıma olanak tanıyan ekli planları (Ek Dosya 2, Ek Dosya 3 ve Ek Dosya 4) kullanarak kelepçe tutucuları ve montaj istasyonunu polieterimid ile üretin.
- 3D baskılı kalıpları kullanarak odaları dökün.
- Hazne kalıplarını silikonla doldurun.
- Silikonu bir vakum odasında (90 mbar) 30 dakika boyunca gazdan arındırın.
- Çözeltinin, kalıplar için kullanılan filamentlerin ısı direncine bağlı olarak, gece boyunca RT'de veya 70 °C'de bir ocak gözünde 1 saat polimerize olmasına izin verin.
- Polimerize odaları kalıplardan dikkatlice çıkarın ve gereksiz silikonu bir neşter ile kesin (No. 21).
- OPSİYONEL: Montaj çubukları ve dolayısıyla çevresindeki bölmeler mekanik olarak yüklenecekse, silikon bölmelerdeki delikleri paslanmaz çelikten yapılmış içi boş borularla güçlendirin.
- Ekteki planı kullanarak paslanmaz çelikten metal kelepçeleri işleyin (Ek Dosya 5).
- Her kullanımdan önce paslanmaz çelik kelepçeleri, polieterimid kelepçe tutucuları, vidaları ve silikon hazneyi yıkayın.
- % 80 etanol (EtOH) ve% 20 ters ozmoz suyunda (ROW) 10 dakika boyunca sonikat.
- % 50 EtOH ve% 50 İzopropanol içinde 10 dakika boyunca sonikate.
- 3 kez ROW ile durulayın.
- % 0.5 alkali temizleme konsantresinde 10 dakika boyunca sonikat (yani, 600 mL ROW'da 3 mL).
- % 0.5 alkali temizleme konsantresinde 10 dakika boyunca sonikate.
- %0,5 alkali temizleme konsantresinde çalkalayarak 1 saat 50 dakika bekletin.
- 3 kez ROW ile durulayın.
- ROW'da 10 dakika boyunca sonicate.
- Bileşenleri havayla kurutun ve otoklavlayın.
4. Çekirdek eksplantların sıkıştırılması
- Eşleşen cl'yi yerleştirinamp tutucular bir metal cl ile birlikteamp her biri montaj istasyonuna.
- Islak otoklavlanmış kağıt parçalarını (4 mm x 25 mm) metal kelepçelerin üzerine yerleştirin ve ardından kağıdı bir neşterle (No. 21) kelepçelerin iç kenarları boyunca kesin. Başka bir kağıt parçasından 2 adet daha küçük kağıt parçasını (4 mm x 1,5 mm) kesin ve ıslak tutun.
- Sivri uçlu cımbız kullanarak, uç noktaları metal kelepçeler üzerinde olacak şekilde metal kelepçelerin arasına kağıda 8 çekirdek eksplant yerleştirin.
- Çekirdek eksplantlarının uç noktalarını hazır daha küçük kağıt parçalarıyla (4 mm x 1,5 mm) kapatın ve ardından üzerlerine metal kelepçeler yerleştirin. Metal kelepçeler ve kelepçe tutucu arasındaki çekirdek eksplantlarını sabitlemek için bir tornavida ve küçük vidalar (M3 x 6 mm) kullanın.
- Kelepçelenmiş çekirdek eksplantlarını dikkatlice silikon kültür odalarına aktarın ve bu odaları 2 mL standart hücre kültürü ortamı (DMEM/F12 + %10 FBS + %1 penisilin/streptomisin + %1 amfoterisin + %1 esansiyel olmayan amino asitler) ile doldurun.
- İSTEĞE BAĞLI: Montajlar/çevresindeki bölmeler mekanik olarak yüklenecekse, bunları ek vidalarla (M3 x 16 mm) delik 3'e (Ek Dosya 2 ve Ek Dosya 3, delik 3) sabitleyin.
5. Kollajen hidrojel hazırlama ve döküm
- Hedef hücreleri, hücre ayırma solüsyonu ile doku kültürü plastiğinden çıkarın, RT'de 5 dakika boyunca 400 x g'da santrifüjleyin ve 1 mL standart kültür ortamında yeniden süspanse edin.
- Bir assembloid için 10 μL PBS (20x), 1.28 μL 1 M NaOH (125x), 8.72 μL çift damıtılmış su (ddH2O, 23x), 80 μL kollajen-1 (2.5x veya 1.6 mg / mL final) ve 100 μL (2x) standart kültür ortamı (çekirdek // hücresiz assembloidler için) veya hücre süspansiyonu gereklidir. Bu bileşenleri iki ayrı çözelti halinde hazırlayın ve dökümden hemen önce karıştırın.
- Çapraz bağlama çözümü: PBS, NaOH, ddH20 ve 12 assembloid'e (+% 10 güvenlik marjı) kadar hücre süspansiyonunu bir çapraz bağlama çözeltisinde toplayın ve buz üzerinde 15 mL'lik plastik bir tüpte tutun. İki çözeltiyi karıştırdıktan sonra aşağıdaki nihai konsantrasyonları elde etmek için hücre süspansiyonunun konsantrasyonunu ayarlayın: 250.000 hücre / mL tendon fibroblastları, 500.000 hücre / mL kas kaynaklı endotel hücreleri veya 370.000 hücre / mL kemik iliği kaynaklı makrofajlar.
- Kollajen-1 çözeltisi: 12 assemboid (+%10 güvenlik marjı) için gerekli olan kolajen-1 solüsyonunu başka bir 15 mL'lik plastik tüpte toplayın ve buz üzerinde tutun.
- Çapraz bağlama çözeltisi ve kollajen-1 çözeltisi buz üzerinde hazır olduğunda, hücre kültürü ortamını kenetlenmiş çekirdek eksplantlarını içeren kültür odalarından aspire edin.
- Kollajen-1 solüsyonunu 1000 μL'lik bir pipet ile çapraz bağlama solüsyonuna ekleyin ve kabarcıklar oluşturmadan hızlı bir şekilde yukarı ve aşağı pipetleyerek iki solüsyonu karıştırın. Tek tek tendon çekirdeği eksplantlarını, silikon odacıklar tarafından sağlanan oluklara pipetleyerek 200 μL karışık çözelti ile örtün.
- Hidrojellerin 37 °C'de 50 dakika polimerize olmasına izin verin.
- Silikon kültür odalarını, odaların köşelerine pipetleyerek 1,5 mL ilgili ko-kültür ortamıyla dikkatlice doldurun.
- Çekirdek // fibroblast ko-kültürü için DMEM/F12, %10 FBS, %1 esansiyel olmayan amino asitler, %1 penisilin/streptomisin, %1 amfoterisin, 200 μM L-Askorbik Asit, 20 ng/mL makrofaj-koloni uyarıcı faktör doldurun.
- Çekirdek // makrofaj ko-kültürü için DMEM/F12, %10 FBS, %1 esansiyel olmayan amino asitler, %1 penisilin / streptomisin, %1 amfoterisin, 200 μM L-Askorbik Asit, 20 ng/mL makrofaj-koloni uyarıcı faktör doldurun.
- Çekirdek // endotel hücre ko-kültürü için, 1: 1 DMEM / F12 ve endopan 3 kiti + 10 U / mL heparin +% 20 FBS +% 1 penisilin / streptomisin +% 1 amfoterisin + 30 mg / mL endotelyal büyüme takviyesi karışımını doldurun.
- Asambloidleri hipoteze uygun kültür koşullarında kültürleyin. Lezyon benzeri bir niş ortamı taklit etmek için, örneğin, onları 37 ° C'de ve% 20O2'de kültürleyin. Kültür ortamını 1 haftada iki kez değiştirin. Enfeksiyonları önlemek için, odaları bir inkübatöre koymadan önce büyük bir Petri kabına veya steril bir kutuya yerleştirin.
NOT: Kültür zamanı, hipoteze ve ortak kültür kurulumuna bağlıdır. Örneğin, lezyon benzeri bir niş ortamındaki çekirdek // fibroblast toplulukları yaklaşık 3 hafta sonra mekanik olarak kararsız hale gelir.
6. Mevcut okuma yöntemleri
- Canlılık ve morfoloji testleri dahil olmak üzere floresan mikroskobu gerçekleştirin.
- Genel olarak, asambloidler tam montajlar olarak görüntülenebilir. Bunu yapmak için, kelepçelere yakın makasla keserek ve 12 oyuklu bir plakaya aktararak montaj bloklarını kelepçelerden çıkarın.
- Asambloidleri PBS ile bir kez yıkayın.
- Canlılık analizi yapılırsa, her bir topluluğu karanlıkta 37 °C'de 20 dakika boyunca PBS'de (EthD-1) 100 μL 4 x 10−6 M etidyum homodimer ile boyayın.
- Asambloidleri 3x PBS ile yıkayın, ardından RT'de 20 dakika boyunca her biri 500 μL %4 formaldehit ile sabitleyin.
DİKKAT: %4 formaldehit alerjenik, kanserojen ve mutajenik etkilere sahiptir, üreme için toksiktir ve gelişimsel toksisiteye (reprotoksik) veya organlarda hasara neden olabilir. Koruyucu giysi ve eldiven, göz koruması ve maske veya diğer solunum koruması kullanın. - Asambloidleri 3x PBS ile yıkayın ve tercih ettiğiniz boyama protokolüne devam edin. Daha önce84,85 numaralı bir dizi boyama tanımlanmıştır.
NOT: Kollajen otofloresansına (yaklaşık 480 nm) yakın bir emisyon dalga boyuna sahip floroforlar kullanan boyamalardan kaçının.
- Üreticinin talimatlarına göre, RT-qPCR veya genom çapında RNA dizilimi için bölmeye özgü RNA izolasyonu gerçekleştirin.
- Asambloidleri kelepçelerden makasla çıkarın.
- İSTEĞE BAĞLI: Çekirdek eksplantlarını dışsal hidrojel bölmesinden ayırmak için cımbız kullanın.
- Yeterli miktarda RNA'yı izole etmek için 20-24 adet 20 mm çekirdek eksplant veya 2 hücre yüklü kollajen hidrojel havuzlayın.
- 1 mL soğuk trizol ve mekanik bozulma (yani, metal boncuklar veya kriyojenik öğütme) havuzlanmış çekirdek eksplantlarının veya havuzlanmış kollajen hidrojellerinin hücre dışı matrisini yok etmek için.
DİKKAT: Oral, dermal ve inhalasyon toksisitesi. Cilt ve göz tahrişine neden olur. Sadece eldivenlerle ve kimyasal güvenlik kabininde tutun. - Daha önce tarif edildiği gibi veya üreticinin talimatlarında84,85 açıklandığı gibi standart RNA ekstraksiyon kitlerini kullanarak hücre lizatından RNA izolasyonuna devam edin.
- Bölmeye özgü akış sitometrisi.
- Asambloidleri kelepçelerden makasla çıkarın.
- İSTEĞE BAĞLI: Çekirdek eksplantları dışsal hidrojel bölmesinden ayırmak için cımbız kullanın.
- Kollajenaz I (3 mg / mL) ile 1 mL PBS'de bölmeleri sindirin ve sürekli çalkalama altında 37 ° C'de 4 saat boyunca II'yi (4 mg / mL) dispas edin.
- Sindirilmiş çözeltiyi RT'de 5 dakika boyunca 500 x g'da santrifüjleyin ve süpernatanı aspire edin.
- Pelet, tercih edilen florofor konjuge antikorları içeren 100 μL FACS tamponunda (PBS'de% 1 FBS) yeniden süspanse edilir. Çalışan florofor-konjuge antikorların bir seçimi daha öncetanımlanmıştır 84,85.
- Boyama solüsyonunu RT'de 30 dakika inkübe edin.
- Boyama solüsyonunu 1.4 mL FACS tamponu ile seyreltin ve RT'de 500 x g'da 5 dakika santrifüjleyin.
- Peletleri 350 μL FACS tamponunda yeniden süspanse edin ve çözeltiyi, üreticinin talimatlarına göre tercih edilen akış sitometresi ile analiz etmeden önce 100 μm'lik bir naylon ağ süzgeç kapağından süzün.
- Süpernatanı analiz edin.
- Süpernatan koleksiyonundan 3 gün önce ko-kültür ortamını serumsuz ko-kültür ortamıyla değiştirin.
- Enzime bağlı immünosorbent testi (ELISA) ve mezo ölçeği keşfi (MSD) test kitleri ile zenginleştirilmiş, seyreltilmemiş süpernatantın anında ve gecikmeli analizini gerçekleştirin. Gecikmeli analiz için, süpernatanı -80 ° C'de 1,5 mL plastik tüplerde saklayın.
- Asamblaj mekanik özelliklerini değerlendirin.
- Mekanik kuvvetler uygulamak ve mekanik özellikleri ölçmek için özel yapım bir germe cihazı kullanın22. Paslanmaz çelik dübel pimleri ve paslanmaz çelik vidalar, kelepçeleri diğer germe cihazlarına da takılabilir hale getirir.
- Montajın mekanik özellikleri büyük ölçüde gömülü çekirdek eksplant 18'inki tarafından belirlendiğinden, ölçüm işleminde taze dökülmüş hidrojelin tahrip olma riskini azaltmak için bir hidrojel içine gömmeden önce kor eksplantının mekanik özelliklerini ölçün.
Temsili Sonuçlar
Bileşen izolasyonu (Şekil 1 ve Şekil 2)
Topluluk ko-kültüründe çekirdek eksplantları ve hücre popülasyonlarını kullanmadan önce, bu bileşenler mikroskop altında kontrol edilmelidir (Şekil 1). Çekirdek eksplantları düzgün bir çapa (100-200 μm) sahip olmalı ve görünür bükülme veya kırışıklık olmamalıdır. Endotel hücreleri, diğer hücrelerle temas halinde uzun bir şekil sunmalıdır, ancak izolasyondan düşük bir başlangıç verimi nedeniyle çok düşük bir yoğunlukta tohumlandıklarında sunmazlar. Bu durumda, endotel hücreleri, hücre iskeleti uzantıları ile daha yuvarlak bir şekil alır ve belirgin şekilde daha yavaş çoğalır. 7-10 gün sonra 1:5 oranında bölün. Aşil tendonlarından izole edilen tendon fibroblastları, 1:6 bölündüklerinde 1-2 pasaj (her biri 10-14 gün) içinde insan muadillerine kıyasla daha yuvarlak bir morfoloji alırlar. Makrofajlar fibroblastlardan veya endotel hücrelerinden çok daha küçüktür ve izolasyondan sonra çoğalmazlar. Partiye bağlı olarak, şekilleri piramidalden yuvarlağa değişebilir.
Hücresel bileşenlerin fenotipleri akım sitometrisi ile doğrulandı. Endotel hücreleri için bir belirteç olarak konjuge bir CD31 antikoru kullanıldı (Şekil 2A). Floresan eşiğinin boyanmamış bir kontrol örneğine (gri) göre ayarlanması, pasaj 1'in (P1) %90.1'i ve pasaj 2 (P2) endotel hücrelerinin %48.7'si CD31 pozitif olarak tanımlandı. Tendon fibroblastlarını karakterize etmek için yeşil bir floresan proteini (ScxGFP) ve konjuge bir CD146 antikoru ile birlikte tendon fibroblast belirteci Skleraxis'i birlikte eksprese eden genetiği değiştirilmiş bir fare hattı kullanıldı (Şekil 2B)35,60. Bir pasaj (P1) sonrası fibroblastların %37.3'ü ScxGFP+CD146-, %0.2'si ScxGFP+CD146+, %4.3'ü ScxGFP-CD146+ ve %58'i ScxGFP-CD146- idi. İki geçişten sonra (P2), ScxGFP+CD146- hücrelerinin yüzdesi %27.6'ya, ScxGFP+CD146+ hücrelerinin yüzdesi %6.9'a, ScxGFP-CD146+ hücrelerinin yüzdesi %10.6'ya ve ScxGFP-CD146- hücrelerinin yüzdesi %54.9'a düştü. Makrofajları tanımlamak ve karakterize etmek için bir CD86 ve bir CD206 antikoru ile kombinasyon halinde bir F4/80 antikoru kullanıldı (Şekil 2C). İzolasyon ve kültür sonrası kemik iliği kaynaklı hücrelerin %96.4'ü F4/80 pozitifti. F4/80 pozitif hücrelerin %8.6'sı CD206+CD86-, %23.6'sı CD206+CD86+, %28.3'ü CD206-CD86+ ve %39.4'ü CD206-CD86- idi. Kollajen çapraz bağlanma hızı partiden partiye değişebilir ve deneylere başlamadan önce test edilmelidir.
Assembloid görünümü (Şekil 3)
Lezyon benzeri kültür koşullarında (36 °C, %20 O2), kor eksplant mekanik olarak gerilebilir kaldı, görünüşte değişmedi ve en az 21 gün boyunca görsel olarak ayırt edilebilir ve çevredeki hidrojelden fiziksel olarak ayrılabilir olmaya devam etti (Şekil 3A, B). Çevreleyen hidrojel, içine ekilen hücre popülasyonuna bağlı olarak sıkıştırma hızı ile zamanla sıkıştırıldı. Aşil tendonundan türetilen fibroblastlar, çevrelerindeki hidrojeli en hızlı şekilde büzüştüler ve bunu, bir çekirdek eksplantının etrafına dökülen bir hidrojel içindeyken ve olmadığında her yöne radyal olarak yaptılar (Şekil 3B, C). Başlangıçta, bir çekirdek eksplantının etrafına yerleştirilen hücresiz hidrojeller de sıkıştırılır. Bu daralma muhtemelen, dinamik bir çapraz bölmeli arayüze işaret eden çekirdek eksplanttan göç eden hücrelerden kaynaklanıyordu. Gömülü bir çekirdek eksplantı olmayan hücresiz hidrojeller tespit edilebilir şekilde sıkışmadığından, su kaybının neden olduğu büzülmenin katkısı ihmal edilebilir görünmektedir (Şekil 3B ve Ek Dosya 6).
Bu nedenle, hidrojel sıkıştırma eksikliği, montaj düzeneğindeki hataları (yani düşük hücre konsantrasyonları) tespit etmek için kullanılabilir ve daha pahalı okuma yöntemlerine devam etmeden önce kontrol edilmelidir. Bu yöntem oluşturulurken, hücre konsantrasyonunu azaltan yaygın hatalar, nispeten sert çapraz bağlama çözeltisinde (yüksek pH, düşük sıcaklık) çok uzun süre bırakıldıkları için dışsal hidrojelde ölen hücreleri ve orta aspirasyon ile hidrojel enjeksiyonu arasındaki süre çok uzun olduğu için çekirdek eksplantlarının kurutulmasını veya kor eksplantının kollajen içine gömülemeyecek kadar yükseğe kenetlenmesini içeriyordu.
Konfokal floresan mikroskobu: Canlılık ve morfoloji analizi (Şekil 3)
Kelepçelerden makasla çıkarıldıktan sonra (Şekil 3B), montajlar sabitlenebilir, boyanabilir ve kesit alınmadan bir bütün olarak konfokal mikroskopla görüntülenebilir. Burada, kor, // endotel hücresi, kor // makrofaj ve kor // fibroblast toplulukları, canlılığı analiz etmek için DAPI (NucBlue) ve Ethidium Homodimer (EthD-1) ve 3D kollajen hidrojeldeki morfolojiyi ve hücre yayılımını analiz etmek için DAPI ve F-aktin ile boyandı (Şekil 3D). Kor // endotel hücre asetbloidlerinin canlılığı ölçüldü ve assembloid montajından sonra genellikle kor // makrofaj ve kor // fibroblast asembloidleri için daha önce bildirilenden daha düşük olduğu bulundu84. Bununla birlikte, canlılık, en az 7. güne kadar assembloid kültürü sırasında sabit kaldı.
Mekanik olarak indüklenen mikro hasar ve mekanik özelliklerin ölçümü (Şekil 4)
Kelepçe tutuculara takılan vidalar ve pimler, kelepçeli montajların tek eksenli germe cihazlarına sabitlenmesine izin verir. Burada kullanılan özel yapım gerdirme cihazı, 10 N'luk bir yük hücresi ile donatılmıştır ve önceki yayınlarda açıklanmıştır (Şekil 4A)22. Tüm numuneler, ölçümlerden önce %1 gerinim için beş esneme döngüsü ile önceden koşullandırıldı.
Çekirdek eksplantlarının veya birleşimlerinin tam gerilim-gerinim eğrisinin kaydedilmesi (Şekil 4B), doğrusal elastik modülün (α), maksimum gerilimin (β) ve maksimum gerinimin (у) ölçülmesine izin verecektir. Bununla birlikte, aynı numuneler için maksimum gerilimin (β) ve maksimum gerinimin (у) uzunlamasına gelişimini değerlendirmeyi imkansız hale getiren çekirdek eksplantına veya asambloidine de geri dönüşü olmayan bir şekilde zarar verir (Şekil 4B). Burada, doğrusal elastik modül, numunenin kuvvetlere dayanma kabiliyeti için bir ölçü olarak kullanılmıştır, çünkü bu ölçüm, numunenin daha önce doğrusal elastik modülde18 kalıcı azalmalara neden olmadığı gösterilen sadece %2'lik gerinim gerilmesini gerektirir. Özellikle, kor // endotel hücre toplulukları, kenetleme prosedürüne %2 gerinim (yaklaşık olarak doğrusal elastik bölgenin sonu) veya %6 gerinim (yaklaşık olarak maksimum gerinim) kadar maruz bırakıldı. Ortaya çıkan mikro hasar, prosedürden önce ve sonra lineer elastik modül ölçülerek değerlendirildi (Şekil 4C).
Mono-kültürlenmiş çekirdek eksplantlarından yararlanan daha önce yapılan deneylere paralel olarak, çekirdek // endotel hücre toplulukları, yarı homeostatik niş koşullarında (29 °C,% 3 O2) kültürlendiğinde ve %2'den yüksek olmayan suşlara maruz kaldıklarında doğrusal elastik modüllerini en az 14 gün boyunca korudular18,21. Mekanik temel stimülasyon ile ilgili olarak, kelepçeler aracılığıyla uygulanan statik gerilme, genellikle matris boşaltma ile ilişkili katabolik süreçleri önlemek için in vivo tendon çekirdek üniteleri tarafından deneyimlenen doğal gerinim seviyelerini yeterince taklit ediyor gibi görünüyordu87. Gerçekten de, %6 suşa maruz kalan çekirdek // endotel hücre topluluklarında gözlenen doğrusal elastik modülün ilerleyici ve istatistiksel olarak anlamlı düşüşü, mekanik olarak indüklenen matris mikro hasarından kaynaklanan matris boşaltmasına bağlanabilir.
Bu deneyleri yaparken, montajın kurumasını önlemek önemlidir. Burada, otoklavlanmış ve ıslatılmış kağıtla kaplandılar, ancak kullanılan germe cihazıyla uyumluluklarına bağlı olarak başka yöntemler de uygulanabilir. Metal kelepçeler ve maça eksplantları arasındaki sürtünme sınırlı olduğundan, kaymayı önlemek için kenetleme sırasında metal ile maça eksplant arasına küçük kağıt parçaları ekleyin ve kaymış maça eksplantlarını ve asambleidleri tespit etmek ve hariç tutmak için germe işlemini yakından izleyin.
Kompartmana özgü transkriptom ve assembloid'e özgü sekretom analizi (Şekil 5 ve Şekil 6)
Burada sunulan ilk çekirdek mono-kültür deneyleri setinde, eksplant izolasyonundan sonra çekirdek gen ekspresyonunun stabilitesi, izolasyonu deneysel etkilerden ayırmak için değerlendirilmiştir (Şekil 5A). Kesin sonuçlar için daha yüksek replika sayıları gerekli olsa da, lezyon benzeri niş koşullarında (37 °C, %20 O2) kültürlendiğinde, eksplant izolasyonundan sonraki saatler içinde taze izole edilmiş çekirdek eksplantlarda Vegfa ve Mmps ekspresyonu güçlü bir şekilde artmıştır.
Neovaskülarizasyon, kısmen hipoksi88 altında tendon çekirdeği tarafından salgılanan pro-anjiyojenik faktörler (yani vasküler endotelyal büyüme faktörü, Vegfa) tarafından aktive edilen endotel hücreleri tarafından yönlendirilebilen tendon hastalığı ve onarımının merkezi bir özelliğidir. Bu potansiyel karışmanın ilk basamağı incelendiğinde (Şekil 5B), hem Vegfa hem de hipoksi belirteci karbonik anhidraz 9'un (Ca9) ekspresyonunun, yüksek oksijen gerilimi altında mono-kültürlenmiş olanların aksine düşük oksijen gerilimi altında mono-kültürlenmiş eksplantlarda istatistiksel olarak anlamlı arttığı bulunmuştur (%20O2). Bu arada, düşük oksijen gerginliği, Skleraksi (Scx) ve kollajen-1 (Kol1a1) gibi tendon fibroblast belirteçlerinin ekspresyonunda değişikliklere neden olmadı. Birlikte, bu sonuçlar, çekirdekte yerleşik hücreleri, hipoksik bir niş içinde pro-anjiyojenik sinyallemeye makul katkıda bulunanlar olarak tanımlamaktadır.
Daha sonra, endotel hücrelerinin pro-anjiyojenik kor sinyali ile aktivasyonu, yüksek (%20O2) ve düşük (%3O2) oksijen gerilimi altında kor // endotel hücre topluluğu ko-kültüründe değerlendirildi. Neyse ki, asembloidlerin modüler bileşimi, çekirdek eksplantını ekstrinsik kollajen hidrojelden fiziksel olarak ayırarak kültürden sonra bölmeye özgü transkriptom analizine izin verir (Şekil 6A). Çekirdek eksplantında (Şekil 6D), Vegfa ekspresyonunun düşük oksijen gerilimi altında arttığı tekrar doğrulandı, ancak Fgf2 gibi diğer hipoksik belirteçler üzerindeki etki daha az belirgindi ve kesin sonuçlar için daha yüksek kopya sayıları gerektiriyordu. Ek olarak, Tnf-α gibi pro-inflamatuar belirteçlerin ve Mmp3 gibi hücre dışı matris yıkımı belirteçlerinin ekspresyonu, düşük oksijen gerilimi altında çekirdekte azalmıştır. Başlangıçta endotel hücreleri ile tohumlanan dışsal hidrojelde (Şekil 6E), canlı bir çekirdek eksplantının (aC) varlığı, düşük oksijen gerilimi altında Vegfa ekspresyonunu azalttı, ancak yüksek oksijen gerilimi altında azaltmadı. Ek olarak, düşük oksijen gerilimi altında devitalize (dC) bir kor eksplantının varlığı da Vegfa ekspresyonunu azaltmadı. Düşük oksijen gerilimi altında, dışsal hidrojeldeki Tnf-α ekspresyonu aC/dC civarında karşılaştırılabilirdi, ancak canlı çekirdek eksplantları çevresinde yüksek oksijen gerilimi altında arttı. Fgf2 ekspresyonu, yüksek oksijen gerilimi altında, ancak çoğu düşük oksijen gerilimi altında, devitalize bir çekirdek eksplant etrafında kültürlenen dışsal endotel hücre yüklü hidrojel ile karşılaştırıldığında her koşulda azalmıştır. Mmp3 ekspresyonu, yüksek oksijen gerilimi altında canlı karot eksplantları çevresinde en yüksek, düşük oksijen gerilimi altında devitalize kor eksplantları çevresinde en düşüktü. Genel olarak, ko-kültürlenmiş endotel hücreleri, hem karışmayı hem de oksijen seviyelerindeki varyasyonları başlatabilen aktif çekirdek eksplantına duyarlı görünmektedir. Daha kapsamlı bir transkriptom analizi, ilgili katkılarının aydınlatılmasını kolaylaştıracaktır.
Asambloid sisteminin modülerliği, floresan raportör genleri içeren genetiği değiştirilmiş hücrelerin entegrasyonuna izin verir. Burada, Pdgfb-iCreER mG fareleri89'dan izole edilen endotel hücreleri hidrojel bölmesine ekildi. Bu hücreler, Pdgfb eksprese eden endotel hücrelerinin mikroskopi altında yeşil görünmesini sağlayan gelişmiş yeşil floresan proteinin (EGFP) yanı sıra endotel hücre belirteci trombosit kaynaklı büyüme faktörü alt birimi b'yi (Pdgfb) birlikte eksprese eder (Şekil 6C). Bu yöntem kullanılarak, Pdgfb eksprese eden endotel hücrelerinin varlığının kültürde (37 ° C) 7 gün boyunca korunduğu doğrulandı ve oksijen gerginliğinden bağımsız olduğu görüldü (% 3O2'ye kıyasla% 20O2).
Asembloidlerin sekretomunu analiz etmek için, sırasıyla çekirdek // hücresiz ve çekirdek // fibroblast, kor // makrofaj veya çekirdek // endotel hücre ko-kültürü için kullanılan kültür ortamı, şimdi sekretomla zenginleştirilmiş süpernatantın aspire edilmesinden ve dondurulmasından üç gün önce serumsuz muadili ile değiştirildi (Şekil 6A). Bu zenginleştirme süresi, vasküler endotelyal büyüme faktörü (VEGF) gibi sitokinleri bir MSD testi ile tespit etmek için yeterliydi, burada lezyon benzeri niş koşullarında kültürlenen kor eksplantlar ve kor // fibroblast asambloidleri için gösterildiği gibi (Şekil 6B).
Çekirdek eksplantların ve assembloidlerin sekretomlarını ve transkriptomlarını analiz ederken dikkat edilmesi gereken önemli hususlar, uygun kontrollerin kullanımı ile ilgilidir. Yeni izole edilmiş kor eksplantları sınırlı bir değere sahiptir, çünkü özellikle Vegfa ve Mmps ekspresyonu izolasyondan sonraki saatler içinde güçlü bir şekilde artar (Şekil 5A). Başlangıçta hücresiz bir hidrojel ile çevrili zamana uygun eksplantlar, çekirdek bölme gen ekspresyonu için kontroller olarak daha uygundur. Dışsal hidrojel için, bir kor eksplant olmadan kültürlenen hücre yüklü hidrojeller, devitalize kor eksplantları etrafında kültürlenen hücre yüklü hidrojellere kıyasla daha düşük kontrollerdir (Ek Dosya 7), çünkü esas olarak hücre morfolojisini büyük ölçüde değiştiren uzun hidrojeller yerine yuvarlakımsı şekiller halinde sıkışırlar (Şekil 3A).
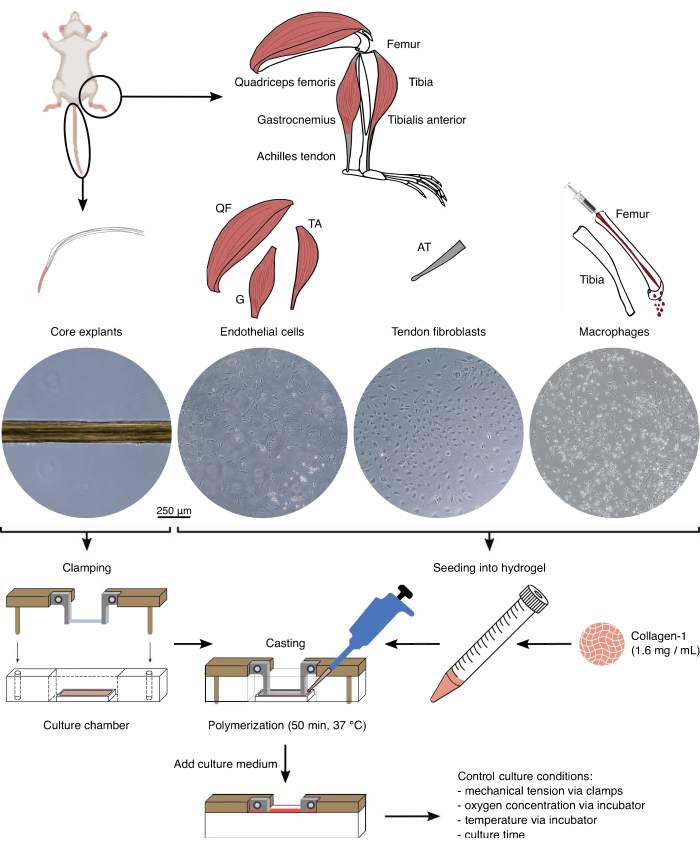
Şekil 1: Montajlı bileşen izolasyonu ve in vivo karışmayı modellemek için montaj. Tendon çekirdeği eksplantları fare kuyruklarından çıkarıldı, kesildi ve kenetlendi. Fare bacak kasları (yani, kuadriseps femoris (QF), gastroknemius (G) ve tibialis anterior (TA)), daha sonra doku kültürü plastiği üzerinde kültürlenen endotel hücrelerini izole etmek için sindirildi. Aşil tendonları (AT), tendon fibroblastlarını izole etmek için sindirildi ve daha sonra doku kültürü plastiği üzerinde kültürlendi. Tibia ve femurdaki kemik iliği kemiklerden dışarı atıldı. Daha sonra izole edilen monositler doku kültürü plastiği üzerinde kültüre edildi ve naif makrofajlara ayrıldı. Işık mikroskobu görüntüleri (10x), çekirdek eksplantların, endotel hücrelerinin, tendon fibroblastlarının ve makrofajların montajlara entegrasyonundan hemen önce görünümünü göstermektedir. Montaj sırasında, plastik üzerinde kültürlenen hücreler süspansiyona sokuldu ve daha sonra bir kollajen-1 çözeltisine (1.6 mg / mL) tohumlandı. Daha sonra, hücre-hidrojel karışımı, kenetlenmiş çekirdek eksplantının etrafına döküldü ve kültür ortamı eklenmeden önce 37 ° C'de 50 dakika polimerize edildi. Kültür koşulları, kelepçeler (mekanik gerilim) ve inkübatör ayarları (oksijen konsantrasyonu, sıcaklık) aracılığıyla kontrol edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
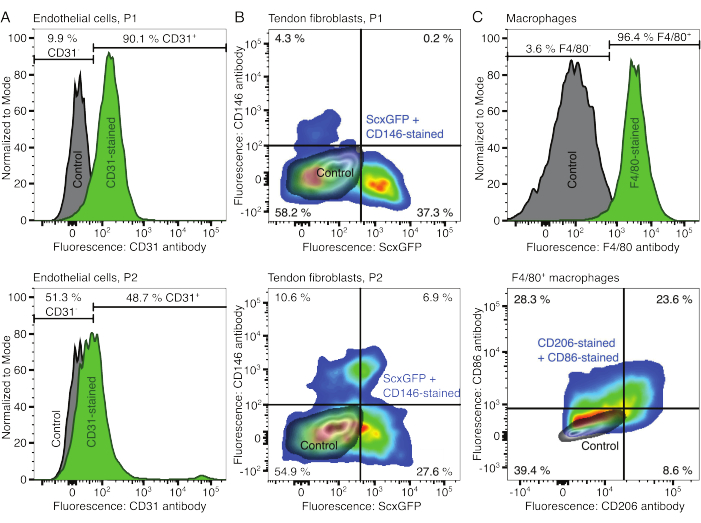
Şekil 2: Hücresel topluluk bileşenlerinin karakterizasyonu. (A) Bir geçişten (P1, üst sıra) ve iki geçişten (P2, alt sıra) sonra kas kaynaklı endotel hücrelerinin temsili akış sitometrik analizi. Boyanmamış (gri) ve CD31 boyalı (yeşil) hücrelerin sayımları modal olarak normalleştirildi. Yüzdeler CD31 boyalı grup için verilmiştir. (B) Bir geçişten (P1, üst sıra) ve iki geçişten (P2, alt sıra) sonra Aşil tendonu kaynaklı fibroblastların temsili akış sitometrik analizi. Eksenler, boyanmamış hücrelerin (gri) ve hem ScxGFP eksprese eden hem de CD146 antikorları (gökkuşağı renkleri) ile boyanmış hücrelerin floresan yoğunluklarını bildirir. (C) Kültürden sonra kemik iliği kaynaklı makrofajların temsili akış sitometrik analizi. En üst sırada, boyanmamış (gri) ve F4/80 lekeli (yeşil) hücrelerin sayıları modal olarak normalleştirildi. Yüzdeler F4/80 lekeli grup için verilmiştir. Alt satırdaki grafik, boyanmamış hücrelerin (gri) floresan yoğunluklarını ve CD206 antikorları ve CD86 antikorları (gökkuşağı renkleri) ile boyanmış hücrelerin F4/80+ alt kümesini bildirir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
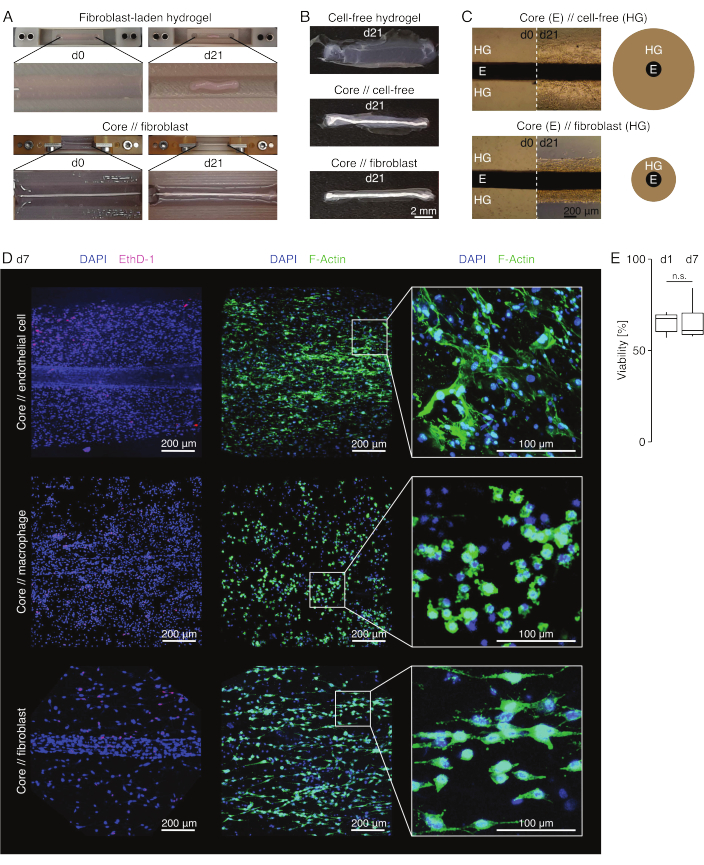
Şekil 3: Assembloid görüntüleme ve görünüm. (A) Kültürün 0. gününde (d0) ve 21. gününde (d21) (37 °C, %20 O2) çekilen temsili fotoğraflar, gömülü bir kor eksplant olmaksızın ekstrinsik fibroblastlar içeren bir hidrojelin çok boyutlu bir kasılmasını ve bir kor eksplant etrafında ekstrensik fibroblastlar içeren bir hidrojelin güçlü radyal sıkışmasını göstermektedir. (B) Kültürün 21. gününde (d21) (37 °C, %20 O2) çekilen temsili fotoğraflar, hücresiz hidrojeller, bir çekirdek eksplantının etrafına dökülen hücresiz hidrojeller ve bir çekirdek eksplantının etrafına dökülen tendon fibroblast yüklü hidrojeller arasındaki sıkıştırma hızındaki farklılıkları göstermektedir. (C) Kültürün 0. (d0) ve 21. gününde (d21) (37 °C, %20 O2) alınan temsili ışık mikroskobu görüntüleri (10x), hücre popülasyonlarının varlığında uzunlamasına değişiklikleri ve çekirdek // hücresiz ve çekirdek // fibroblast topluluğu ko-kültüründe çekirdek eksplant (E) etrafındaki kollajen hidrojelin (HG) sıkıştırma hızını gösterir. Şematik gösterim, çekirdek // hücresiz assemboid ve çekirdek // fibroblast assembloid ko-kültürü arasındaki hidrojel sıkıştırmasındaki farklılıkları gösterir. (D) Kor // endotel hücresi, kor // makrofaj ve kor // fibroblast asambloid ko-kültürünün (37 °C,% 20 O2) 7. gününde (d7) alınan temsili konfokal mikroskopi görüntüleri. Sol sıradaki resimler, mavi renkle boyanmış hücre çekirdekleri (DAPI) ve pembe ile boyanmış ölü hücreler (Ethidium homodimer-1) ile asambloidleri göstermektedir. Diğer iki sıra, mavi (DAPI) ile boyanmış hücre çekirdekleri ve yeşil (F-aktin) aktin filamentleri ile assembloidleri tasvir eder. (E) Ko-kültürün 1. gününde (d1) ve 7. gününde (d7) çekirdek // endotel hücre topluluklarının niceliksel canlılığını gösteren kutu grafikleri. N = 5 olur. Üst ve alt menteşeler birinci ve üçüncü çeyreklere (25. ve 75. yüzdelik dilimler) ve ortadaki menteşeler medyana karşılık gelir. Bıyıklar, üst/alt menteşeden en büyük/en küçük değere kadar uzanır, çeyrekler arası aralığın en fazla 1,5 katı. P değerleri: n.s.p > 0.05. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
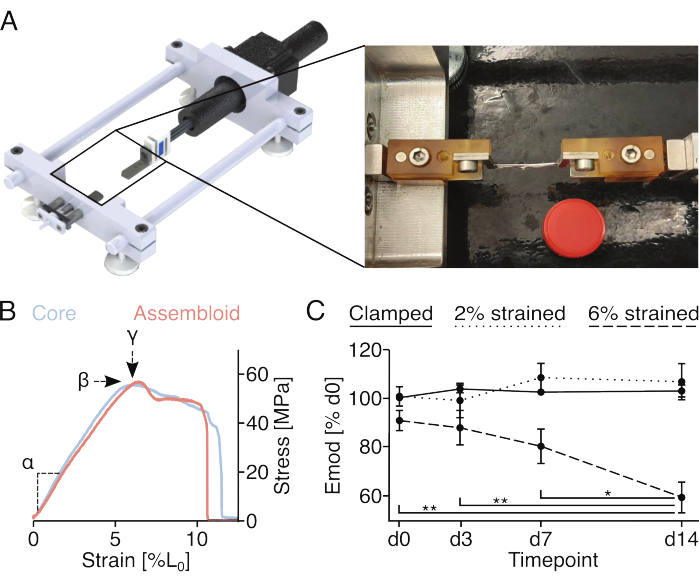
Şekil 4: Asambloidlerin mekanik stimülasyonu ve asambloid mekanik özelliklerinin ölçümü. (A) Kelepçe tutucu platformlar, bir kuvvet sensörü ve bir step motordan oluşan özel yapım gerdirme cihazının grafiksel gösterimi. Fotoğrafik görüntü, gerdirme cihazına kelepçelerle monte edilmiş bir montajcıyı göstermektedir. Kireç için kullanılan 15 mL'lik plastik tüpün (Ø: 17 mm) kapağı. (B) Çekirdek eksplantlar (açık mavi) ve montajlar (açık kırmızı) için temsili gerilim/gerinim eğrilerini gösteren grafik. Doğrusal elastik modül (α), maksimum gerilme (β) ve maksimum gerinim (у), çekirdek eksplant veya asambloidi mekanik olarak karakterize etmek için verilerden çıkarılabilir. (C) Kenetlendikten (düz çizgi), kenetlendikten ve %2 L0 gerine (noktalı çizgi) gerildikten sonra 14 günlük bir süre boyunca birlikte kültürlenen (29 ° C,% 3 O2) çekirdek // endotel hücre topluluklarının doğrusal elastik modülünü (Emod) gösteren grafik veya deneyin başlangıcında% 6 L0 gerinimine (kesikli çizgi) kenetlendi ve gerildi. N = 5 olur. Veri noktaları, gerdirmeden önce başlangıç modülü doğrusal elastik modülüne normalleştirildi ve tümü ortalama (±sem) olarak görüntülendi. P değerleri: *p < 0.05, **p < 0.01. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
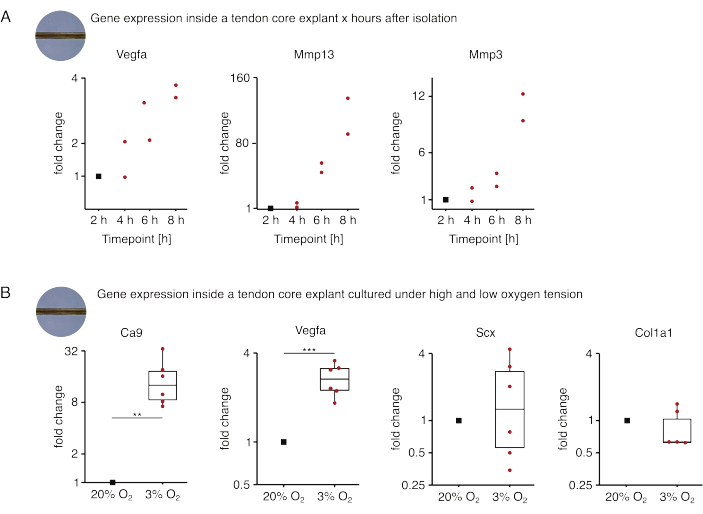
Şekil 5: Farklı niş koşulları altında izolasyon ve kültür sonrası çekirdek transkriptomundaki değişiklikler. (A) Monokültürlü (37 °C, %20O2) murin çekirdeğinde Vegfa, Mmp13 ve Mmp3 gen ekspresyonundaki kıvrım değişikliklerini gösteren dağılım grafiği, kuyruktan izole edildikten 2 saat, 4 saat, 6 saat ve 8 saat sonra eksplantlar. İlgili zaman noktalarındaki kıvrım değişiklikleri, izolasyondan 2 saat sonra gen ekspresyonuna normalize edildi. N = 2 olur. (B) Düşük oksijen gerilimi altında (%3 O2) mono-kültürlenmiş çekirdek eksplantlarda Ca9, Vegfa, Scx ve Col1a1 gen ekspresyonundaki kıvrım değişikliklerini gösteren kutu grafikleri normalize edilmiş ve yüksek oksijen gerilimi (%20O2) altında mono-kültürlenmiş olanlarla karşılaştırılmıştır. N = 5-6 olur. Kutu grafiklerinin üst ve alt menteşeleri birinci ve üçüncü çeyreklere (25. ve 75. yüzdelik dilimler) ve ortadaki medyana karşılık gelir. Bıyıklar, üst/alt menteşeden en büyük/en küçük değere kadar uzanır, çeyrekler arası aralığın en fazla 1,5 katı. Normalleştirme için kullanılan veri noktaları siyah noktalar ve tek tek veri noktaları kırmızı noktalar olarak gösterilir. P değerleri: **p < 0.01, ***p < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
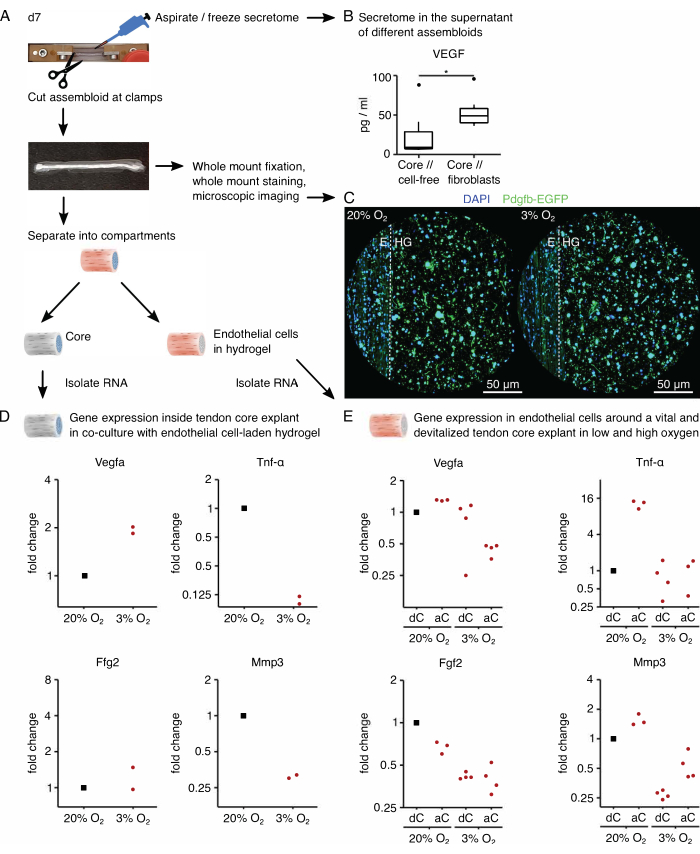
Şekil 6: Assembloid'e özgü sekretom ve bölmeye özgü transkriptom analizi. (A) Sekretom ve transkriptom örneklerinin alındığı 7. günde (d7) assembloid'i gösteren temsili fotoğraf ve altta yatan iş akışının tasviri. (B) 7 günlük ko-kültürden (37 ° C,% 20 O2) sonra çekirdek // hücresiz ve çekirdek // fibroblast topluluklarının süpernatanında VEGF konsantrasyonu (pg / mL) kutu grafikleri olarak tasvir edilmiştir. N = 6 olur. (C) Yüksek oksijen gerilimi (% 20 O 2) ve% 3 O2 (% 3O2) altında 7 günlük ko-kültürden (37 ° C) sonra çekirdek // endotel hücre topluluklarının temsili konfokal mikroskopi görüntüleri. Hücre çekirdekleri mavi (DAPI) ile boyanır ve gömülü endotel hücreleri, endotel hücresi işaretleyici trombosit kaynaklı büyüme faktörü alt birimi b (Pdgfb) ile birlikte gelişmiş yeşil floresan proteini (EGFP) birlikte eksprese eder. Noktalı çizgi, çekirdek eksplant (E) ile endotel hücre yüklü hidrojel (HG) arasındaki bölmeli arayüzü gösterir. (D) Düşük oksijen gerilimi altında birlikte kültürlenmiş çekirdek // endotel hücre topluluklarından çekirdek bölmesindeki Vegfa, Tnf-α, Fgf2 ve Mmp3 gen ekspresyonundaki kıvrım değişikliklerini gösteren saçılma grafiği (%3O2) normalize edilmiş ve yüksek oksijen gerilimi altında kültürlenenlerle karşılaştırılmıştır (%20O2). N = 2 olur. (E) Yüksek oksijen gerilimi (% 20 O2) ve düşük oksijen gerilimi (% 3 O2 ) altında birlikte kültürlenmiş canlı bir çekirdek (aC) veya cansızlaştırılmış bir çekirdek (dC) ile çekirdek // endotel hücre topluluklarının dışsal bölmesinde Vegfa, Tnf-α, Fgf2 ve Mmp3 gen ekspresyonundaki kıvrım değişikliklerini gösteren dağılım grafiği). İlgili koşullardaki kıvrım değişiklikleri, yüksek oksijen gerilimi (% 20O2) altında birlikte kültürlenmiş devitalize bir çekirdek (dC) ile bir çekirdek // endotel hücre topluluğunun dışsal bölmesine normalleştirildi. N = 3-4 olur. B'de, kutu grafiklerin üst ve alt menteşeleri birinci ve üçüncü çeyreklere (25. ve 75. yüzdelik dilimler) ve ortadaki medyana karşılık gelir. Bıyıklar, üst / alt menteşeden en büyük / en küçük değere, çeyrekler arası aralığın 1,5 katından fazla uzanmaz. Aykırı değerler siyah noktalar olarak tasvir edilir. P değerleri: *p < 0.05. D ve E'de, normalleştirme için kullanılan veri noktaları siyah noktalar olarak gösterilir ve tek tek veri noktaları kırmızı noktalar olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Tendon hastalığı ve yaralanma model sistemleri için girdi gereksinimleri. Primer tendon hastalığı tetikleyicilerinin ve ikincil sürücülerin bir listesi, izlenebilirliği tendon hastalığı ve yaralanmasını modellemek için merkezi olan bir dizi girdi parametresiyle eşleştirildi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Tendon hastalığı ve yaralanma model sistemleri için çıktı gereksinimleri. Tendon hastalığı ayırt edici özellikleri, ölçülebilirliği tendon hastalığı ve yaralanma modeli davranışının yorumlanması için merkezi olan bir dizi çıktı parametresiyle eşleşti. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Kelepçe tutucular, montaj istasyonu ve hazne kalıpları için .stl dosyası. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: Sağ kelepçe tutucunun planı. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: Sol kelepçe tutucunun planı. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 4: Montaj platformunun planı Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 5: Metal kelepçelerin planı. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 6: Hücresiz hidrojel büzülmesini gösteren resim. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 7: Devitalize bir karot eksplantını gösteren resim. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Genel olarak, burada sunulan montaj modeli sisteminin vurgulanması gereken birkaç kritik adımı vardır. İlk olarak, model sistemi yalnızca bileşenlerinin kalitesi kadar iyidir. Montaj işlemine başlamadan önce çekirdek eksplantını ve tohumlanacak hücre popülasyonlarını mikroskop altında kontrol etmek hayati önem taşır. İzole edilen hücre popülasyonlarının fenotipinin en az bir kez akış sitometrisi ile doğrulanması da benzer şekilde önemlidir. Özellikle yeni bir kollajen-1 partisi ilk kez kullanıldığında, hücreleri içine yerleştirmeden önce bir deneme çalışmasında çapraz bağlanma hızını kontrol etmek avantajlıdır. Montaj montajı, enfeksiyon riskini artıran çok sayıda manuel kullanım gerektirir. Enfeksiyon riskini en aza indirmek için, laminer hava akışına sahip steril bir biyogüvenlik başlığında çalışın, eldivenleri sık sık değiştirin ve eldivenleri ve çalışma alanını %80 etanol ile dekontamine edin. Benzer nedenlerle, 3D baskılı kelepçe tutucuları bir kereden fazla kullanmayın. Gömme işleminden önce, erken çapraz bağlanmayı önlemek için tüm hidrojel bileşenlerini (çapraz bağlama solüsyonu, kollajen-1 solüsyonu) buz üzerinde tutmak önemlidir. Sonuç olarak, çapraz bağlama çözeltisinin yüksek pH'ı ve düşük sıcaklığı nedeniyle hücre ölümünü sınırlamak için hücreler çapraz bağlama çözeltisine eklendikten sonra hızlı bir şekilde çalışılmalıdır. Çekirdek eksplantında kurumaya bağlı hücre ölümünü önlemek için, çapraz bağlama solüsyonunu kollajen-1 solüsyonu ile karıştırmadan hemen önce kenetlenmiş çekirdek eksplantlarını kaplayan ortamı aspire edin. Çekirdek eksplantının hidrojel içine merkezi yerleşimini garanti etmek için, hidrojeli hafifçe gerilmiş kenetlenmiş bir çekirdek eksplantının etrafına dökmek idealdir. Bunu yapmak için, dübel pimini ve M3 x 16 mm cıvata vidasını kullanarak kelepçe tutucuları uygun uzunluklarda deliklerle ayarlanmış (3D baskılı) bir plakaya sabitleyin. 50 dakikalık polimerizasyon süresinden sonra, gömülü çekirdek eksplantı, istenen kültür koşullarına bağlı olarak tekrar gerginliği giderilebilir. Asambloidin kültür sırasında yaşadığı gerginlik miktarı, deneysel sonuçlar üzerinde derin bir etkiye sahiptir ve örnekler ve koşullar arasında aynı tutulmalıdır21.
Bununla birlikte, mekanik (un-) yüklemenin deneysel sonuçlar üzerindeki büyük etkisi, özellikle çekirdek eksplantın korunan matris bileşiminin hücresel düzeydekompleks in vivo yükleme modellerini de yeniden oluşturması gerektiğinden, çoğu doku mühendisliği alternatifine göre assemboid modelinin ana avantajıdır. Uygulamada, şimdiye kadar sadece doğrusal elastik modülün, maksimum gerilme geriniminin ve montajların maksimum gerilme geriliminin ölçümü gösterilmiş olsa da, başka yerlerdeki tendon çekirdeği eksplantları için yorulma mukavemeti ve gerilme gevşemesi ölçümleri için protokoller tanımlanmıştır ve91,92 topluluklarına uygulanabilir olmalıdır. İn vivo benzeri yükleme modellerine ek olarak, montajın çok seviyeli modülerliği muhtemelen en büyük avantajıdır. Bireysel kültür odaları sayesinde, her numune için ayrı ayrı kontrol edilebilir bir dizi niş koşulu ayarlanabilir (yani sıcaklık, oksijen gerilimi, glikoz konsantrasyonu, takviye, uyarıcılar, inhibitörler ve bir plaka ile statik esneme). Daha sonra, ekstrinsik bölmenin matris sertliği ve matris bileşimi, hidrojel bileşimi aracılığıyla özelleştirilebilir ve örneğin, daha fazla kollajen-3 ve hücresel fibronektin 93,94,95 dahil ederek giderek daha hastalıklı bir doku mikro ortamının etkisinin incelenmesine izin verir. Dışsal bölmede değerlendirilen hücre popülasyonları, hangi hücrelerin tohumlanacağı seçilerek kolayca uyarlanabilir, ancak aynı zamanda, yerleşik genetiği değiştirilmiş hücre dizileri ve fare dizileri (yani, ScxLin hücre tükenmesi) kullanılarak tendon çekirdeği eksplantında da değiştirilebilir96. İki bölmenin farklı matrisi ve hücre bileşimi ayrıca, başka bir merkezi tendon ayırt edici özelliğiolan benzersiz bir bölümlere ayrılmış 3D yapı sağlar 1,30,46.
Bu sistemi kullanırken, sonuç parametrelerinin ayrıntı düzeyi için sistemin modülerliğinin sonuçlarını dikkate almak önemlidir. Hücre proliferasyonu ve alımı her bölme için ayrı ayrı değerlendirilebilirken, mekanik özellikler, sekretom bileşenleri ve bozunma ürünleri şu anda yalnızca tam montaj için ölçülebilir. Verimle ilgili olarak, uygun şekilde eğitilmiş bir kişi, normal bir iş gününde 50'ye kadar montaj hazırlayabilir ve ana darboğaz sıkıştırma prosedürüdür. Okuma yöntemlerinden bazıları birbirini dışlasa da, mekanik özellikleri ve sekretom bileşenlerini aynı numune üzerinde tekrar tekrar değerlendirmek ve ayrıca hücre popülasyonu kompozisyonu (akış sitometrisi), hücre transkriptomu (RT-qPCR, RNA dizilimi) veya matris ve hücre dağılımı (immünositokimya/floresan mikroskobu) uç noktalarda. Önceki yayınlarda, bu yöntemler, lezyon benzeri bir nişe maruz kalan kor // fibroblast ve kor // makrofaj topluluklarında hücreler arası, bölümler arası etkileşimleri kapsamlı bir şekilde karakterize etmek için kullanılmıştır84,85. Bu çalışmada, asambloid model sisteminin, farklı mikroçevresel uyaranlar altında çekirdek ve dışsal endotel hücreleri arasındaki çapraz bölmeli etkileşimi araştırma yeteneği araştırılmıştır.
Model sisteminin modülerliği, mevcut tasarım yinelemesinin aşağıdaki sınırlamalarının üstesinden gelmek için gerekli olan yöntemin gelecekte iyileştirilmesine izin verir. Bu çalışmada sunulan akış sitometrik analizi ve yakın zamanda yayınlanan tek hücreli RNA dizileme verileri, tendon çekirdeğinde yerleşik tenositlerin ve Aşil tendonundan türetilen popülasyonların daha önce varsayıldığından daha heterojen olduğunu ortaya koydu 24,34,59,84,97. Ek olarak, başlangıçta çekirdek veya hidrojelde yerleşik hücre popülasyonlarının göç davranışı, kültür sırasında asambloid bölümlendirmeyi bulanıklaştırır. Her iki faktör birlikte, transkriptomik farklılıkları belirli hücre tiplerine atfetmeyi ve proliferasyonu göçe dayalı süreçlerden ayırmayı zorlaştırır. Bu sınırlama, son in vivo çalışmalarda karakterize edilen sağlıklı veya hastalıklı tendonların hücresel bileşimine dayalı olarak floresanla aktive edilen hücre sıralaması (FACS) ile girdi popülasyonunun rafine edilmesi, tek hücreli RNA dizilimi uygulanarak okumanın iyileştirilmesi ve mikroskopi sırasında bir EdU (5-etinil-2'-deoksiüridin) boyama gibi proliferasyon belirteçlerinin entegre edilmesiyle aşılabilir.
Burada sunulan asambloidler, vücudun geri kalanından kopuk hastalıklı organları simüle eden şu anda mevcut olan in vitro sistemlerin çoğuyla bir zayıflığı da paylaşmaktadır98,99. Bununla birlikte, burada kullanılan kültür odası tabanlı platform, model sistemini, farklı organları taklit eden asambloidlerin birbirine bağlandığı ve organlar arası etkileşimlerin incelenebildiği çok organlı bir platforma entegrasyon için iyi konumlandırmaktadır.
Özünde, model sistemi pozisyonel kemirgen tendonlarına dayanmaktadır ve bu da kendine özgü dezavantajlarla sonuçlanır. İlk olarak, sonuçların çevrilebilirliği, tendon hastalıklarıgeliştirmeyen veya bunlardan muzdarip olmayan vahşi tip fareler tarafından engellenmektedir 8,100,101. İnsanlardan alınan doku ve hücrelerin veya tendon hastalığının özelliklerini sergileyen yeni geliştirilen fare suşlarının entegre edilmesi bu sorunu hafifletebilir102. İnsan bazlı bir asambloid'e geçiş, farklı hastalıklı tendonlardan (yani tendinit, tendinoz veya peritendinit) hasta kaynaklı dokularla ve hatta daha kişiselleştirilmiş tedavi programlarının kilidini açabilecek tedaviye dirençli donörlerle yapılan çalışmaları mümkün kılacağı için özellikle ilginçtir. İkincisi, murin kuyruk tendonu eksplantları, aşırı yüklenmeye bağlı mikro hasarı özellikle iyi idare etmez, bu da model sistemin akut tendon hasarının incelenmesi için uygulanabilirliğini sınırlar.
Tüm bu nedenlerden dolayı, eksplant // hidrojel toplulukları, niş kaynaklı mikro hasara yanıt olarak tendon çekirdek biyolojisini, matris yapısı-fonksiyon etkileşimlerini ve spesifik hücre popülasyonları arasındaki çapraz bölmeli etkileşimleri incelemek için birinci sınıf bir konumdadır. Bu oldukça yüksek verimli çalışmalardan elde edilen içgörüler, in vivo araştırma ve tedavi geliştirmeye yön verebilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma ETH Hibe 1-005733 tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
Referanslar
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır