0:00
Overview
1:22
Principles of HPLC
5:05
Preparation of the Mobile Phase
6:08
Preparation of Component and Standard Solutions
7:25
HPLC Setup
9:25
Diet Soda Samples
10:16
Results
11:27
Applications
12:44
Summary
La chromatographie en phase liquide à haute performance (CLHP)
Source : Dr Paul Bower - Purdue University
Chromatographie en phase liquide à haute performance (HPLC) est une méthode d’analyse importante couramment utilisée pour séparer et quantifier les composants d’échantillons liquides. Dans cette technique, une solution (première phase) est pompée à travers une colonne contenant un emballage de petites particules poreuses avec une deuxième phase liée à la surface. Les solubilités différentes les composants de l’échantillon dans les deux phases causent les composants pour vous déplacer dans la colonne avec des vitesses moyennes différentes, créant ainsi une séparation de ces composants. La solution de pompage est appelée la phase mobile, tandis que la phase de la colonne est appelée la phase stationnaire.
Il existe plusieurs modes de chromatographie en phase liquide, selon le type de phase stationnaire ou mobile utilisée. Cette expérience utilise la chromatographie en phase inversée, où la phase stationnaire est non polaire et la phase mobile est polaire. La phase stationnaire devant être utilisés est C18 liés à des particules de silice de 3 µm, tandis que la phase mobile est un tampon aqueux avec un modificateur organique polaire (acétonitrile) ajouté à varier sa force d’élution des groupes hydrocarbonés. Sous cette forme, la silice peut être utilisée pour les échantillons qui sont solubles dans l’eau, fournissant un vaste éventail d’applications. Dans cette expérience, les mélanges de trois éléments fréquemment trouvés dans le régime alimentaire des boissons non alcoolisées (caféine, benzoate et l’aspartame) sont séparés. Sept solutions préparées contenant des quantités connues de ces trois espèces sont utilisées et leur chromatogramme est ensuite enregistrés.
Pendant une expérience HPLC, une pompe à haute pression prend la phase mobile provenant d’un réservoir à travers un injecteur. Il traverse ensuite une colonne en phase inverse C18-emballés pour la séparation des composants. Enfin, la phase mobile se déplace dans une cellule du détecteur, où l’absorbance est mesurée à 220 nm et se termine dans une bouteille pour eaux usées. La quantité de temps qu’il faut pour un composant de voyager depuis le port de l’injecteur au niveau du détecteur est appelée temps de rétention.
Un chromatographe en phase liquide est utilisé dans cette expérience, où la séparation est effectuée sur une colonne en phase inverse. Les dimensions de la colonne sont de 3 mm (d.i.) x 100 mm et la silice d’emballage (granulométrie de 3 µm) est fonctionnalisée avec C18 octadécylsilane (ODS). Une valve de 6 ports rotatif injection Rheodyne sert à stocker au départ l’échantillon dans une petite boucle et introduit l’échantillon à la phase mobile à la rotation de la soupape.
La détection est par spectroscopie d’absorption à une longueur d’onde de 220 nm. Cette expérience peut être exécutée à 254 nm, si un détecteur n’est pas variable. Les données du détecteur dispose d’une sortie analogique de tension, qui est mesurée à l’aide d’un multimètre numérique (DMM), et lu par un ordinateur doté d’un programme d’acquisition de données. Le chromatogramme obtenu a une crête pour chaque composant dans l’échantillon. Pour cette expérience, les trois composantes éluer à 5 min.
Cette expérience utilise une seule phase mobile et la pompe, qu’on appelle une phase mobile isocratique. Pour les échantillons qui sont difficiles à séparer, une phase mobile dégradée peut être utilisée. C’est lors de la phase initiale du mobile est principalement un aqueux, et au fil du temps, une phase mobile deuxième organique est progressivement ajoutée à la phase mobile dans l’ensemble. Cette méthode déclenche la polarité de cette phase au fil du temps, ce qui diminue les temps de rétention des éléments et fonctionne de manière similaire à un gradient de température sur un chromatographe en phase gazeuse. Il y a certains cas où la colonne est chauffée (habituellement à 40 ° C), qui enlève toute rétention d’erreurs associé à un changement de la température ambiante.
En HPLC en phase inversée, la phase stationnaire de colonne d’emballage est généralement un C4, C8 ou C18 d’emballage. Les colonnes de C4 sont principalement des protéines de grands poids moléculaire, tandis que les colonnes C18 sont des peptides et des échantillons élémentaires de bas poids moléculaire.
Détection par spectroscopie d’absorption est très majoritairement la méthode de détection de choix, comme les spectres d’absorption des composants sont tous facilement accessibles. Certains systèmes utilisent des mesures électrochimiques, telles que la conductivité ou ampérométrie, tant que leur méthode de détection.
Pour cette expérience, la phase mobile est principalement de 20 % d’acétonitrile et 80 % purifié l’eau désionisée (DI). Une petite quantité d’acide acétique est ajoutée pour baisser le pH de la phase mobile, ce qui maintient le silanol dans la phase stationnaire d’emballage dans un État non dissocié. Cela réduit le pic de l’adsorption de résidus, donnant des pics plus étroits. Ensuite, le pH est ajusté avec 40 % d’hydroxyde de sodium pour augmenter le pH et aider à diminuer les temps de rétention des éléments.
Chaque groupe utilise un jeu des 7 flacons contenant différentes concentrations des solutions étalons (tableau 1). Les 3 premiers sont utilisés pour identifier chaque pic, et les 4 derniers sont pour la création d’un graphique d’étalonnage pour chaque composant. Normes 1-3 sont également utilisés pour le tableau de calibrage.
| Nombre | Caféine (mL) | Benzoate de (mL) | Aspartame (mL) |
| 1 | 4 | 0 | 0 |
| 2 | 0 | 4 | 0 |
| 3 | 0 | 0 | 4 |
| 4 | 1 | 1 | 1 |
| 5 | 2 | 2 | 2 |
| 6 | 3 | 3 | 3 |
| 7 | 5 | 5 | 5 |
Le tableau 1. Volumes des étalons utilisés pour préparer les 7 étalons de travail fourni (volume total de chaque norme est de 50 mL).
1. rendre la Phase Mobile
- Préparer la phase mobile en ajoutant 400 mL d’acétonitrile à environ 1,5 L d’eau purifiée de DI.
- Ajouter avec précaution 2,4 mL d’acide acétique glacial à cette solution.
- Diluer la solution d’un volume total de 2.0 L dans une fiole jaugée avec de l’eau purifiée DI. La solution obtenue doit avoir un pH entre 2,8 à 3,2.
- Ajuster le pH à 4,2 en ajoutant 40 % d’hydroxyde de sodium, titration à l’aide d’un pH-mètre numérique calibré. Ajouter très lentement lorsque le pH atteint 4.0. Cela devrait prendre environ 50 gouttes d’accomplir.
- Filtrer la phase mobile à travers un filtre de membrane de Nylon 66 0,47 µm sous vide pour dégazer la solution et pour éliminer les solides qui pouvaient brancher la colonne chromatographique. Il est important de dégazer la phase mobile pour éviter d’avoir une bulle, ce qui pourrait provoquer un vide dans la phase stationnaire à l’entrée de la colonne ou faire son chemin dans la cellule du détecteur, causant l’instabilité avec l’absorbance UV.
2. créer les Solutions composant
Les trois composantes qui doivent être apportées sont la caféine (0,8 mg/mL), benzoate de potassium (1,4 mg/mL) et l’aspartame (ester méthylique de L-aspartyl-L-phénylalanine) (6,0 mg/mL). Ces concentrations, une fois diluées de la même façon, mettent les normes aux niveaux trouvés dans les échantillons de soude.
- Ajouter 0,40 g de caféine dans une fiole jaugée de 500 mL, puis diluer à la marque 500 mL avec de l’eau distillée.
- Ajoutez 0,70 g de benzoate dans une fiole jaugée de 500 mL, puis diluer à la marque 500 mL avec de l’eau distillée.
- Ajouter 0,60 g d’aspartame dans une fiole jaugée de 100 mL, puis diluer à la marque de 100 mL avec l’eau distillée. Place cette solution dans un réfrigérateur pour éviter la décomposition pendant l’entreposage.
3. rendre les Solutions Standard 7
Tous les trois composantes ont des coefficients de distribution différents, qui influe sur la manière dont chacun interagit avec tous les deux des phases. Plus le coefficient de distribution, le temps plus que le composant passe dans la phase stationnaire, ce qui entraîne une rétention plus longue fois pour atteindre le détecteur.
- Suivant le tableau dans le tableau 1, pipette une quantité suffisante de chaque composant dans une fiole jaugée de 50 mL.
- Diluer chaque solution stock à la marque 50 mL sur les fioles jaugées avec la phase mobile.
- Versez chaque solution étalon dans étiquetées petites fioles dans un rack d’échantillon.
- Rangez les grilles des échantillons dans un réfrigérateur, ainsi que les autres solutions dans les fioles jaugées de 50 mL.
4. vérifier les paramètres initiaux du système HPLC
- Confirmer que la conduite d’écoulement est dans un conteneur à déchets et n’est pas recyclage dans la phase mobile.
- Vérifiez que le débit de la phase mobile est défini sur 0,5 mL/min. C’est suffisamment élevé pour permettre tous les pics à éluer à moins de 5 min et ralentir suffisamment pour permettre une résolution agréable.
- Vérifier que la pression minimale et maximale et la vitesse d’écoulement sont définies pour les valeurs correctes sur le panneau avant du système solvant (la pompe).
- Réglage de la pression minimale : 250 lb/po2 (c’est à l’arrêt de la pompe, si une fuite se produit).
- Réglage de la pression maximale : 4 000 lb/po2 (c’est pour protéger la pompe contre la rupture, si une forme de sabot).
- Appuyez sur « zéro » sur la façade du détecteur afin de mettre à l’essai à blanc (le blanc est la phase mobile pure).
- Rincez une seringue de 100 µL d’eau déionisée, puis avec plusieurs volumes d’un étalons de travail pour être analysés et remplissez la seringue avec cette solution. Commencez avec les 3 échantillons mono-composant, qui permet d’identifier le pic de chaque composant d’intérêt.
5. manuellement par injection de l’échantillon et la collecte de données
- Avec le stylo injecteur dans la position de chargement, injecter lentement 100 µL de solution via le port de la cloison.
- Vérifiez que le programme de collecte de données est défini pour recueillir des données pour 300 s, ce qui permet de suffisamment de temps pour tous les 3 pics à éluer à travers le détecteur.
- Lorsque vous êtes prêt à commencer le procès, tourner la manivelle d’injecteur au poste inject (qui injecte l’échantillon dans la phase mobile) et cliquez sur « Commencer le procès » sur le programme de collecte de données ordinateur immédiatement. Pour les normes 1-3, seul les trois pics séquentielles apparaissent sur l’écran pendant la course (Figure 1).
- Une fois 300 s ont passé, la collecte de données envoie une invite à enregistrer le fichier de données. Enregistrer les données sous un nom de fichier approprié (par exemple, STD #1).
- Remarque la durée en secondes pour le sommet de chaque essai, qui est utilisé pour identifier ce composant.
- Retirer la seringue de la cloison et répétez le processus pour toutes les normes de travail restant, en utilisant le même temps par le chromatogramme comme déterminé à partir de la première manche.
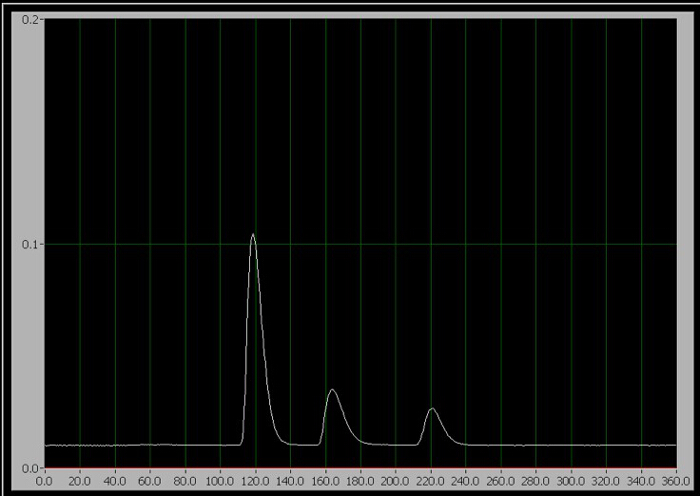
Figure 1. Le chromatogramme des 3 composants. De gauche à droite, ils sont la caféine, l’aspartame et le benzoate.
6. les échantillons de boissons gazeuses diète
Diet Coke et Pepsi diète Coke Zero sont les « inconnues ». Ils ont été laissés dans des conteneurs ouverts toute la nuit pour se débarrasser de la carbonatation, comme les bulles ne sont pas bonnes pour le système de CLHP. Suffisamment, il se débarrasse de tout le gaz dans les échantillons.
- Attirer environ 2 mL de soda de la diète dans une seringue en plastique.
- Fixez l’extrémité du filtre à la seringue par l’intermédiaire de Luer-Lok en le tournant en place.
- Pousser le liquide dans la seringue à travers le filtre et dans un flacon de verre. Il se débarrasse des particules indésirables qui pourraient potentiellement bloquer la colonne de séparation.
- Diluer chaque échantillon avec une quantité égale de l’eau distillée, afin qu’ils soient à 50 % de pureté.
- Injecter 100 µL de l’échantillon dans la boucle d’échantillonnage et exécuter des essais avec les mêmes paramètres que pour les standards.
7. les calculs
- D’après les concentrations des solutions composant, calculer la concentration de tous les composants dans les normes, basés sur les dilutions qui ont été faites pour les 7 échantillons.
- Déterminer des pics sur les chromatogrammes pour chaque étalon et les échantillons inconnus par la méthode triangulaire, ce qui équivaut à périodes de hauteur, la largeur à ½ hauteur (Figure 2). Après avoir déterminé quel pic correspond à chaque composant basé sur le temps que nécessaire pour chaque composant montrer leur apogée respectif, entrer dans ces domaines de pointe dans un tableur informatique.
- Créer des courbes d’étalonnage de la surface du pic vs concentration (mg/L) dans les normes pour chacune des trois composantes.
- Définir les méthode des moindres carrés pour chaque courbe d’étalonnage.
- Calculer la concentration de chaque composante dans les boissons gazeuses diète de la montré dans les essais de la CLHP pour les échantillons de surface des pics. N’oubliez pas que le soda diète a été dilué par un facteur de 2 avant l’injection dans le système de CLHP.
- Calculer la quantité, en mg/L, de chaque composante dans les boissons gazeuses diète.
- Selon les résultats, calculer la milligrammes de chaque composant dans une canette de 12 onces de soude. Supposons que 12 oz = 354,9 mL.
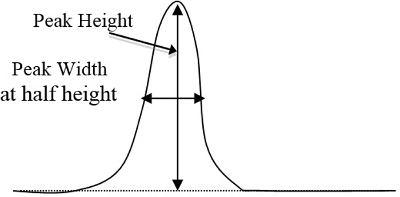
La figure 2. Un exemple de base d’une courbe hauteur et largeur, qui doivent être multipliés (hauteur du pic fois largeur à ½ de la hauteur).
Les chromatogrammes HPLC sont en mesure de quantifier chacune des 3 composantes de tous les échantillons basés sur les courbes d’étalonnage des normes (Figure 3).
Cette série d’expériences, on a déterminé qu’une canette de 12 onces de ces boissons gazeuses diète contenait les quantités suivantes de chaque composant :
Diet Coke : 50,5 mg de caféine ; aspartame 217,6 mg ; benzoate de 83,6 mg.
Coke Zero : 43,1 mg de caféine ; aspartame de 124,9 mg ; benzoate de 85,3 mg.
Pepsi diète : 34,1 mg caféine ; aspartame de 184,7 mg ; benzoate de 79,5 mg.
Sans surprise, tous les 3 n’avait à peu près la même quantité de benzoate, tel qu’il est juste un préservatif. Les produits de Coke avaient un peu plus de caféine, et le Coke Zero avait beaucoup moins l’aspartame que les deux autres sodas, puisqu’elle comprend également l’acide citrique pour certains arômes.
Les numéros suivants sont les montants réels de caféine et de l’aspartame dans une canette de 12 onces du sodas de 3 régime (la teneur en caféine a été obtenue sur les sites Web de Coca-Cola et Pepsi. Le contenu de l’aspartame a été obtenu à la fois LiveStrong.com et DiabetesSelfManagement.com.) :
Diet Coke : 46 mg de caféine ; aspartame 187,5 mg
Coke Zero : 34 mg de caféine ; aspartame 87,0 mg
Pepsi diète : 35 mg caféine ; aspartame 177,0 mg
Exemples de calcul (tableau 2) :
Concentration de caféine dans STD #1 : la solution de composant pour la caféine avait 0,400 g de caféine jusqu'à 500 mL = 0,500 L → 0,800 g / L = 0,800 mg / mL.
STD #1 a 1 mL de cette solution diluée à 50,0 mL
0,800 mg/mL * (1,0 mL/50,0 mL) = 0,016 mg / mL = 16,0 mg / L.
STD #2 a 2 mL de cette solution diluée à 50,0 mL
0,800 mg/mL * (2,0 mL/50,0 mL) = 0,032 mg / mL = 32,0 mg / L.
Les résultats de la trois d’abaques (Figure 4) a donné les équations suivantes :
Aire du pic de caféine = 0.1583* [mg/L de caféine] - 0.574
Aire du pic de l’aspartame = 0.02696* [Aspartame mg/L] - 0,405
Aire du pic de benzoate = 0.1363* [Benzoate mg/L] - 1,192
Diet Coke : Aire du pic de caféine = 10.68 = 0.1583* [mg/L de caféine] - 0.574
[Mg/L de caféine] = (10,68 + 0.574) / (0.1583) = 71,1 mg/L dans l’échantillon injecté.
Étant donné que l’échantillon a été dilué par un facteur de 2, le Diet Coke avait caféine 141,2 mg/L.
Le montant par 12 onces peut = (141,2 mg/L) (can de 0.3549 mL/12 oz) = 50,5 mg de caféine / can.
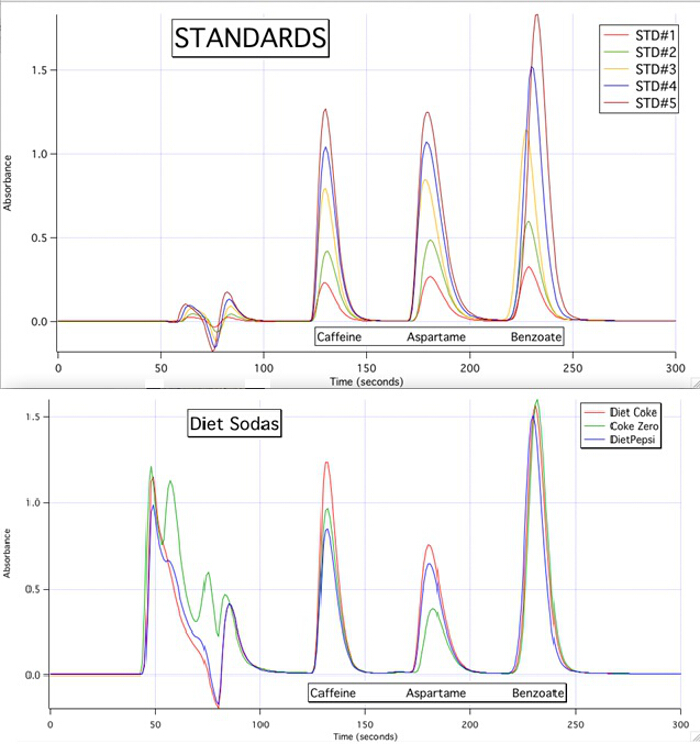
La figure 3. Les chromatogrammes HPLC des 5 normes et les 3 échantillons.
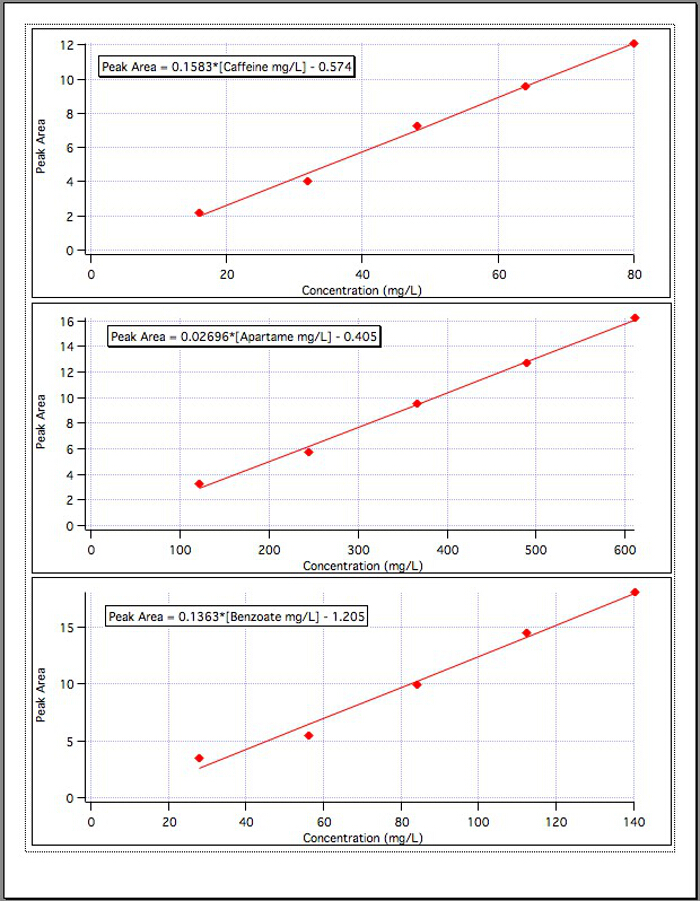
La figure 4. Les courbes d’étalonnage pour chacun des 3 composants.
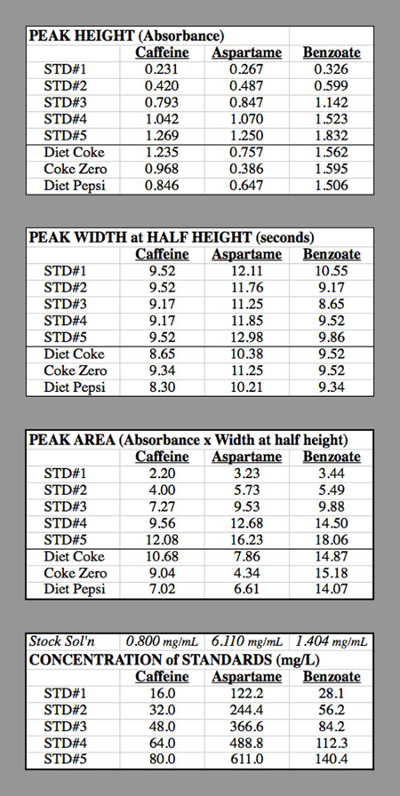
Le tableau 2. Les tableaux de données pour les essais de HPLC utilisés pour générer les courbes d’étalonnage.
HPLC est une technique largement utilisée dans la séparation et la détection pour de nombreuses applications. Il est idéal pour les composés non volatils, comme la chromatographie en phase gazeuse (GC) exige que les échantillons sont dans leur phase gazeuse. Composés non volatils comprennent des sucres, des vitamines, des médicaments et des métabolites. En outre, il est non destructive, qui permet à chaque composant à être prélevés pour une analyse ultérieure (par exemple la spectrométrie de masse). Les phases mobiles sont pratiquement illimitées, qui permet de modifier la polarité du pH pour atteindre la meilleure résolution. L’utilisation de phases mobiles gradients permet pour ces changements au cours des essais réels.
Il y a eu des inquiétudes sur les problèmes de santé possibles qui peuvent être associés à l’édulcorant artificiel aspartame. Étiquetage des produits actuel ne montre pas le montant de ces composants à l’intérieur les boissons de régime alimentaire. Cette méthode permet de quantifier ces montants, ainsi que de la caféine et le benzoate.
D’autres applications comprennent le calcul des montants des pesticides dans l’eau ; détermination du montant de l’acétaminophène ou l’ibuprofène en comprimés de soulageur de douleur ; déterminer s’il y a des produits dopants présents dans le sang des athlètes ; ou tout simplement déterminer la présence de drogues dans un laboratoire du crime. Alors que les concentrations de ces échantillons et souvent l’identité des composants, peuvent être facilement déterminés, l’une des limites sont que plusieurs échantillons pourraient avoir à proximité de rétention identique fois, résultant en co à élution.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved