0:00
Overview
1:22
Principles of HPLC
5:05
Preparation of the Mobile Phase
6:08
Preparation of Component and Standard Solutions
7:25
HPLC Setup
9:25
Diet Soda Samples
10:16
Results
11:27
Applications
12:44
Summary
כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC)
מקור: ד"ר פול באוור - אוניברסיטת פרדו
כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) היא שיטה אנליטית חשובה המשמשת בדרך כלל להפרדת וכימות רכיבים של דגימות נוזליות. בטכניקה זו, פתרון (שלב ראשון) נשאב דרך עמודה המכילה אריזה של חלקיקים נקבוביים קטנים עם שלב שני קשור לפני השטח. המסיסות השונות של רכיבי המדגם בשני השלבים גורמות לרכיבים לנוע דרך העמודה במהירויות ממוצעות שונות, ובכך יוצרות הפרדה בין רכיבים אלה. הפתרון השאוב נקרא השלב הנייד, בעוד השלב בעמודה נקרא השלב הנייח.
ישנם מספר מצבים של כרומטוגרפיה נוזלית, בהתאם לסוג של שלב נייח ו / או נייד מועסק. ניסוי זה משתמש בכרומטוגרפיה הפוכה, שבה השלב הנייח אינו קוטבי, והשלב הנייד הוא קוטבי. השלב הנייח שיש להשתמש בו הוא קבוצות פחמימנים C18 המלוכדות לחלקיקי סיליקה של 3 מיקרומטר, בעוד שהשלב הנייד הוא חיץ מימי עם מחליף אורגני קוטבי (acetonitrile) שנוסף כדי לשנות את כוחו המתחמק. בצורה זו, סיליקה יכול לשמש עבור דגימות כי הם מסיסים במים, מתן מגוון רחב של יישומים. בניסוי זה, תערובות של שלושה מרכיבים הנמצאים לעתים קרובות משקאות קלים דיאטה (כלומר קפאין, בנזואט, אספרטיים) מופרדים. שבעה פתרונות מוכנים המכילים כמויות ידועות של שלושת המינים משמשים, ולאחר מכן הכרומטוגרמה שלהם מתועדת.
במהלך ניסוי HPLC, משאבה בלחץ גבוה לוקחת את השלב הנייד ממאגר דרך מזרק. לאחר מכן הוא עובר דרך עמודה C18-ארוזה בשלב הפוך להפרדת רכיבים. לבסוף, השלב הנייד עובר לתא גלאי, שבו הספיגה נמדדת ב 220 ננומטר, ומסתיים בבקבוק פסולת. משך הזמן שלוקח לרכיב לנסוע מיציאת המזרק לגלאי נקרא זמן השמירה.
כרומטוגרפיה נוזלית משמשת בניסוי זה, שבו ההפרדה מתבצעת בעמודה בשלב הפוך. מידות העמודות הן 3 מ"מ (i.d.) x 100 מ"מ, ואת אריזת סיליקה (גודל חלקיק 3 מיקרומטר) הוא פונקציונלי עם C18 octadecylsilane (ODS). Rheodyne 6-6-יציאות שסתום הזרקה סיבובית משמש בתחילה לאחסן את המדגם בלולאה קטנה ומציג את המדגם לשלב הנייד על סיבוב של השסתום.
הזיהוי הוא על ידי ספקטרוסקופיית ספיגה אורך גל של 220 ננומטר. ניסוי זה יכול להיות מופעל ב 254 ננומטר, אם גלאי אינו משתנה. לנתונים מהגלאי יש יציאת מתח אנלוגית, הנמדדת באמצעות מולטימטר דיגיטלי (DMM), ונקראת על ידי מחשב טעון בתוכנית לרכישת נתונים. הכרומטוגרמה המתקבלת יש שיא עבור כל רכיב במדגם. לניסוי זה, כל שלושת הרכיבים חומטים תוך 5 דקות.
ניסוי זה משתמש בשלב נייד אחד ומשאבה, אשר נקרא שלב נייד איזוקרטי. עבור דוגמאות שקשה להפריד, ניתן להשתמש בשלב נייד הדרגתי. זאת כאשר השלב הנייד הראשוני הוא בעיקר מימי, ועם הזמן, שלב נייד אורגני שני מתווסף בהדרגה לשלב הנייד הכולל. שיטה זו מעלה את הקוטביות של שלב זה לאורך זמן, אשר מוריד את זמני השמירה של הרכיבים ועובד באופן דומה שיפוע טמפרטורה על כרומטוגרפיה גז. ישנם כמה מקרים שבהם העמודה מחוממת (בדרך כלל עד 40 °C (40 °F), אשר לוקח משם כל שגיאות זמן שמירה הקשורים לשינוי של טמפרטורת הסביבה.
ב- HPLC בשלב הפוך, אריזת השלב הנייח של העמודה היא בדרך כלל אריזת C4, C8 או C18. עמודות C4 מיועדות בעיקר לחלבונים בעלי משקלים מולקולריים גדולים, ואילו עמודות C18 מיועדות לפפטידים ודגימות בסיסיות עם משקלים מולקולריים נמוכים יותר.
זיהוי על ידי ספקטרוסקופיית ספיגה הוא באופן גורף שיטת הזיהוי של בחירה, כמו ספקטרום הקליטה של הרכיבים זמינים כולם. מערכות מסוימות משתמשות במדידות אלקטרוכימיות, כגון מוליכות או אמפרומטריה, כשיטת הזיהוי שלהן.
עבור ניסוי זה, השלב הנייד הוא בעיקר 20% acetonitrile ו 80% מים מטוהרים (DI). כמות קטנה של חומצה אצטית מתווספת כדי להוריד את ה- pH של השלב הנייד, אשר שומר על סילנול בשלב האריזה הניחת במצב לא מזוהה. זה מפחית את שיא הספיגה מן הזנב, נותן פסגות צרות יותר. לאחר מכן, ה- pH מותאם עם 40% נתרן הידרוקסיד כדי להעלות את ה- pH ולעזור להפחית את זמני השמירה של הרכיבים.
כל קבוצה משתמשת בקבוצה של 7 הבקבוקונים המכילים ריכוזים שונים של הפתרונות הסטנדרטיים (טבלה 1). 3 הראשונים משמשים לזיהוי כל שיא, ו- 4 האחרונים מיועדים ליצירת תרשים כיול עבור כל רכיב. תקנים 1-3 משמשים גם עבור תרשים הכיול.
| מספר | קפאין (מ"ל) | בנזואט (מ"ל) | אספרטיים (מ"ל) |
| 1 | 4 | 0 | 0 |
| 2 | 0 | 4 | 0 |
| 3 | 0 | 0 | 4 |
| 4 | 1 | 1 | 1 |
| 5 | 2 | 2 | 2 |
| 6 | 3 | 3 | 3 |
| 7 | 5 | 5 | 5 |
טבלה 1. נפחים של תקני מלאי המשמשים להכנת 7 תקני העבודה שסופקו (הנפח הכולל של כל תקן הוא 50 מ"ל).
1. להפוך את השלב הנייד
- הכן את השלב הנייד על ידי הוספת 400 מ"ל של acetonitrile כ 1.5 ליטר של מים DI מטוהרים.
- בזהירות להוסיף 2.4 מ"ל של חומצה אצטית קרחונית לפתרון זה.
- לדלל את הפתרון לנפח כולל של 2.0 L בבקבוק נפחי עם מי DI מטוהרים. הפתרון המתקבל צריך להיות pH בין 2.8 ל 3.2.
- התאם את רמת ה-pH ל-4.2 על-ידי הוספת 40% נתרן הידרוקסיד, מבחינת ירידה עם שימוש במד pH דיגיטלי מכויל. הוסף לאט מאוד ברגע pH מגיע 4.0. זה צריך לקחת סביב 50 טיפות כדי להשיג.
- לסנן את השלב הנייד באמצעות מסנן ממברנה ניילון 66 0.47-μm תחת ואקום כדי degas הפתרון כדי להסיר מוצקים שיכולים לחבר את העמוד הכרומטוגרפי. חשוב degas השלב הנייד כדי למנוע בועה, אשר יכול גם לגרום חלל בשלב הנייח בכניסת העמודה או לעבוד את דרכו לתוך תא הגלאי, גרימת חוסר יציבות עם ספיגת UV.
2. יצירת פתרונות הרכיבים
שלושת המרכיבים שצריכים להיעשות הם קפאין (0.8 מ"ג/מ"ל), אשלגן בנזואט (1.4 מ"ג/מ"ל) ואפרטם (L-אספרטיל-L-פנילאלנין מתיל אסתר) (6.0 מ"ג/מ"ל). ריכוזים אלה, פעם מדולל באותה צורה, לשים את הסטנדרטים ברמות שנמצאו דגימות סודה.
- הוסיפו 0.40 גרם קפאין לבקבוק נפחי של 500 מ"ל, ואז לדלל לסימן 500 מ"ל עם מי DI.
- הוסיפו 0.70 גרם בנזואט לבקבוק נפחי של 500 מ"ל, ואז לדלל לסימן 500 מ"ל עם מי DI.
- הוסף 0.60 גרם אספרטיים לבקבוק נפחי של 100 מ"ל, ולאחר מכן לדלל לסימן 100 מ"ל עם מי DI. מניחים את הפתרון הזה במקרר כדי למנוע פירוק במהלך האחסון.
3. יצירת 7 פתרונות סטנדרטיים
שלושת הרכיבים כולם יש מקדמי הפצה שונים, אשר משפיע על האופן שבו כל אינטראקציה עם שני השלבים. ככל שמקדם ההפצה גדול יותר, כך הרכיב מבלה יותר זמן בשלב הנייח, וכתוצאה מכך זמני שמירה ארוכים יותר בהגעה לגלאי.
- לאחר התרשים בטבלה 1, הזרם את הכמות המתאימה של כל רכיב לבקבוק נפחי של 50 מ"ל.
- לדלל כל אחד מפתרונות המניה לסימן 50 מ"ל על הבקבוקונים הנפחיים עם שלב נייד.
- יוצקים כל פתרון סטנדרטי לבקבוקונים קטנים המסומנים בארון דוגמה.
- אחסן את מדפי הדגימות במקרר, יחד עם הפתרונות הנותרים בבקבוקונים נפחיים של 50 מ"ל.
4. בדיקת ההגדרות הראשוניות של מערכת HPLC
- ודא כי קו הפסולת נמצא במיכל פסולת ואינו מיחזור בחזרה לשלב הנייד.
- ודא שקצב הזרימה של השלב הנייד מוגדר ל- 0.5 מ"ל/דקה. זה גבוה מספיק כדי לאפשר לכל הפסגות לחמוק תוך 5 דקות ואיטי מספיק כדי לאפשר רזולוציה נחמדה.
- ודא כי הלחץ המינימלי והמקסימלי וקצב הזרימה מוגדרים לערכים הנכונים בלוח הקדמי של מערכת המסירה הממסית (המשאבה).
- הגדרת לחץ מינימלית: 250 פסאיי (זה כדי לכבות את המשאבה, אם מתרחשת דליפה).
- הגדרת לחץ מקסימלית: 4,000 פסאיי (זאת כדי להגן על המשאבה מפני שבירה, אם נוצר סתימה).
- לחץ על "אפס" בלוח הקדמי של הגלאי כדי להגדיר את הריק (הריק הוא השלב הנייד הטהור).
- לשטוף מזרק 100-μL עם מים deionized, ולאחר מכן עם כמה כרכים של אחד תקני העבודה שיש לנתח, ולמלא את המזרק עם פתרון זה. התחל עם 3 דגימות של רכיב יחיד, המאפשר לזהות את השיא של כל רכיב עניין.
5. הזרקה ידנית של המדגם ואיסוף הנתונים
- עם ידית מזרק במצב עומס, לאט להזריק 100 μL של פתרון דרך יציאת המחיצה.
- ודא שתוכנית איסוף הנתונים מוגדרת לאיסוף נתונים עבור 300 s, מה שמאפשר מספיק זמן לכל 3 הפסגות לחמוק דרך הגלאי.
- כאשר אתה מוכן להתחיל את הניסוי, לסובב את ידית המזרק למיקום ההזרקה (אשר מזריק את המדגם לתוך השלב הנייד) ולחץ על "התחל ניסיון" על תוכנית איסוף נתוני המחשב מיד. בתקנים 1-3, רק אחת משלוש הפסגות הרצופות מופיעה על המסך במהלך הריצה(איור 1).
- לאחר ש- 300 s חלפו, איסוף הנתונים שולח בקשה לשמירת קובץ הנתונים. שמור את הנתונים תחת שם קובץ מתאים(למשל,STD #1).
- שים לב לזמן בשניות עבור השיא של כל גירסת ניסיון, המשמשת לזיהוי רכיב זה.
- הסר את המזרק מן המחיצה ולחזור על התהליך עבור כל אחד תקני העבודה הנותרים, באמצעות באותו זמן לכל כרומטוגרמה כפי שנקבע מההפעלה הראשונה.
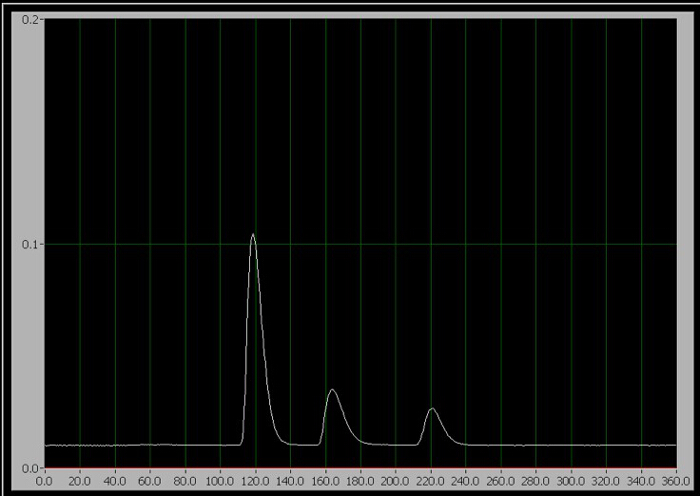
איור 1. הכרומטוגרמה של 3 הרכיבים. משמאל לימין, הם קפאין, אספרטיים, ובנזואט.
6. הדגימות של דיאט סודה
דיאט קולה, דיאט פפסי וקולה זירו הם ה"לא ידועים". הם הושארו בחוץ במיכלים פתוחים בן לילה כדי להיפטר מהפחמימה, שכן בועות אינן טובות למערכת HPLC. זה מספיק נפטר מכל גזים בדגימות.
- צייר סביב 2 מ"ל של סודה דיאטה לתוך מזרק פלסטיק.
- חבר את קצה המסנן למזרק דרך Luer-Lok על ידי סיבובו במקום.
- דוחפים את הנוזל במזרק דרך המסנן לתוך בקבוקון זכוכית קטן. זה נפטר מחלקיקים לא רצויים שעלולים לסתום את עמודת ההפרדה.
- לדלל כל מדגם עם כמות שווה של מים DI, כך שהם ב 50% טוהר.
- הזרק 100 μL של המדגם לתוך לולאת המדגם, ולהפעיל ניסויים עם אותם פרמטרים כמו עבור הסטנדרטים.
7. חישובים
- מהריכוזים של פתרונות הרכיבים, לחשב את הריכוז של כל הרכיבים בתקנים, בהתבסס על דילול שנעשו עבור 7 דגימות.
- קבע אזורי שיא בכרומטוגרמה עבור כל תקן ואת הדגימות הלא ידועות בשיטה המשולשת, השווה לגובה שיא כפול הרוחב בגובה 1/2 (איור 2). לאחר קביעת הפסגה המתאימה לכל רכיב בהתבסס על הזמן שלוקח לכל רכיב להציג את השיא המתאים לו, הזן אזורי שיא אלה בגיליון אלקטרוני של המחשב.
- צור עקומות כיול של אזור שיא לעומת ריכוז (mg/L) בתקנים עבור כל שלושת הרכיבים.
- קבעו את הריבועים הפחות מתאימים לכל עקומת כיול.
- חשב את הריכוז של כל רכיב במשקאות מוגזים דיאט מאזורי השיא המוצגים בניסויי HPLC עבור הדגימות. זכור כי סודה דיאטה היה מדולל על ידי גורם של 2 לפני הזרקה לתוך מערכת HPLC.
- לחשב את הסכום, mg /L, של כל רכיב משקאות מוגזים דיאטה.
- בהתבסס על התוצאות, לחשב את המיליגרם של כל רכיב שנמצא פחית 12 אונקיות של סודה. נניח 12 אונקיות = 354.9 מ"ל.
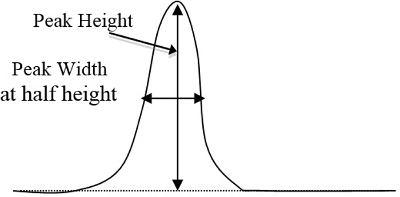
איור 2. דוגמה בסיסית לגובה ולרוחב השיא של העקומה, שיש להכפיל (גובה שיא כפול רוחב בגובה 1/2).
הכרומטוגרמה של HPLC מסוגלת לכמת כל אחד מ-3 הרכיבים עבור כל הדגימות בהתבסס על עקומות הכיול של התקנים(איור 3).
מתוך קבוצה זו של ניסויים, נקבע כי פחית 12 אונקיות של משקאות דיאט דיאט אלה הכיל את הכמויות הבאות של כל רכיב:
דיאט קולה: 50.5 מ"ג קפאין; 217.6 מ"ג אספרטיים; 83.6 מ"ג בנזואט.
קולה זירו: 43.1 מ"ג קפאין; 124.9 מ"ג אספרטיים; 85.3 מ"ג בנזואט.
דיאט פפסי: 34.1 מ"ג קפאין; 184.7 מ"ג אספרטיים; 79.5 מ"ג בנזואט.
באופן לא מפתיע, כל 3 היה בערך באותה כמות של בנזואט, כפי שהוא רק חומר משמר. למוצרי הקולה היה קצת יותר קפאין, ולקולה זירו היה הרבה פחות אספרטיים משתי המשקאות הנוספים, מכיוון שהוא כולל גם חומצת לימון לקצת טעם.
המספרים הבאים הם כמויות קפאין ואפרטם בפועל בפחית של 12 אונקיות של 3 משקאות מוגזים דיאט (תוכן הקפאין התקבל מאתרי קוקה קולה ופפסי. תוכן אספרטיים התקבל הן LiveStrong.com והן DiabetesSelfManagement.com.):
דיאט קולה: 46 מ"ג קפאין; 187.5 מ"ג אספרטיים
קולה זירו: 34 מ"ג קפאין; 87.0 מ"ג אספרטיים
דיאט פפסי: 35 מ"ג קפאין; 177.0 מ"ג אספרטיים
חישובים לדוגמה (טבלה 2):
ריכוז קפאין ב STD #1: הפתרון המרכיב עבור קפאין היה 0.400 גרם של קפאין מדולל ל 500 מ"ל = 0.500 L → 0.800 גרם / ליטר = 0.800 מ"ג / מ"ל.
STD #1 היה 1 מ"ל של פתרון זה מדולל ל 50.0 מ"ל
0.800 מ"ג/מ"ל * (1.0 מ"ל / 50.0 מ"ל) = 0.016 מ"ג / מ"ל = 16.0 מ"ג / ליטר.
STD #2 היה 2 מ"ל של פתרון זה מדולל ל 50.0 מ"ל
0.800 מ"ג/מ"ל * (2.0 מ"ל / 50.0 מ"ל) = 0.032 מ"ג / מ"ל = 32.0 מ"ג / ליטר.
התוצאות משלושת תרשימי הכיול (איור 4) הניבו את המשוואות הבאות:
אזור שיא קפאין = 0.1583*[קפאין מ"ג/ליטר] - 0.574
אזור פסגת אספרטיים = 0.02696*[אספרטיים מ"ג/ליטר] - 0.405
אזור פסגת בנזואט = 0.1363*[בנזואט מ"ג/ל' - 1.192
דיאט קולה: אזור שיא קפאין = 10.68 = 0.1583*[קפאין מ"ג/ליטר] - 0.574
[קפאין מ"ג/L] = ((10.68 + 0.574)/ (0.1583) = 71.1 מ"ג/ל' במדגם המוזרק.
מאז המדגם היה מדולל על ידי גורם של 2, דיאט קולה היה 141.2 מ"ג / ליטר קפאין.
הכמות לכל פחית של 12 אונקיות = (141.2 מ"ג/ל')(0.3549 מ"ל/12 אונקיות) = 50.5 מ"ג קפאין/פחית.
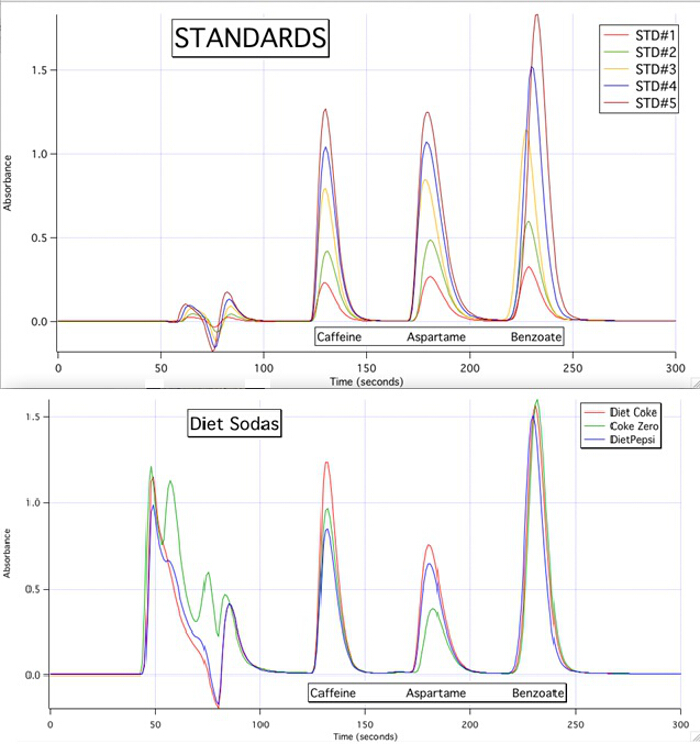
איור 3. הכרומטוגרמה של HPLC של 5 התקנים ו-3 הדגימות.
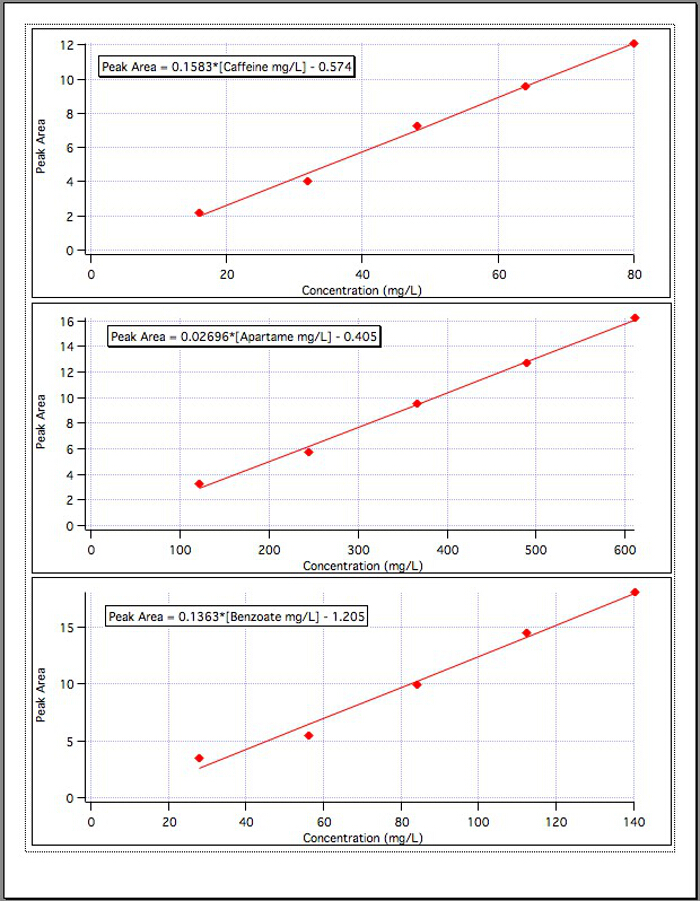
איור 4. הכיול מתעקל עבור כל אחד מ-3 הרכיבים.
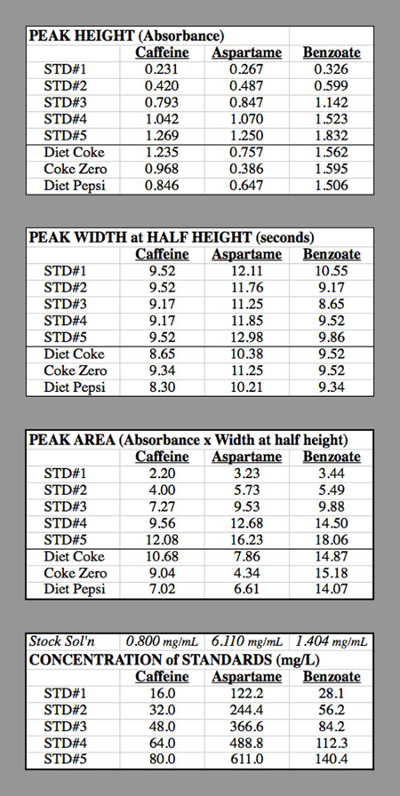
טבלה 2. טבלאות הנתונים עבור ניסויי HPLC המשמשים ליצירת עקומות הכיול.
HPLC היא טכניקה נפוצה בהפרדה ובזיהוי עבור יישומים רבים. הוא אידיאלי עבור תרכובות לא נדיפות, כמו כרומטוגרפיה גז (GC) דורש כי הדגימות נמצאות בשלב הגז שלהם. תרכובות לא נדיפות כוללות סוכרים, ויטמינים, תרופות, מטבוליטים. כמו כן, זה לא הרסני, המאפשר לאסוף כל רכיב לניתוח נוסף (כגון ספקטרומטריית מסה). השלבים הניידים הם כמעט בלתי מוגבלים, מה שמאפשר שינויים בקוטביות של pH כדי להשיג רזולוציה טובה יותר. השימוש בשלבים ניידים הדרגתיים מאפשר שינויים אלה במהלך הניסויים בפועל.
יש כבר חשש לגבי בעיות בריאותיות אפשריות שעשויות להיות קשורות אספרטיים ממתיק מלאכותי. תיוג המוצר הנוכחי אינו מציג את כמות הרכיבים האלה בתוך משקאות הדיאטה. שיטה זו מאפשרת לכמת כמויות אלה, יחד עם קפאין ובנזואט.
יישומים אחרים כוללים קביעת כמויות חומרי הדברה במים; קביעת כמות פרצטמול או איבופרופן בטבליות משככי כאבים; קביעת אם יש תרופות לשיפור ביצועים נוכח זרם הדם של ספורטאים; או פשוט לקבוע את נוכחותם של סמים במעבדת פשע. בעוד הריכוזים של דגימות אלה, ולעתים קרובות את זהות הרכיבים, ניתן לקבוע בקלות, המגבלה היחידה היא כי כמה דגימות יכול להיות קרוב זמני שימור זהים, וכתוצאה מכך שיתוף eluting.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved