0:00
Overview
1:22
Principles of HPLC
5:05
Preparation of the Mobile Phase
6:08
Preparation of Component and Standard Solutions
7:25
HPLC Setup
9:25
Diet Soda Samples
10:16
Results
11:27
Applications
12:44
Summary
Cromatografia liquida ad alta prestazione (HPLC)
Fonte: Dr. Paul Bower - Purdue University
La cromatografia liquida ad alte prestazioni (HPLC) è un importante metodo analitico comunemente usato per separare e quantificare componenti di campioni liquidi. In questa tecnica, una soluzione (prima fase) viene pompata attraverso una colonna che contiene un imballaggio di piccole particelle porose con una seconda fase legata alla superficie. Le diverse solubilità dei componenti del campione nelle due fasi fanno sì che i componenti si muoano attraverso la colonna con velocità medie diverse, creando così una separazione di questi componenti. La soluzione pompata è chiamata fase mobile, mentre la fase nella colonna è chiamata fase stazionaria.
Esistono diverse modalità di cromatografia liquida, a seconda del tipo di fase stazionaria e/o mobile impiegata. Questo esperimento utilizza la cromatografia a fase inversa, in cui la fase stazionaria è non polare e la fase mobile è polare. La fase stazionaria da impiegare sono i gruppi di idrocarburi C18 legati a particelle di silice da 3 μm, mentre la fase mobile è un tampone acquoso con un modificatore organico polare (acetonitrile) aggiunto per variare la sua forza di eluizione. In questa forma, la silice può essere utilizzata per campioni solubili in acqua, fornendo una vasta gamma di applicazioni. In questo esperimento, le miscele di tre componenti che si trovano frequentemente nelle bevande analcoliche dietetiche (vale a dire caffeina, benzoato e aspartame) sono separate. Vengono utilizzate sette soluzioni preparate contenenti quantità note delle tre specie e vengono quindi registrati i loro cromatogrammi.
Durante un esperimento HPLC, una pompa ad alta pressione prende la fase mobile da un serbatoio attraverso un iniettore. Quindi viaggia attraverso una colonna imballata inversa C18 per la separazione dei componenti. Infine, la fase mobile si sposta in una cella di rilevamento, dove l'assorbanza viene misurata a 220 nm e termina in una bottiglia di scarto. La quantità di tempo necessaria affinché un componente viaggi dalla porta dell'iniettore al rilevatore è chiamata tempo di ritenzione.
In questo esperimento viene utilizzato un cromatografo liquido, in cui la separazione viene eseguita su una colonna a fase inversa. Le dimensioni della colonna sono 3 mm (i.d.) x 100 mm e l'impacchettamento di silice (dimensione delle particelle di 3 μm) è funzionalizzato con C18 octadecylsilane (ODS). Una valvola di iniezione rotativa Rheodyne a 6 porte viene utilizzata per conservare inizialmente il campione in un piccolo anello e introduce il campione nella fase mobile dopo la rotazione della valvola.
Il rilevamento avvieni mediante spettroscopia di assorbimento ad una lunghezza d'onda di 220 nm. Questo esperimento può essere eseguito a 254 nm, se un rivelatore non è variabile. I dati del rilevatore hanno un'uscita di tensione analogica, che viene misurata utilizzando un multimetro digitale (DMM) e letta da un computer caricato con un programma di acquisizione dati. Il cromatogramma risultante ha un picco per ogni componente del campione. Per questo esperimento, tutti e tre i componenti elute entro 5 minuti.
Questo esperimento utilizza una singola fase mobile e una pompa, che è chiamata fase mobile isocratica. Per i campioni difficili da separare, è possibile utilizzare una fase mobile gradiente. Questo è quando la fase mobile iniziale è principalmente acquosa e, nel tempo, una seconda fase mobile organica viene gradualmente aggiunta alla fase mobile complessiva. Questo metodo aumenta la polarità di questa fase nel tempo, che abbassa i tempi di ritenzione dei componenti e funziona in modo simile a un gradiente di temperatura su un gascromatografo. Ci sono alcuni casi in cui la colonna viene riscaldata (di solito a 40 ° C), il che elimina eventuali errori di tempo di ritenzione associati a un cambiamento della temperatura ambiente.
Nell'HPLC a fase inversa, l'imballaggio in fase stazionaria della colonna è solitamente un imballaggio C4, C8 o C18. Le colonne C4 sono principalmente per proteine con grandi pesi molecolari, mentre le colonne C18 sono per peptidi e campioni di base con pesi molecolari inferiori.
Il rilevamento mediante spettroscopia di assorbimento è in modo schiacciante il metodo di rilevamento preferito, poiché gli spettri di assorbimento dei componenti sono tutti prontamente disponibili. Alcuni sistemi utilizzano misure elettrochimiche, come la conducibilità o l'amperometria, come metodo di rilevamento.
Per questo esperimento, la fase mobile è principalmente il 20% di acetonitrile e l'80% di acqua deionizzata purificata (DI). Una piccola quantità di acido acetico viene aggiunta per abbassare il pH della fase mobile, che mantiene il silanolo nella fase di imballaggio stazionario in uno stato non dissociato. Ciò riduce il picco di adsorbimento dalla coda, dando picchi più stretti. Quindi, il pH viene regolato con idrossido di sodio al 40% per aumentare il pH e contribuire a ridurre i tempi di ritenzione dei componenti.
Ogni gruppo utilizza un insieme dei 7 flaconcini contenenti diverse concentrazioni delle soluzioni standard (Tabella 1). I primi 3 vengono utilizzati per identificare ogni picco e gli ultimi 4 per la creazione di un grafico di calibrazione per ciascun componente. Gli standard 1-3 sono utilizzati anche per la tabella di calibrazione.
| Numero | Caffeina (mL) | Benzoato (mL) | Aspartame (mL) |
| 1 | 4 | 0 | 0 |
| 2 | 0 | 4 | 0 |
| 3 | 0 | 0 | 4 |
| 4 | 1 | 1 | 1 |
| 5 | 2 | 2 | 2 |
| 6 | 3 | 3 | 3 |
| 7 | 5 | 5 | 5 |
Tabella 1. Volumi di standard di magazzino utilizzati per preparare i 7 standard di lavoro forniti (il volume totale di ogni standard è di 50 ml).
1. Fare la fase mobile
- Preparare la fase mobile aggiungendo 400 ml di acetonitrile a circa 1,5 L di acqua DI purificata.
- Aggiungere con attenzione 2,4 ml di acido acetico glaciale a questa soluzione.
- Diluire la soluzione ad un volume totale di 2,0 L in un matraccio volumetrico con acqua DI purificata. La soluzione risultante dovrebbe avere un pH compreso tra 2,8 e 3,2.
- Regolare il pH a 4,2 aggiungendo il 40% di idrossido di sodio, in base alle gocce con l'uso di un pHmetro digitale calibrato. Aggiungere molto lentamente una volta che il pH raggiunge 4.0. Questo dovrebbe richiedere circa 50 gocce per realizzare.
- Filtrare la fase mobile attraverso un filtro a membrana nylon 66 da 0,47 μm sotto vuoto per degassare la soluzione e rimuovere i solidi che potrebbero tappare la colonna cromatografica. È importante degassare la fase mobile per evitare di avere una bolla, che potrebbe causare un vuoto nella fase stazionaria all'ingresso della colonna o farsi strada nella cella del rivelatore, causando instabilità con l'assorbanza UV.
2. Creazione delle soluzioni dei componenti
I tre componenti che devono essere prodotti sono caffeina (0,8 mg / mL), benzoato di potassio (1,4 mg / mL) e aspartame (L-aspartyl-L-fenilalanina metile estere) (6,0 mg / mL). Queste concentrazioni, una volta diluite nello stesso modo, mettono gli standard ai livelli trovati nei campioni di soda.
- Aggiungere 0,40 g di caffeina in un matraccio volumetrico da 500 ml, quindi diluire fino al segno di 500 ml con acqua DI.
- Aggiungere 0,70 g di benzoato in un matraccio volumetrico da 500 ml, quindi diluire fino al segno di 500 ml con acqua DI.
- Aggiungere 0,60 g di aspartame a un matraccio volumetrico da 100 ml, quindi diluire fino al segno di 100 ml con acqua DI. Mettere questa soluzione in frigorifero per evitare la decomposizione durante la conservazione.
3. Realizzare le 7 soluzioni standard
I tre componenti hanno tutti coefficienti di distribuzione diversi, che influenzano il modo in cui ciascuno interagisce con entrambe le fasi. Maggiore è il coefficiente di distribuzione, maggiore è il tempo che il componente trascorre nella fase stazionaria, con conseguenti tempi di ritenzione più lunghi nel raggiungere il rivelatore.
- Seguendo il grafico della tabella 1, convogliare la quantità corretta di ciascun componente in un matraccio tarare da 50 ml.
- Diluire ciascuna delle soluzioni stock fino al segno di 50 ml sui palloni volumetrici con fase mobile.
- Versare ogni soluzione standard in piccoli flaconcini etichettati in un rack di campioni.
- Conservare le scaffalature dei campioni in frigorifero, insieme alle soluzioni rimanenti nei palloni volumetrici da 50 ml.
4. Verifica delle impostazioni iniziali del sistema HPLC
- Verificare che la linea dei rifiuti si trova in un contenitore dei rifiuti e che non venga riciclata nella fase mobile.
- Verificare che la portata della fase mobile sia impostata su 0,5 ml/min. Questo è abbastanza alto da consentire a tutti i picchi di eluire entro 5 minuti e abbastanza lento da consentire una buona risoluzione.
- Verificare che la pressione minima e massima e la portata siano impostate sui valori corretti sul pannello frontale del sistema di erogazione del solvente (la pompa).
- Impostazione della pressione minima: 250 psi (questo per spegnere la pompa, se si verifica una perdita).
- Impostazione della pressione massima: 4.000 psi (questo per proteggere la pompa dalla rottura, se si forma uno zoccolo).
- Premere "zero" sul pannello frontale del rilevatore per impostare lo spazio vuoto (lo spazio vuoto è la fase mobile pura).
- Risciacquare una siringa da 100 μL con acqua deionizzata, quindi con diversi volumi di uno degli standard di lavoro da analizzare, e riempire la siringa con quella soluzione. Inizia con i 3 campioni monocomponenti, che consentono di identificare il picco di ciascun componente di interesse.
5. Iniezione manuale del campione e della raccolta dei dati
- Con la maniglia dell'iniettore in posizione di carico, iniettare lentamente 100 μL di soluzione attraverso la porta del setto.
- Verificare che il programma di raccolta dati sia impostato per raccogliere dati per 300 s, il che consente tempo sufficiente affinché tutti e 3 i picchi eluino attraverso il rilevatore.
- Quando si è pronti per iniziare la prova, ruotare la maniglia dell'iniettore nella posizione di iniezione (che inietta il campione nella fase mobile) e fare clic su "Avvia prova" sul programma di raccolta dati del computer immediatamente. Per gli standard 1-3, solo uno dei tre picchi sequenziali viene visualizzato sullo schermo durante l'esecuzione (Figura 1).
- Una volta trascorsi 300 s, la raccolta dati invia una richiesta per salvare il file di dati. Salvare i dati con un nome di file adatto(ad esempio,STD#1).
- Prendere nota del tempo in secondi per il picco di ogni prova, che viene utilizzato per identificare quel componente.
- Rimuovere la siringa dal setto e ripetere il processo per ciascuno degli standard di lavoro rimanenti, utilizzando lo stesso tempo per cromatogramma determinato dalla prima esecuzione.
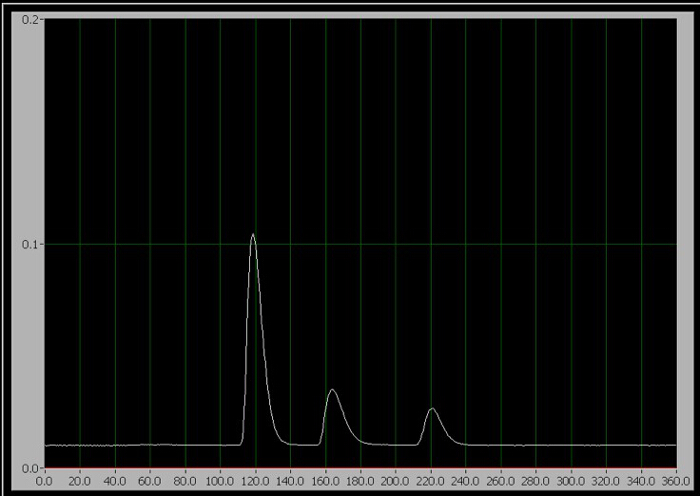
Figura 1. Il cromatogramma dei 3 componenti. Da sinistra a destra, sono caffeina, aspartame e benzoato.
6. I campioni di bibite dietetiche
Diet Coke, Diet Pepsi e Coke Zero sono le "incognite". Sono stati lasciati fuori in contenitori aperti durante la notte per sbarazzarsi della carbonatazione, poiché le bolle non sono buone per il sistema HPLC. Questo elimina sufficientemente tutti i gas nei campioni.
- Aspirare circa 2 ml di soda dietetica in una siringa di plastica.
- Attaccare la punta del filtro alla siringa tramite Luer-Lok ruotandola in posizione.
- Spingere il liquido nella siringa attraverso il filtro e in un piccolo flaconcino di vetro. Questo elimina le particelle indesiderate che potrebbero potenzialmente ostruire la colonna di separazione.
- Diluire ogni campione con una quantità uguale di acqua DI, in modo che siano al 50% di purezza.
- Iniettare 100 μL del campione nel ciclo del campione ed eseguire prove con gli stessi parametri degli standard.
7. Calcoli
- Dalle concentrazioni delle soluzioni dei componenti, calcolare la concentrazione di tutti i componenti negli standard, in base alle diluizioni effettuate per i 7 campioni.
- Determinare le aree di picco sui cromatogrammi per ciascun campione standard e sconosciuto con il metodo triangolare, che equivale all'altezza del picco volte la larghezza a 1/2 altezza (Figura 2). Dopo aver determinato quale picco corrisponde a ciascun componente in base al tempo necessario a ciascun componente per mostrare il rispettivo picco, inserisci queste aree di picco in un foglio di calcolo del computer.
- Creare curve di calibrazione dell'area di picco rispetto alla concentrazione (mg/L) negli standard per tutti e tre i componenti.
- Determinare i minimi quadrati adatti a ciascuna curva di calibrazione.
- Calcola la concentrazione di ciascun componente nelle bibite dietetiche dalle aree di picco mostrate dagli studi HPLC per i campioni. Ricorda che la soda dietetica è stata diluita di un fattore 2 prima di essere iniettata nel sistema HPLC.
- Calcolare la quantità, in mg/L, di ogni componente delle bibite dietetiche.
- Sulla base dei risultati, calcolare i milligrammi di ciascun componente trovato in una lattina di soda da 12 once. Supponiamo 12 oz = 354,9 ml.
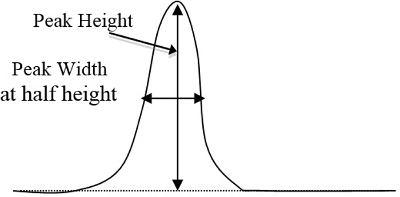
Figura 2. Un esempio di base dell'altezza e della larghezza di picco di una curva, che devono essere moltiplicate (altezza di picco per larghezza a 1/2 altezza).
I cromatogrammi HPLC sono in grado di quantificare ciascuno dei 3 componenti per tutti i campioni in base alle curve di calibrazione delle norme (Figura 3).
Da questa serie di esperimenti, è stato determinato che una lattina da 12 once di queste bibite dietetiche conteneva le seguenti quantità di ciascun componente:
Diet Coke: 50,5 mg di caffeina; 217,6 mg di aspartame; 83,6 mg di benzoato.
Coca-Cola Zero: 43,1 mg di caffeina; 124,9 mg di aspartame; 85,3 mg di benzoato.
Dieta Pepsi: 34,1 mg di caffeina; 184,7 mg di aspartame; 79,5 mg di benzoato.
Non sorprende che tutti e 3 avessero all'incirca la stessa quantità di benzoato, in quanto è solo un conservante. I prodotti Coca-Cola avevano un po 'più di caffeina e la Coca-Cola Zero aveva molto meno aspartame rispetto alle altre due bibite, in quanto include anche acido citrico per alcuni aromi.
I seguenti numeri sono le quantità effettive di caffeina e aspartame in una lattina da 12 once delle 3 bibite dietetiche (Il contenuto di caffeina è stato ottenuto dai siti Web Coca-Cola e Pepsi. Il contenuto di aspartame è stato ottenuto sia da LiveStrong.com che da DiabetesSelfManagement.com.):
Diet Coke: 46 mg di caffeina; 187,5 mg di aspartame
Coca-Cola Zero: 34 mg di caffeina; 87,0 mg di aspartame
Dieta Pepsi: 35 mg di caffeina; 177,0 mg di aspartame
Calcoli di esempio (Tabella 2):
Concentrazione di caffeina in STD#1: La soluzione componente per la caffeina aveva 0,400 g di caffeina diluita a 500 ml = 0,500 L → 0,800 g / L = 0,800 mg / mL.
STD#1 aveva 1 mL di questa soluzione diluita a 50,0 mL
0,800 mg/mL * (1,0 mL / 50,0 mL) = 0,016 mg/mL = 16,0 mg/L.
STD#2 aveva 2 mL di questa soluzione diluita a 50,0 mL
0,800 mg/mL * (2,0 mL / 50,0 mL) = 0,032 mg/mL = 32,0 mg/L.
I risultati dei tre grafici di calibrazione (Figura 4) hanno prodotto le seguenti equazioni:
Area di picco della caffeina = 0,1583*[Caffeina mg/L] - 0,574
Area di picco dell'aspartame = 0,02696*[Aspartame mg/L] - 0,405
Area di picco del benzoato = 0,1363*[benzoato mg/L] - 1,192
Diet Coke: Caffeine Peak Area = 10,68 = 0,1583*[Caffeina mg/L] - 0,574
[Caffeina mg/L] = (10,68 + 0,574)/ (0,1583) = 71,1 mg/L nel campione iniettato.
Poiché il campione è stato diluito di un fattore 2, la Diet Coke aveva 141,2 mg / L di caffeina.
La quantità per lattina da 12 once = (141,2 mg / L) (0,3549 ml / lattina da 12 once) = 50,5 mg di caffeina / lattina.
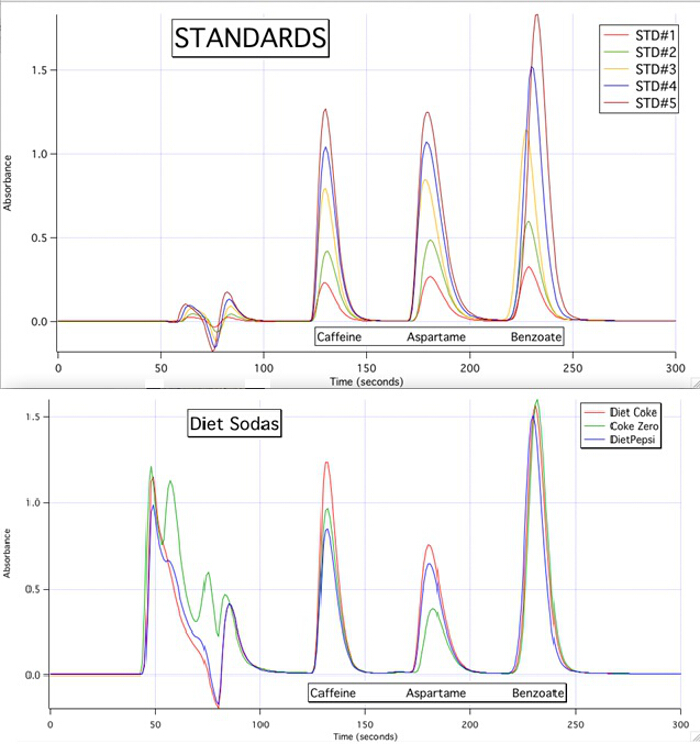
Figura 3. I cromatogrammi HPLC delle 5 norme e dei 3 campioni.
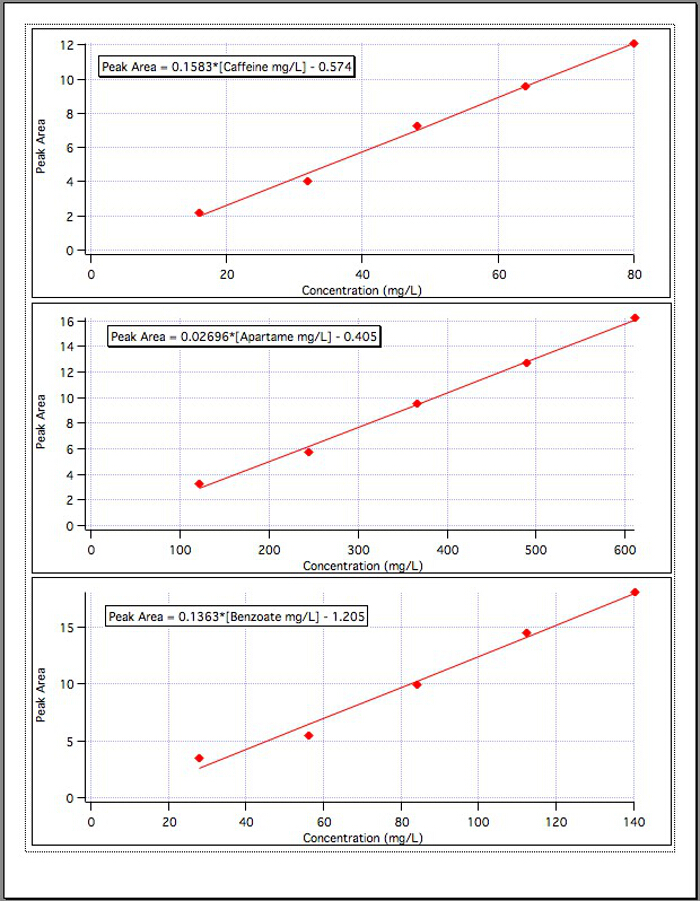
Figura 4. Le curve di calibrazione per ciascuno dei 3 componenti.
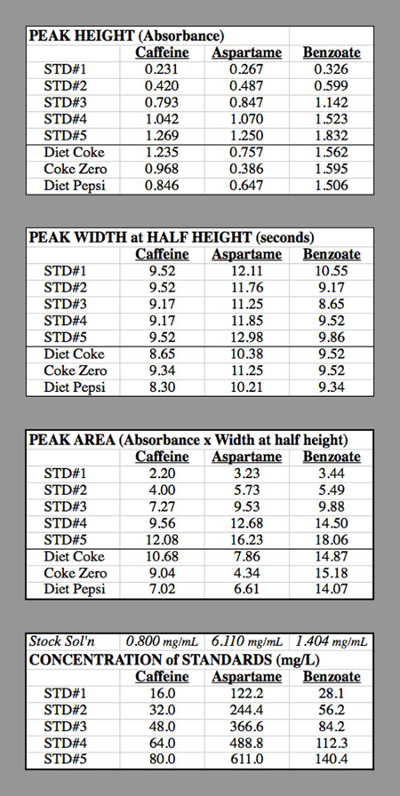
Tabella 2. Le tabelle dati per le prove HPLC utilizzate per generare le curve di calibrazione.
L'HPLC è una tecnica ampiamente utilizzata nella separazione e nel rilevamento per molte applicazioni. È ideale per i composti non volatili, poiché la gascromatografia (GC) richiede che i campioni siano nella loro fase gassosa. I composti non volatili includono zuccheri, vitamine, farmaci e metaboliti. Inoltre, non è distruttivo, il che consente di raccogliere ogni componente per ulteriori analisi (come la spettrometria di massa). Le fasi mobili sono praticamente illimitate, il che consente di apportare modifiche alla polarità del pH per ottenere una migliore risoluzione. L'uso di fasi mobili gradienti consente questi cambiamenti durante le prove effettive.
C'è stata preoccupazione per i possibili problemi di salute che possono essere associati al dolcificante artificiale aspartame. L'attuale etichettatura del prodotto non mostra la quantità di questi componenti all'interno delle bevande dietetiche. Questo metodo consente di quantificare queste quantità, insieme alla caffeina e al benzoato.
Altre applicazioni includono la determinazione delle quantità di pesticidi nell'acqua; determinare la quantità di paracetamolo o ibuprofene in compresse antidolorifiche; determinare se ci sono farmaci che migliorano le prestazioni presenti nel flusso sanguigno degli atleti; o semplicemente determinare la presenza di droghe in un laboratorio del crimine. Mentre le concentrazioni di questi campioni, e spesso l'identità dei componenti, possono essere facilmente determinate, l'unica limitazione è che diversi campioni potrebbero avere tempi di ritenzione quasi identici, con conseguente co-eluizione.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved