0:00
Overview
1:22
Principles of HPLC
5:05
Preparation of the Mobile Phase
6:08
Preparation of Component and Standard Solutions
7:25
HPLC Setup
9:25
Diet Soda Samples
10:16
Results
11:27
Applications
12:44
Summary
Cromatografia Líquida de Alta Eficiência (HPLC)
Fonte: Dr. Paul Bower - Universidade Purdue
Cromatografia líquida de alto desempenho (HPLC) é um importante método analítico comumente utilizado para separar e quantificar componentes de amostras líquidas. Nesta técnica, uma solução (primeira fase) é bombeada através de uma coluna que contém uma embalagem de pequenas partículas porosas com uma segunda fase ligada à superfície. As diferentes solubilidades dos componentes amostrais nas duas fases fazem com que os componentes se movam através da coluna com velocidades médias diferentes, criando assim uma separação desses componentes. A solução bombeada é chamada de fase móvel, enquanto a fase na coluna é chamada de fase estacionária.
Existem vários modos de cromatografia líquida, dependendo do tipo de fase estacionária e/ou móvel empregada. Este experimento usa cromatografia de fase invertida, onde a fase estacionária não é polar, e a fase móvel é polar. A fase estacionária a ser empregada são grupos de hidrocarbonetos C18 ligados a partículas de sílica de 3 μm, enquanto a fase móvel é um tampão aquoso com um modificador orgânico polar (acetonitrila) adicionado para variar sua força de eluição. Nesta forma, a sílica pode ser usada para amostras solúveis em água, proporcionando uma ampla gama de aplicações. Neste experimento, as misturas de três componentes frequentemente encontrados em refrigerantes diet (cafeína, benzoato e aspartame) são separadas. Sete soluções preparadas contendo quantidades conhecidas das três espécies são usadas, e seus cromatogramas são então registrados.
Durante um experimento hplc, uma bomba de alta pressão leva a fase móvel de um reservatório através de um injetor. Em seguida, ele viaja através de uma coluna c18 de fase inversa para a separação de componentes. Finalmente, a fase móvel se move para uma célula detectora, onde a absorção é medida a 220 nm, e termina em uma garrafa de resíduo. A quantidade de tempo que leva para um componente viajar da porta do injetor para o detector é chamada de tempo de retenção.
Um cromatógrafo líquido é usado neste experimento, onde a separação é realizada em uma coluna de fase inversa. As dimensões da coluna são de 3 mm (i.d.) x 100 mm, e a embalagem de sílica (tamanho de partícula de 3-μm) é funcionalizada com octidalsilano C18 (ODS). Uma válvula de injeção rotativa Rheodyne de 6 portas é usada para armazenar inicialmente a amostra em um pequeno loop e introduz a amostra à fase móvel após a rotação da válvula.
A detecção é por espectroscopia de absorção em um comprimento de onda de 220 nm. Este experimento pode ser executado a 254 nm, se um detector não for variável. Os dados do detector têm uma saída de tensão analógica, que é medida por meio de um multimímetro digital (DMM), e lida por um computador carregado com um programa de aquisição de dados. O cromatógrafo resultante tem um pico para cada componente da amostra. Para este experimento, todos os três componentes elute dentro de 5 min.
Este experimento usa uma única fase móvel e bomba, que é chamada de fase móvel isocrática. Para amostras difíceis de separar, uma fase móvel gradiente pode ser usada. É quando a fase móvel inicial é principalmente aquosa, e com o tempo, uma segunda fase móvel orgânica é gradualmente adicionada à fase móvel global. Este método eleva a polaridade desta fase ao longo do tempo, que reduz os tempos de retenção dos componentes e funciona de forma semelhante a um gradiente de temperatura em um cromatógrafo de gás. Existem alguns casos em que a coluna é aquecida (geralmente a 40 °C), o que tira quaisquer erros de tempo de retenção associados a uma mudança de temperatura ambiente.
Em fase inversa HPLC, a embalagem de fase estacionária da coluna geralmente é uma embalagem C4, C8 ou C18. As colunas C4 são principalmente para proteínas com grandes pesos moleculares, enquanto as colunas C18 são para peptídeos e amostras básicas com pesos moleculares mais baixos.
A detecção por espectroscopia de absorção é esmagadoramente o método de detecção de escolha, pois os espectros de absorção dos componentes estão prontamente disponíveis. Alguns sistemas utilizam medidas eletroquímicas, como condutividade ou amperometria, como seu método de detecção.
Para este experimento, a fase móvel é principalmente 20% de acetonitrila e 80% de água deionizada purificada (DI). Uma pequena quantidade de ácido acético é adicionada para diminuir o pH da fase móvel, que mantém o silanol na fase de embalagem estacionária em um estado não dissociado. Isso reduz o pico de adsorção do rejeito, dando picos mais estreitos. Em seguida, o pH é ajustado com hidróxido de sódio de 40% para elevar o pH e ajudar a diminuir os tempos de retenção dos componentes.
Cada grupo utiliza um conjunto dos 7 frascos contendo diferentes concentrações das soluções padrão(Tabela 1). Os 3 primeiros são usados para identificar cada pico, e os últimos 4 são para a criação de um gráfico de calibração para cada componente. As normas 1-3 também são usadas para o gráfico de calibração.
| Número | Cafeína (mL) | Benzoato (mL) | Aspartame (mL) |
| 1 | 4 | 0 | 0 |
| 2 | 0 | 4 | 0 |
| 3 | 0 | 0 | 4 |
| 4 | 1 | 1 | 1 |
| 5 | 2 | 2 | 2 |
| 6 | 3 | 3 | 3 |
| 7 | 5 | 5 | 5 |
Mesa 1. Volumes de padrões de estoque utilizados para preparar os 7 padrões de trabalho fornecidos (o volume total de cada padrão é de 50 mL).
1. Fazendo a fase móvel
- Prepare a fase móvel adicionando 400 mL de acetonitrilo a aproximadamente 1,5 L de água DI purificada.
- Adicione cuidadosamente 2,4 mL de ácido acético glacial a esta solução.
- Diluir a solução para um volume total de 2,0 L em um frasco volumoso com água DI purificada. A solução resultante deve ter um pH entre 2,8 e 3,2.
- Ajuste o pH para 4,2 adicionando hidróxido de sódio de 40%, em termos de gota com o uso de um medidor de pH digital calibrado. Adicione muito lentamente quando o pH atingir 4.0. Isso deve levar cerca de 50 gotas para realizar.
- Filtre a fase móvel através de um filtro de membrana nylon 66 de 0,47-μm sob vácuo para desgasar a solução e remover sólidos que poderiam conectar a coluna cromatográfica. É importante desgasar a fase móvel para evitar ter uma bolha, o que poderia causar um vazio na fase estacionária na entrada da coluna ou trabalhar seu caminho para a célula detectora, causando instabilidade com a absorvência UV.
2. Criando as soluções componentes
Os três componentes que precisam ser fabricados são cafeína (0,8 mg/mL), benzoato de potássio (1,4 mg/mL) e aspartame (L-aspartyl-L-phenylalanine metil ester) (6,0 mg/mL). Essas concentrações, uma vez diluídas da mesma forma, colocam os padrões nos níveis encontrados nas amostras de refrigerante.
- Adicione 0,40 g de cafeína a um frasco volumoso de 500 mL e, em seguida, dilua para a marca de 500 mL com água DI.
- Adicione 0,70 g de benzoato a um frasco volumoso de 500 mL e, em seguida, dilua para a marca de 500 mL com água DI.
- Adicione 0,60 g de aspartame a um frasco volumoso de 100 mL e, em seguida, dilua para a marca de 100 mL com água DI. Coloque esta solução em uma geladeira para evitar a decomposição durante o armazenamento.
3. Fazendo as 7 soluções padrão
Todos os três componentes possuem coeficientes de distribuição diferentes, o que afeta a forma como cada um interage com ambas as fases. Quanto maior o coeficiente de distribuição, maior o tempo que o componente passa na fase estacionária, resultando em tempos de retenção mais longos para chegar ao detector.
- Seguindo o gráfico na Tabela 1,in pipe a quantidade adequada de cada componente em um frasco volumoso de 50 mL.
- Diluir cada uma das soluções de estoque para a marca de 50 mL nos frascos volumosicos com fase móvel.
- Despeje cada solução padrão em frascos pequenos rotulados em um rack de amostra.
- Armazene os racks de amostras em uma geladeira, juntamente com as demais soluções nos frascos volumosos de 50 mL.
4. Verificando as configurações iniciais do sistema HPLC
- Confirme que a linha de resíduos está em um contêiner de lixo e não está reciclando de volta à fase móvel.
- Verifique se a taxa de fluxo da fase móvel está definida para 0,5 mL/min. Isso é alto o suficiente para permitir que todos os picos se eluem dentro de 5 minutos e lento o suficiente para permitir uma boa resolução.
- Verifique se a pressão mínima e máxima e a taxa de fluxo estão definidas para os valores corretos no painel frontal do sistema de entrega de solventes (a bomba).
- Ajuste mínimo de pressão: 250 psi (isto é para desligar a bomba, se ocorrer um vazamento).
- Ajuste máximo de pressão: 4.000 psi (isto é para proteger a bomba de quebrar, se um entupimento se formar).
- Pressione "zero" no painel frontal do detector para definir o branco (o branco é a fase móvel pura).
- Enxágüe uma seringa de 100 μL com água deionizada, depois com vários volumes de uma das normas de trabalho a serem analisadas e encha a seringa com essa solução. Comece com as 3 amostras de componente único, que permite identificar o pico de cada componente de interesse.
5. Injetando manualmente a amostra e a coleta de dados
- Com a alça do injetor na posição de carga, injete lentamente 100 μL de solução através da porta de septo.
- Verifique se o programa de coleta de dados está definido para coletar dados para 300 s, o que permite tempo suficiente para todos os 3 picos passarem pelo detector.
- Quando estiver pronto para iniciar o teste, gire a alça do injetor para a posição de injeção (que injeta a amostra na fase móvel) e clique em "Iniciar o teste" no programa de coleta de dados do computador imediatamente. Para as normas 1-3, apenas um dos três picos sequenciais aparecem na tela durante a execução (Figura 1).
- Uma vez que 300 s passaram, a coleta de dados envia um prompt para salvar o arquivo de dados. Salve os dados em um nome de arquivo adequado (por exemplo,STD#1).
- Observe o tempo em segundos para o pico de cada ensaio, que é usado na identificação desse componente.
- Remova a seringa do septo e repita o processo para cada uma das normas de trabalho restantes, usando o mesmo tempo por cromatógrafo determinado desde a primeira execução.
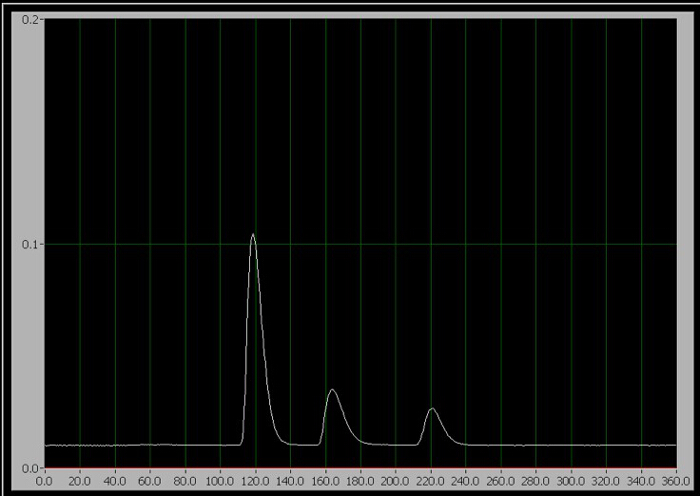
Figura 1. O cromatógrafo dos 3 componentes. Da esquerda para a direita, são cafeína, aspartame e benzoato.
6. As amostras de refrigerantes diet
Coca Diet, Diet Pepsi e Coca-Cola Zero são as "incógnitas". Eles foram deixados de fora em recipientes abertos durante a noite para se livrar da carbonação, já que bolhas não são boas para o sistema HPLC. Isso se livra suficientemente de qualquer gases nas amostras.
- Desenhe cerca de 2 mL do refrigerante diet em uma seringa de plástico.
- Conecte a ponta do filtro à seringa via Luer-Lok, torcendo-a no lugar.
- Empurre o líquido na seringa através do filtro e em um pequeno frasco de vidro. Isso se livra de partículas indesejadas que poderiam potencialmente entupir a coluna de separação.
- Diluir cada amostra com uma quantidade igual de água DI, por isso estão em 50% de pureza.
- Injete 100 μL da amostra no loop amostral e execute ensaios com os mesmos parâmetros dos padrões.
7. Cálculos
- A partir das concentrações das soluções componentes, calcule a concentração de todos os componentes nas normas, com base nas diluições feitas para as 7 amostras.
- Determine áreas de pico nos cromatogramas para cada padrão e amostras desconhecidas pelo método triangular, o que equivale ao pico de altura vezes a largura a 1/2 de altura(Figura 2). Depois de determinar qual pico corresponde a cada componente com base no tempo que leva para cada componente mostrar seu respectivo pico, insira essas áreas de pico em uma planilha de computador.
- Crie curvas de calibração da área de pico versus concentração (mg/L) nos padrões para os três componentes.
- Determine os quadrados menos adequados para cada curva de calibração.
- Calcule a concentração de cada componente nos refrigerantes diet das áreas de pico mostradas a partir dos ensaios hplc para as amostras. Lembre-se que o refrigerante diet foi diluído por um fator de 2 antes de injetar no sistema HPLC.
- Calcule a quantidade, em mg/L, de cada componente nos refrigerantes dietéticos.
- Com base nos resultados, calcule os miligramas de cada componente encontrado em uma lata de refrigerante de 12 oz. Assuma 12 oz = 354,9 mL.
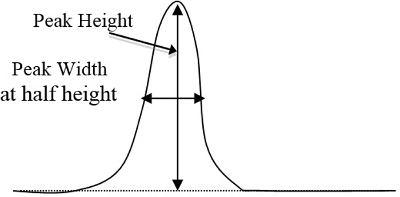
Figura 2. Um exemplo básico da altura e largura de pico de uma curva, que devem ser multiplicados (os horários de altura de pico se largura a 1/2 altura).
Os cromatogramas HPLC são capazes de quantificar cada um dos 3 componentes para todas as amostras com base nas curvas de calibração das normas(Figura 3).
A partir deste conjunto de experimentos, foi determinado que uma lata de 12 oz desses refrigerantes diet continha as seguintes quantidades de cada componente:
Coca Diet: 50,5 mg de cafeína; 217,6 mg aspartame; 83,6 mg de benzoato.
Coca-Cola Zero: 43,1 mg de cafeína; 124,9 mg aspartame; 85,3 mg de benzoato.
Pepsi Diet: 34,1 mg de cafeína; 184,7 mg aspartame; 79,5 mg de benzoato.
Não surpreende que todos os três tivessem aproximadamente a mesma quantidade de benzoato, pois é apenas um conservante. Os produtos de Coca-Cola tinham um pouco mais de cafeína, e o Coke Zero tinha muito menos aspartame do que os outros dois refrigerantes, pois também inclui ácido cítrico para alguns aromatizantes.
Os números a seguir são as quantidades reais de cafeína e aspartame em uma lata de 12 oz dos 3 refrigerantes diet (O teor de cafeína foi obtido nos sites da Coca-Cola e pepsi. O conteúdo aspartame foi obtido tanto de LiveStrong.com quanto de DiabetesSelfManagement.com.):
Coca Diet: 46 mg de cafeína; 187,5 mg aspartame
Coca-Cola Zero: 34 mg de cafeína; 87,0 mg aspartame
Pepsi Diet: 35 mg de cafeína; 177,0 mg aspartame
Cálculos amostrais(Tabela 2):
Concentração de cafeína em DST #1: A solução componente para a cafeína teve 0,400 g de cafeína diluída a 500 mL = 0,500 L → 0,800 g/L = 0,800 mg/mL.
StD#1 teve 1 mL desta solução diluída para 50,0 mL
0,800 mg/mL * (1,0 mL / 50,0 mL) = 0,016 mg/mL = 16,0 mg/L.
STD#2 teve 2 mL desta solução diluída para 50,0 mL
0,800 mg/mL * (2,0 mL / 50,0 mL) = 0,032 mg/mL = 32,0 mg/L.
Os resultados dos três gráficos de calibração(Figura 4) produziram as seguintes equações:
Área de Pico da Cafeína = 0,1583 *[Cafeína mg/L] - 0,574
Aspartame Peak Area = 0,02696 *[Aspartame mg/L] - 0,405
Área de Pico do Benzoato = 0,1363*[Benzoato mg/L] - 1.192
Coca-Cola Diet: Área de Pico da Cafeína = 10,68 = 0,1583 *[Cafeína mg/L] - 0,574
[Cafeína mg/L] = (10,68 + 0,574)/ (0,1583) = 71,1 mg/L na amostra injetada.
Como a amostra foi diluída por um fator de 2, a Coca Diet tinha 141,2 mg/L de cafeína.
A quantidade por lata de 12 oz = (141,2 mg/L)(0,3549 mL/12-oz pode) = 50,5 mg de cafeína/lata.
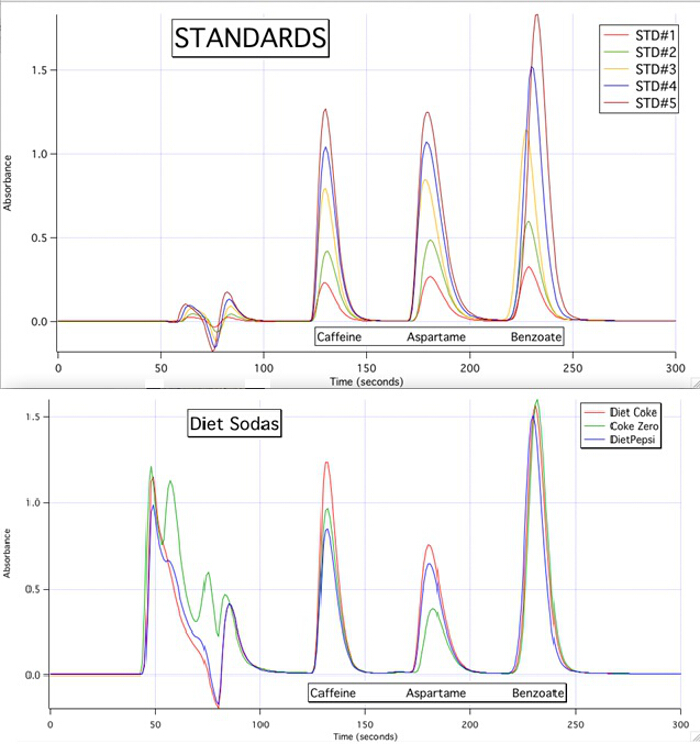
Figura 3. Os cromatogramas HPLC das 5 normas e das 3 amostras.
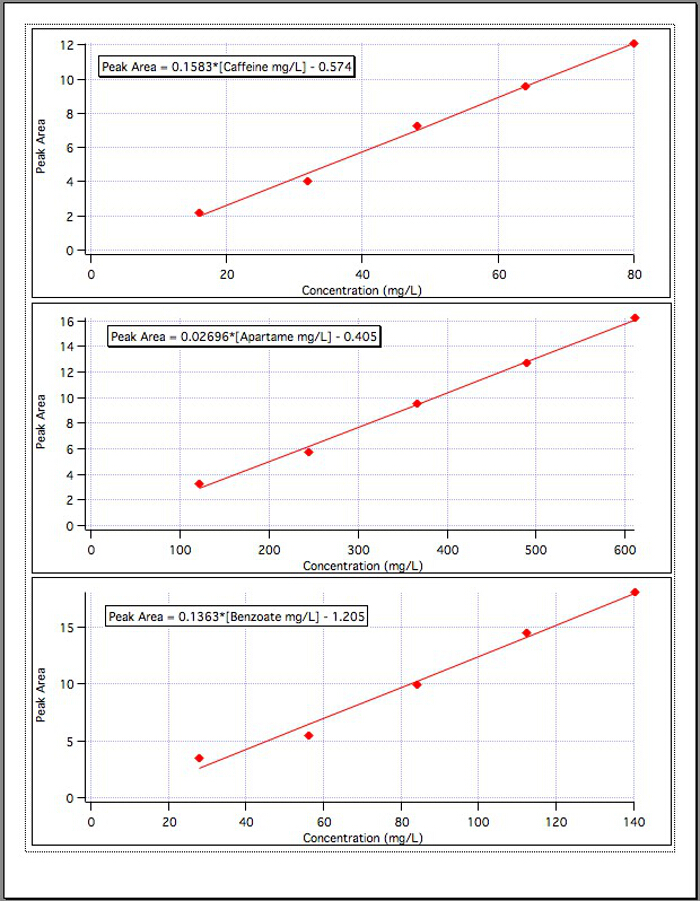
Figura 4. As curvas de calibração para cada um dos 3 componentes.
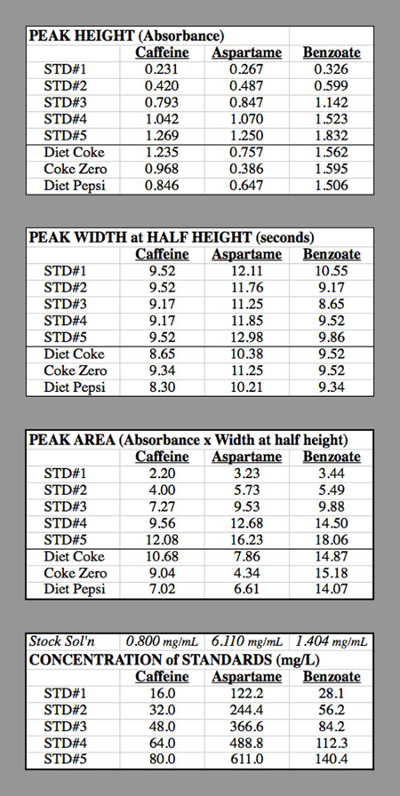
Mesa 2. As tabelas de dados para os ensaios HPLC utilizados para gerar as curvas de calibração.
O HPLC é uma técnica amplamente utilizada na separação e detecção de muitas aplicações. É ideal para compostos não voláteis, pois a cromatografia gasosa (GC) exige que as amostras estejam em fase de gás. Compostos não voláteis incluem açúcares, vitaminas, drogas e metabólitos. Além disso, não é destrutivo, o que permite que cada componente seja coletado para análise suplementar (como espectrometria de massa). As fases móveis são praticamente ilimitadas, o que permite mudanças na polaridade do pH para obter uma melhor resolução. O uso de fases móveis gradientes permite essas alterações durante os ensaios reais.
Há preocupação com os possíveis problemas de saúde que podem estar associados ao adoçante artificial aspartame. A rotulagem atual do produto não mostra a quantidade desses componentes dentro das bebidas dietéticas. Este método permite quantificar essas quantidades, juntamente com a cafeína e benzoato.
Outras aplicações incluem determinar as quantidades de pesticidas na água; determinando a quantidade de acetaminofeno ou ibuprofeno em comprimidos para aliviar a dor; determinar se há medicamentos que melhoram o desempenho presentes na corrente sanguínea dos atletas; ou simplesmente determinar a presença de drogas em um laboratório criminal. Embora as concentrações dessas amostras, e muitas vezes a identidade dos componentes, possam ser prontamente determinadas, a única limitação é que várias amostras podem ter tempos de retenção idênticos, resultando em co-eluição.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved