0:00
Overview
0:56
General Considerations for Blood Withdrawal
3:57
Retro Orbital Bleed
7:18
Tail Bleed
9:42
Cardiac Blood Collection
14:15
Applications
16:07
Summary
Prélèvement d'échantillons de sang I
Source : Kay Stewart, RVT, RLATG, CMAR ; Valerie A. Schroeder, RVT, RLATG. Université de Notre Dame, Indiana
Collecte de sang est une exigence commune pour les études de recherche qui impliquent des souris et des rats. La méthode de prélèvement de sang chez des rats et des souris dépend de la quantité de sang nécessaire, la fréquence de l’échantillonnage, l’état de santé de l’animal à être saigné et le niveau de compétence du technicien. 1 tous les saignements de méthodes discutées-rétro-orbitaire sinus, saignements de snip queue initiale et intracardiaque saigne-nécessite l’utilisation d’une anesthésie générale.
Avant la procédure de purge, le type d’échantillon nécessaire doit être déterminé. Il faudra effectuer des procédures expérimentales sang total, sérum ou plasma. Pour le sang total, un anticoagulant doit être ajouté à l’échantillon. Plasma, qui contient le fibrinogène et autres facteurs de coagulation lorsque séparé de globules rouges, peut être extraites d’un échantillon d’anticoagulé. Sérum est obtenu par prélèvement sanguin sans anticoagulant. Le sérum résulteront de centrifugation de l’échantillon une fois qu’un caillot s’est formé. Comme l’exemple a coagulé, le sérum ne contient pas de fibrinogène ou autres facteurs de coagulation. Sérum et le plasma sont obtenus par l’utilisation d’une centrifugeuse courue à 2200-2500 tr/min pour un minimum de 15 minutes.
Pour un exemple qui doit céder le sang total ou plasma, un anticoagulant approprié doit être utilisé. Les anticoagulants couramment utilisés pour les animaux de laboratoire sont l’héparine, citrate de sodium et l’acide éthylènediamine tétraacétique (EDTA) ; sélection dont est issue des besoins de recherche. Séquestrer une forme liquide d’EDTA, héparine et citrate de sodium-peut être chargé directement dans la seringue pour enduire les surfaces. Cela permet le contact de l’anticoagulant directement lorsque le sang est tiré, aidant dans la prévention de la coagulation. Rat des caillots sanguins plus rapides que le sang plus chez les mammifères, il est essentiel que le bon ratio d’anticoagulant à sang soit utilisée pour la collecte de sang.
Sélection de l’aiguille est basée sur la taille de l’animal et le site de la ponction veineuse. En général, plus le diamètre de l’aiguille, plus vite l’échantillon peut être collecté. Moins de dommages pour les cellules sanguines est un autre avantage à grandes AIG. Toutefois, le principal inconvénient d’aiguilles de gros calibre est des dommages potentiels causés au navire. Sur les rats et les souris, les choix du calibre des aiguilles de calibre de 20 à 29 qui sont de 0,5 à 1,5 pouces de longueur. Si une aiguille est trop longue, non seulement est-il difficile à utiliser, mais ayant de l’espace supplémentaire dans l’aiguille pourrait entraîner la coagulation. La taille de l’aiguille appropriée est répertoriée pour chaque méthode dans la section procédures.
La taille de l’échantillon requis doit également être prédéterminée. En raison de l’exiguïté de la souris ou le rat, le montant maximal de prélèvement de sang doit être calculé pour un saignement de la survie. Une souris moyenne 25 grammes a un volume de sang total de 1,8 ml ; le rat moyen pesant 250 grammes a un volume de sang total de 16 ml. Pour obtenir un exemple simple de sang sur une souris ou un rat sans le remplacement des liquides, le volume maximal de sang qui peut être enlevé en toute sécurité est de 10 % du volume sanguin total, ou 7.7-8 µl/g. Ainsi pour une souris moyenne, 10 % de son volume sanguin est de 193-200 µl. Pour un rat moyen de 250 grammes, cela équivaut à 1,9-2,0 ml. des études ont montré que l’enlève plus de 15 % du volume sanguin peut causer un choc hypovolémique. 1, 2 , avec remplacement liquidien, jusqu'à 15 % du volume sanguin total- ou 12 µl/g-peut être supprimé. Pour une souris de 25 grammes, cela équivaut à 300 µl ; pour un rat de 250 grammes, il est équivalent à 3 ml. Pour remplacer les liquides, les liquides doivent être réchauffés et sous-cutanée.
S’il est nécessaire de prélever des échantillons multiples, réduire le volume de sang tiré. Le volume maximal de sang qui peut-être être dessiné par semaine est pas plus de 7,5 % du volume sanguin total, ou 6 µl/g. Pour une souris de 25 grammes, cela revient à 145-150 µl par semaine. Pour un rat de 250 grammes, cela revient à 1,45 à 1,50 ml par semaine. Si le prélèvement aura lieu toutes les 2 semaines, jusqu'à concurrence de 10 % du volume sanguin total (8 µl/g) peut-être être dessiné. C’est équivalent à 200 µl toutes les 2 semaines pour une souris moyenne et jusqu'à 2,00 ml toutes les 2 semaines pour un rat de 250 grammes. Une étude effectuée sur des rats avec un poids moyen de 250 grammes, a révélé que lorsque les volumes sanguins de 15 à 20 % ont été supprimés, il a fallu plus de 29 jours, pour les niveaux sanguins de normaliser. 1, 2 pour la collecte de sang répétées, remplacement liquidien ne permet pas pour un plus grand volume de sang ou de la collecte de sang plus fréquente, car il ne remplace que volume. L’animal aura besoin de temps pour reconstituer les cellules sanguines.
L’utilisation du plexus rétro-orbitaire est une pratique courante dans le passé. Cependant, beaucoup de préoccupations concernant la cruauté de cette procédure sont apparus. Au cours de la procédure, un mouvement excessif du tube hématocrite une fois placé dans le canthus médial de le œil peut endommager les tissus environnants, ce qui entraîne un gonflement des paupières et/ou des membranes conjonctivales. Les tissus enflés peuvent causer le globe oculaire saillie assez loin pour que la fermeture de la paupière est entravée, potentiellement entraînant un séchage cornéen et l’endommager. Douleur de gonflement peut déclencher des rayures et l’automutilation qui résulte en une énucléation de l’oeil. Une mauvaise mise en place du tube hématocrite au cours d’une hémorragie rétro-orbitaire peut rompre le nerf optique, entraînant la cécité. Si le tube de l’hématocrite est avancé à un mauvais angle, le œil peut être forcé hors de l’orbite, ce qui permet des paupières tomber derrière le globe oculaire. Dans ce cas, il est très difficile de remplacer correctement l’oeil dans la douille. Autres problèmes qui peuvent survenir incluent la fracturation des os fragiles orbite, pénétration du globe oculaire entraînant la perte de vitré, ou la formation d’un hématome derrière le œil qui peut se traduire par une douleur extrême en raison de la pression sur le œil et de ses environs Ouvrages d’art. Malgré tous ces soucis, si un technicien effectue la procédure et que l’animal est complètement anesthésié avec une anesthésie générale, comme l’isoflurane inhalant anesthésie, rétro-orbitaire hémorragie s’est avéré être une méthode efficace de sang collection chez les rongeurs.
La structure anatomique de la zone orbitale est différente entre la souris et le rat. La souris a la rétro-orbitaire sinus-une collection de bateaux qui créent un sinus dans la zone orbitale. Dans l’orbite de l’oeil de rat, il y a un plexus de navires qui coulent derrière cet oeil ; Toutefois, ils ne forment pas un sinus, comme dans la souris. Par conséquent, il est plus facile d’effectuer cette procédure sur des souris. Pour la collecte d’échantillonnage répété par l’intermédiaire du plexus rétro-orbitaire, un minimum de 10 jours entre saigne est nécessaire pour permettre les tissus dans la zone à guérir. Bien que l’anesthésie générale est recommandé, la procédure peut être effectuée chez les souris sans anesthésie générale si un anesthésique topique ophtalmique, tels que proparacaïne ou tétracaïne, est appliqué avant l’intervention. Comme les rats n’ont pas le sinus rétro-orbitaire, et parce que leurs membranes autour de l’orbite sont beaucoup plus forts, il est obligatoire de les anesthésier pour cette procédure.
On trouvera des échantillons de série d’un petit volume en utilisant une méthode d’attache de queue. La première amputation de la queue doit être limitée à un bout de la queue, environ 0,5 à 1,0 mm de longueur chez les souris et rats de 2,0 mm. 1 que la procédure de capture de queue pour prélèvement sanguin permet pour les collections de la série en perturbant la tavelure ou caillot de l’original coupé à l’extrémité de la queue. Amputation supplémentaire de la pointe de la queue n’est généralement pas nécessaire. Volumes de sang prélevé gamme 20-100 µL de souris et de 75-150 µL pour les rats. Le montant perçu est variable entre les animaux et peut être influencé par l’âge, l’état de santé et le poids.
L’échantillon prélevé dans un snip queue peut contenir de sang artériel et veineux, ainsi que de la contamination des tissus produits. La qualité de l’échantillon diminue si la queue est caressée ou « traites » pour obtenir plus de sang. Pour augmenter le flux sanguin, la queue peut être chauffée avec des compresses chaudes, une lampe chauffante ou l’immersion dans l’eau tiède. La pression doit être appliquée à l’extrémité de la queue pour l’hémostase, et animaux doit être vérifiée toutes les 5-10 minutes afin d’assurer l’hémostase a été atteint. Hémostase est souvent retardée avec échantillonnage répété. Une poudre styptique peut être utilisée pour l’hémostase. Pour la première amputation, anesthésie (générale ou locale) est recommandé. Saignement ultérieur ne devrait pas nécessiter l’anesthésie, autant que les animaux deviennent habitués à la procédure. L’anesthésie va causer une baisse de tension artérielle, ce qui rend difficile le prélèvement de sang avec cette technique.
Une alternative à un snip de queue est le Pseudo de navire de queue. Cette procédure est facilement réalisée sur des souris et des rats. Cependant, comme avec le snip de queue, les échantillons peuvent être contaminées avec des produits de tissus, en particulier chez la souris. Pour les rats, une aiguille hypodermique est insérée dans le vaisseau, et le sang est prélevé de la station de l’aiguille. Une étude a démontré l’utilisation d’un tourniquet placé au-dessus du site de ponction de l’aiguille afin d’aider à la collecte de sang. 3 Une seringue n’est pas utilisée pour dessiner le sang hors du récipient, comme la pression engendrée de la seringue s’effondrera le navire. Cette méthode peut aussi servir pour série d’échantillonnage, un caillot peut être enlevé pour provoquer le site de saigner à nouveau. Comme avec des cisailles de queue, il est impératif d’assurer l’hémostase en appliquant une pression sur le site et revérifier l’animal toutes les 5-10 minutes.
Souvent, les études exigent une nonsurvival, l’échantillon de sang importante qui est recueillie par exsanguination via une purge intracardiaque ou la veine cave caudale. 4 environ la moitié du volume total de sang peut être prélevée une souris ou un rat par ponction cardiaque. Cela revient à 40 µl/g ou environ 1 ml, pour une moyenne de 25 grammes de souris. Un rat de 250 grammes, produirait environ 10 ml de sang. Les animaux doivent être anesthésiés pour exsanguination. Inhalant anesthésie ou CO2 narcose peut être utilisé par un technicien compétent ; injectable anesthésie peut également être utilisé. Toutefois, il peut y avoir une diminution de la pression artérielle et la circulation, ce qui pourrait diminuer la quantité de sang prélevé.
La méthode de la veine cave caudale nécessite que l’animal être profondément anesthésiés pour exposer chirurgicalement le navire. CO2 narcose n’est pas suffisant, car le cœur doit être battu et l’animal respiratoires durant le prélèvement de sang. Au cours de la procédure, trop rapide du prélèvement de sang peut causer le navire de s’effondrer sur le biseau de la seringue, occlusion de la collection de sang ouverture et prévention. En outre, les parois des vaisseaux sont minces, et ainsi le mouvement de la main et l’aiguille doit être évité pour prévenir une rupture ou une fuite de sang provenant du site d’entrée de l’aiguille. Que l’aiguille n’est pas en passant à travers la peau, cette méthode se traduit par le prélèvement d’un échantillon stérile. Méthodes d’euthanasie appoint doivent être employés pour s’assurer que l’animal ne récupère pas d’anesthésie. Cette méthode est souvent suivie d’une perfusion cardiaque ou aortique.
La méthode intracardiaque peut être effectué soit avec l’animal immobilisé manuellement une fois que c’est anesthésié (méthode fermée), ou le cœur peut être chirurgicalement exposé conformément au protocole pour la méthode de collecte de sang veine cave caudale (méthode ouverte). Pour la méthode fermée, les points de repère pour le placement de l’aiguille sont le sillon formé par la cage thoracique au processus xiphoïde, côté gauche de l’animal.
1. rétro-orbitaire saigner
- Matériel
- Préparer une cloche de verre, ou chambre de l’induction anesthésique, d’administrer un gaz anesthésique comme l’isoflurane. Lorsque vous utilisez une cloche de verre, il est impératif que l’anesthésie liquide n’entre pas en contact avec l’animal, pour éviter l’absorption par la peau. Une plate-forme avec de petits trous peut être utilisée.
- Microhematocrit tubes contenant de 50 à 75 microlitres sont préférés. Mylar enveloppé de tubes sont moins susceptibles de rompre entre les doigts de l’opérateur et doivent être considérés comme une mesure de sécurité.
- Plusieurs épaisseurs de serviette de papier ou d’autres matériaux isolants, est placés sur la surface de travail pour maintenir la chaleur du corps de l’animal au cours de la procédure.
- Préparation et positionnement de l’animal
- L’animal est anesthésié avec une anesthésique, comme l’isoflurane, dans une chambre d’induction anesthésie cloche de verre ou de gaz à effet d’inhalation.
- Une fois que l’animal est complètement anesthésié, il est enlevé et placé en décubitus latéral.
- Le œil est dépassait en plaçant un doigt sur le dessus de la tête et le long de la mâchoire et en tirant la peau en arrière et vers le bas.
- Évitez exerçant une pression sur la trachée, car qui peut s’effondrer ou occlure les voies respiratoires causant la mort par asphyxie.
- Prélèvement de sang
- Le microhematocrit est placé dans le canthus médial de le œil et dirigé en direction caudale à un angle de 30-45° de l’avion du nez.
- Appliquer une pression tout en tournant doucement le tube de l’hématocrite. Cela coupera à travers les membranes conjonctivales et rompent le plexus oculaire.
- Le sang s’écoule dans le tube de l’hématocrite par capillarité.
- Évitez de pousser si profond que vous frappez l’os à l’arrière de la cavité oculaire.
- Une fois que le sang commence à couler, maintenir la pression pour garder l’oeil dépassait.
- Pour collecter plusieurs tubes de sang, il n’est pas nécessaire de placer le prochain tube dans le plexus oculaire, car le sang continuera à couler et peuvent être collectées comme il vient du canthus médial.
- Pour arrêter l’hémorragie, relâcher la peau et laisser l’oeil revenir à la position normale. Appliquer une pression à l’orbite afin d’assurer l’hémostase.
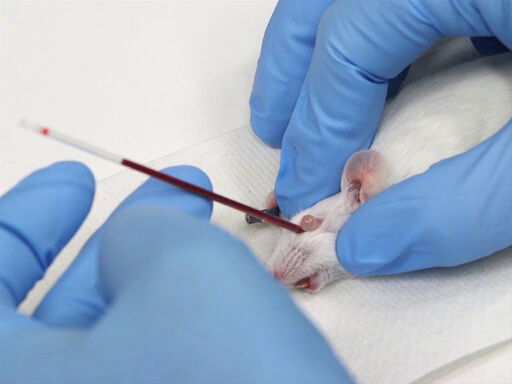
La figure 1. Retrait de sang orbitale rétro chez la souris.
2. procédures de purge queue : snip queue et nick de queue
- Matériel
- Une lame de bistouri stériles, de préférence une lame numéro 11 ou une lame de rasoir simple face, est utilisé pour faire l’amputation initiale pour la méthode de capture de queue. Ciseaux ne doit pas être utilisé parce que la coupe faite par ciseaux est écrasant, ce qui favorise la coagulation et en réduisant la circulation sanguine. Pour la procédure de nick de queue, une lame de bistouri n° 11 ou 15 est utilisée pour faire la coupe.
- Un tube de retenue qui permet d’accéder à la queue de la souris est prête.
- Serviettes en papier absorbant ou une gaze sont utilisés comme substrat pour l’exécution de la capture de la queue.
- Tubes de prélèvement ou de tubes de l’hématocrite sont également requis.
- Poudre styptique devrait bénéficier de l’aide dans l’hémostase.
- Dispositif de retenue pour
- L’animal est placé dans le tube, telle que la queue soit accessible. Pour Broome retardateurs de type, l’animal est tiré croupion tout d’abord dans le tube. Pour les autres tubes, l’animal est placé tête première.
- Animaux est sécurisés dans le tube, tels qu’ils ne peuvent pas faire demi-tour ou retirer la queue.
- Certaines souris permettra la collecte de snip et le sang de queue avec un minimum de retenue manuelle s’ils sont autorisés à saisir une surface rugueuse.
- Certains rats nécessitera l’anesthésie par inhalation pour cette méthode de collecte de sang.
- Prélèvement de sang
- La queue est frottée avec l’eau tiède pour enlever les débris et provoquer une légère vasodilatation. N’utilisez pas d’eau chaude.
- Pour la capture de la queue, la queue est étendue, et la fin de la queue (0,5 à 1 mm pour souris et jusqu'à 2 mm pour les rats) est coupée avec la lame de bistouri.
- Pour le Pseudo de queue, la queue est étendue, et une incision est faite avec la lame de bistouri Swann-Morton environ 2/3 la distance de la croupe, directement au-dessus de la veine caudale latéral.
- La queue peut être tracée de rumsteck à la pointe pour favoriser la circulation sanguine ; Cependant, cela va diminuer la qualité de l’échantillon.
- Le sang est prélevé de la pointe ou le nick utilisant des tubes à hématocrite ou autorisé au goutte à goutte dans un flacon de collection.
3. collecte de sang cardiaque
- Matériel
- Pour une souris, une seringue de 3 cc avec un calibre 22-25 x 1" aiguille est préféré. Seringues plus petites n’ont pas la même pression arrière et peuvent rendre plus difficile les prélèvement de sang. Aiguilles à moins de 25 gauge restreint la circulation du sang, conduisant à une augmentation de la coagulation et endommagent les cellules sanguines. Aiguilles plus courts que 1" peuvent ne pas atteindre le niveau du cœur lorsque vous approchez du diaphragme.
- Pour un rat, une seringue de cc 10-12 avec un calibre 18 x 1.5" aiguille est préférée. Selon la taille du rat, une seringue plus petite ne peut-être pas avoir le volume de sang entier à percevoir, et donc la seringue devra être modifiée au cours de la procédure. Aiguilles à moins de 20 gauge restreignent la circulation du sang, conduisant à une augmentation de la coagulation. Aiguilles plus courtes que 1.5" peuvent ne pas atteindre le niveau du cœur lorsque vous approchez du diaphragme.
- Un tube de prélèvement de sang de taille suffisante est utilisé pour tenir le sang recueilli.
- Dispositif de retenue pour
- La restriction appropriée est essentielle à la réussite de cette méthode. L’animal est détenu par la peau du cou avec le corps suspendu verticalement. Il est important que le corps soit directement à empêcher la déviation du cœur ou une torsion de la poitrine.
- Une autre position est le décubitus dorsal lorsque vous placez l’aiguille entre les côtes du côté gauche de l’animal. Ceci est particulièrement utile pour les très gros rats ou lorsque plusieurs animaux doivent être saignés.
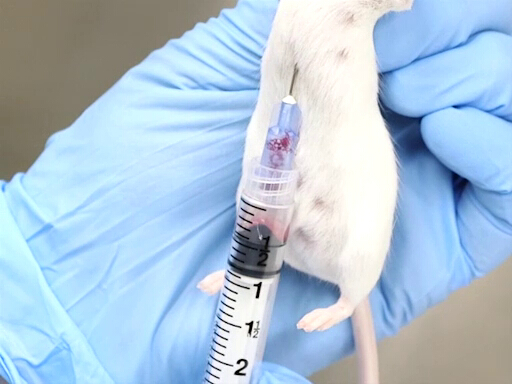
La figure 2. Prélèvement de sang cardiaque avec souris maintenu verticalement.
- Prélèvement de sang
- L’approche de la face postérieure, la perforation de la membrane est plus facilement réalisable lorsque la souris ou le rat est maintenu verticalement par la peau du cou.
- L’aiguille est avancée dans l’encoche située juste à gauche de la pointe de l’animal.
- L’aiguille doit être parallèle à la colonne vertébrale et placé juste sous les côtes.
- Le cœur est situé approximativement au niveau du coude.
- Placer l’aiguille, biseau vers le haut, dans la poitrine et percer le cœur.
- Appliquez une légère pression arrière avec la seringue. Si l’aiguille est dans le cœur, le sang coulera dans la seringue.
- Attendez que le sang a rempli la seringue avant d’ajouter la contre-pression supplémentaire sur la seringue.
- L’approche latérale du côté gauche de l’animal nécessite l’animal de positionnement en décubitus dorsal.
- Le point d’entrée est mesuré sur la pointe du coude sur la paroi thoracique. Le cœur est situé approximativement au niveau du coude.
- L’aiguille est insérée perpendiculaire au plan de la table à un point situé à mi-chemin sur la paroi thoracique mesurée dorsoventralement.
- Placer l’aiguille, biseau vers le haut, dans la poitrine et percer le cœur.
- Appliquez une légère pression arrière avec la seringue. Si l’aiguille est dans le cœur, le sang coulera dans la seringue.
- Attendez que le sang a rempli la seringue avant d’ajouter la contre-pression supplémentaire sur la seringue.
- L’approche de la face postérieure, la perforation de la membrane est plus facilement réalisable lorsque la souris ou le rat est maintenu verticalement par la peau du cou.
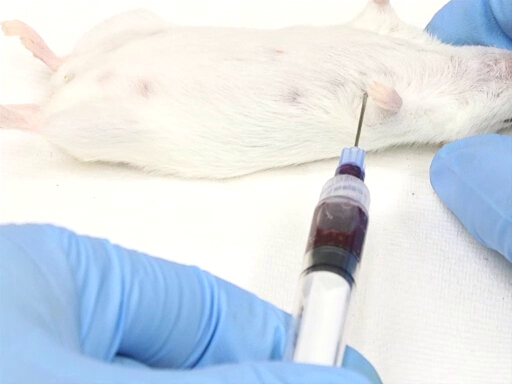
La figure 3. Prélèvement de sang cardiaque avec la souris en position de décubitus dorsal.
- Conseils techniques
- Le coeur normal se trouve avec l’apex pointant vers la gauche. Dans de rares cas, le cœur peut être inversé, résultant en difficulté en perforant le coeur.
- Contre-pression excessive sur la seringue peut-être s’effondrer au cœur, obstruant le biseau de l’aiguille et l’arrêt de la circulation sanguine dans la seringue.
- Appliquant la contre-pression et relâchez-le à plusieurs reprises amorcera la coagulation dans la seringue.
- Doucement exerçant une pression sur le foie peut forcer le volume de sang supplémentaire dans le système circulatoire, ce qui en fait disponible pour le retrait.
4. prélèvement de sang postérieure de la veine cave supérieure
- Matériel
- Une seringue de TB avec une aiguille de calibre 25-29 est utilisée pour la collecte de sang chez la souris. Pour les rats, il faut une seringue cc de 10-12 avec un calibre 22-25 x 1" aiguille.
- Une plate-forme chirurgicale, plateau de dissection ou toute autre surface pour garantir l’animal est nécessaire, ainsi que des liens, une bande ou épingles pour fixer les branches en position.
- Injectable anesthésie ou anesthésie par inhalation n’est nécessaire. Si vous utilisez l’anesthésie par inhalation, il est souhaitable que l’anesthésique livrés via un vaporisateur de précision avec un cône de nez. La longueur de la procédure est telle qu’à l’aide d’une chambre à induction sans livraison supplémentaire gaz anesthésique ne fournira pas suffisamment de temps pour achever le retrait de sang avant que l’animal fait revivre.
- Ciseaux d’iris pour la souris, ou ciseaux pointue-arrondie de salle d’opération pour le rat, est tenus, au long avec pince pouce petit atraumatique et un 2 "x 2 » de gaze.
- Dispositif de retenue pour
- Lorsque l’animal est complètement anesthésié, tel que déterminé par le pincement de l’orteil ou le pincement de la queue, l’animal est placé en décubitus dorsal.
- Les branches sont fixés à la plate-forme avec du sparadrap ou des épingles. Les membres devraient être étendues loin du corps.
- Retrait
- La peau se soulève et une petite coupe transversale est faite à travers la peau juste au-dessus du bassin chez les femelles, ou juste au dessus du prépuce chez les hommes.
- Le point des ciseaux est placé dans la coupe, et une incision médiane est faite à travers la peau du prépuce/bassin de la xiphoïde.
- La peau est reflétée latéralement de chaque côté. Par dissection par clivage peut être nécessaire de desserrer le muscle sous-jacent.
- Le muscle est levé, et une petite coupe transversale est faite à travers le muscle juste au-dessus de la coupe de la peau.
- Le point des ciseaux est placé dans l’abdomen et une incision médiane est faite à travers le muscle à la xiphoïde. N’oubliez pas de point le scissors' vers le haut pour éviter de couper les organes d’angle.
- Couper transversalement le long de la courbe des côtes de chaque côté. Faire preuve de prudence supplémentaire ne pas à percer le foie.
- Déplacez doucement les intestins à gauche de l’animal afin d’exposer la veine cave postérieure.
- Placez une compresse sur le foie et l’index et le médius de repos sur le foie.
- Avec l’autre main, introduire l’aiguille, biseau vers le haut, dans la veine cave supérieure, à mi-chemin entre la jonction des vaisseaux rénaux et de la bifurcation iliaque.
- Retirer lentement le sang tout en exerçant une pression sur le foie.
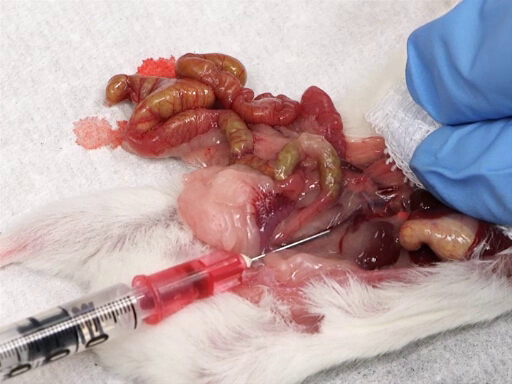
La figure 4. Prélèvement de sang de la veine cave postérieure.
Collecte de sang pour souris et rats peut être accompli avec une variété de techniques. Bien que de nombreux facteurs, tels que la taille de l’échantillon, la fréquence d’échantillonnage et la taille et l’âge de l’animal influencent, la composante la plus importante est le niveau de compétence du technicien effectuant le prélèvement des échantillons. Pour les méthodes décrites ici, la bonne utilisation des anesthésiques est également cruciale pour la qualité des échantillons et le bien-être des animaux.
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved