0:00
Overview
0:56
General Considerations for Blood Withdrawal
3:57
Retro Orbital Bleed
7:18
Tail Bleed
9:42
Cardiac Blood Collection
14:15
Applications
16:07
Summary
נסיגת דם I
מקור: קיי סטיוארט, RVT, RLATG, CMAR; ואלרי א. שרודר, אר.די.ג'י, אר-אל-ג'י. אוניברסיטת נוטרדאם, IN
איסוף דם הוא דרישה נפוצה למחקרים הכוללים עכברים וחולדות. שיטת נסיגת הדם בעכברים וחולדות תלויה בנפח הדם הדרוש, בתדירות הדגימה, במצב הבריאותי של החיה שיש לדמם, וברמת המיומנות של הטכנאי. 1 כל השיטות שנדונו- דימומים בסינוס רטרו-מסלולית, דימומים ראשוניים של חיתוך זנב ודימומים תוך-לבביים - דורשות שימוש בהרדמה כללית.
לפני הליך הדימום, יש לקבוע את סוג המדגם הנדרש. הליכים ניסיוניים עשויים לדרוש דם שלם, פלזמה או נסיוב. עבור דם שלם, יש להוסיף נוגד קרישה לדגימה. פלזמה, המכיל פיברינוגן וגורמי קרישה אחרים כאשר מופרדים מתאי הדם האדומים, ניתן לחלץ מדגם נוגד קרישה. סרום מתקבל באמצעות איסוף דם ללא נוגד קרישה. הנסיוב ייווצר מצנטריפוגה של הדגימה ברגע שנוצר קריש דם. כמו המדגם יש קרישה, הסרום לא יכיל פיברינוגן או גורמי קרישה אחרים. הן פלזמה והן סרום מתקבלים באמצעות צנטריפוגה לרוץ ב 2200-2500 סל"ד למשך מינימום של 15 דקות.
עבור מדגם שחייב להניב דם שלם או פלזמה, יש להשתמש נוגד קרישה מתאים. נוגדי קרישה נפוצים עבור חיות מעבדה הם הפרין, נתרן סיטראט, חומצה טטראצטית אתילנדיאמין (EDTA); הבחירה בה מבוססת על צרכי מחקר. ניתן לטעון ישירות למזרק צורה נוזלית של EDTA, הפרין ונתרן סיטראט. זה מאפשר מגע של נוגד קרישה ישירות כמו הדם נמשך, סיוע במניעת קרישה. כמו קרישי דם חולדה מהר יותר מאשר רוב דם היונקים, זה חיוני כי היחס הנכון של נוגד קרישה לדם ישמש לאיסוף דם.
בחירת המחט מבוססת על גודל החיה והאתר של venipuncture. באופן כללי, ככל שהשעמום של המחט גדול יותר, כך ניתן לאסוף את המדגם במהירות רבה יותר. פחות נזק לתאי הדם הוא יתרון נוסף למחטים גדולות יותר. עם זאת, החיסרון העיקרי למחטים גדולות הוא הנזק הפוטנציאלי לכלי הדם. על עכברים וחולדות, הבחירות של גודל נע בין 20-29 מחטים מד כי הם 0.5-1.5 אינץ 'אורך. אם מחט ארוכה מדי, לא רק שזה מביך לשימוש, אבל יש את המרחב הנוסף במחט יכול לגרום קרישה. גודל המחט המתאים מופיע עבור כל שיטה בסעיף ההליכים.
יש גם תגדיר מראש את גודל המדגם הנדרש. בשל הגודל הקטן של העכבר או החולדה, יש לחשב את הכמות המרבית של איסוף דם עבור דימום הישרדותי. עכבר ממוצע במשקל 25 גרם יש נפח דם כולל של 1.8 מ"ל; החולדה הממוצעת במשקל 250 גרם יש נפח דם כולל של 16 מ"ל. עבור דגימת דם אחת על עכבר או חולדה ללא החלפת נוזלים, נפח הדם המרבי שניתן להסיר בבטחה הוא 10% מנפח הדם הכולל, או 7.7-8 מיקרול/גרם. לכן עבור עכבר ממוצע, 10% מנפח הדם שלה הוא 193-200 μl. עבור חולדה ממוצעת של 250 גרם, זה שווה ערך 1.9-2.0 מ"ל. מחקרים הראו כי הסרת יותר מ -15% מנפח הדם יכולה לגרום להלם תת-נפחי. 1,2 עם זאת, עם החלפת נוזלים, עד 15% מכלל נפח הדם - או 12 μl / g-ניתן להסיר. עבור עכבר 25 גרם, זה שווה ערך 300 μl; עבור חולדה 250 גרם, זה שווה ערך 3 מ"ל. להחלפת נוזלים, יש לחמם את הנוזלים ולהעניק אותם באופן תת עורי.
אם יש צורך לקחת דגימות מרובות, נפח הדם נמשך מופחת. נפח הדם המרבי שניתן לצייר בשבוע הוא לא יותר מ 7.5% מכלל נפח הדם, או 6 μl/ g. עבור עכבר 25 גרם, זה שווה ערך 145-150 μl בשבוע. עבור חולדה 250 גרם, זה שווה ערך 1.45-1.50 מ"ל בשבוע. אם דגימה תתרחש כל שבועיים, עד 10% מנפח הדם הכולל (8 מיקרול/גרם) עשוי להימשך. זה שווה ערך 200 μl כל שבועיים עבור עכבר ממוצע, ועד 2.00 מ"ל כל 2 שבועות עבור חולדה 250 גרם. מחקר אחד, שבוצע על חולדות עם משקל ממוצע של 250 גרם, גילה כי כאשר נפחי דם של 15-20% הוסרו, זה לקח יותר מ 29 ימים עבור רמות הדם לנרמל. 1,2 לאיסוף דם חוזר ונשנית, החלפת נוזלים אינה מאפשרת נפח דם גדול יותר או איסוף דם תכוף יותר, שכן הוא מחליף רק נפח. החיה תזדקק לזמן כדי לחדש את מלאי תאי הדם.
השימוש בקלעת הרטרו-מסלולית היה מנהג נפוץ בעבר. עם זאת, חששות רבים לגבי האנושיות של הליך זה התעוררו. במהלך ההליך, תנועה מופרזת של צינור המטוקריט פעם להציב קנתוס המתיווך של העין יכול לגרום נזק לרקמות שמסביב, וכתוצאה מכך נפיחות של העפעפיים ו /או ממברנות הלחמית. הרקמות הנפוחות יכולות לגרום לגלגל העין לבלוט מספיק רחוק, כך שסגירת העפעף תיפגע, מה שעלול לגרום לייבוש ונזק בקרנית. כאב מנפיחות יכול לעורר גירוד והשחתה עצמית שתוצאתה תמריץ את העין. מיקום לא תקין של צינור המטוקריט במהלך דימום רטרו-מסלולי יכול לנתק את עצב הראייה, וכתוצאה מכך עיוורון. אם צינור ההמטוקריט מתקדם בזווית לא נכונה, ניתן לכפות את העין לצאת מהמסלול, מה שמאפשר לעפעפיים ליפול מאחורי גלגל העין. אם זה קורה, קשה מאוד להחליף את העין כראוי לתוך השקע. בעיות אחרות שעלולות להתעורר כוללות שבירה של עצמות המסלול השברירי, חדירה של כדור הארץ וכתוצאה מכך אובדן הומור זגג, או היווצרות של שטף דם מאחורי העין שיכול לגרום לכאב קיצוני עקב הלחץ על העין והמבנים שמסביב. למרות כל החששות הללו, אם טכנאי מיומן מבצע את ההליך והחיה מורדם לחלוטין עם הרדמה כללית, כגון הרדמה משאיפה איזופלורן, דימום רטרו-מסלולי הוכח כשיטה יעילה של איסוף דם במכרסמים.
המבנה האנטומי של אזור המסלול שונה בין העכבר לעכברוש. לעכבר יש את הסינוס הרטרו-מסלולי - אוסף של כלי שיט שיוצרים סינוס באזור המסלול. במסלול של עין החולדה, יש מקלעת של כלי שיט שזורמים מאחורי העין; עם זאת, הם אינם יוצרים סינוס, כמו בעכבר. כתוצאה מכך, קל יותר לבצע הליך זה על עכברים. עבור איסוף דגימה חוזר דרך מקלעת רטרו-מסלולית, מינימום של 10 ימים בין דימומים נדרש כדי לאפשר את הרקמות באזור לרפא. למרות הרדמה כללית מומלץ, ההליך יכול להתבצע בעכברים ללא הרדמה כללית אם הרדמה עיניים אקטואלי, כגון פרופרקאין או טטרקאין, מוחל לפני ההליך. מכיוון שלעכברושים אין את הסינוס הרטרו-מסלולי, ומכיוון שהממברנות שלהם סביב המסלול חזקות בהרבה, חובה להרידים אותן להליך זה.
ניתן להשיג דוגמאות טוריות של אמצעי אחסון קטן באמצעות שיטת קליפ זנב. הקטיעה הראשונית של הזנב חייבת להיות מוגבלת לקצה הזנב, כ 0.5-1.0 מ"מ אורך בעכברים ו 2.0 מ"מ בחולדות. 1 הליך חיתוך הזנב לאיסוף דם מאפשר איסוף סדרתי על ידי שיבוש הגלד או קריש של החתך המקורי בסוף הזנב. בדרך כלל, קטיעה נוספת של קצה הזנב אינה הכרחית. נפחי הדם שנאספו נעים בין 20-100 μL לעכברים ו 75-150 μL עבור חולדות. הסכום שנאסף משתנה בין בעלי חיים ויכול להיות מושפע מגיל, מצב בריאותי ומשקל.
המדגם שנאסף מגזרת זנב יכול להכיל דם עורקי ורידי, יחד עם זיהום מוצר רקמה. איכות המדגם פוחתת אם הזנב הוא ליטף או "חלב" כדי להשיג יותר דם. כדי להגביר את זרימת הדם, הזנב יכול להיות מחומם עם קומפרסים חמים, מנורת חום, או שקוע במים חמים. לחץ צריך להיות מופעל על קצה הזנב עבור hemostasis, ובעלי חיים צריך להיבדק כל 5-10 דקות כדי להבטיח hemostasis הושג. המוסטזיס מתעכב לעתים קרובות עם דגימה חוזרת ונשנית. אבקה סטייפטית עשויה לשמש להמוסטזיס. עבור הקטיעה הראשונית, מומלץ הרדמה (כללית או מקומית). דימום לאחר מכן לא צריך לדרוש הרדמה, במיוחד כמו בעלי החיים להיות רגילים להליך. הרדמה תגרום לירידה בלחץ הדם, מה שהופך את איסוף הדם עם טכניקה זו קשה.
חלופה לגזור זנב היא ניק כלי הזנב. הליך זה מבוצע בקלות הן על עכברים והן על חולדות. עם זאת, כמו עם חיתוך הזנב, הדגימות עשויות להיות מזוהמות עם מוצרי רקמות, במיוחד בעכבר. עבור חולדות, מחט תת עורית מוכנסת לכלי, והדם נאסף ממרכז המחט. מחקר אחד הדגים את השימוש ב חוסם עורקים שהוצב מעל אתר ניקוב המחט כדי לסייע באיסוף דם. 3 מזרק אינו משמש כדי להוציא את הדם מהכלי, שכן הלחץ שנוצר מהמזרק ימוטט את כלי הדם. שיטה זו יכולה לשמש גם לדגימה טורית, כמו קריש ניתן להסיר כדי לגרום לאתר לדמם שוב. כמו עם חיתולים זנב, זה הכרחי כדי להבטיח hemostasis על ידי הפעלת לחץ על האתר ובדיקה מחדש של החיה כל 5-10 דקות.
לעתים קרובות, מחקרים דורשים דגימת דם לא-שורבית וגדולה שנאספה באמצעות דימום תוך-לבבי או קווה הווריד. 4 כמחצית נפח הדם הכולל ניתן לאסוף מעכבר או חולדה על ידי ניקוב לב. זה שווה ערך 40 μl/g או כ 1 מיליליטר עבור עכבר ממוצע 25 גרם. חולדה 250 גרם תיבול כ 10 מ"ל של דם. החיה חייבת להיות מרדים לדם. הרדמה תפופה או CO 2 נרקוסיס יכול לשמש על ידיטכנאי מיומן; ניתן להשתמש גם בהרדמה להזרקה. עם זאת, ייתכן שיש ירידה בלחץ הדם ובמחזור הדם, אשר יכול להפחית את כמות הדם שנאסף.
שיטת הווצק הקאווה caudal דורשת כי החיה להיות מרדים עמוק לחשוף את הכלי בניתוח. CO2 נרקוסיס אינו מספיק, כמו הלב חייב להיות פועם ואת הנשימה החיה במהלך גמילה מהדם. במהלך ההליך, מהיר מדי של נסיגת דם יכול לגרום לכלי לקרוס על שיפוע המזרק, אוסם את הפתח ומניעת איסוף דם. כמו כן, קירות כלי הדם דקים, ולכן יש להימנע מתנועה של היד והמחט כדי למנוע קרע או דליפת דם מאתר הכניסה למחט. כמו המחט אינה עוברת דרך העור, שיטה זו גורמת לאיסוף של מדגם סטרילי. יש להשתמש בשיטות המתת חסד כדי להבטיח שבעל החיים לא יתאושש מהרדמה. שיטה זו מלווה לעתים קרובות זלוף לב או בתחום העורקים.
השיטה תוך-לבבית יכולה להתבצע עם בעל החיים מרוסן באופן ידני ברגע שהוא מרדים (שיטה סגורה), או הלב יכול להיחשף בניתוח לפי הפרוטוקול עבור שיטת איסוף דם veaudal veva (שיטה פתוחה). עבור השיטה הסגורה, ציוני הדרך למיקום מחט הם החריץ שנוצר על ידי כלוב הצלעות בתהליך xiphoid, בצד שמאל של החיה.
1. דימום רטרו-מסלולי
- ציוד
- הכן צנצנת פעמון, או תא אינדוקציה הרדמה, כדי לנהל גז הרדמה כגון איזופלוראן. בעת שימוש בצנצנת פעמון, זה הכרחי כי הרדמה נוזלית לא בא במגע עם החיה, כדי למנוע ספיגה דרך העור. פלטפורמה עם חורים קטנים ניתן להשתמש.
- צינורות מיקרוהמטוקריט המכילים 50-75 מיקרוליטרים מועדפים. צינורות עטופים מיילר נוטים פחות לשבור בין האצבעות של המפעיל ויש לשקול כאמצעי בטיחות.
- מספר עוביים של מגבת נייר, או חומרי בידוד אחרים, ממוקמים על משטח העבודה כדי לשמור על חום הגוף של החיה במהלך ההליך.
- הכנה ומיצוב של החיה
- החיה מורדמת עם הרדמה בשאיפה, כגון איזופלוראן, בצנצנת פעמון או תא אינדוקציה הרדמה גז, כדי להשפיע.
- ברגע שהחיה היא מרדים לחלוטין, הוא מוסר ומושם recumbency לרוחב.
- העין בולטת על ידי הנחת אצבע על החלק העליון של הראש ולאורך קו הלסת, ומשיכת העור אחורה ולמטה.
- הימנע מהפעלת לחץ על קנה הנשימה, שכן זה עלול לקרוס או לאטום את דרכי הנשימה הגורמות למוות על ידי חנק.
- נסיגת דם
- המיקרוהמטוקריט ממוקם בקנותן המהודד של העין ומכוון בזווית של 30-45 מעלות ממישור האף.
- יש להפעיל לחץ תוך כדי סיבוב עדין של צינור ההמטוקריט. זה יחתוך את הממברנות הלחמית ויקרע את מקלעת העין.
- הדם יזרום לתוך צינור ההמטוקריט על ידי פעולה נימית.
- הימנע דוחף כל כך עמוק שאתה מכה את העצם בחלק האחורי של חלל העין.
- ברגע שהדם מתחיל לזרום, לשמור על לחץ כדי לשמור על העין בולטת.
- כדי לאסוף צינורות מרובים של דם, אין צורך למקם את הצינור הבא לתוך מקלעת העין, כמו הדם ימשיך לזרום וניתן לאסוף כפי שהוא מגיע מן הקנתוס המתיווך.
- כדי לעצור את הדימום, לשחרר את העור ולאפשר לעין לחזור למצב נורמלי. להפעיל לחץ על המסלול כדי להבטיח המוסטזיס.
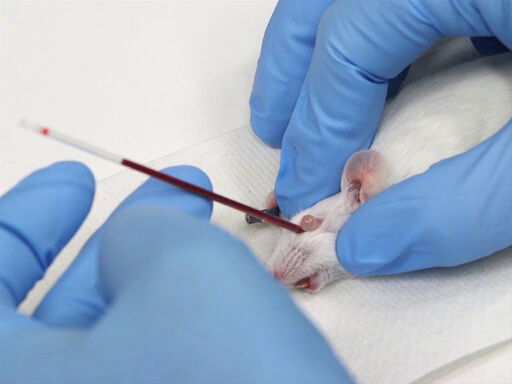
איור 1. נסיגת דם מסלולית רטרו בעכברים.
2. הליכי דימום בזנב: חיתוך זנב וניק זנב
- ציוד
- להב אזמל סטרילי, רצוי להב מספר 11 או סכין גילוח חד צדדי, משמש כדי להפוך את הקטיעה הראשונית עבור שיטת חיתוך הזנב. מספריים לא צריך לשמש כי החתך שנעשה על ידי מספריים הוא מוחץ, ובכך קידום קרישה והפחתת זרימת הדם. עבור הליך ניק הזנב, מספר 11 או 15 להב אזמל משמש כדי להפוך את החתך.
- צינור ריסון המאפשר גישה לזנב העכבר מוכן.
- מגבות נייר סופגות או גזה משמשות כמצע לביצוע חיתוך הזנב.
- צינורות איסוף או צינורות המטוקריט נדרשים גם כן.
- אבקה סטייפטית צריכה להיות זמינה כדי לסייע בהמוסטזיס.
- איפוק
- החיה ממוקמת לתוך הצינור כך הזנב נגיש. עבור מרסנים מסוג ברום, החיה נמשכת תחילה לתוך הצינור. עבור צינורות אחרים, החיה ממוקמת ראש ראשון.
- בעלי חיים מאובטחים לתוך הצינור כך שהם לא יכולים להסתובב או למשוך את הזנב.
- עכברים מסוימים יאפשרו חיתוך זנב ואיסוף דם עם ריסון ידני מינימלי אם הם מורשים לתפוס משטח מחוספס.
- חולדות מסוימות ידרשו הרדמה שאיפה לשיטה זו של איסוף דם.
- נסיגת דם
- הזנב מנגב במים חמים כדי להסיר פסולת ולגרום vasodilation קל. אין להשתמש במים חמים.
- עבור חיתוך הזנב, הזנב הוא מורחב, ואת קצה הזנב (0.5-1 מ"מ עבור עכברים עד 2 מ"מ עבור חולדות) נחתך עם להב האזמל.
- עבור ניק הזנב, הזנב הוא מורחב, וחתך נעשה עם להב האזמל כ 2/3 המרחק מן הישבן, ישירות מעל הווריד זנב לרוחב.
- הזנב יכול להיות ליטף מן הישבן לקצה כדי לעודד את זרימת הדם; עם זאת, זה יקטין את איכות המדגם.
- הדם נאסף מהקצה או ניק באמצעות צינורות המטוקריט או מותר לטפטף לתוך מקטורון אוסף.
3. איסוף דם לבבי
- ציוד
- עבור עכבר, מזרק 3 סמ"ק עם מחט 22-25 מד x 1" הוא המועדף. מזרקים קטנים יותר אין את אותו לחץ גב והוא יכול להפוך את גמילה בדם קשה יותר. מחטים קטנות מ 25 מד להגביל את זרימת הדם, המוביל קרישה מוגברת ונזק לתאי הדם. מחטים קצרות מ-1 אינץ' לא יגיעו לרמת הלב כשמתקרבים מהסרעפת.
- עבור חולדה, מזרק 10-12 סמ"ק עם מחט 18 מד x 1.5 " הוא המועדף. בהתאם לגודל החולדה, מזרק קטן יותר לא יכול להחזיק את כל נפח הדם כדי לאסוף, ולכן המזרק היה צריך להיות שונה במהלך ההליך. מחטים קטנות מ 20 מד להגביל את זרימת הדם, המוביל קרישה מוגברת. מחטים קצרות מ-1.5 אינץ' עשויות שלא להגיע לרמת הלב כאשר מתקרבים מהסרעפת.
- צינור איסוף דם בגודל מספיק משמש להחזיק את הדם שנאסף.
- איפוק
- איפוק נכון חיוני להצלחת שיטה זו. החיה מוחזקת על ידי הקשקוש עם הגוף תלוי אנכית. חשוב כי הגוף להיות ישר כדי למנוע הסטה של הלב או פיתול של החזה.
- עמדה חלופית היא recumbency הגב בעת הצבת המחט בין הצלעות בצד שמאל של החיה. זה שימושי במיוחד עבור חולדות גדולות מאוד או כאשר בעלי חיים מרובים הם להיות דימם.
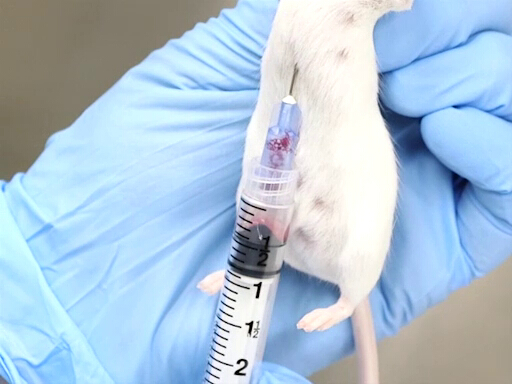
איור 2. נסיגת דם לב עם עכבר מוחזק אנכית.
- נסיגת דם
- הגישה מן ההיבט האחורי, ניקוב הסרעפת מושגת בקלות רבה יותר כאשר העכבר או החולדה מוחזקים אנכית על ידי הקשקוש.
- המחט מתקדמת בימין ממש משמאל לקסיפיד של החיה.
- המחט צריכה להיות מקבילה לעמוד השדרה ומונחת ממש מתחת לצלעות.
- הלב ממוקם בערך ברמה של המרפק.
- מניחים את המחט, משופעים, לתוך החזה, ולנקב את הלב.
- יש למרוח לחץ גב קל עם המזרק. אם המחט בלב, הדם יזרום למזרק.
- המתן עד שהדם ימלא את המזרק לפני הוספת לחץ גב נוסף על המזרק.
- הגישה לרוחב מצד שמאל של החיה דורשת מיקום החיה בנסיגה הגבית.
- נקודת הכניסה נמדדת כנגד נקודת המרפק על דופן החזה. הלב ממוקם בערך ברמה של המרפק.
- המחט מוכנסת בניצב למישור השולחן בנקודה באמצע הדרך על דופן החזה כפי שנמדדה באופן דורסוונטרי.
- מניחים את המחט, משופעים, לתוך החזה, ולנקב את הלב.
- יש למרוח לחץ גב קל עם המזרק. אם המחט בלב, הדם יזרום למזרק.
- המתן עד שהדם ימלא את המזרק לפני הוספת לחץ גב נוסף על המזרק.
- הגישה מן ההיבט האחורי, ניקוב הסרעפת מושגת בקלות רבה יותר כאשר העכבר או החולדה מוחזקים אנכית על ידי הקשקוש.
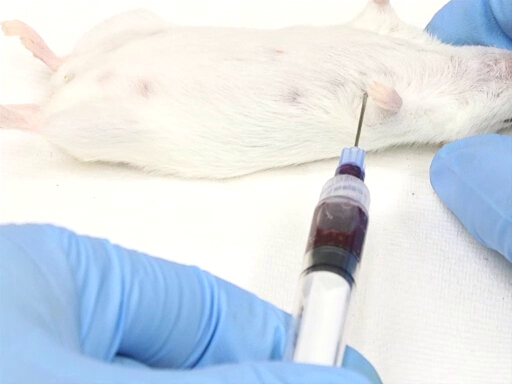
איור 3. נסיגת דם לבבית עם עכבר בתנוחת נסיגה הגבית.
- טיפים טכניים
- הלב הנורמלי ממוקם עם פסגת הצבעה שמאלה. במקרים נדירים, הלב עשוי להיות הפוך, וכתוצאה מכך קושי לנקב את הלב.
- לחץ גב מוגזם על המזרק עלול למוטט את הלב, לחנוק את משופע המחט ולעצור את זרימת הדם למזרק.
- הפעלת לחץ גב ושחרורו שוב ושוב יפעיל קרישה במזרק.
- החלה עדינה של לחץ על הכבד יכולה לכפות נפח דם נוסף לתוך מערכת הדם, מה שהופך אותו זמין לגמילה.
4. נסיגת דם הוועד האחורית
- ציוד
- מזרק שחפים עם מחט 25-29 מד משמש לאיסוף דם בעכבר. עבור חולדות, מזרק 10-12 סמ"ק עם מחט 22-25 מד x 1" נדרש.
- פלטפורמה כירורגית, מגש ניתוח או משטח אחר לאבטחת החיה נדרשים, יחד עם קשרים, סרט הדבקה או סיכות כדי להדביק את הגפיים בעמדה.
- הרדמה להזרקה או הרדמה שאיפה יש צורך. אם משתמשים בהרדמה בשאיפה, רצוי שההרדמה תימסר באמצעות מאדה מדויק עם חרוט אף. אורך ההליך הוא כזה ששימוש בתא אינדוקציה ללא אספקת גז הרדמה נוספת לא יספק מספיק זמן כדי להשלים את נסיגת הדם לפני החיה מתעוררת לחיים.
- מספריים איריס עבור העכבר, או מספריים חדים קהים חדר עבור החולדה, נדרשים, יחד עם מלקחיים אגודל אטראומטיים קטנים, וספוג גזה 2 "x 2".
- איפוק
- כאשר החיה היא מרדים לחלוטין, כפי שנקבע על ידי צביטת הבוהן או צביטת זנב, החיה ממוקמת recumbency הגב.
- הגפיים מאובטחות לרציף עם סרט או סיכות. הגפיים צריכות להיות מורחבות הרחק מהגוף.
- גמילה
- העור מורם וחתך רוחבי קטן נעשה דרך העור ממש מעל האגן אצל הנקבות, או ממש מעל ההקדמה אצל הזכרים.
- נקודת המספריים ממוקמת לתוך החתך, וחתך בקו האמצע נעשה דרך העור מהאגן / prepuce אל xiphoid.
- העור משתקף לרוחב לכל צד. ניתוח קהה עשוי להיות נחוץ כדי לשחרר אותו מהשריר הבסיסי.
- השריר מורם, וחתך רוחבי קטן נעשה דרך השריר ממש מעל העור לחתוך.
- הנקודה של המספריים ממוקמת לתוך הבטן ו חנק קו האמצע נעשה דרך השריר כדי xiphoid. הקפד לכוון את נקודת המספריים כלפי מעלה כדי להימנע מחיתוך איברים כלשהם.
- חותכים לרוחב לאורך עקומת הצלעות בכל צד. לנקוט זהירות נוספת לא לנקב את הכבד.
- הזיזו בעדינות את המעיים לשמאל החיה כדי לחשוף את הוועד הנבי האחורי.
- מניחים כרית גזה על הכבד, ומניחים את האינדקס והאצבע האמצעית על הכבד.
- עם היד השנייה, להכניס את המחט, משופע כלפי מעלה, לתוך הווריד קאווה באמצע הדרך בין הצומת של כלי הכליה ואת bifurcation הכסל.
- לאט למשוך את הדם תוך הפעלת לחץ על הכבד.
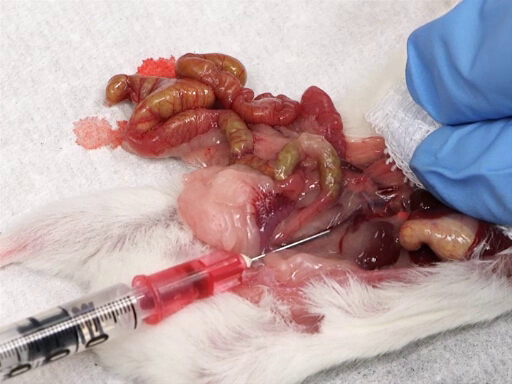
איור 4. נסיגת דם מוועד הוועד האחורי.
איסוף דם לעכברים וחולדות יכול להתבצע במגוון טכניקות. למרות שגורמים רבים, כגון גודל המדגם, תדירות הדגימה, ואת הגודל והגיל של החיה להשפיע על זה, המרכיב החיוני ביותר הוא רמת המיומנות של הטכנאי ביצוע אוסף המדגם. עבור השיטות המתוארות כאן, השימוש הנכון בהרדמה הוא חיוני גם עבור דגימות איכות ורווחתם של בעלי החיים.
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved