0:00
Overview
0:56
General Considerations for Blood Withdrawal
3:57
Retro Orbital Bleed
7:18
Tail Bleed
9:42
Cardiac Blood Collection
14:15
Applications
16:07
Summary
혈액 채취 I
출처: 케이 스튜어트, RVT, RLATG, CMAR; 발레리 A. 슈뢰더, RVT, RLATG. 노틀담 대학교, IN
혈액 수집은 마우스와 쥐를 관련시키는 연구 결과를 위한 일반적인 요구 사항입니다. 마우스와 쥐의 혈액 철수 방법은 필요한 혈액의 부피, 샘플링 빈도, 피를 흘릴 동물의 건강 상태 및 기술자의 기술 수준에 따라 달라집니다. 1 모든 방법은 복고풍 궤도 부비동 출혈, 초기 꼬리 스니핑 출혈 및 심장 내 출혈에 대해 논의하여 전신 마취의 사용을 요구합니다.
출혈 절차에 앞서 필요한 샘플 유형을 결정해야 합니다. 실험 절차는 전혈, 혈장 또는 혈청을 요구할 수 있었습니다. 전혈의 경우 항응고제를 시료에 첨가해야 합니다. 적혈구로부터 분리될 때 피브리뇨유발 물질 및 기타 응고 인자를 포함하는 플라즈마는 항응고식 시료로부터 추출될 수 있다. 혈청은 항응고제없이 혈액 수집을 통해 수득된다. 혈전은 응고가 형성되면 시료의 원심 분리로 인해 발생합니다. 샘플이 응고된 바와 같이, 혈청은 피브리노겐 또는 다른 응고 인자를 포함하지 않습니다. 플라즈마와 혈청 은 최소 15 분 동안 2200-2500 RPM에서 원심 분리기 실행을 사용하여 얻을 수 있습니다.
전혈 또는 혈을 산출해야 하는 시료의 경우 적절한 항응고제를 사용해야 합니다. 실험실 동물에 대 한 일반적으로 사용 되는 항 응 고제는 heparin, 화분 나트륨, 그리고 에틸렌디아민 테트라 아 세트 산 (EDTA); 그 중 선택은 연구 요구에 기초합니다. EDTA, 헤파린 및 구연산 나트륨의 액체 형태인 분리기는 주사기에 직접 적재하여 표면을 코팅할 수 있습니다. 이것은 혈액이 그려질 때 항응고제의 접촉을 직접 허용하고 응고의 예방을 돕습니다. 쥐 혈전은 대부분의 포유류 혈액 보다 빠른, 혈액에 항 응고제의 정확한 비율은 혈액 수집에 사용 하는 것이 필수적이다.
바늘 선택은 동물의 크기와 정맥의 부위를 기반으로합니다. 일반적으로, 바늘의 보어가 클수록 시료를 더 빠르게 수집할 수 있다. 혈액 세포에 적은 손상은 더 큰 바늘에 또 다른 이점. 그러나, 큰 보어 바늘에 주요 단점은 선박에 잠재적인 손상이다. 쥐와 쥐에, 크기의 선택은 길이0.5-1.5 인치 20-29 게이지 바늘에서 범위. 바늘이 너무 길면 사용하기가 어색할뿐만 아니라 바늘에 여분의 공간이 있으면 응고될 수 있습니다. 적절한 바늘 크기는 절차 섹션의 각 방법에 대해 나열됩니다.
필요한 샘플의 크기도 미리 결정되어야 합니다. 마우스 또는 쥐의 작은 크기로 인해 생존 출혈을 위해 최대 양의 혈액 수집량을 계산해야합니다. 무게 평균 마우스 25 그램의 총 혈액 볼륨1.8 ml; 무게 평균 쥐 250 그램의 총 혈액 볼륨16 ml. 유체 교체없이 마우스 또는 쥐의 단일 혈액 샘플의 경우, 안전하게 제거 할 수있는 최대 혈액 부피는 총 혈액 부피의 10 % 또는 7.7-8 μl/g입니다. 따라서 평균 마우스의 경우 혈액 부피의 10 %가 193-200 μl입니다. 250 그램의 평균 쥐의 경우, 이것은 1.9-2.0 ml에 해당합니다. 연구 결과는 혈액 부피의 15% 이상을 제거하는 것이 저혈당 충격을 일으키는 원인이 될 수 있다는 것을 보여주었습니다. 1,2 그러나 유체 교체를 통해 전체 혈액 부피의 최대 15 % 또는 12 μl /g-를 제거 할 수 있습니다. 25그램 마우스의 경우 300 μl과 같습니다. 250 그램 쥐의 경우 3 ml에 해당합니다. 유체 교체를 위해 유체를 따뜻하게 하고 피하로 주어져야 합니다.
여러 샘플을 복용해야 하는 경우, 그려진 혈액 량이 줄어듭니다. 주당 그릴 수 있는 최대 혈액 부피는 총 혈액 부피의 7.5% 또는 6 μl/g 이하입니다. 25그램 마우스의 경우 주당 145-150 μl과 같습니다. 250 그램 쥐의 경우, 이것은 주당 1.45-1.50 ml에 해당합니다. 샘플링이 2주마다 발생하면 총 혈액 부피(8 μl/g)의 최대 10%까지 추출될 수 있습니다. 이는 평균 마우스의 경우 2주마다 200 μl, 250그램 쥐의 경우 2주마다 최대 2.00ml에 해당합니다. 한 연구, 의 평균 무게를 가진 쥐에 수행 250 그램, 15-20%의 혈액 볼륨을 제거 될 때, 그것은 이상 했다 29 정상화 혈액 수준에 대 한 일. 1,2 반복혈액 수집의 경우, 체액 교체는 부피만 대체하기 때문에 더 큰 혈액 량 또는 더 빈번한 혈액 수집을 허용하지 않습니다. 동물은 혈액 세포를 보충하는 시간이 필요합니다.
복고풍 궤도 신경총의 사용은 과거에 일반적인 관행이었다. 그러나, 이 절차의 인도성에 관하여 많은 관심사가 생겼습니다. 시술 도중, 눈의 내측 캔투스에 한 번 놓인 혈종 관의 과도한 움직임은 눈꺼풀 및/또는 결막의 팽윤귀결과로 주변 조직에 손상을 입힐 수 있습니다. 부은 조직은 눈꺼풀의 폐쇄가 방해되도록 안구가 충분히 튀어 나오게 할 수 있으므로 각막 건조 및 손상이 발생할 수 있습니다. 팽윤으로 인한 통증은 눈의 에클레오싱을 초래하는 긁힘과 자기 절단을 유발할 수 있습니다. 복고풍 궤도 출혈 동안 헤마토크 튜브의 부적절한 배치는 시신경을 끊을 수 있으며 실명증을 초래할 수 있습니다. 헤마토크릿 튜브가 부적절한 각도로 진행되면 눈을 강제로 궤도 밖으로 내밀어 눈꺼풀이 눈알 뒤에 떨어질 수 있습니다. 이 경우 눈을 소켓으로 올바르게 교체하기가 매우 어렵습니다. 발생할 수 있는 다른 문제는 깨지기 쉬운 궤도 뼈의 골절, 유리체 유머의 손실을 초래하는 눈 지구의 침투, 또는 눈과 주변 구조물에 대한 압력으로 인해 극심한 통증을 초래할 수 있는 눈 뒤에 혈종의 형성을 포함합니다. 이러한 모든 우려에도 불구하고, 숙련 된 기술자가 절차를 수행하고 동물이 이소플루란 흡입 마취와 같은 전신 마취로 완전히 마취되면 복고풍 궤도 출혈은 설치류에서 혈액 수집의 효과적인 방법으로 나타났습니다.
궤도 영역의 해부학 적 구조는 마우스와 쥐 사이에 다릅니다. 마우스는 궤도 지역에 부비동을 만드는 선박의 복고풍 궤도 부비동 - 컬렉션을 가지고있다. 쥐 눈의 궤도에, 그 눈 뒤에 흐르는 선박의 신경총이있다; 그러나 마우스와 같이 부비동을 형성하지 않습니다. 따라서 마우스에서이 절차를 수행하는 것이 더 쉽습니다. 복고풍 궤도 신경총을 통한 반복 샘플링 컬렉션의 경우, 피리 사이의 최소 10일이 필요하며, 이 지역의 조직이 치유될 수 있도록 허용해야 합니다. 전신 마취가 권장되지만, 프로파라카인 이나 테트라카인과 같은 국소 안과 마취가 시술 전에 적용되는 경우 전신 마취없이 마우스에서 시술을 수행 할 수 있습니다. 쥐는 복고풍 궤도 부비동을 가지고 있지 않기 때문에, 궤도 주위의 그들의 막이 훨씬 강하기 때문에,이 절차를 위해 그들을 마취하는 것이 필수적입니다.
작은 볼륨의 직렬 샘플은 꼬리 클립 방법을 사용하여 얻을 수 있습니다. 꼬리의 초기 절단은 꼬리 끝, 마우스의 길이 약 0.5-1.0 mm 및 쥐의 2.0 mm로 제한되어야합니다. 1 혈액 수집을위한 꼬리 스니핑 절차는 꼬리 끝에 원래 컷의 딱지 또는 응고를 방해하여 연속 수집을 허용합니다. 일반적으로 꼬리 끝의 추가 절단은 필요하지 않습니다. 수집된 혈액의 양은 마우스를 위한 20-100 μL 및 쥐를 위한 75-150 μL에서 구역 수색합니다. 수집된 양은 동물 들 사이에서 가변적이며 나이, 건강 상태 및 체중에 의해 영향을 받을 수 있습니다.
꼬리 스닙에서 채취한 샘플에는 조직 제품 오염과 함께 동맥 및 정맥 혈액이 모두 포함될 수 있습니다. 꼬리가 쓰다듬거나 "착유"되면 샘플 품질이 감소하여 더 많은 혈액을 얻습니다. 혈류를 증가시키기 위해 꼬리는 따뜻한 압축, 열램프 또는 따뜻한 물에 침수하여 가열 할 수 있습니다. 기압은 최면에 대한 꼬리 팁에 적용되어야하며, 동물은 자혈이 달성되었는지 확인하기 위해 5-10 분마다 확인해야합니다. Hemostasis는 종종 반복 샘플링으로 지연됩니다. 스티피틱 파우더는 혈전증에 사용될 수 있다. 초기 절단의 경우 마취(일반 또는 현지)를 권장합니다. 후속 출혈은 마취를 필요로하지 않아야하며, 특히 동물이 절차에 습관화될 때. 마취는 혈압의 하락을 일으킬 것입니다, 어려운이 기술로 혈액 수집을 만들기.
꼬리 스니핑의 대안은 꼬리 용기 닉입니다. 이 절차는 마우스와 쥐 모두에서 쉽게 수행됩니다. 그러나 꼬리 스니핑과 마찬가지로 샘플은 특히 마우스에서 조직 제품으로 오염될 수 있습니다. 쥐의 경우 피하 바늘이 용기에 삽입되고 바늘의 허브에서 혈액이 수집됩니다. 한 연구는 혈액 수집을 돕기 위해 바늘 천자 부위 위에 배치 된 지혈대의 사용을 입증했다. 3 주사기로 인한 압력이 혈관을 무너질 것이기 때문에 주사기는 혈관에서 혈액을 끌어내는 데 사용되지 않습니다. 이 방법은 또한 연재 샘플링에 사용할 수 있습니다., 혈전을 제거 할 수 있습니다 다시 출혈 사이트를 일으키는 원인이 될 수 있습니다. 꼬리 스닙과 마찬가지로, 부위에 압력을 가하고 5-10분마다 동물을 다시 검사하여 혈전을 보장하는 것이 필수적입니다.
종종, 연구는 비 생존을 필요로, 내심 출혈 또는 caudal 베나 카바를 통해 흥분을 통해 수집되는 큰 혈액 샘플. 4 총 혈액 량의 약 절반은 심장 펑크에 의해 마우스 또는 쥐로부터 수집될 수 있다. 이는 평균 25그램 마우스의 경우 40 μl/g 또는 약 1ml에 해당합니다. 250 그램 쥐는 약 10 ml의 혈액을 낳을 것입니다. 동물은 멸시를 위해 마취되어야 합니다. 흡입성 마취 또는 CO2 마약은 숙련 된 기술자에 의해 사용될 수있다; 주사용 마취도 사용할 수 있습니다. 그러나, 혈압과 순환에 있는 감소가 있을 수 있습니다., 수집 된 혈액의 양을 줄일 수 있는.
caudal vena cava 방법은 동물이 외과적으로 혈관을 드러내기 위하여 깊이 마취될 것을 요구합니다. CO2 나르코시스는 심장이 뛰고 혈액 철수 중에 동물이 호흡해야하기 때문에 충분하지 않습니다. 절차 도중, 혈액 철수의 너무 급속한 것은 구멍의 bevel에 있는 혈관을 붕괴시키는 원인이 될 수 있습니다, 개구부를 가리고 혈액 수집을 방지하. 또한 혈관 벽은 얇기 때문에 바늘 입구 부위로부터 혈액이 파열되거나 누출되는 것을 방지하기 위해 손과 바늘의 움직임을 피해야 한다. 바늘이 피부를 통과하지 못하기 때문에, 이 방법은 멸균 샘플의 수집을 초래한다. 부막제 안락사 방법은 동물이 마취에서 회복되지 않도록 하기 위해 사용되어야 합니다. 이 방법은 종종 심장 또는 대동맥 관류다음에.
상기 심내 방법은 마취(closed method)가 되면 동물을 수동으로 절제하거나, 심장이 카우달 베나 카바 혈액 수집 방법(open method)에 대한 프로토콜에 따라 외과적으로 노출될 수 있다. 폐쇄 된 방법의 경우, 바늘 배치의 랜드 마크는 동물의 왼쪽에, xiphoid 과정에서 늑골 케이지에 의해 형성 된 홈입니다.
1. 복고풍 궤도 출혈
- 설비
- 벨 항아리 또는 마취 유도 챔버를 준비하여 이소플루란과 같은 마취 가스를 투여하십시오. 종항아리를 사용하는 경우, 액체 마취제가 동물과 접촉하지 않고 피부를 통한 흡수를 피하는 것이 필수적입니다. 구멍이 작은 플랫폼을 사용할 수 있습니다.
- 50-75 마이크로리터를 보유하는 미세 한 종크라이트 튜브가 바람직하다. 마일라 포장 튜브는 운전자의 손가락 사이에 파손 될 가능성이 적고 안전 조치로 간주되어야한다.
- 여러 종이 타월 두께, 또는 기타 절연 재료는 절차 중에 동물의 체온을 유지하기 위해 작업 표면에 배치됩니다.
- 동물의 준비 및 위치
- 동물은 벨 항아리 또는 가스 마취 유도 챔버에서 이소플루란과 같은 흡입 마취로 마취되어 효과가 있습니다.
- 동물이 완전히 마취되면 제거되어 측면 의실에 놓입니다.
- 눈은 머리 의 상단과 턱선을 따라 손가락을 배치하고 피부를 앞뒤로 당겨 튀어 나오게됩니다.
- 질식에 의한 죽음을 일으키는 기도가 붕괴되거나 폐색될 수 있기 때문에 기관에 압력을 가하지 마십시오.
- 혈액 철수
- 미세 한 종동은 눈의 내측 캔투스에 배치 하 고 코의 평면에서 30-45° 각도에서 caudally 지시.
- 헤마토크튜브를 부드럽게 회전시키면서 압력을 가합니다. 이것은 결막막을 통해 절단하고 안구 신경병이 파열합니다.
- 혈액은 모세관 작용에 의해 혈전관으로 흐를 것입니다.
- 안구 구멍 의 뒷면에 뼈를 명중 너무 깊은 밀어 하지 마십시오.
- 혈액이 흐르기 시작하면 눈을 돌출하기 위해 압력을 유지하십시오.
- 혈액의 여러 튜브를 수집하기 위해, 혈액이 계속 흐르고 내측 캔투스에서 오는 대로 수집 될 수 있기 때문에, 안구 신경통에 다음 튜브를 배치 할 필요가 없습니다.
- 출혈을 멈추려면 피부를 풀어 놓고 눈이 정상 위치로 돌아갈 수 있도록 하십시오. 배후를 보장하기 위해 궤도에 압력을 가하십시오.
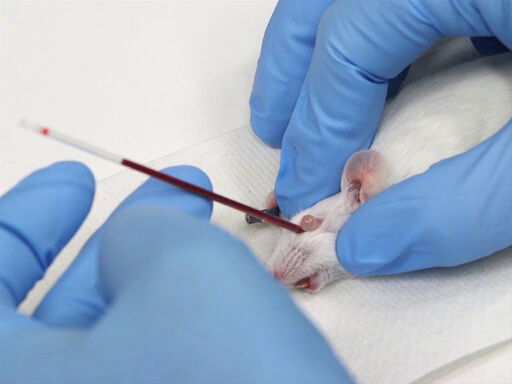
그림 1. 마우스에서 복고풍 궤도 혈액 철수.
2. 꼬리 출혈 절차 : 꼬리 스니핑과 꼬리 닉
- 설비
- 멸균 메스 블레이드는 바람직하게는 숫자 11 블레이드 또는 단면 면도날, 꼬리 스니핑 방법에 대한 초기 절단을 하는 데 사용된다. 가위가 분쇄되어 응고를 촉진하고 혈류를 감소시키기 때문에 가위를 사용해서는 안됩니다. 꼬리 닉 절차의 경우, 숫자 11 또는 15 메스 블레이드가 절단을 하는 데 사용됩니다.
- 마우스의 꼬리에 접근할 수 있는 구속 튜브가 준비되어 있습니다.
- 흡수성 종이 타월 이나 거즈는 꼬리 스니핑을 수행 하기 위한 기판으로 사용 됩니다.
- 수집 튜브 또는 헤마토크릿 튜브도 필요합니다.
- 스티피틱 파우더는 혈청을 돕기 위해 사용할 수 있어야합니다.
- 구속
- 동물은 꼬리에 접근 할 수 있도록 튜브에 배치됩니다. 브룸 형 제지제의 경우, 동물은 먼저 튜브에 엉덩이를 당긴다. 다른 튜브의 경우, 동물은 먼저 머리를 배치합니다.
- 동물은 꼬리를 돌리거나 철회할 수 없도록 튜브에 고정됩니다.
- 일부 마우스는 거친 표면을 잡을 수 있다면 최소한의 수동 구속으로 꼬리 스니핑과 혈액 수집을 허용합니다.
- 몇몇 쥐는 혈액 수집의 이 방법에 대한 흡입 마취를 요구할 것입니다.
- 혈액 철수
- 꼬리는 이물질을 제거하고 약간의 혈관 확장을 일으키는 따뜻한 물로 닦아냅니다. 뜨거운 물을 사용하지 마십시오.
- 꼬리 스니핑의 경우 꼬리가 확장되고 꼬리의 맨 끝 (쥐의 경우 0.5-1 mm 및 쥐의 경우 최대 2mm)이 메스 블레이드로 절단됩니다.
- 꼬리 닉의 경우 꼬리가 확장되고, 컷은 말살 꼬리 정맥 바로 위에, 엉덩이에서 약 2/3 거리 메스 블레이드로 만들어집니다.
- 꼬리는 혈류를 장려하기 위해 엉덩이에서 팁으로 쓰다듬을 수 있습니다. 그러나, 이것은 견본의 질을 감소시다.
- 혈액은 혈중 경구를 사용하여 팁이나 닉에서 수집하거나 수집 유리병에 물방울을 허용합니다.
3. 심장 혈액 수집
- 설비
- 마우스의 경우 22-25 게이지 x 1"바늘이 있는 3cc 주사기가 바람직하다. 더 작은 주사기는 동일한 배압을 가지고 있지 않으며 혈액 철수를 더 어렵게 만들 수 있습니다. 25 게이지보다 작은 바늘은 혈액의 흐름을 제한하여 혈액 세포에 응고 및 손상을 증가시합니다. 1 이하의 바늘은 다이어프램에서 접근할 때 심장의 수준에 도달하지 못할 수 있습니다.
- 쥐의 경우, 18 게이지 x 1.5"바늘을 가진 10-12 cc 주사기를 선호합니다. 쥐의 크기에 따라, 더 작은 주사기는 수집될 전체 혈액 양을 보유하지 않을 수 있습니다, 따라서 주사기는 절차 도중 변경되어야 할 것이다. 20 게이지보다 작은 바늘은 혈액의 흐름을 제한하여 응고가 증가합니다. 1.5"보다 짧은 바늘은 다이어프램에서 접근할 때 심장의 수준에 도달하지 않을 수 있습니다.
- 충분한 크기의 혈액 수집 튜브는 수집 된 혈액을 보유하는 데 사용됩니다.
- 구속
- 적절한 구속은이 방법의 성공에 필수적이다. 동물은 몸이 수직으로 매달려 있는 스크러프에 의해 유지됩니다. 몸이 심장의 편향이나 가슴의 비틀림을 방지하기 위해 똑바로하는 것이 중요합니다.
- 대체 위치는 동물의 왼쪽에 갈비뼈 사이에 바늘을 배치 할 때 등쪽 침전이다. 이것은 매우 큰 쥐 또는 여러 동물이 피를 흘릴 때 특히 유용합니다.
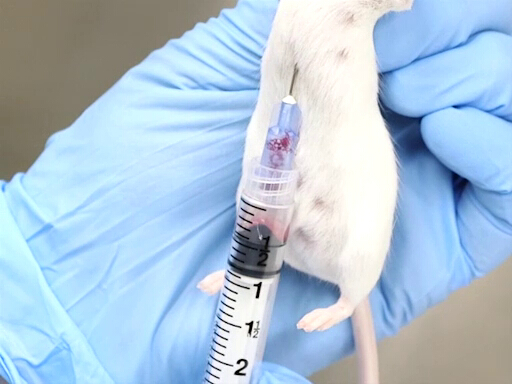
그림 2. 마우스가 수직으로 유지와 심장 혈액 철수.
- 혈액 철수
- 마우스 또는 쥐가 스크러프에 의해 수직으로 유지될 때 후방 양상에서, 다이어프램을 뚫는 접근은 더 쉽게 달성된다.
- 바늘은 동물의 xiphoid의 왼쪽에 있는 노치에서 진행됩니다.
- 바늘은 척추와 평행해야하며 갈비뼈 바로 아래에 놓아야합니다.
- 심장은 팔꿈치 의 수준에 대략 위치합니다.
- 바늘을 놓고, 구부리고, 가슴에 넣고, 심장에 구멍을 뚫습니다.
- 주사기로 약간의 허리 압력을 가하십시오. 바늘이 심장에 있으면 혈액이 주사기로 흘러 들어갑니다.
- 주사기에 추가 적인 허리 압력을 추가 하기 전에 혈액 주사기를 가득 때까지 기다립니다.
- 동물의 왼쪽에서 측면 접근은 등쪽 의 재시간에 동물을 배치해야합니다.
- 진입점은 가슴 벽에 있는 팔꿈치의 지점에 대해 측정됩니다. 심장은 팔꿈치 의 수준에 대략 위치합니다.
- 바늘은 흉벽의 중간 지점에서 테이블의 평면에 수직으로 삽입됩니다.
- 바늘을 놓고, 구부리고, 가슴에 넣고, 심장에 구멍을 뚫습니다.
- 주사기로 약간의 허리 압력을 가하십시오. 바늘이 심장에 있으면 혈액이 주사기로 흘러 들어갑니다.
- 주사기에 추가 배압을 추가하기 전에 혈액이 주사기를 채울 때까지 기다립니다.
- 마우스 또는 쥐가 스크러프에 의해 수직으로 유지될 때 후방 양상에서, 다이어프램을 뚫는 접근은 더 쉽게 달성된다.
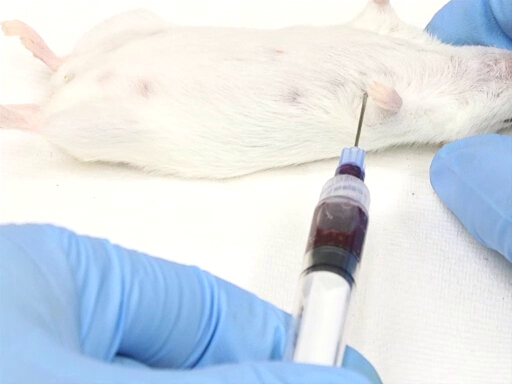
그림 3. 등대 반수 위치에 마우스와 심장 혈액 철수.
- 기술 팁
- 정상적인 심장은 왼쪽을 가리키는 정점과 함께 위치하고 있습니다. 드문 경우에, 심장은 심장을 천공에 있는 어려움귀착되었던 반전될 수 있습니다.
- 주사기에 과도한 역압은 심장을 붕괴시킬 수 있으며, 바늘 벨을 가리고 주사기로의 혈류를 막을 수 있습니다.
- 백 압력을 적용하고 반복적으로 방출하면 주사기에 응고가 시작됩니다.
- 간경에 부드럽게 압력을 가하면 순환 계통에 추가 혈액량을 강제할 수 있으므로 철수할 수 있습니다.
4. 후방 베나 카바 혈액 철수
- 설비
- 25-29 게이지 바늘을 가진 결핵 주사기는 마우스에 있는 혈액 수집에 이용됩니다. 쥐의 경우 22-25 게이지 x 1"바늘이있는 10-12 cc 주사기가 필요합니다.
- 동물을 보호하기 위해 외과 플랫폼, 해부 트레이 또는 기타 표면이 필요하며, 사지를 제자리에 부착하기 위해 넥타이, 테이프 또는 핀이 필요합니다.
- 주사용 마취 또는 흡입 마취가 필요합니다. 흡입 마취를 사용하는 경우, 마취가 코 콘을 가진 정밀 기화기를 통해 전달되는 것이 바람직하다. 절차 길이는 추가 마취 가스 전달없이 유도 챔버를 사용하면 동물이 부활하기 전에 혈액 배출을 완료하기에 충분한 시간을 제공하지 않습니다.
- 쥐용 아이리스 가위 또는 쥐용 날카로운 무딘 가위 수술실이 필요하며, 작은 외상성 엄지 집게와 2"x 2" 거즈 스폰지가 필요합니다.
- 구속
- 동물이 발가락 꼬집거나 꼬리 꼬집어 결정된 대로 완전히 마취되면 동물은 등갈에 배치됩니다.
- 팔다리는 테이프 나 핀으로 플랫폼에 고정됩니다. 사지는 몸에서 멀리 확장되어야한다.
- 출금
- 피부가 들어 올려지고 작은 횡방향 컷은 여성의 골반 바로 위 또는 남성의 프레덕트 바로 위에 있는 피부를 통해 만들어집니다.
- 가위의 점은 컷에 배치되고, 중간 선절절은 골반 / 프레추에서 xiphoid에 피부를 통해 이루어집니다.
- 피부는 양쪽에 측면으로 반사됩니다. 무딘 해부는 기본 근육에서 그것을 느슨하게 할 필요가 있을 수 있습니다.
- 근육이 들어 올려지고, 작은 횡방향 절단은 피부 절단 바로 위의 근육을 통해 만들어집니다.
- 가위의 포인트는 복부에 배치되고 중간 선 절개는 xiphoid에 근육을 통해 이루어집니다. 장기를 자르지 않도록 가위 의 점을 위쪽으로 각도로 조정하십시오.
- 양쪽의 갈비뼈 곡선을 따라 횡적으로 자른다. 간을 뚫지 않도록 주의하십시오.
- 창자를 동물의 왼쪽으로 부드럽게 움직이면 후방 베나 카바를 노출시니다.
- 간장에 거즈 패드를 놓고, 간위에 검지와 가운데 손가락을 놓습니다.
- 다른 한편으로, 바늘을 삽입, 위쪽으로 bevel, 신장 혈관의 접합과 장골 분열 사이의 중간 베나 카바에.
- 간에서 압력을 가하면서 혈액을 천천히 철회하십시오.
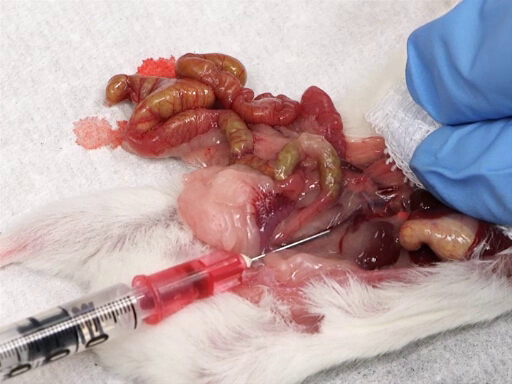
그림 4. 후방 베나 카바에서 혈액 철수.
쥐와 쥐에 대한 혈액 수집은 다양한 기술로 달성 될 수있다. 샘플 크기, 샘플링 빈도 및 동물의 크기와 나이와 같은 많은 요인이 영향을 미치지만 가장 중요한 구성 요소는 샘플 수집을 수행하는 기술자의 기술 수준입니다. 여기에 설명된 방법에 대해 마취제의 적절한 사용은 양질의 샘플과 동물의 웰빙에도 중요합니다.
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved