0:01
Concepts
3:01
Coating and Blocking the Plate
4:42
Plating and Activating Cells
7:05
Detection
9:03
Substrate
10:01
Data Acquisition and Analysis
11:07
Results
Test ELISPOT : Détection des splénocytes sécrétants l'IFNgamma
Source: Tonya J. Webb1
1 Département de microbiologie et d'immunologie, University of Maryland School of Medicine et Marlene and Stewart Greenebaum Comprehensive Cancer Center, Baltimore, Maryland 21201
ELISPOT est un test standardisé et reproductible utilisé pour détecter les réponses immunitaires cellulaires. L'essai utilise une méthode d'analyse immunosorbent liée à l'enzyme (ELISA) pour détecter les réponses immunitaires à cellule unique qui peuvent être visualisées par taches, d'où le nom ELISPOT. ELISPOT a été décrit pour la première fois en 1983, par Czerkinsky, comme méthode d'énumération du nombre d'hybridomas à cellules B produisant des immunoglobulines spécifiques à l'antigène (1). Le même groupe a développé le résultat pour mesurer la fréquence des lymphocytes T produisant de la cytokine. Maintenant ELISPOT est devenu une norme d'or pour mesurer l'immunité des lymphocytes T spécifiques à l'antigène dans les essais cliniques et les candidats vaccins. Par exemple, après la vaccination ou lors d'une infection, les cellules plasmatiques et les cellules de la mémoire B sécrètent des anticorps qui assurent une protection. Typiquement, ces réponses de cellules de B sont évaluées en mesurant des titers de sérum des anticorps antigène-spécifiques. Cependant, ce type d'analyse, généralement mesurée par ELISA, peut ne pas inclure les cellules de mémoire B, qui peuvent être présentes même en l'absence de niveaux d'anticorps sériques détectables. En outre, il a été bien établi que les cellules de mémoire B circulantes sont importantes pour la réponse rapide et protectrice d'anticorps observée après la réexposition d'agent pathogène, ainsi il est essentiel d'être en mesure de détecter ces cellules. Par conséquent, pour évaluer clairement les réponses de cellules B de mémoire spécifiques à l'antigène, il faut utiliser ELISA et ELISPOT (2).
L'évaluation ELISPOT utilise une plaque contenant des puits doublés de membrane qui sont recouverts d'anticorps afin de capturer les protéines sécrétées d'intérêt. Ensuite, la plaque est chargée de cellules et de stimuli pour induire la production de protéines. Les protéines sécrétées sont capturées par les anticorps enduits à la surface. Après le temps d'incubation approprié, les cellules sont enlevées et la molécule sécrétée est détectée en utilisant un anticorps biotinylated qui est spécifique pour un épitome différent, par rapport à l'anticorps de capture. Ensuite, la peroxidase de streptavidine est ajoutée, suivie de l'ajout d'un substrat qui permet la détection des taches (figure 1). La force de cet analyse est qu'il permet de quantifier le nombre de cellules produisant la protéine d'intérêt. Fait important, on peut évaluer s'il y a des changements dans le nombre total de cellules produisant une protéine spécifique ou si les cellules individuelles au sein d'une population produisent plus de protéines. En outre, il peut fournir des informations sur la cinétique et peut être utilisé pour évaluer l'activation immunitaire globale (stimulation mitogène) par rapport aux réponses spécifiques à l'antigène (simulation d'antigène). L'analyse ELISPOT permettra la détection d'une cellule activée parmi 300 000 cellules suivant une activation mitogène ou spécifique à l'antigène.
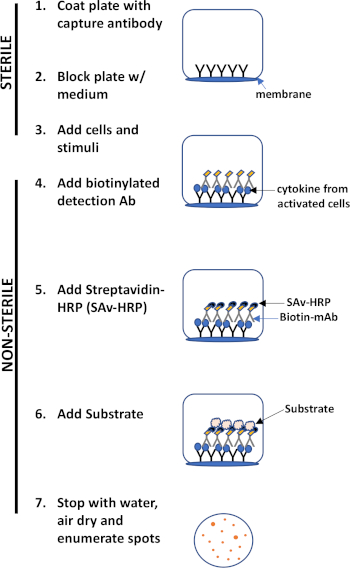
Figure 1 : Aperçu du protocole ELISPOT.
Les principaux avantages de cet exemple sont sa- a. Simplicité- le protocole est relativement simple et simple. Il ne nécessite pas d'expertise technique, b. Sensibilité - il permet la détection des cellules immunitaires au niveau des cellules uniques et nécessite très peu de cellules par rapport à d'autres méthodes telles que la cytométrie du débit, c. Fonctionnalité - il fournit des données quantitatives concernant le système immunitaire fonction.
Cet exercice de laboratoire démontre le protocole ELISPOT pour la détection des splenocytes sécrétion IFN-MD, mais comme mentionné ci-dessus cet analyse peut également être utilisé pour évaluer la sécrétion d'anticorps par les cellules B (3).
1. Mise en place
Buffers et réactifs
- Saline saline (PBS) tamponnée de phosphate stérile sans calcium ni magnésium
- Tampon de revêtement- PBS stérile ou tampon de carbonate
- Assay diluent- 10% sérum bovin fœtal (FBS) en PBS
- Culture cellulaire moyenne- RPMI 1640 avec 10% FBS, pénicilline/streptomycine, et L-glutamine
- Tampon de lavage- PBS contenant 0.05% Tween20
- Eau distillée double (ddH2
Dans cet analyse ELISPOT, les leucocytes spléniques des souris de type sauvage et tumeur-portantes ont été analysés pour IFN-MD. La figure 2 A montre l'image visuelle du résultat de l'analyse. Les nombres dans la couleur verte indiquent le nombre de taches par puits (TNTC indique « trop nombreux pour compter »). Notez que le nombre de taches diminue avec la diminution de la concentration cellulaire.
L'analyse ELISPOT permet d'évaluer l'activation des cellules immunitaires en déterminant le nombre de cellules sécrétant un analyte spécifique. La taille et l'intensité des taches fournissent des informations sur la quantité d'analyte produite par chaque cellule. Le protocole décrit ci-dessus détaille la détection d'une seule cytokine. Cependant, les développements récents ont amélioré l'utilité de cet exemple. Actuellement, on peut utiliser des colorants de détection fluorescents afin de détecter plusie...
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved