0:01
Concepts
3:01
Coating and Blocking the Plate
4:42
Plating and Activating Cells
7:05
Detection
9:03
Substrate
10:01
Data Acquisition and Analysis
11:07
Results
EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Fonte: Tonya J. Webb1
1 Dipartimento di Microbiologia e Immunologia, University of Maryland School of Medicine e Marlene and Stewart Greenebaum Comprehensive Cancer Center, Baltimora, Maryland 21201
ELISPOT è un test standardizzato e riproducibile utilizzato per rilevare le risposte immunitarie cellulari. Il test utilizza un metodo basato su un saggio immunoassorbente enzimatico (ELISA) per rilevare le risposte immunitarie a singola cellula che possono essere visualizzate da macchie, da cui il nome ELISPOT. ELISPOT è stato descritto per la prima volta nel 1983, da Czerkinsky, come un metodo per enumerare il numero di ibridomi a cellule B che producono immunoglobuline antigene-specifiche (1). Lo stesso gruppo ha ulteriormente sviluppato il test per misurare la frequenza dei linfociti T che producono citochine. Ora ELISPOT è diventato un gold standard per misurare l'immunità delle cellule T antigene-specifiche negli studi clinici e nei candidati vaccini. Ad esempio, dopo la vaccinazione o durante un'infezione, le plasmacellule e le cellule B della memoria secernono anticorpi che forniscono protezione. Tipicamente, queste risposte delle cellule B sono valutate misurando i titoli sierici di anticorpi antigene-specifici. Tuttavia, questo tipo di analisi, tipicamente misurata da ELISA, potrebbe non includere le cellule B di memoria, che possono essere presenti anche in assenza di livelli sierici di anticorpi rilevabili. Inoltre, è stato ben stabilito che le cellule B della memoria circolanti sono importanti per la risposta anticorpale rapida e protettiva osservata dopo la ricon esposizione dei patogeni, quindi è fondamentale essere in grado di rilevare queste cellule. Pertanto, per valutare chiaramente le risposte delle cellule B della memoria antigene-specifica, devono essere utilizzati sia ELISA che ELISPOT (2).
Il test ELISPOT utilizza una piastra contenente pozzetti rivestiti di membrana rivestiti di anticorpi al fine di catturare le proteine secrete di interesse. Quindi, la piastra viene caricata con cellule e stimoli per indurre la produzione di proteine. Le proteine secrete vengono catturate dagli anticorpi rivestiti sulla superficie. Dopo un adeguato tempo di incubazione, le cellule vengono rimosse e la molecola secreta viene rilevata utilizzando un anticorpo biotinilato specifico per un epitopo diverso, rispetto all'anticorpo di cattura. Successivamente, viene aggiunta la streptavicina perossidasi, seguita dall'aggiunta di un substrato che consente il rilevamento delle macchie (Figura 1). Il punto di forza di questo test è che consente di quantificare il numero di cellule che producono la proteina di interesse. È importante sottolineare che si può valutare se ci sono cambiamenti nel numero totale di cellule che producono una proteina specifica o se le singole cellule all'interno di una popolazione producono più proteine. Inoltre, può fornire informazioni sulla cinetica e può essere utilizzato per valutare l'attivazione immunitaria complessiva (stimolazione mitogena) rispetto alle risposte antigene-specifiche (simulazione dell'antigene). Il test ELISPOT consentirà di rilevare una cellula attivata tra 300.000 cellule a seguito di attivazione mitogenica o antigene-specifica.
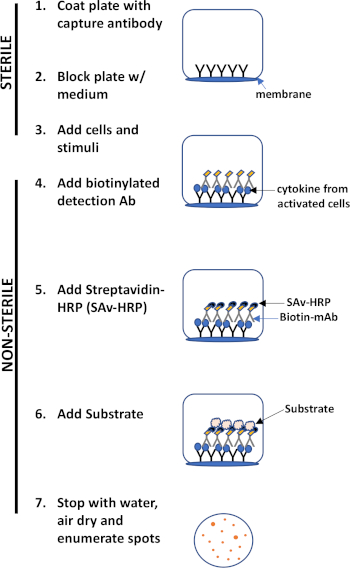
Figura 1: Panoramica del protocollo ELISPOT.
I principali vantaggi di questo test sono il suo- a. Semplicità: il protocollo è relativamente semplice e diretto. Non richiede competenze tecniche, b. Sensibilità- permette il rilevamento di cellule immunitarie a livello di singola cellula e richiede pochissime cellule rispetto ad altri metodi come la citometria a flusso, c. Funzionalità: fornisce dati quantitativi relativi alla funzione immunitaria.
Questo esercizio di laboratorio dimostra il protocollo ELISPOT per il rilevamento di splenociti secernenti IFN-γ, ma come accennato in precedenza questo test può anche essere utilizzato per valutare la secrezione di anticorpi da parte delle cellule B (3).
1. Configurazione
Tamponi e reagenti
- Soluzione salina sterile tamponata con fosfato (PBS) senza calcio o magnesio
- Tampone di rivestimento: PBS sterile o tampone carbonaato
- Diluente di dosaggio- 10% siero bovino fetale (FBS) in PBS
- Terreno di coltura cellulare - RPMI 1640 con 10% FBS, penicillina / streptomicina e L-glutammina
- Tampone di lavaggio - PBS contenente 0,05% Tween20
- Acqua doppia distillata (
In questo test ELISPOT, i leucociti splenici di topi wildtype e portatori di tumore sono stati analizzati per la γ IFN. La Figura 2 A mostra l'immagine visiva del risultato del test. I numeri nel colore verde indicano il numero di macchie per pozzo (TNTC indica "troppo numerosi per contare"). Si noti che il numero di macchie diminuisce con la diminuzione della concentrazione cellulare.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
Il test ELISPOT consente di valutare l'attivazione delle cellule immunitarie determinando il numero di cellule che secernono un analita specifico. La dimensione e l'intensità delle macchie forniscono informazioni sulla quantità di analita prodotta da ciascuna cellula. Il protocollo sopra descritto ha dettagliato il rilevamento di una singola citochina. Tuttavia, i recenti sviluppi hanno migliorato l'utilità di questo test. Attualmente, è possibile utilizzare coloranti fluorescenti per rilevare più analiti all'intern...
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved