0:01
Concepts
3:01
Coating and Blocking the Plate
4:42
Plating and Activating Cells
7:05
Detection
9:03
Substrate
10:01
Data Acquisition and Analysis
11:07
Results
Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Fonte: Tonya J. Webb1
1 Departamento de Microbiologia e Imunologia, Faculdade de Medicina da Universidade de Maryland e o Centro de Câncer Integral Marlene e Stewart Greenebaum, Baltimore, Maryland 21201
ELISPOT é um ensaio padronizado e reprodutível usado para detectar respostas imunes celulares. O ensaio utiliza um ensaio imunossorbente ligado à enzima (ELISA) para detectar respostas imunes unicelulares que podem ser visualizadas por manchas, daí o nome ELISPOT. Elispot foi descrito pela primeira vez em 1983, por Czerkinsky, como um método de enumerar o número de híbridos de células B produzindo imunoglobulinas específicas de antígeno (1). O mesmo grupo desenvolveu o ensaio para medir a frequência de linfócitos T produtores de citocinas. Agora elispot tornou-se um padrão-ouro para medir a imunidade de células T específica de antígeno em ensaios clínicos e candidatos a vacinas. Por exemplo, após a vacinação ou durante uma infecção, células plasmáticas e células B de memória secretam anticorpos que fornecem proteção. Normalmente, essas respostas de células B são avaliadas medindo títulos de soro de anticorpos específicos de antígeno. No entanto, esse tipo de análise, tipicamente medida pela ELISA, pode não incluir células B de memória, que podem estar presentes mesmo na ausência de níveis detectáveis de anticorpos séricos. Além disso, foi bem estabelecido que as células B da memória circulante são importantes para a resposta rápida e protetora de anticorpos observada após a reexposição do patógeno, portanto, é fundamental ser capaz de detectar essas células. Portanto, para avaliar claramente as respostas de células B de memória específicas do antígeno, tanto a ELISA quanto o ELISPOT devem ser utilizados (2).
O ensaio ELISPOT usa uma placa contendo poços forrados de membrana que são revestidos com anticorpos, a fim de capturar proteínas secretas de interesse. Em seguida, a placa é carregada com células e estímulos para induzir a produção de proteínas. As proteínas secretas são capturadas pelos anticorpos revestidos na superfície. Após o tempo de incubação apropriado, as células são removidas e a molécula secretada é detectada usando um anticorpo biotinilado que é específico para um epítope diferente, em comparação com o anticorpo de captura. Em seguida, é adicionado streptavidin peroxidase, seguido pela adição de um substrato que permite a detecção das manchas (Figura 1). A força deste ensaio é que permite quantificar o número de células que produzem a proteína de interesse. É importante avaliar se há mudanças no número total de células que produzem uma proteína específica ou se as células individuais dentro de uma população estão produzindo mais proteína. Além disso, pode fornecer informações sobre cinética e pode ser usado para avaliar a ativação imune global (estimulação mitogótica) em relação às respostas específicas do antígeno (simulação de antígeno). O ensaio ELISPOT permitirá a detecção de uma célula ativada entre 300.000 células após ativação mitogênica ou específica de antígeno.
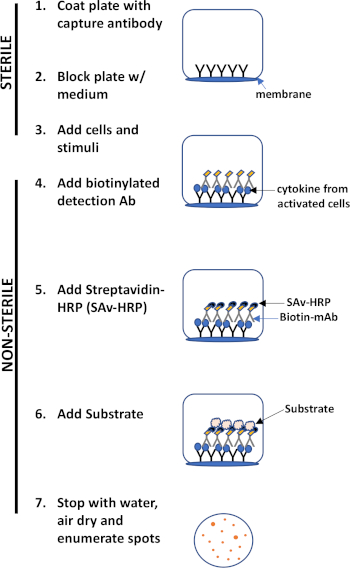
Figura 1: Visão geral do protocolo ELISPOT.
As principais vantagens deste ensaio são suas. Simplicidade- o protocolo é relativamente simples e simples. Não requer perícia técnica, b. Sensibilidade- permite a detecção de células imunes no nível único celular e requer muito poucas células em comparação com outros métodos como citometria de fluxo, c. Funcionalidade- fornece dados quantitativos sobre a função imunológica.
Este exercício de laboratório demonstra o protocolo ELISPOT para detecção de ifn-γ secretando splenócitos, mas como mencionado acima deste ensaio também pode ser usado para avaliar a secreção de anticorpos por células B (3).
1. Configuração
Tampões e reagentes
- Salina tamponada de fosfato estéril (PBS) sem cálcio ou magnésio
- Tampão de revestimento- PBS estéril ou tampão de carbonato
- Ensaio diluído- 10% soro bovino fetal (FBS) na PBS
- Cultura celular média- RPMI 1640 com 10% de FBS, penicilina/estreptomicina, & L-glutamina
- Tampão de lavagem- PBS contendo 0,05% Tween20
- Dupla água destilada (ddH2O) ...
Neste ensaio ELISPOT, leucócitos esplênicos de camundongos selvagens e portadores de tumores foram analisados para ifn-γ. A Figura 2 A mostra a imagem visual do resultado do ensaio. Os números na cor verde indicam o número de pontos por poço (TNTC indica "numeroso demais para contar"). Observe que o número de manchas diminui com a diminuição da concentração celular.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
O ensaio ELISPOT permite avaliar a ativação de células imunes determinando o número de células que secretam um analito específico. O tamanho e intensidade das manchas fornece informações sobre a quantidade de analito que está sendo produzida por cada célula. O protocolo descrito acima detalhava a detecção de uma única citocina. No entanto, os desenvolvimentos recentes melhoraram a utilidade deste ensaio. Atualmente, pode-se usar corantes fluorescentes de detecção para detectar vários analitos dentro de um...
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved