0:01
Concepts
3:01
Coating and Blocking the Plate
4:42
Plating and Activating Cells
7:05
Detection
9:03
Substrate
10:01
Data Acquisition and Analysis
11:07
Results
Ensayo ELISPOT: Detección de esplenocitos secretores de IFN-γ
Fuente: Tonya J. Webb1
1 Departamento de Microbiología e Inmunología, Facultad de Medicina de la Universidad de Maryland y el Centro Integral del Cáncer Marlene y Stewart Greenebaum, Baltimore, Maryland 21201
ELISPOT es un ensayo estandarizado y reproducible que se utiliza para detectar respuestas inmunitarias celulares. El ensayo utiliza un método basado en el ensayo inmunoabsorbente ligado a enzimas (ELISA) para detectar respuestas inmunitarias de una sola célula que pueden ser visualizadas por manchas, de ahí el nombre ELISPOT. ELISPOT fue descrito por primera vez en 1983, por Czerkinsky, como un método para enumerar el número de hibridaomas de células B que producen inmunoglobulinas específicas de antígenos (1). El mismo grupo desarrolló el ensayo para medir la frecuencia de los linfocitos T productores de citoquinas. Ahora ELISPOT se ha convertido en un estándar de oro para medir la inmunidad de células T específicas de antígenos en ensayos clínicos y candidatos a vacunas. Por ejemplo, después de la vacunación o durante una infección, las células plasmáticas y las células B de memoria secretan anticuerpos que proporcionan protección. Por lo general, estas respuestas de células B se evalúan midiendo los valoradores séricos de anticuerpos específicos de antígenos. Sin embargo, este tipo de análisis, normalmente medido por ELISA, puede no incluir células de memoria B, que pueden estar presentes incluso en ausencia de niveles de anticuerpos séricos detectables. Además, se ha establecido que las células B de memoria circulante son importantes para la respuesta rápida y protectora de anticuerpos observada después de la reexposición de patógenos, por lo que es fundamental poder detectar estas células. Por lo tanto, para evaluar claramente las respuestas de células B de memoria específica del antígeno, se deben utilizar TANTO ELISA como ELISPOT (2).
El ensayo ELISPOT utiliza una placa que contiene pozos revestidos de membrana que están recubiertos con anticuerpos con el fin de capturar proteínas secretas de interés. Luego, la placa se carga con células y estímulos para inducir la producción de proteínas. Las proteínas secretadas son capturadas por los anticuerpos recubiertos en la superficie. Después del tiempo de incubación adecuado, las células se eliminan y la molécula secretada se detecta mediante el uso de un anticuerpo biotinilado que es específico para un epítopo diferente, en comparación con el anticuerpo de captura. A continuación, se añade la estreptavidina peroxidasa, seguida de la adición de un sustrato que permite la detección de las manchas (Figura 1). La fuerza de este ensayo es que permite cuantificar el número de células que producen la proteína de interés. Es importante destacar que se puede evaluar si hay cambios en el número total de células que producen una proteína específica o si las células individuales dentro de una población están produciendo más proteína. Además, puede proporcionar información sobre la cinética y se puede utilizar para evaluar la activación inmune general (estimulación de mitogenos) en relación con las respuestas específicas del antígeno (simulación de antígeno). El ensayo ELISPOT permitirá la detección de una célula activada entre 300.000 células después de la activación mitogénica o específica del antígeno.
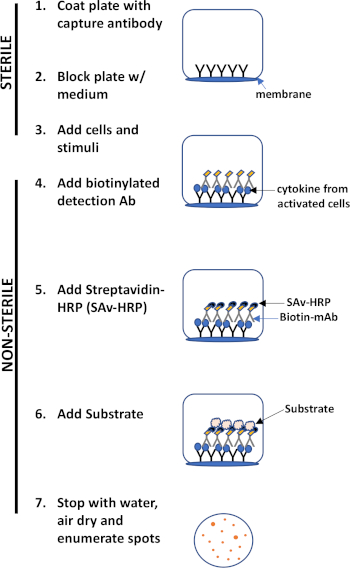
Figura 1: Descripción general del protocolo ELISPOT.
Las principales ventajas de este ensayo son su- a. Simplicidad - el protocolo es relativamente simple y directo. No requiere experiencia técnica, b. Sensibilidad- permite la detección de células inmunitarias a nivel de células únicas y requiere muy pocas células en comparación con otros métodos como la citometría de flujo, c. Funcionalidad- proporciona datos cuantitativos con respecto al inmune Función.
Este ejercicio de laboratorio demuestra el protocolo ELISPOT para la detección de esplenocitos secretos de IFN-o, pero como se mencionó anteriormente este ensayo también se puede utilizar para evaluar la secreción de anticuerpos por células B (3).
1. Configuración
Búferes y reactivos
- Salina estéril con fosfato (PBS) sin calcio o magnesio
- Tampón de recubrimiento: PBS estéril o tampón de carbonato
- Ensayo diluyente- 10% suero bovino fetal (FBS) en PBS
- Cultivo celular medio- RPMI 1640 con 10% FBS, penicilina/estreptomicina, y L-glutamina
- Tampón de lavado- PBS que contiene 0.05% Tween20
- Agua destilada doble (ddH2O)
- Sustra...
En este ensayo ELISPOT, se analizaron leucocitos esplénicos de ratones de tipo salvaje y tumores para ifN-o. La figura 2 A muestra la imagen visual del resultado del ensayo. Los números en el color verde indican el número de puntos por pozo (TNTC indica "demasiado numerosos para contar"). Observe que el número de manchas disminuye con la disminución de la concentración celular.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
El ensayo ELISPOT permite evaluar la activación de las células inmunitarias determinando el número de células que segregan un analito específico. El tamaño y la intensidad de las manchas proporciona información sobre la cantidad de analito que produce cada célula. El protocolo descrito anteriormente detallaba la detección de una sola citoquina. Sin embargo, los acontecimientos recientes han mejorado la utilidad de este ensayo. Actualmente, se pueden utilizar colorantes de detección fluorescentes para detectar m...
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved