0:01
Concepts
3:25
Immunoprecipitation Using Protein A/G Plus Agarose Beads
8:18
IP Verification Through Western Blot Analysis
12:36
Results
טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
מקור: סוזנה סי. שיסלר1, טוניה ג'יי ווב1
המחלקה למיקרוביולוגיה ואימפונולוגיה, אוניברסיטת מרילנד, בולטימור, MD 21201
אימונופרציפיטציה (IP, הידועה גם בשם "משיכה למטה" היא טכניקה נפוצה שיש לה יישומים במגוון תחומים. הוא נוצר לראשונה בשנת 1984, והוא שופר בשנת 1988 (1, 2). המטרה הבסיסית של IP היא טיהור ובידוד של חלבון מסוים באמצעות נוגדן נגד חלבון זה. המילה "אימונו" מתייחסת לשימוש בנוגדן בעוד המילה "משקעים" מתייחסת למשיכת חומר מסוים מפתרון. חלבון המטרה עשוי להיות אנדוגני או רקומביננטי. רוב החלבונים רקומביננטיים יש תג epitope (כלומר myc או דגל) מחובר אליהם כדי לפשט את הטיהור הבא. בדרך כלל, קל יותר לייעל IP חלבון רקומביננטי כי הנוגדנים נגד תגי אפיטופ רקומביננטי הם חזקים מאוד ויעילים. נוגדנים נגד חלבונים אנדוגניים יש יעילות משתנה מאוד - מה שהופך את זה הרבה יותר קשה לייעל IPs אלה. צעד הכרחי לאחר אימונופרציפיטציה הוא אימות של טיהור. החלבון המבודד נפתר באמצעות SDS-PAGE ולאחר מכן נבדק לטוהר על ידי כתמים מערביים (איור 1). שליטה חשובה היא שימוש בנוגדן אחר במהלך כתם המערב כדי לאמת משיכה של החלבון הנכון. השילוב של IP עם טכניקות עוקבות הוא כלי ניתוח רב עוצמה. המטרה לאחר הטיהור עשויה להיות אפיון החלבון עצמו על ידי NMR, ספקטרומטריית מסה ובוחן, או ניתוח של השותפים לאינטראקציה של החלבון (כלומר חלבון, DNA, RNA) (3, 4, 5).
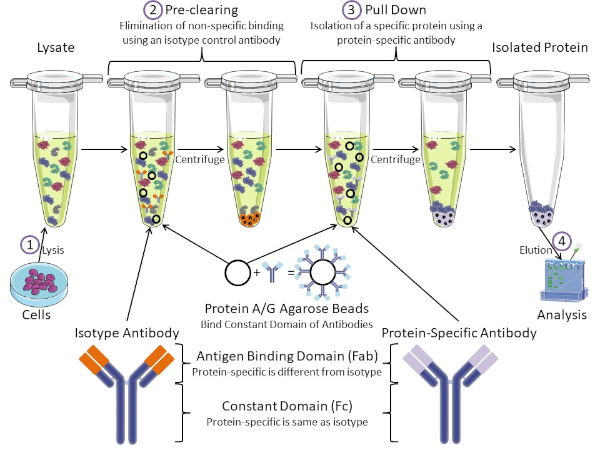
איור 1: סקירה כללית של הליך האימונופרנציה. אימונופרציפיטציה היא בידוד של חלבון מסוים באמצעות נוגדן. לאחר ייצור של ליסאט מהתאים, ישנם שני שלבים עיקריים- ניקוי מראש ומשיכה למטה. במהלך שלב טרום ניקוי, תאי-lysates מנוקים מראש של חלבונים שנקשרים נוגדנים שאינם במיוחד באמצעות נוגדן בקרת איזוטיפ. בצעד למטה, חלבון היעד נמשך למטה באמצעות נוגדן ספציפי לחלבון. לאחר מכן מנתחים את החלבון המבודד על ידי כתם מערבי. נוגדני איזוטיפ ונוגדנים ספציפיים לחלבון הם בעלי אותו תחום קבוע, אך תחומים שונים של כריכת אנטיגן. מרכיב מרכזי בפרוטוקול זה הוא חרוזי אגרוז חלבון A/G הקושרים את התחום הקבוע של נוגדנים - ומאפשרים אימונופרציפיטציה של חלבון היעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
נוגדנים הם המרכיב העיקרי של אימונופרציפיטציה המבדילה אותו מצורות אחרות של טיהור חלבונים (כלומר טיהור עמודת זיקה לניקל). נוגדנים הם מולקולות המיוצרות על ידי תאי B שיכולות לזהות אפיטופים ספציפיים של חלבון. לנוגדנים יש שני תחומים: קבוע (Fc) ואנטיגן מחייב (Fab) (איור 1). התחום הקבוע מזהה את סוג הנוגדן ומכתיב פונקציה ב vivo. בדרך כלל, התחומים הקבועים של נוגדנים המשמשים IP הם עכבר, חולדה, או ארנב IgG. החלק המחייב של האנטיגן בנוגדן מזהה אפיטופ ספציפי של חלבון מסוים. נוגדנים יכולים לזהות אפיטופים על חלבונים מקופלים שאולי לא קיימים כאשר החלבון מושחת ולהיפך. לכן, הזמינות של האפיטופ תלויה קיפול חלבון - זיהוי גורם חשוב שיש לקחת בחשבון בעת בחירת נוגדנים ותנאים עבור IP.
הן למערכות פרוקריוטיות והן למערכות אאוקריוטיות יש חלבונים מחייבי נוגדנים. במערכות אאוקריוטיות, המטרה היא הגנה חיסונית מפני חיידקים בעוד במערכות פרוקריוטיות, המטרה היא הגנה מפני המערכת החיסונית. חלבונים מחייבי נוגדנים משפיעים על מתודולוגיית הקניין הרוחני בשתי דרכים. ראשית, יש צורך בצעד הכרחי לפני הסליקה (איור 1) כדי לפטור את הריסאט מחלבונים שקושרים נוגדנים - ובכך להפחית כריכה לא ספציפית במוצר הסופי. שלב זה משתמש בנוגדן איזוטיפ בעל אותו תחום קבוע כמו תחום מחייב נוגדנים שונה מאשר הנוגדן הספציפי לחלבון שלך. חלבונים מחייבי נוגדנים חיידקיים הם המרכיב המרכזי השני בשיטה זו. לאחר שהנוגדן הספציפי לחלבון קושר את חלבון המטרה, יש להוריד את קומפלקס החלבון (איור 1). חלבונים A, G ו- L הם חלבונים חיידקיים הקושרים את התחום הקבוע של נוגדנים. בעוד חיידקים להשתמש בזה כדי לחתור תחת המערכת החיסונית, החוקרים בחרו יחד מערכת זו לטיהור נוגדנים קל, והוא משמש הן במהלך השלבים לפני ניקוי ומשיכה למטה. חלבונים אלה יש זיקה מחייבת שונה עבור מינים שונים ותת-סוגים שונים של תחום קבוע - גורם נוסף שיש לקחת בחשבון בעת בחירת תנאים עבור IP. חברות רבות מוכרות חרוזי חלבון A/G המסומנים באגרוז (איור 1), עמודות ספין מראש או שרבפים להכנת עמודות. באופן כללי, חרוזים ועמודות ספין משמשים לגדלי מדגם קטנים יותר בעוד שריפים משמשים לטיהור בתפזורת.
בתרגיל מעבדה זה, אנו מדגימים כיצד לטהר את החלבון האנדוגני C-myc, מתימושיטים מורינים ראשוניים, באמצעות חרוזי חלבון A/G Plus agarose המבוססים על טכניקת אימונופרציפיטציה בסיסית. הפרוטוקול מתחיל מהכנת ליסאט התא ומסתיים באימות של משיכת חלבון מוצלחת למטה באמצעות ניתוח כתם מערבי.
1. אימונופרציפיטציה באמצעות חרוזי אגרוז A/G PLUS של חלבון A/G PLUS
הכנת ליסאט תא
- צנטריפוגה 108 תימוקיטים במיקרוצנטריפוגה ב-13,000 סל"ד למשך 3 דקות ומסירים את הסופר-נט.
הערה: מספר התא ישתנה בהתאם לרמות הביטוי של החלבון הרצוי וסוג התא הנבחר. ...
תוצאות ההליך המפורט לעיל מוצגות באיור 2. משמאל לימין, הנתיבים מכילים את קבוצת הביקורת (איזוטיפ), את קבוצת הבדיקה (c-myc), את ליסאט שפונה מראש (ליסאט) ואת סולם המשקל המולקולרי (סולם). רצועות הסולם של 25 ו-75 kDa מסומנות. שתי הרצועות הבולטות ב- ~ 25 kDa ו - 50 kDa הן השרשרת הקלה והכבדה של הנוגד...
בקיצור, אימונופרציפיטציה היא בידוד של חלבון מסוים באמצעות נוגדן. בדוגמה זו, התוצאות של אימונופרציפיטציה נותחו על ידי כתם מערבי כדי להעריך את הטוהר. החלבון המבודד יכול לשמש במספר יישומים לאחר מכן כולל: NMR למבנה חלבון, ספקטרומטריית מסה לרצף חומצות אמינו, או בדיקות במבחנה לאפיון אנזימטי....
- Olliver, C. L. and Boyd, C. D. (1984). Immunoprecipitation of In Vitro Translation Products with Protein A Bound to Sepharose. In J. M. Walker (eds), Nucleic Acids. Methods in Molecular Biology (pp. 157-160). New Jersey: Humana Press.
- Thurston, C. F. and Henley, L. F. (1988). Direct Immunoprecipitation of Protein. In J. M. Walker (eds), New Protein Techniques. Methods in Molecular Biology (pp. 149-158). New Jersey: Humana Press.
- Anderson, N. G. (1998). Co-immunoprecipitation: Identification of Interacting Proteins. In R. A. Clegg (eds), Protein Targeting Protocols.Methods in Molecular Biology (pp. 35-45). New Jersey: Humana Press.
- Jackson, D. I. and Dickson, C. (1999). Protein Techniques: Immunoprecipitation, In Vitro Kinase Assays, and Western Blotting. In P.T. Sharpe and I. Mason (eds), Molecular Embryology. Methods in Molecular Biology (pp. 699-708). New Jersey: Humana Press.
- Trieu, E. P. and Targoff, I. N. (2015). Immunoprecipitation: Western Blot for Proteins of Low Abundance. In B. Kurien and R. Scofield (eds), Western Blotting. Methods in Molecular Biology (pp. 327-342). New York, NY: Humana Press.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved