0:01
Concepts
4:08
Preparation of Plates and Bacteria
6:04
Determining MIC Using E-Test
7:01
Synergy Testing: Cross Approach
7:47
Synergy Testing: Non-Cross Approach
8:56
MIC Determination Using Broth Dilution
10:33
Data Analysis: Broth Microdilution
11:10
Data Analysis and Results: Synergy Testing
抗生素敏感性测试:Epsilo计测试,以确定两种抗生素的MIC值,并评估抗生素协同效应
资料来源:安娜·布吕克伯格1, 罗尔夫·卢德1
1临床科学系 隆德,感染医学系,生物医学中心,隆德大学,221 00 隆德瑞典
了解抗生素和细菌之间的相互作用对于了解微生物如何进化抗生素耐药性非常重要。1928年,亚历山大·弗莱明发现了青霉素,一种通过干扰细胞壁再生来发挥抗菌作用的抗生素(1)。随后发现了其他具有不同作用机制的抗生素,包括抑制细菌DNA复制和蛋白质转化的药物;然而,近年来没有开发任何新的抗生素。对现行抗生素的耐药性一直在增加,导致无法有效治疗的严重传染病(2)。在这里,我们描述了几种评估细菌群抗生素耐药性的方法。这些方法中的每一个都有效,无论所使用的抗生素的作用机制如何,因为细菌死亡是测量的结果。抗生素耐药性不仅通过医院环境迅速传播,而且在全社会迅速传播。为了研究这种抗性手段,已经开发出了不同的方法,包括Epsilo计测试(E测试)和肉汤稀释试验(3)。
电子测试是一种公认的方法,是一种具有成本效益的工具,可量化最小抑制浓度 (MIC) 数据,这是抑制微生物可见生长的抗菌素的最低浓度。根据所使用的细菌菌株和抗生素,MIC 值在子 μg/mL 到 >1000 μg/mL (4) 之间可能有所不同。E-test 使用包含预定义的抗生素梯度的塑料条进行,该塑料条以 μg/mL 为单位与 MIC 读数表一起印记。当应用于接种琼脂板时,该条带直接在琼脂基质上传输。孵育后,随着细菌生长的预防,沿带可见对称的椭圆抑制区。MIC 由抑制区域定义,该区域是椭圆与条带相交的端点。另一种确定MIC的常见方法是微溴稀释法。微溴稀释含有不同浓度的抗菌剂添加到含有接种细菌的汤培养基中。孵育后,MIC被定义为阻止可见生长的最低浓度抗生素(5)。它也是一种定量方法,可应用于多种细菌。该方法的缺点包括制备试剂浓度时可能存在错误,以及实验所需的大量试剂。从临床和研究的角度衡量抗生素耐药性是必须的,下面将讨论并展示这些研究耐药性的体外方法。
可以应用特定细菌的耐药性概况,以优化抗生素治疗,以确定患者是否会受益于联合治疗与单一治疗。对于一次使用多个抗生素,必须了解它们之间的相互作用,以及它们是否具有添加剂、协同或对抗作用。当抗生素的关节效应等于以等剂量给予的单个抗生素的效力时,可以看到添加剂效应。另一方面,当抗生素的联合作用比单独给予药物更有效时,抗生素之间的协同作用就存在(6)。应用抗菌治疗组合,避免抗菌素耐药性的发生,从而增强单个抗生素治疗的效果(7)。对抗知识对于防止不必要地使用抗菌素组合也同样重要。电子测试方法提供了简单和多种方法,以确定不同抗菌剂之间可能的协同作用和对抗。为了面对抗生素耐药病原体的扩散,了解某些抗生素的可能协同和对抗机制对于临床疗效和对抗多药耐药性非常重要。
使用电子测试确定协同效应可以分为两大类:交叉测试和非交叉测试。虽然这两种协同测试都依赖于以前对各个 MIC 值的了解,但两种方法在方法和概念方法上略有不同。在非交叉协同测试中,被测试的对中的第一个抗生素被放置在接种细菌的琼脂板上。允许从第一条中注入板中的抗生素(例如,在 1 小时后),去除该条,并将包含第二种抗生素的新条放在与第一个抗生素完全相同的位置,确保将两个单独的 MIC 值放在每个 ot 的顶部她。然后,可以按上述方式分析产生的抑制区,并根据公式 1 计算协同效应。
公式 1 - 分数抑制浓度 (FIC)
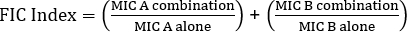
值 >0.5 显示了协同效应。
虽然用易于分析的板来奖励考官,但由于条带的变化,以及每个实验需要使用两个板,这种方法有些费力和费时。相反,通常采用交叉测试。而不是添加两个不同的电子测试条随后彼此的顶部(删除第一个后),两者同时放置,但以十字(90° 角)的形式,与两个先前确定的MIC值形成90°角。通过这种方法,每个协同测试只需要一个板,而且工作更少,尽管分析起来稍微困难一些,但还是成为首选。组合抗生素方法中新的MIC值可以可视化为经过修饰的抑制区,之后可以通过公式1确定协同效应。
角)的形式,与两个先前确定的MIC值形成90°角。通过这种方法,每个协同测试只需要一个板,而且工作更少,尽管分析起来稍微困难一些,但还是成为首选。组合抗生素方法中新的MIC值可以可视化为经过修饰的抑制区,之后可以通过公式1确定协同效应。
微broth方法通常具有更高的灵活性(例如,在电子测试条限制之外选择特定浓度的抗生素的能力),而不是使用琼脂板方法,通常可以优先使用。此外,微broth测试建议更敏感,因为它们在液体溶液中均匀分布抗生素,而不是取决于固体相(琼脂板)内的解散。96孔微孔中的孔将接种一组细菌(106 cfu/mL:细菌浓度可通过OD600 nm测量、浊度标准或从10倍细菌系列稀释中传播电镀样品来估计),以及不同稀释液中的抗生素将被添加到井中。同样,对于电子测试条,MIC被确定为与抗生素浓度最低抑制细菌可见生长的交叉点(井/点)。
实验目标
- 以下项目描述了通过两种不同的方法确定青霉素G和链球菌组G的基母菌素的MIC值的策略,即电子测试和微溴稀释。在电子测试中,用G链球菌组接种的Mueller-Hinton琼脂板与青霉素G和/或文母素的梯度条结合使用;而MH-broth与50%溶化马血和20mg/mLβ-NAD一起使用可溶性抗生素与链球菌组G在微broth方法。
材料
- 血琼脂板上的细菌菌落,在4°C中储存<7天
- 血琼脂板
- 0.5 麦克法兰标准
- 1% 巴克莱2
- 1% H2SO4
- 盐管 (2 mL)
- 棉尖施用器
- 穆勒-欣顿琼脂板(MHA板)
- 含有50%裂裂马血和20mg/mL +-NAD(MH-F)的MH肉汤
- 电子测试青霉素/金霉素(或感兴趣的抗生素)(BioMerieux,马西埃托莱,法国,瑞典)
- 抗生素青霉素/青霉素(或感兴趣的抗生素(粉末/溶液))
注意:用于细菌生长的特定介质可能因不同物种而异。
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved