0:01
Concepts
4:08
Preparation of Plates and Bacteria
6:04
Determining MIC Using E-Test
7:01
Synergy Testing: Cross Approach
7:47
Synergy Testing: Non-Cross Approach
8:56
MIC Determination Using Broth Dilution
10:33
Data Analysis: Broth Microdilution
11:10
Data Analysis and Results: Synergy Testing
Tests de sensibilité aux antibiotiques : Utilisation du ETEST pour déterminer la CMI de deux antibiotiques et évaluer la synergie des antibiotiques
Source: Anna Blàckberg1, Rolf Lood1
1 Département des sciences cliniques Lund, Division de médecine de l'infection, Centre biomédical, Université de Lund, 221 00 Lund Suède
La connaissance des interactions entre les antibiotiques et les bactéries est importante pour comprendre comment les microbes évoluent la résistance aux antibiotiques. En 1928, Alexander Fleming découvre la pénicilline, un antibiotique qui exerce sa fonction antibactérienne en interférant avec la régénération de la paroi cellulaire (1). D'autres antibiotiques avec divers mécanismes d'action ont été découverts par la suite, y compris des médicaments qui inhibent la réplication de l'ADN et la traduction des protéines chez les bactéries; cependant, aucun nouvel antibiotique n'a été développé ces dernières années. La résistance aux antibiotiques actuels a augmenté, ce qui a entraîné des maladies infectieuses graves qui ne peuvent pas être traitées efficacement (2). Ici, nous décrivons plusieurs méthodes pour évaluer la résistance aux antibiotiques dans les populations bactériennes. Chacune de ces méthodes fonctionne, quel que soit le mécanisme d'action des antibiotiques utilisés, parce que la mort bactérienne est le résultat mesuré. La résistance aux antibiotiques est non seulement rapidement disséminée spécifiquement dans les milieux hospitaliers, mais aussi dans toute la société. Afin d'étudier de tels moyens de résistance, différentes méthodes ont été développées, y compris le test Epsilomètre (E-test) et le test de dilution du bouillon (3).
Le test électronique est une méthode bien établie et un outil rentable qui quantifie les données de concentration inhibitrice minimale (MIC), la plus faible concentration d'un antimicrobien qui inhibe la croissance visible d'un micro-organisme. Selon la souche bactérienne et les antibiotiques utilisés, la valeur du MIC peut varier entre le sous-g/mL et le 4. Le test Électronique est effectué à l'aide d'une bande de plastique contenant un gradient antibiotique prédéfini, qui est imprimé avec l'échelle de lecture du MIC en 'g/mL. Cette bande est directement transférée sur la matrice d'agar lorsqu'elle est appliquée sur la plaque d'agar inoculée. Après l'incubation, une zone d'inhibition elliptique symétrique est visible le long de la bande à mesure que la croissance bactérienne est empêchée. LE MIC est défini par la zone d'inhibition, qui est le point de terminaison où l'ellipse croise la bande. Une autre méthode courante pour déterminer LE MIC est la méthode de dilution des microbroths. La dilution du microbroth incorpore différentes concentrations de l'agent antimicrobien ajouté à un milieu bouillon contenant des bactéries inoculées. Après l'incubation, le MIC est défini comme la plus faible concentration d'antibiotiques qui empêche la croissance visible (5). Il s'agit également d'une méthode quantitative qui peut être appliquée à plusieurs bactéries. Les inconvénients de cette méthode comprennent la possibilité d'erreurs lors de la préparation des concentrations des réactifs et le grand nombre de réactifs requis pour l'expérience. La mesure de la résistance aux antibiotiques est impérative du point de vue clinique et de la recherche, et ces méthodes in vitro d'étude de la résistance sont discutées et présentées ci-dessous.
Le profil de résistance pour une bactérie spécifique peut être appliqué afin d'optimiser le traitement antibiotique afin de déterminer si un patient bénéficierait d'un traitement combiné par rapport à un traitement unique. Pour l'utilisation de plus d'un antibiotique à la fois, il est impératif de connaître leurs interactions les uns avec les autres et s'ils ont un effet additif, synergique ou antagoniste. Un effet additif peut être vu lorsque l'effet articulaire des antibiotiques équivaut à la puissance des antibiotiques individuels administrés à dose égale. La synergie entre les antibiotiques, d'autre part, est présente lorsque l'effet articulaire des antibiotiques est plus puissant que si le médicament serait administré seul (6). L'application de combinaisons de traitement antimicrobien est utilisée pour éviter l'apparition de la résistance aux antimicrobiens afin d'améliorer l'effet du traitement antibiotique individuel (7). La connaissance de l'antagonisme est également aussi importante pour prévenir l'utilisation inutile de combinaisons d'antimicrobiens. La méthodologie de test électronique offre des moyens simples et de plusieurs façons de déterminer la synergie et l'antagonisme possibles entre les différents agents antimicrobiens. Afin de faire face à la prolifération des agents pathogènes résistants aux antibiotiques, la connaissance des mécanismes synergiques et antagonistes possibles de certains antibiotiques est importante, ce qui entraîne une efficacité clinique et lutte contre la multirésistance aux médicaments.
La détermination de la synergie à l'aide des tests e peut être divisée en deux approches générales : les tests croisés et non croisés. Bien que les deux tests de synergie s'appuient sur la connaissance antérieure des valeurs individuelles du MIC, les deux approches sont légèrement différentes en méthodologie et en approche conceptuelle. Dans un test de synergie non croisé, le premier antibiotique de la paire à être testé est placé sur une plaque d'agar inoculée avec des bactéries. Après avoir permis aux antibiotiques de la première bande infuser la plaque (par exemple après 1 heure), la bande est enlevée et une nouvelle bande contenant le deuxième antibiotique est placé au même endroit que le premier, en veillant à placer les deux valeurs MIC individuelles sur le dessus de chaque ot son. La zone d'inhibition qui en résulte peut ensuite être analysée comme décrite ci-dessus, et la synergie calculée sur la base de l'équation 1.
Équation 1 - Concentrations inhibitrices fractionnelles (FIC)
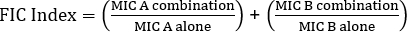
Les valeurs de la marque sont des valeurs qui démontrent une synergie.
Tout en récompensant l'examinateur avec des plaques faciles à analyser, la méthode est un peu laborieuse et longue en raison du changement de bandes, ainsi que la nécessité d'utiliser deux plaques par expérience. Au lieu de cela, un test croisé est souvent utilisé. Au lieu d'ajouter les deux bandes d'essai E différentes par la suite sur l'autre (après l'enlèvement de la première), les deux sont placés simultanément, mais sous la forme d'une croix (angle de 90 degrés), avec les deux valeurs MIC précédemment déterminées formant l'angle de 90 degrés. Par cette approche, une seule plaque est nécessaire par test de synergie, ainsi que moins de travail, ce qui en fait un choix préféré en dépit d'être un peu plus difficile à analyser. Les nouvelles valeurs du MIC dans l'approche combinée des antibiotiques peuvent être visualisées comme les zones d'inhibition modifiées, après quoi la synergie peut être déterminée par l'équation 1.
l'enlèvement de la première), les deux sont placés simultanément, mais sous la forme d'une croix (angle de 90 degrés), avec les deux valeurs MIC précédemment déterminées formant l'angle de 90 degrés. Par cette approche, une seule plaque est nécessaire par test de synergie, ainsi que moins de travail, ce qui en fait un choix préféré en dépit d'être un peu plus difficile à analyser. Les nouvelles valeurs du MIC dans l'approche combinée des antibiotiques peuvent être visualisées comme les zones d'inhibition modifiées, après quoi la synergie peut être déterminée par l'équation 1.
Au lieu d'utiliser une approche de plaque d'agar, une approche de microbroth peut souvent être préférentielle en raison de sa plus grande flexibilité (par exemple, la capacité de choisir des concentrations spécifiques d'antibiotiques en dehors des limites d'une bande de test électronique). En outre, les tests de microbroth sont suggérés pour être plus sensibles en raison de leur distribution uniforme d'antibiotiques dans une solution liquide, ne dépend pas de la dissociation dans une phase solide (plaque d'agar). Les puits dans une microplaque de 96 puits seront inoculés avec un nombre fixe de bactéries (106 cfu/mL : la concentration bactérienne peut être estimée par des mesures OD600 nm, des normes de turbidité, ou par des échantillons de placage de 10x dilutions bactériennes en série), et antibiotiques dans différentes dilutions seront ajoutés aux puits. De même, pour les bandes e-test MIC est déterminé comme l'intersection (bien / spot) avec la plus faible concentration d'antibiotiques inhibant la croissance visible des bactéries.
Objectif expérimental
- Le projet ci-dessous décrit les stratégies visant à déterminer les valeurs MIC de la pénicilline G et de la gentamicine du groupe G de Streptococcus par deux méthodes différentes, le test électronique et la dilution du microbroth. Pour l'essai électronique, les plaques d'agar De Mueller-Hinton inoculées avec le groupe G de Streptococcus ont été employées en combination avec des bandes de gradient de la pénicilline G et/ou de la gentamicine ; tandis que MH-broth avec 50% de sang de cheval lysé et 20 mg/mL -NAD ont été utilisés avec des antibiotiques solubles avec streptocoque groupe G dans une approche de microbroth.
Matériaux
- Colonies bactériennes sur une plaque d'agar de sang, stockées 7 jours dans 4 oC
- Plaques d'agar de sang
- 0.5 Norme McFarland
- 1% BaCl2
- 1% H2SO4
- Tube salin (2 mL)
- Applicateur à pointe de coton
- Plaques d'agar Mueller-Hinton (plaques MHA)
- Bouillon MH avec 50% de sang de cheval lysé et 20 mg/mL-NAD (MH-F)
- E-test pénicilline/gentamicin (ou antibiotiques d'intérêt) (BioMerieux, Marcy l'Etoile, France, Suède)
- Pénicilline/gentamicine (ou antibiotiques d'intérêt (poudre/solution))
Remarque : Les médias spécifiques utilisés pour la croissance bactérienne peuvent varier selon les espèces.
1. Tests d'epsilomètre (E-tests)
-
arrangement
- Portez des gants et une blouse de laboratoire
- Préparer l'espace de travail en le stérilisant à l'aide de 70 % d'éthanol
- Recueillir les plaques d'agar Mueller-Hinton (plaques MHA)
-
Préparation d'une norme de turbidité McFarland no 0.5
- Préparer une solution de 1% de chlorure de baryum (BaCl2):
Ajouter 1 gramme de chlorure de baryum ...
- Préparer une solution de 1% de chlorure de baryum (BaCl2):
Valeurs MIC en E-test
Les valeurs du MIC individuel ont été identifiées à la figure 1 comme étant de 0,094 g/mL pour la pénicilline G et de 8 g/mL pour la gentamicine. Pour les tests de synergie, les deux ont démontré une valeur MIC pour la pénicilline G de 0,064 g/mL (Figures 2, 3), tandis que la gentamicine avait un MIC 4 g/mL pour les essais croisés et non croisés. Notez qu'un léger écart entre les tests croisés et non croisé...
La résistance aux antibiotiques est un problème de santé mondial. Afin de déterminer les mécanismes de résistance des microbes, des méthodes de test de synergie et d'antagonisme avec différents antibiotiques sont cruciales. La méthode E-test est rapide, facile à reproduire, et peut être utilisée pour étudier n'importe quel potentiel synergique des thérapies combinées. La méthode de dilution du bouillon peut également être évaluée pour prédire l'activité bactéricide. Afin d'étudier les mécanismes ...
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved