0:01
Concepts
3:12
Gram Staining
5:48
Capsule Staining
7:31
Endospore Staining - Schaeffer-Fulton Method
9:48
Results
Microscopia e colorazioni: la colorazione di Gram, delle endospore e del capside
Fonte: Rhiannon M. LeVeque1, Natalia Martin1, Andrew J. Van Alst1e Victor J. DiRita1
1 Dipartimento di Microbiologia e Genetica Molecolare, Michigan State University, East Lansing, Michigan, Stati Uniti d'America
I batteri sono diversi microrganismi che si trovano quasi ovunque sulla Terra. Molte proprietà aiutano a distinguerli l'uno dall'altro, incluso ma non limitato al tipo di colorazione di Gram, alla forma e alla disposizione, alla produzione di capsule e alla formazione di spore. Per osservare queste proprietà, si può usare la microscopia ottica; tuttavia, alcune caratteristiche batteriche (ad esempio dimensioni, mancanza di colorazione e proprietà di rifrazione) rendono difficile distinguere i batteri esclusivamente con un microscopio ottico (1, 2). La colorazione dei batteri è necessaria quando si distinguono i tipi batterici con la microscopia ottica. I due principali tipi di microscopi otscopici sono semplici e composti. La principale differenza tra loro è il numero di lenti utilizzate per ingrandire l'oggetto. I microscopi semplici (ad esempio una lente d'ingrandimento) hanno una sola lente per ingrandire un oggetto, mentre i microscopi composti hanno diverse lenti per migliorare l'ingrandimento (Figura 1). I microscopi composti hanno una lente obiettiva vicino all'oggetto che raccoglie la luce per creare un'immagine dell'oggetto. Questo viene poi ingrandito dall'oculare (lente oculare) che ingrandisce l'immagine. La combinazione dell'obiettivo e dell'oculare consente un ingrandimento maggiore rispetto all'utilizzo di una singola lente da sola. Tipicamente, i microscopi composti hanno più lenti obiettivo di varie potenze per consentire un ingrandimento diverso (1, 2). Qui, discuteremo la visualizzazione dei batteri con macchie di Gram, macchie di capsule e macchie di endospore.

Figura 1: Un tipico microscopio composto. Le parti più importanti del microscopio sono etichettate.
La macchia di Gram, sviluppata nel 1884 dal batteriologo danese Hans Christian Gram (1), differenzia i batteri in base alla composizione della parete cellulare (1, 2, 3, 4). In breve, uno striscio batterico viene posto su un vetrino per microscopio e quindi fissato a calore per far aderire le cellule al vetrino e renderle più facilmente accettabili delle macchie (1). Il campione fissato a caldo viene colorato con Crystal Violet, trasformando le cellule in viola. Il vetrino viene lavato con una soluzione di iodio, che fissa il Crystal Violet alla parete cellulare, seguito da un decolorante (un alcool) per lavare via qualsiasi Crystal Violet non fisso. Nella fase finale, una controcolore, Safranin, viene aggiunta alle celle colorate di rosso (Figura 2). I batteri Gram-positivi si colorano di viola a causa dello spesso strato di peptidoglicano che non è facilmente penetrato dal decolorante; I batteri Gram-negativi, con il loro strato peptidoglicano più sottile e il più alto contenuto lipidico, si dissacrono con il decolorante e sono controcolorati di rosso quando viene aggiunta Safranina (Figura 3). La colorazione di Gram viene utilizzata per differenziare le cellule in due tipi (Gram-positivo e Gram-negativo) ed è anche utile per distinguere la forma delle cellule (sfere o cocchi, aste, aste curve e spirali) e la disposizione (celle singole, coppie, catene, gruppi e cluster) (1, 3).
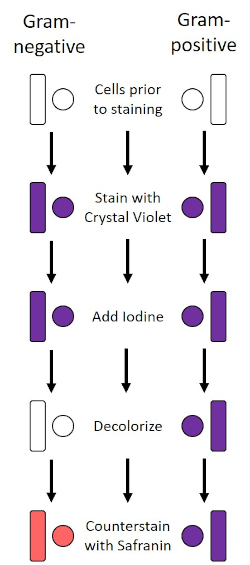
Figura 2: Schema del protocollo di colorazione di Gram. La colonna di sinistra mostra come reagiscono i batteri Gram-negativi in ogni fase del protocollo. La colonna di destra mostra come reagiscono i batteri Gram-positivi. Inoltre, sono mostrate due tipiche forme di cellule batteriche: i bacilli (o bastoncelli) e i cocchi (o sfere).
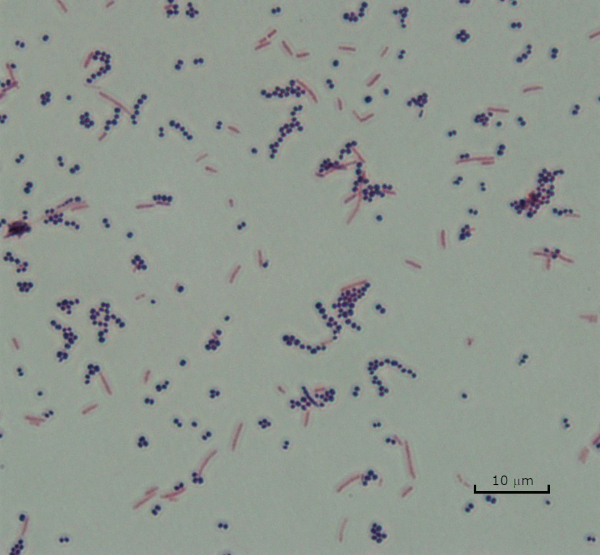
Figura 3: Risultati della colorazione di Gram. Una macchia di Gram di una miscela di Staphylococcus aureus (cocchi viola Gram-positivi) ed Escherichia coli (barre rosse Gram-negative).
Alcuni batteri producono uno strato esterno viscoso extracellulare chiamato capsula (3, 5). Le capsule sono strutture protettive con varie funzioni, tra cui, a titolo esemplificativo ma non esaustivo, l'aderenza a superfici e altri batteri, la protezione dall'essiccazione e la protezione dalla fagocitosi. Le capsule sono tipicamente composte da polisaccaridi contenenti più del 95% di acqua, ma alcune possono contenere polialcoli e poliammine (5). A causa della loro composizione per lo più non ionica e della tendenza a respingere le macchie, i semplici metodi di colorazione non funzionano con la capsula; invece, la colorazione della capsula utilizza una tecnica di colorazione negativa che macchia le cellule e lo sfondo, lasciando la capsula come un alone chiaro intorno alle cellule (1, 3) (Figura 4). La colorazione della capsula comporta la spalma di un campione batterico in una macchia acida su un vetrino per microscopio. A differenza della colorazione di Gram, lo striscio batterico non viene fissato termicamente durante una colorazione della capsula. Il fissaggio del calore può interrompere o disidratare la capsula, portando a falsi negativi (5). Inoltre, il fissaggio termico può ridurre le celle con conseguente pulizia intorno alla cellula che può essere scambiata per una capsula, portando a falsi positivi (3). La macchia acida colora lo sfondo della diapositiva; mentre segue con una macchia di base, Crystal Violet, colora le cellule batteriche stesse, lasciando la capsula incontaminata e apparendo come un alone chiaro tra le cellule e lo sfondo del vetrino (Figura 5). Tradizionalmente, l'inchiostro indiano è stato usato come macchia acida perché queste particelle non possono penetrare nella capsula. Pertanto, né la capsula né la cellula sono macchiate dall'inchiostro dell'India; invece, lo sfondo è macchiato. Congo Red, Nigrosin o Eosin possono essere utilizzati al posto dell'inchiostro indiano. La colorazione della capsula può aiutare i medici a diagnosticare le infezioni batteriche quando si guardano le colture dai campioni dei pazienti e guidare il trattamento appropriato del paziente. Le malattie comuni causate da batteri incapsulati includono polmonite, meningite e salmonellosi.
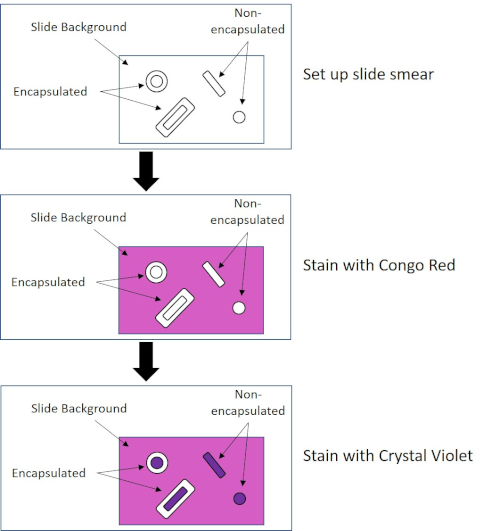
Figura 4: Schema del protocollo di colorazione della capsula. Il pannello superiore mostra lo striscio di scorrimento prima di qualsiasi applicazione di macchia. Il pannello centrale mostra come la diapositiva e i batteri si occupano della macchia primaria, Congo Red. Il pannello finale mostra come il vetrino e i batteri si occupano della controcolorazione, Crystal Violet.
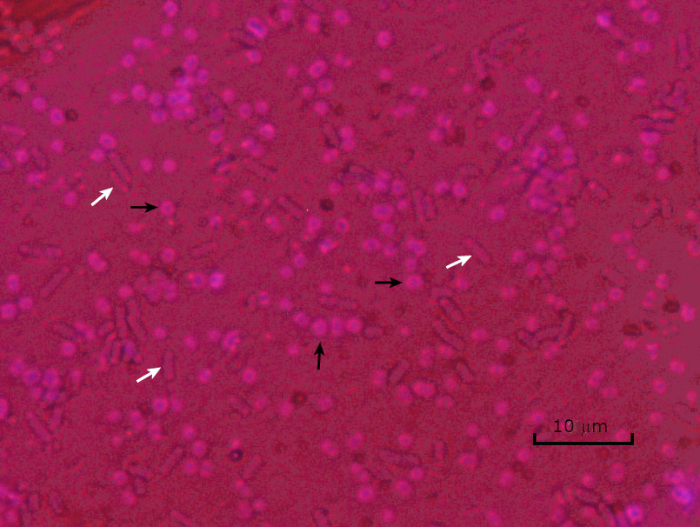
Figura 5: Risultati della colorazione della capsula. Colorazione della capsula di Acinetobacter baumannii incapsulato (indicato con frecce nere) e Escherichia coli non incapsulato (indicato con frecce bianche). Si noti che lo sfondo è scuro e le cellule di A. baumannii sono macchiate di viola. La capsula intorno alle cellule di A. baumannii è evidente come un alone, mentre E. coli non ha alone.
In condizioni avverse (ad esempio limitazione dei nutrienti, temperature estreme o disidratazione), alcuni batteri producono endospore, strutture metabolicamente inattive resistenti ai danni fisici e chimici (1, 2, 8, 9). Le endospore consentono al batterio di sopravvivere a condizioni difficili proteggendo il materiale genetico delle cellule; una volta che le condizioni sono favorevoli alla crescita, le spore germinano e la crescita batterica continua. Le endospore sono difficili da macchiare con le tecniche di colorazione standard perché sono impermeabili ai coloranti tipicamente utilizzati per la colorazione (1, 9). La tecnica abitualmente utilizzata per macchiare le endospore è il Metodo Schaeffer-Fulton (Figura 6),che utilizza la macchia primaria Malachite Green, una macchia solubile in acqua che si lega relativamente debolmente al materiale cellulare, e il calore, per consentire alla macchia di sfondare la corteccia della spora (Figura 7). Questi passaggi colorano le cellule in crescita (denominate cellule vegetative nel contesto della biologia delle endospore), così come le endospore e le eventuali spore libere (quelle che non sono più all'interno del precedente involucro cellulare). Le cellule vegetative vengono lavate con acqua per rimuovere Malachite Green; le endospore trattengono la macchia a causa del riscaldamento del verde malachite all'interno della spora. Infine, le cellule vegetative sono controbattete con Safranin per visualizzare (Figura 8). La colorazione per le endospore aiuta a differenziare i batteri in formatori di spore e formatori non sporici, oltre a determinare se le spore sono presenti in un campione che, se presente, potrebbe portare a contaminazione batterica al momento della germinazione.
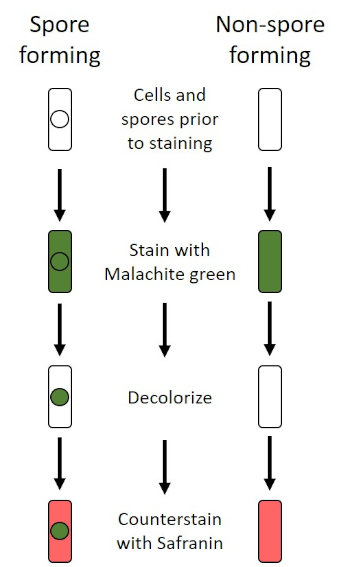
Figura 6: Schema del protocollo di colorazione delle endospore. La colonna di sinistra mostra come reagiscono i batteri che formano spore in ogni fase del protocollo. La colonna di destra mostra come reagiscono i batteri che non formano spore.
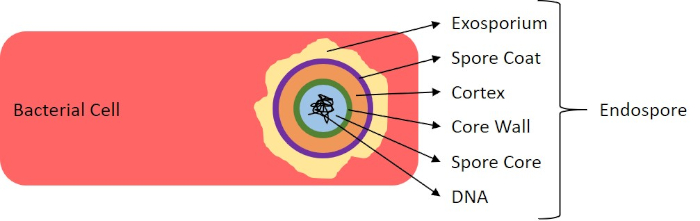
Figura 7: Diagramma della struttura delle endospore. Cellula batterica contenente un'endospora con le varie strutture sporiche etichettate.
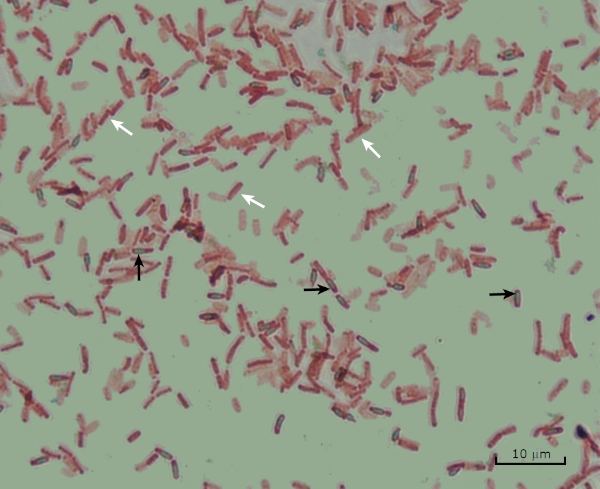
Figura 8: Risultati della colorazione delle endospore. Una colorazione tipica delle endospore di Bacillus subtilis. Le cellule vegetative (indicate con le frecce bianche) sono macchiate di rosso, mentre le endospore (denotate con le frecce nere) sono macchiate di verde.
1. Colorazione del grammo
-
Configurazione
- Indossare guanti e un cappotto da laboratorio non infiammabile, poiché i coloranti macchiano mani e vestiti.
- Un bruciatore Bunsen viene utilizzato per riscaldare i batteri. Usare attenzione quando si lavora con la fiamma; legare i capelli lunghi.
- Verranno utilizzati reagenti per macchie di Gram disponibili in commercio.
- Pulire i vetrini del microscopio con salviette da laboratorio.
I batteri hanno caratteristiche distintive che possono aiutare nella loro identificazione. Alcune di queste caratteristiche possono essere osservate mediante colorazione e microscopia ottica. Tre tecniche di colorazione utili per osservare queste caratteristiche sono la colorazione di Gram, la colorazione della capsula e la colorazione delle endospore. Ogni tecnica identifica diverse caratteristiche dei batteri e può essere utilizzata per aiutare i medici a raccomandare trattamenti per i pazienti, identificare potenzial.
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved