0:01
Concepts
3:12
Gram Staining
5:48
Capsule Staining
7:31
Endospore Staining - Schaeffer-Fulton Method
9:48
Results
Microscopia e Coloração: Coloração de Gram, Cápsula e Endósporo
Fonte: Rhiannon M. LeVeque1, Natalia Martin1, Andrew J. Van Alst1, e Victor J. DiRita1
1 Departamento de Microbiologia e Genética Molecular, Michigan State University, East Lansing, Michigan, Estados Unidos da América
Bactérias são microrganismos diversos encontrados em quase todos os lugares da Terra. Muitas propriedades ajudam a distingui-los umas das outras, incluindo, mas não se limitando ao tipo de coloração gram, forma e arranjo, produção de cápsula e formação de esporos. Para observar essas propriedades, pode-se usar microscopia leve; no entanto, algumas características bacterianas (por exemplo tamanho, falta de coloração e propriedades refrativas) dificultam a distinção de bactérias apenas com um microscópio leve (1, 2). A coloração de bactérias é necessária ao distinguir tipos bacterianos com microscopia leve. Os dois principais tipos de microscópios leves são simples e compostos. A principal diferença entre eles é o número de lentes usadas para ampliar o objeto. Microscópios simples (por exemplo, uma lupa) têm apenas uma lente para ampliar um objeto, enquanto microscópios compostos têm várias lentes para melhorar a ampliação (Figura 1). Microscópios compostos têm uma lente objetiva perto do objeto que coleta luz para criar uma imagem do objeto. Isso é então ampliado pela ocular (lente ocular) que amplia a imagem. Combinar a lente objetiva e a ocular permite uma ampliação maior do que usar apenas uma única lente. Normalmente, microscópios compostos têm múltiplas lentes objetivas de diferentes poderes para permitir diferentes ampliações (1, 2). Aqui, discutiremos a visualização de bactérias com manchas de Gram, manchas de cápsula e manchas de Endospore.

Figura 1: Um microscópio composto típico. As partes mais importantes do microscópio são rotuladas.
A mancha de Gram, desenvolvida em 1884 pelo bacteriologista dinamarquês Hans Christian Gram (1), diferencia bactérias baseadas na composição da parede celular (1, 2, 3, 4). Brevemente, uma mancha bacteriana é colocada em um slide de microscópio e, em seguida, fixada a calor para aderir as células ao slide e torná-las mais prontamente aceitando manchas (1). A amostra fixa de calor está manchada com Crystal Violet, tornando as células roxas. O slide é lavado com uma solução de iodo, que fixa o Cristal Violet na parede celular, seguido por um descolorador (um álcool) para lavar qualquer Violeta cristal não fixa. Na etapa final, uma contra-mancha, Safranin, é adicionada às células coloridas vermelhas (Figura 2). As bactérias gram-positivas mancham o roxo devido à espessa camada peptidoglycan que não é facilmente penetrada pelo descolorador; Bactérias gram-negativas, com sua camada peptidoglycan mais fina e maior teor lipídudo, se desarmam com o descolorador e são contra-manchadas de vermelho quando Safranin é adicionado (Figura 3). A coloração gramada é usada para diferenciar células em dois tipos (Gram-positivo e Gram-negativo) e também é útil para distinguir a forma celular (esferas ou cocci, hastes, hastes curvas e espirais) e arranjo (células únicas, pares, cadeias, grupos e clusters) (1, 3).
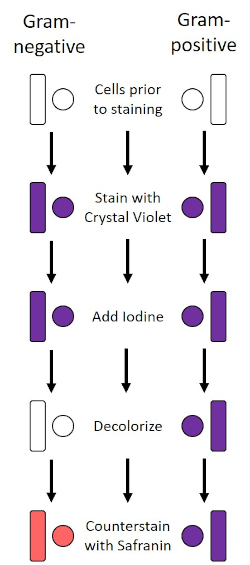
Figura 2: Esquema do Protocolo de Coloração de Grama. A coluna esquerda mostra como as bactérias Gram-negativas reagem a cada passo do protocolo. A coluna certa mostra como as bactérias Gram-positivas reagem. Além disso, são mostradas duas formas típicas de células bacterianas: os bacilos (ou hastes) e o cocci (ou esferas).
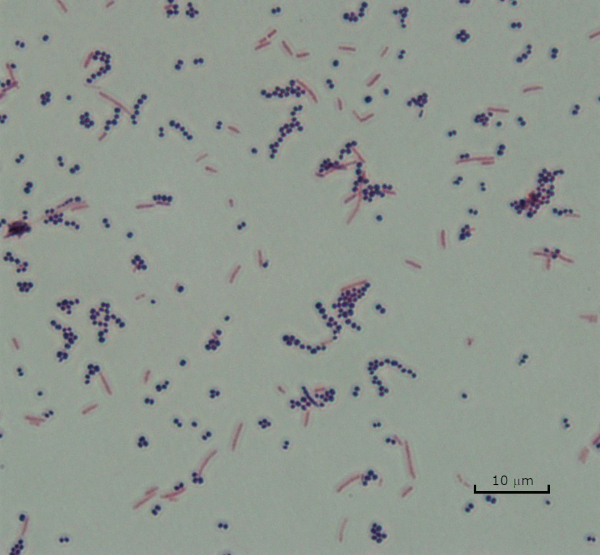
Figura 3: Resultados de coloração de grama. Uma mancha gram de uma mistura de Staphylococcus aureus (Gram-positivo cocci roxo) e Escherichia coli (barras vermelhas Gram-negativas).
Algumas bactérias produzem uma camada externa viscosa extracelular chamada cápsula (3, 5). As cápsulas são estruturas protetoras com várias funções, incluindo, mas não se limitando à adesão a superfícies e outras bactérias, proteção contra profanação e proteção contra fagocitose. As cápsulas são tipicamente compostas de polissacarídeos contendo mais de 95% de água, mas algumas podem conter polialcoólicos e poliaminas (5). Devido à sua composição não iônica e tendência a repelir manchas, métodos simples de coloração não funcionam com cápsula; em vez disso, a coloração da cápsula utiliza uma técnica de coloração negativa que mancha as células e o fundo, deixando a cápsula como um halo claro ao redor das células (1, 3) (Figura 4). A coloração da cápsula envolve a mancha de uma amostra bacteriana em uma mancha ácida em um slide de microscópio. Ao contrário da mancha gram, a mancha bacteriana não é fixada durante uma mancha de cápsula. A fixação de calor pode interromper ou desidratar a cápsula, levando a falsos negativos (5). Além disso, a fixação de calor pode encolher as células resultando em uma clareira ao redor da célula que pode ser confundida como uma cápsula, levando a falsos positivos (3). A mancha ácida colore o fundo do slide; enquanto segue com uma mancha básica, Crystal Violet, colore as próprias células bacterianas, deixando a cápsula sem manchas e aparecendo como um halo claro entre as células e o fundo do slide (Figura 5). Tradicionalmente, a tinta da Índia tem sido usada como mancha ácida porque essas partículas não podem penetrar na cápsula. Portanto, nem a cápsula nem a célula são manchadas pela tinta da Índia; em vez disso, o fundo está manchado. Congo Red, Nigrosin ou Eosin podem ser usados no lugar da tinta da Índia. A coloração da cápsula pode ajudar os médicos a diagnosticar infecções bacterianas ao analisar culturas a partir de amostras de pacientes e orientar o tratamento adequado do paciente. Doenças comuns causadas por bactérias encapsuladas incluem pneumonia, meningite e salmonelose.
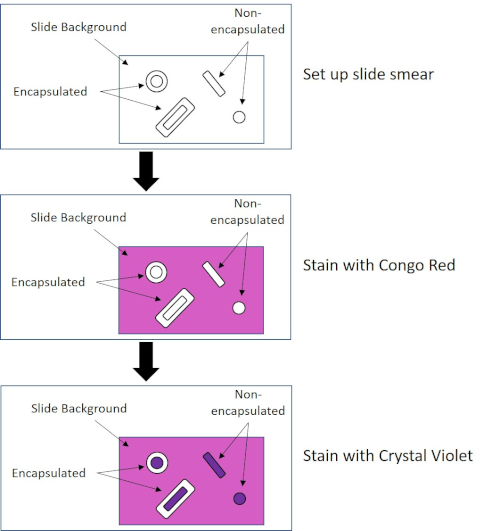
Figura 4: Esquema do Protocolo de Coloração da Cápsula. O painel superior mostra a mancha de slides antes de qualquer aplicação de mancha. O painel do meio mostra como o slide e as bactérias cuidam da mancha primária, Congo Red. O painel final mostra como o slide e as bactérias cuidam da contra-mancha, Crystal Violet.
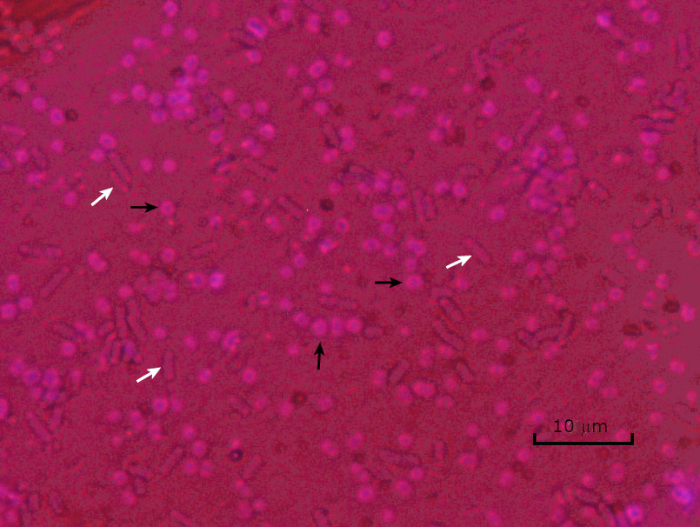
Figura 5: Resultados de coloração da cápsula. Coloração cápsula de Acinetobacter baumannii encapsulada (denotada com setas pretas) e Escherichia coli não encapsulada (denotada com setas brancas). Note que o fundo é escuro e as células A. baumannii estão manchadas de roxo. A cápsula ao redor das células de A. baumannii é evidente como um halo, enquanto E. coli não tem halo.
Em condições adversas (por exemplo, limitação de nutrientes, temperaturas extremas ou desidratação), algumas bactérias produzem endosporos, estruturas metabolicamente inativas resistentes a danos físicos e químicos (1, 2, 8, 9). Os endosporos permitem que a bactéria sobreviva a condições severas, protegendo o material genético das células; uma vez que as condições são favoráveis para o crescimento, os esporos germinam e o crescimento bacteriano continua. Os endosporos são difíceis de colorir com técnicas de coloração padrão porque são impermeáveis a corantes tipicamente usados para coloração (1, 9). A técnica rotineiramente utilizada para manchar endospores é o Método Schaeffer-Fulton (Figura 6),que utiliza a mancha primária Malachite Green, uma mancha solúvel em água que se liga relativamente fracamente ao material celular, e ao calor, para permitir que a mancha rompe através do córtex do esporo (Figura 7). Esses passos colorem as células em crescimento (chamadas células vegetativas no contexto da biologia endospora), bem como endosporos e quaisquer esporos livres (aqueles que não estão mais dentro do antigo envelope celular). As células vegetativas são lavadas com água para remover o Malachite Green; endosporos retêm a mancha devido ao aquecimento do Verde Malachite dentro do esporo. Finalmente, as células vegetativas são contra-manchadas com Safranin para visualizar (Figura 8). A coloração para endosporos ajuda a diferenciar bactérias em ex-esporos e ex-esporos, bem como determina se esporos estão presentes em uma amostra que, se presente, poderia levar à contaminação bacteriana após a germinação.
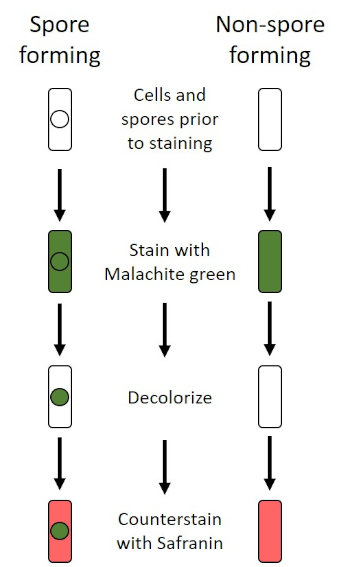
Figura 6: Esquema do Protocolo de Coloração de Endospore. A coluna esquerda mostra como as bactérias formadoras de esporos reagem a cada passo do protocolo. A coluna direita mostra como as bactérias que formam os não esporos reagem.
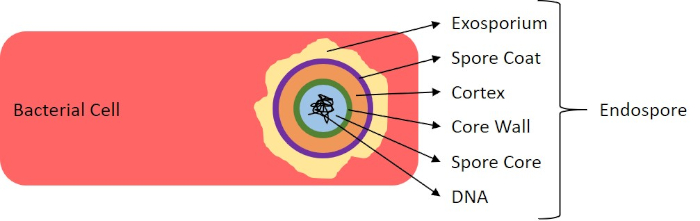
Figura 7: Diagrama da Estrutura Endospore. Célula bacteriana contendo um endospore com as várias estruturas de esporos rotuladas.
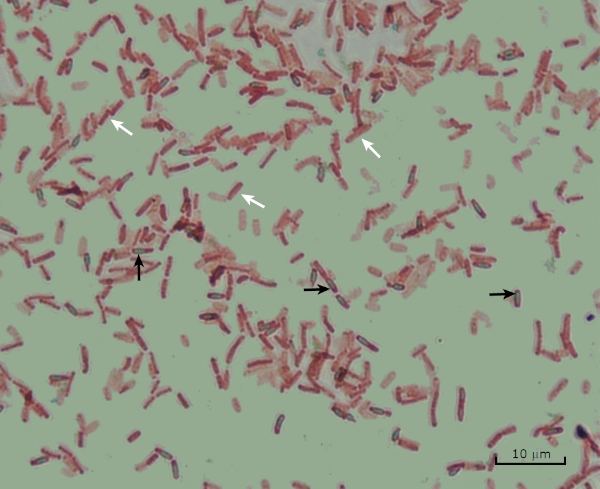
Figura 8: Resultados de Coloração de Endospore. Uma mancha típica de endosporos de Bacillus subtilis. As células vegetativas (denotadas com as setas brancas) estão manchadas de vermelho, enquanto os endosporos (denotados com as setas pretas) estão manchados de verde.
1. Gram Staining
-
Configuração
- Use luvas e um jaleco não inflamável, pois os corantes mancharão as mãos e as roupas.
- Um queimador Bunsen é usado para aquecer a bactéria. Use os cuidados ao trabalhar com chama; amarrar cabelo comprido.
- Serão utilizados reagentes de manchas Gram disponíveis comercialmente.
- Limpe slides de microscópio com lenços de laboratório.
-
Protocolo
- Pipe...
As bactérias têm características distintas que podem auxiliar em sua identificação. Algumas dessas características podem ser observadas por coloração e microscopia de luz. Três técnicas de coloração úteis para observar essas características são coloração de Gram, coloração de cápsulas e coloração de Endospore. Cada técnica identifica diferentes características das bactérias e pode ser usada para ajudar os médicos a recomendar tratamentos para pacientes, identificar potenciais contaminantes em am...
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved