0:01
Concepts
3:12
Gram Staining
5:48
Capsule Staining
7:31
Endospore Staining - Schaeffer-Fulton Method
9:48
Results
Microscopía y tinción: Tinción de Gram, cápsula y endosporas
Fuente: Rhiannon M. LeVeque1, Natalia Martin1, Andrew J. Van Alst1, y Victor J. DiRita1
1 Departamento de Microbiología y Genética Molecular, Universidad Estatal de Michigan, East Lansing, Michigan, Estados Unidos de América
Las bacterias son microorganismos diversos que se encuentran en casi todas partes de la Tierra. Muchas propiedades ayudan a distinguirlos entre sí, incluyendo pero no limitado a tipo de tinción de Gram, forma y disposición, producción de cápsulas, y la formación de esporas. Para observar estas propiedades, se puede utilizar microscopía de luz; sin embargo, algunas características bacterianas (por ejemplo, el tamaño, la falta de coloración y las propiedades refractivas) hacen que sea difícil distinguir las bacterias únicamente con un microscopio ligero (1, 2). Las bacterias de la tinción son necesarias al distinguir los tipos bacterianos con microscopía de luz. Los dos tipos principales de microscopios de luz son simples y compuestos. La principal diferencia entre ellos es el número de lentes utilizadas para magnificar el objeto. Los microscopios simples (por ejemplo, una lupa) tienen una sola lente para magnificar un objeto, mientras que los microscopios compuestos tienen varias lentes para mejorar el aumento (Figura 1). Los microscopios compuestos tienen una lente objetiva cerca del objeto que recoge la luz para crear una imagen del objeto. Esto es emagnificado por el ocular (lente ocular) que agranda la imagen. La combinación de la lente objetivo y el ocular permite un aumento más alto que el uso de una sola lente. Por lo general, los microscopios compuestos tienen múltiples lentes objetivas de diferentes potencias para permitir un aumento diferente (1, 2). Aquí, vamos a discutir la visualización de bacterias con manchas de Gram, manchas de cápsula, y manchas de endospora.

Figura 1: Un microscopio compuesto típico. Las partes más importantes del microscopio están etiquetadas.
La tinción Gram, desarrollada en 1884 por el bacteriólogo danés Hans Christian Gram (1), diferencia las bacterias en función de la composición de la pared celular (1, 2, 3, 4). Brevemente, se coloca un frotis bacteriano en un portaobjetos del microscopio y luego se fija térmicamente para adherir las células a la diapositiva y hacerlas aceptar más fácilmente de las manchas (1). La muestra termofija se tiñe con Cristal Violeta, convirtiendo las células en púrpura. La diapositiva se lava con una solución de yodo, que fija el Cristal Violet a la pared celular, seguido de un decolorante (un alcohol) para lavar cualquier Crystal Violet no fijo. En el paso final, se añade una contramancha, Safranin, a las celdas de color rojo (Figura 2). Bacterias Gram-positivas mancha púrpura debido a la gruesa capa de peptidoglycan que no es fácilmente penetrado por el decolorante; Bacterias gramnegativas, con su capa de peptidoglycan más delgada y mayor contenido de lípidos, descolorante con el decolorante y se contratienen en rojo cuando se añade Safranin (Figura 3). La tinción de Gram se utiliza para diferenciar las células en dos tipos (Gram-positivo y Gram-negativo) y también es útil para distinguir la forma de la célula (esferas o cocci, varillas, varillas curvas y espirales) y la disposición (células individuales, pares, cadenas, grupos y racimos) (1, 3) .
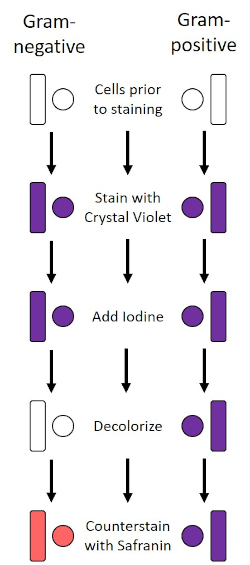
Figura 2: Esquema del protocolo Gram Staining Protocol. La columna izquierda muestra cómo reaccionan las bacterias Gram-negativas en cada paso del protocolo. La columna derecha muestra cómo reaccionan las bacterias Gram-positivas. Además, se muestran dos formas celulares bacterianas típicas: los bacilos (o varillas) y los cocci (o esferas).
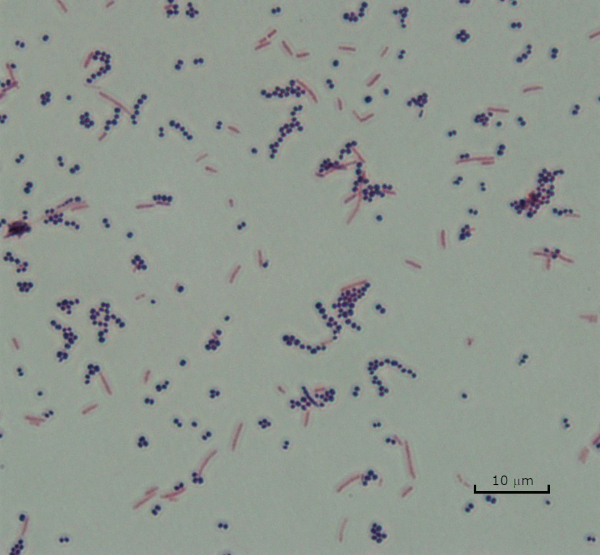
Figura 3: Resultados de la tinción de Gram. Una tinción de Gram de una mezcla de Staphylococcus aureus (cocci púrpura Gram-positivo) y Escherichia coli (barras rojas gramnegativas).
Algunas bacterias producen una capa externa viscosa extracelular llamada cápsula (3, 5). Las cápsulas son estructuras protectoras con varias funciones, incluyendo pero no limitado a la adherencia a las superficies y otras bacterias, protección contra la desecación, y protección contra la fagocitosis. Cápsulas se componen típicamente de polisacáridos que contienen más del 95% de agua, pero algunos pueden contener polialcohols y poliaminas (5). Debido a su composición principalmente no iónica y su tendencia a repeler las manchas, los métodos de tinción simples no funcionan con la cápsula; en su lugar, la tinción de cápsulas utiliza una técnica de tinción negativa que mancha las células y el fondo, dejando la cápsula como un halo claro alrededor de las células (1, 3) (Figura 4). La tinción de la cápsula consiste en frotar una muestra bacteriana en una mancha ácida en un portaobjetos del microscopio. A diferencia de la tinción de Gram, el frotis bacteriano no se fija térmicamente durante una mancha de cápsula. La fijación de calor puede interrumpir o deshidratar la cápsula, lo que provoca falsos negativos (5). Además, la fijación de calor puede encoger las células, lo que resulta en un claro alrededor de la célula que se puede confundir como una cápsula, lo que conduce a falsos positivos (3). La mancha ácida colorea el fondo de la diapositiva; mientras que el seguimiento con una mancha básica, Crystal Violet, colorea las propias células bacterianas, dejando la cápsula sin mancha y apareciendo como un halo claro entre las células y el fondo de la diapositiva (Figura 5). Tradicionalmente, la tinta de la India se ha utilizado como la mancha ácida porque estas partículas no pueden penetrar en la cápsula. Por lo tanto, ni la cápsula ni la célula están manchadas por tinta de la India; en su lugar, el fondo está manchado. Congo Red, Nigrosin, o Eosin se pueden utilizar en lugar de tinta de la India. La tinción de cápsulas puede ayudar a los médicos a diagnosticar infecciones bacterianas cuando examinan los cultivos a partir de muestras de pacientes y guían el tratamiento adecuado del paciente. Las enfermedades comunes causadas por bacterias encapsuladas incluyen neumonía, meningitis y salmonelosis.
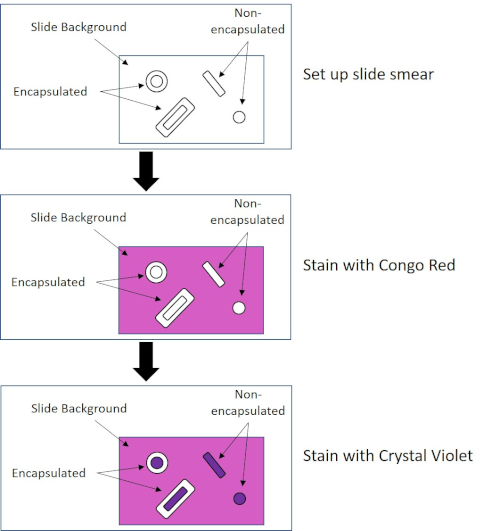
Figura 4: Esquema del protocolo de tinción de cápsula. El panel superior muestra el frotis de diapositivas antes de cualquier aplicación de manchas. El panel central muestra cómo el deslizamiento y las bacterias se ven después de la mancha primaria, Congo Red. El panel final muestra cómo la diapositiva y las bacterias se ven después de la contramancha, Crystal Violet.
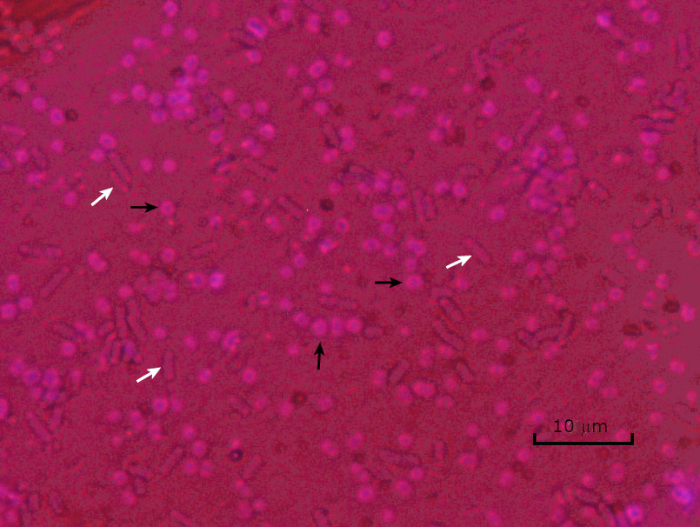
Figura 5: Resultados de la tinción de la cápsula. Tinción de cápsulas de Acinetobacter baumannii encapsulado (denotado con flechas negras) y Escherichia coli no encapsulado (denotado con flechas blancas). Observe que el fondo es oscuro y a. las células baumannii están teñidas de púrpura. La cápsula alrededor de las células de A. baumannii es evidente como un halo, mientras que E. coli no tiene halo.
En condiciones adversas (por ejemplo, limitación de nutrientes, temperaturas extremas o deshidratación), algunas bacterias producen endosporas, estructuras metabólicamente inactivas que son resistentes al daño físico y químico (1, 2, 8, 9). Las endosporas permiten que la bacteria sobreviva a las duras condiciones protegiendo el material genético de las células; una vez que las condiciones son favorables para el crecimiento, las esporas germinan, y el crecimiento bacteriano continúa. Las endosporas son difíciles de manchar con técnicas de tinción estándar porque son impermeables a los colorantes que se suelen utilizar para la tinción (1, 9). La técnica utilizada rutinariamente para manchar las endosporas es el Método Schaeffer-Fulton (Figura 6),que utiliza la mancha primaria Malachite Green, una mancha soluble en agua que se une relativamente débilmente al material celular, y el calor, para permitir que la mancha se rompa a través de la corteza de la espora (Figura 7). Estos pasos colorean las células en crecimiento (llamadas células vegetativas en el contexto de la biología de la endospora), así como las endosporas y cualquier espora libre (aquellas que ya no están dentro de la envoltura de células anteriores). Las células vegetativas se lavan con agua para eliminar Malaquías Verde; los endospores retienen la mancha debido a la calefacción del verde malaquita dentro de las esporas. Finalmente, las células vegetativas se contratratan con Safranin para visualizar (Figura 8). La tinción de endosporas ayuda a diferenciar las bacterias en ex años de esporas y los años no esporas, así como determina si las esporas están presentes en una muestra que, si está presente, podría conducir a contaminación bacteriana tras la germinación.
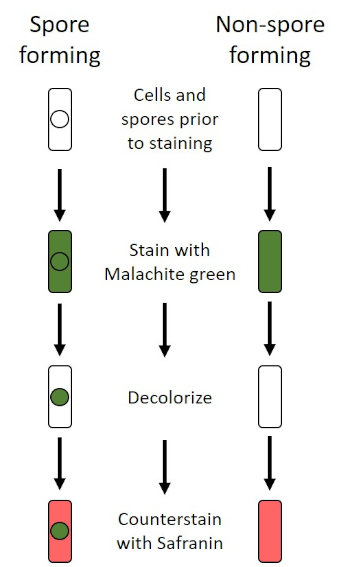
Figura 6: Esquema del Protocolo de Tinción de Endospora. La columna izquierda muestra cómo reaccionan las bacterias formadoras de esporas en cada paso del protocolo. La columna derecha muestra cómo reaccionan las bacterias que no forman esporas.
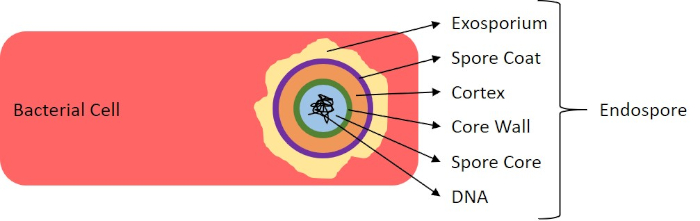
Figura 7: Diagrama de la estructura de la endospora. Célula bacteriana que contiene una endospora con las diversas estructuras de esporas etiquetadas.
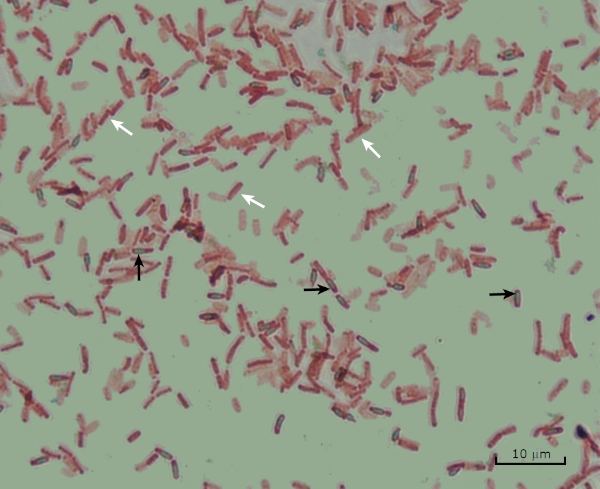
Figura 8: Resultados de la tinción de endospora. Una tinción típica de endosporas de Bacillus subtilis. Las células vegetativas (denotadas con las flechas blancas) están teñidas de rojo, mientras que las endosporas (denotadas con las flechas negras) están teñidas de verde.
1. Tinción de Gram
-
Configuración
- Use guantes y una capa de laboratorio no inflamable, ya que los colorantes mancharán las manos y la ropa.
- Un quemador Bunsen se utiliza para fijar el calor de las bacterias. Tenga cuidado al trabajar con llamas; atar el pelo largo.
- Se utilizarán reactivos de tinción de Gram disponibles comercialmente.
- Limpie las guías del microscopio con toallitas de laboratorio.
- P...
Las bacterias tienen características distintivas que pueden ayudar en su identificación. Algunas de estas características se pueden observar mediante la tinción y la microscopía de luz. Tres técnicas de tinción útiles para observar estas características son la tinción de Gram, tinción de cápsulas y tinción de endospora. Cada técnica identifica diferentes características de las bacterias y se puede utilizar para ayudar a los médicos a recomendar tratamientos para pacientes, identificar posibles contaminant...
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved