0:01
Concepts
3:53
Preparation of Donor and Recipient Strains
6:01
Conjugation
9:27
Data Analysis by Polymerase Chain Reaction (PCR)
11:29
Results
结合:将阿霉素耐药性从捐赠者转移到受体大肠杆菌的方法
资料来源:亚历山大·金1,托尼娅·科尔皮茨1
1波士顿大学医学院微生物学系,国家新兴感染疾病实验室,波士顿,马萨诸塞州
1946年,莱德伯格和塔图姆首次发现,结合是细菌之间的一种水平基因转移形式,依赖于两个细菌细胞之间的直接物理接触(1)。与其他形式的基因转移(如转化或转导)不同,结合是一个自然发生的过程,DNA以单向的方式从供体细胞分泌到受体细胞。这种方向性和这一过程增加细菌遗传多样性的能力,使结合作为细菌"交配"的一种形式的声誉,这被认为极大地促进了最近抗生素耐药性的上升细菌(2,3)。通过使用选择性压力,例如使用抗生素,结合纵用于实验室设置,使其成为细菌之间水平基因转移的有力工具,在某些情况下,从细菌到酵母、植物和动物单元格 (4)。除了在实验室中的应用,通过结合转移真核酸细菌基因是DNA转移的一个令人兴奋的途径,具有多种可能的生物技术应用和自然发生的影响(5)。
结合被认为是通过"两步机制"(6)工作。首先,在转移任何DNA之前,供体细胞必须与受体进行细胞对细胞的直接接触。这个过程在革兰氏阴性细菌中具有最佳特征,其中研究最多的是大肠杆菌。细胞与细胞接触是通过在捐赠者身上存在一个复杂的细胞外细丝网络而建立的,这种结合因子由称为F(生育)因子(7,8)的可转移基因编码。除了在供体和受体之间建立接触外,几种蛋白质通过性皮球输送到受体细胞质,在两个细胞之间形成IV型分泌系统(T4SS)导管,这是第二步的必要结构。共和,DNA转移(6)。通过将性皮鲁斯的这种功能与DNA的滚动循环复制相结合,供体细胞能够通过"芽和泵"模型(6)将DNA以可转位元素的形式(如质粒或转位子)转移给受体。在这种情况下,"射击"是通过T4SS将具有链接DNA的先导蛋白输送到受体细胞,而"泵送"是DNA向受体的主动传输,这个过程依赖于T4SS,并通过耦合蛋白(6)催化。这个过程中使用的机械由转移序列(oriT)的起源组成,必须由CIS和转基因中的DNA提供,该DNA编码松弛酶、配偶配对形成复合体和IV型耦合蛋白,以及可以存在于cis或转(9) 中。这种松弛酶在oriT序列中分裂尼克位点,并共价附着在转移链的5'端,以产生松弛体,一种单链DNA-松弛酶复合物与其他辅助蛋白(9)。一旦形成,松弛体通过IV型耦合蛋白连接到交配对形成复合体,它允许SsDNA-松弛酶复合物通过T4SS(10)转移到受体细胞中。一旦进入受体的细胞质,DNA可以集成到受体基因组中,或者以质粒的形式单独存在,其中任何一种都允许其基因的表达。
在本实验中,使用广泛使用的偶联供体菌株大肠杆菌WM3064将对受体大肠杆菌J53的抗中青霉素的基因编码转移。 虽然革兰氏阴性细菌的两种菌株对四环素具有抗药性,但只有供体菌株WM3064具有氨基青霉素抗性基因,编码为pWD2-oriT穿梭载体中,对二氨基甲酸(DAP)(DAP)具有辅助营养性。该实验包括两个主要步骤,一是制备供体和受体菌株,然后是通过结合将安培林抗性基因从供体转移到受体(图1)。
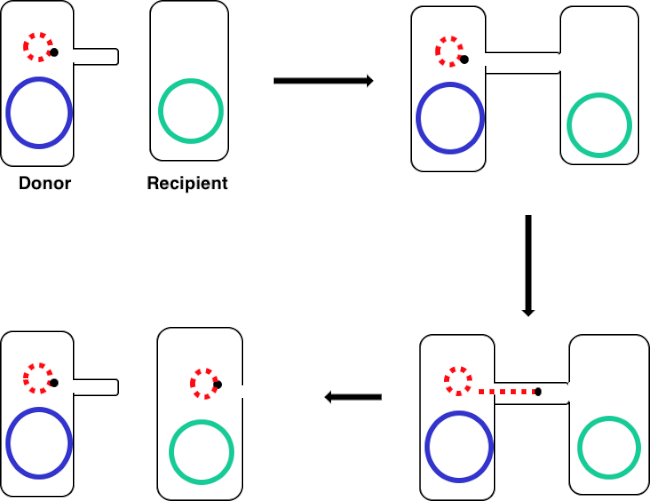
图1:共通示意图。此原理图显示了质粒(仅可转位DNA元素的一个示例)从供体细胞使用结合从受体细胞成功转移。当供体细胞通过性皮鲁斯与受体细胞接触时,质粒通过滚动循环复制复制,通过连接两个细胞的多蛋白复合体移动,并在受体细胞中形成新的全长质粒。
通过孵育供体和受体细胞的混合物,然后在四环素和DAP的存在下连续电镀这些细胞,从而成功转移了阿霉素抗性基因。在四环素和安平存在的情况下,从这种混合物中生长的连续电镀细胞,由于缺少DAP和可能尚未获得环青素抗基因的任何受体细胞,去除了所有供体细胞,产生严格受体J53菌株获得对青霉素的细菌(图2)。一旦进行,通过PCR证实了青霉素抗性基因的成功转移。由于结合成功,大肠杆菌的J53菌株含有pWD2-oriT,对阿霉素具有抗药性,PCR可检测到这种抗性的基因编码。然而,如果不成功,将没有检测到阿霉素耐药性基因,而阿霉素仍将作为对抗J53菌株的有效抗生素。
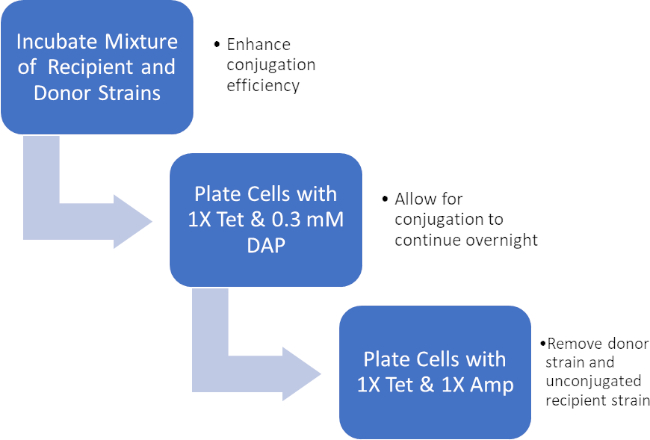
图2:协议示意图。此原理图显示了所呈现协议的概述。
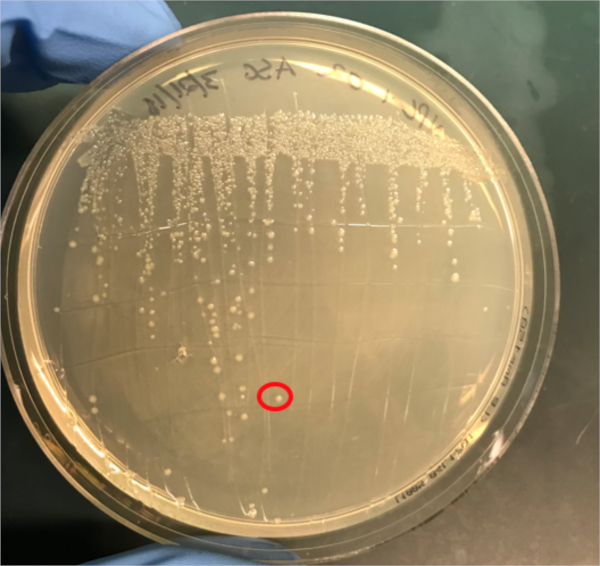
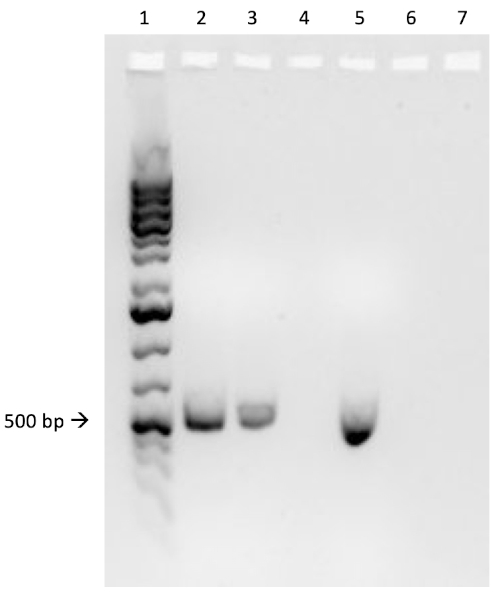
图3A:PCR成功结合的确认。A) 在琼脂板上条纹的偶联和阴性对照样本的冷冻库,并选择一个菌群(红色)进行DNA分离。
1. 设置
- 高压灭菌器约 1L 卢里亚-贝尔塔尼介质 (LB)。这种无菌 LB 将用于制造约 5 mL 的 LB,其中包含 0.3 mM 二氨基酸 (DAP)。
- 收集以下板:LB 琼脂板,1X Tet 和 0.3 mM DAP,仅 1X Tet 的 LB 琼脂板,仅 1X 置时/特的 LB 琼脂板。
- 确保一些甘油和一盒预消毒的塑料移液器吸头在手附近。
- 在开始任何涉及微生物的工作之前,使用 70% 乙醇对工作空间进行消毒。务必?...
- Lederberg J, Tatum, E.L. Gene recombination in Escherichia coli Nature. 1946;158:558.
- Holmes R.K. J, M.G. Genetics: Exchange of Genetic Information. 4th Edition ed. Baron S, editor. Galveston, TX: University of Texas Medical Branch at Galveston; 1996.
- Cruz F, Davies, J. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends in Microbiology. 2000;8:128-33.
- Llosa M, Cruz, F. Bacterial conjugation: a potential tool for genomic engineering. Ressearch in Microbiology. 2005;156:1-6.
- Lacroix B, Citovsky, V. Transfer of DNA from Bacteria to Eukaryotes. mBio. 2016;7(4):1-9.
- Llosa M, et al. Bacterial conjugation: a two-step mechanism for
- DNA transport. Molecular Microbiology. 2002;45:1-8.
- Grohmann E, Muth, G., Espinosa, M. Conjugative Plasmid Transfer in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 2003;67:277-301.
- Firth N, Ippen-Ihler, K, Skurray, RA. Structure and function of the F factor and mechanism of conjugation. Escherichia coli and salmonella: cellular and molecular biology. 1996;2:2377-401.
- Smillie C, Garcillan-Barcia MP, Francia MV, Rocha EPC, De La Cruz F. Mobility of Plasmids. Microbiology and Molecular Biology Reviews. 2010;74(3):434-52.
- Cascales E. Definition of a Bacterial Type IV Secretion Pathway for a DNA Substrate. 2004;304(5674):1170-3.
- Wang P, Yu Z, Li B, Cai X, Zeng Z, Chen X, et al. Development of an efficient conjugation-based genetic manipulation system for Pseudoalteromonas. Microbial Cell Factories. 2015;14(1):11.
- Yi H, Cho YJ, Yong D, Chun J. Genome Sequence of Escherichia coli J53, a Reference Strain for Genetic Studies. Journal of Bacteriology. 2012;194(14):3742-3.
- Baumann RLB, E. H.; Wiseman, J. S.; Vaal, M.; Nichols, J. S. Inhibition of Escherichia coli Growth and Diaminopimelic Acid Epimerase by 3-Chlorodiaminopimelic Acid. Antimicrobial Agents and Chemotherapy 1988;32:1119-23.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved