0:01
Concepts
3:53
Preparation of Donor and Recipient Strains
6:01
Conjugation
9:27
Data Analysis by Polymerase Chain Reaction (PCR)
11:29
Results
הטיות: שיטה להעברת עמידות אמפיצ'ין מתורם לנמען E. coli
מקור: אלכסנדר ס. גולד1, טוניה מ. קולפיטס1
1 המחלקה למיקרוביולוגיה, בית הספר לרפואה של אוניברסיטת בוסטון, המעבדות הלאומיות למחלות זיהומים מתעוררות, בוסטון, תואר שני
ההטיה, שהתגלתה לראשונה על ידי לדרברג וטאטום בשנת 1946, היא צורה של העברת גנים אופקית בין חיידקים הנשענת על מגע פיזי ישיר בין שני תאים חיידקיים (1). שלא כמו צורות אחרות של העברת גנים, כגון טרנספורמציה או טרנסדוקציה, הטיות הוא תהליך טבעי שבו דנ"א מופרש מתא תורם לתא נמען באופן חד-כיווני. כיווניות זו והיכולת של תהליך זה להגדיל את המגוון הגנטי של חיידקים העניקו להטיה את המוניטין כצורה של "הזדווגות" חיידקית, אשר ככל הנראה תרמה רבות לעלייה האחרונה בחיידקים עמידים לאנטיביוטיקה (2, 3). על ידי שימוש בלחצים סלקטיביים, למשל השימוש באנטיביוטיקה, ההטיה עברה מניפולציה לשימוש בסביבת המעבדה, מה שהופך אותה לכלי רב עוצמה להעברת גנים אופקית בין חיידקים, ובמקרים מסוימים מחיידקים ועד שמרים, צמחים ותאי בעלי חיים (4). מלבד יישומים במעבדה, העברת גנים חיידק-אאוקריוטה על ידי הטיות היא שדרה מרגשת של העברת DNA עם שפע של יישומים ביוטכנולוגיה אפשריים והשלכות טבעיות (5).
ההטיות נחשבות לפעולה על ידי "מנגנון דו-שלבי" (6). ראשית, לפני שניתן יהיה להעביר דנ"א כלשהו, על התא התורם ליצור קשר ישיר בין התא לתא עם הנמען. תהליך זה מאופיין בצורה הטובה ביותר בחיידקים גרם שלילי, הנחקר ביותר שבהם הוא Escherichia coli. קשר בין תא לתא נוצר על ידי נוכחות של רשת מורכבת של חוטים חוץ תאיים על התורם המכונה pilus המין, אלמנט הצמדי מקודד על ידי הגן להעברה המכונה F (פוריות) גורם (7, 8). בנוסף ליצירת קשר בין התורם לנמען, מספר חלבונים מועברים באמצעות פילוס המין לציטופלזמה של הנמען, ויוצרים צינור הפרשת סוג IV (T4SS) בין שני התאים, מבנה הכרחי לשלב השני של ההטיה, העברת DNA (6). על ידי שילוב פונקציה זו של פילוס המין עם שכפול מעגל מתגלגל של DNA, התא התורם מסוגל להעביר DNA בצורה של אלמנט ניתן להעברה, כגון plasmid או transposon, לנמען על ידי מודל "לירות ולשאוב" (6). במקרה זה, "הירי" הוא הובלת חלבון הפיילוט, עם DNA מקושר, על ידי T4SS לתא הנמען, ואת "שאיבה" הוא ההובלה הפעילה של DNA לנמען, תהליך הנשען על T4SS ומזרז על ידי חלבוני צימוד (6). המכונות המשמשות בתהליך זה מורכבות ממקור של רצף העברה (oriT), אשר חייב להיות מסופק על ידי ה- DNA בגנים cis ו trans, אשר מקודדים relaxase, קומפלקס היווצרות זוג בן זוג, סוג חלבון צימוד IV, והוא יכול להיות נוכח cis או טרנס (9). רגיעה זו מצמידה את אתר ה-nic בתוך רצף ה-OriT ומתחברת באופן קוולנטי לקצה ה-5' של הגדיל המועבר כדי לייצר את ה-relaxosome, קומפלקס דנ"א-relaxase חד-גדילי עם חלבוני עזר אחרים (9). לאחר שנוצר, relaxosome מתחבר קומפלקס היווצרות זוג הזדווגות, באמצעות סוג חלבון צימוד IV, המאפשר העברה של קומפלקס ssDNA-relaxase לתאי הנמען על ידי T4SS (10). פעם אחת בציטופלסמה של הנמען, ה- DNA יכול להשתלב בגנום המטופל או להתקיים בנפרד בצורה של פלסמיד, שכל אחד מהם מאפשר ביטוי של הגנים שלה.
בניסוי זה, זן תורם ההטיה הנפוץ E. coli WM3064 שימש להעברת קידוד הגן להתנגדות אמפיצלין לזן הנמען E. coli J53. בעוד ששני הזנים של החיידקים גרם שלילי היו עמידים טטרציקלין, רק זן התורם WM3064 היה הגן להתנגדות אמפיצלין, מקודד בווקטור המעבורת pWD2-oriT, והיה auxotrophic לחומצה diaminopimelic (DAP) (11-13). ניסוי זה כלל שני שלבים עיקריים, הכנת זנים של תורמים ומקבלים, ולאחר מכן העברת הגן עמידות אמפיצלין מתורם למקבל על ידי הטיות (איור 1).
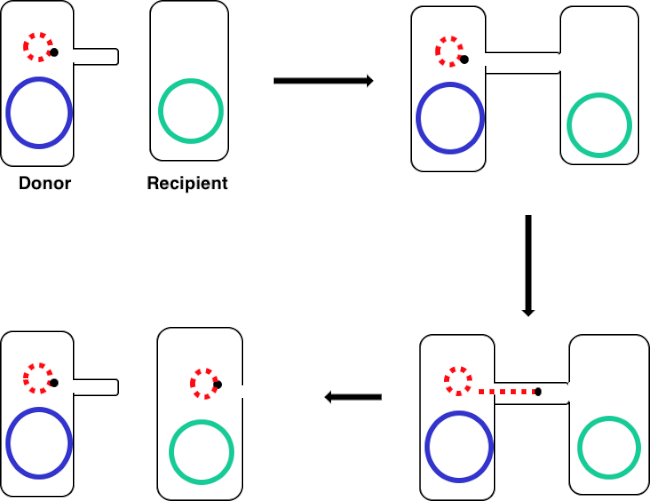
איור 1: שרטוט ההטיה. סכמטי זה מציג את ההעברה המוצלחת של פלסמיד, רק דוגמה אחת של רכיב DNA הניתן להעברה, מתא תורם לתא נמען באמצעות הטיות. לאחר מגע עם תא הנמען על ידי תא התורם באמצעות פילוס המין, הפלסמיד משכפל על ידי שכפול מעגל מתגלגל, עובר דרך קומפלקס הרב-פרוטיין המצטרף לשני התאים ויוצר פלסמיד חדש באורך מלא בתא הנמען.
על ידי דגירה של תאים תורמים ונמענים, ולאחר מכן ברצף ציפוי תאים אלה בנוכחות טטרציקלין ו- DAP, זה איפשר העברה מוצלחת של הגן עמידות אמפיצלין. תאי ציפוי רצופים שגדלו מתערובת זו בנוכחות טטרציקלין ואמפצילין, הסירו את כל התאים התורמים בשל היעדר DAP וכל תאי הנמען שאולי לא השיגו את הגן עמידות אמפיצלין, הניבו חיידקי זן J53 שקיבלו עמידות בפני אמפיצ'ין (איור 2). לאחר ביצוע, ההעברה המוצלחת של הגן עמידות אמפצילין אושרה על ידי PCR. מאז ההטיה הצליחה, זן J53 של E. coli הכיל pWD2-oriT והיה עמיד בפני אמפיצלין, ואת קידוד הגן עבור התנגדות זו ניתן לזהות על ידי PCR. עם זאת, אם לא הצליח לא היה זיהוי של הגן עמידות אמפצילין אמפצילין עדיין לתפקד כאנטיביוטיקה יעילה נגד זן J53.
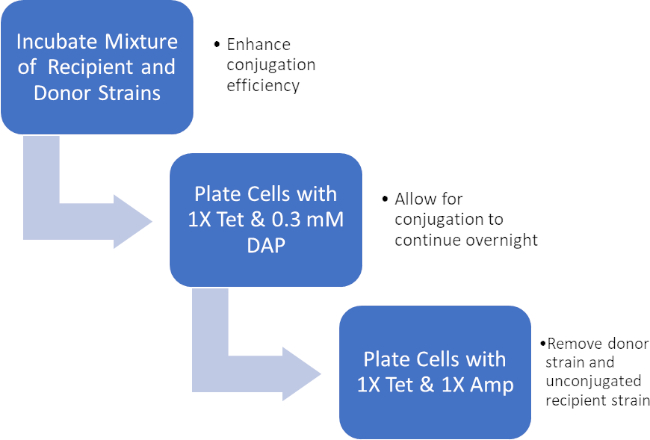
איור 2: שרטוט פרוטוקול. סכמטי זה מציג מבט כולל על הפרוטוקול המוצג.
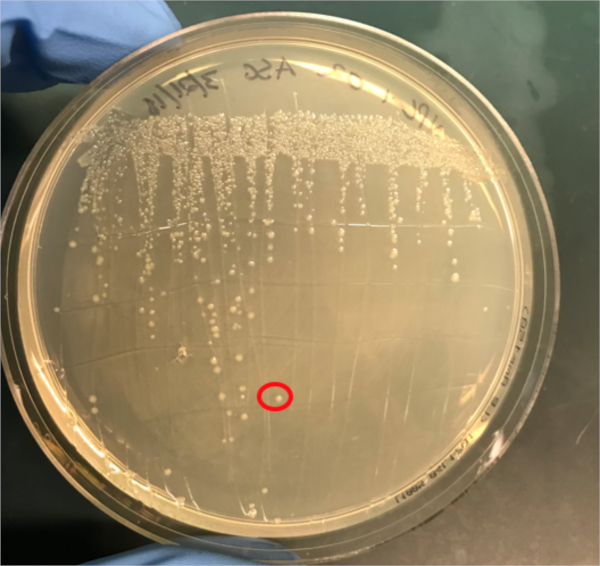
איור 3א: אישור ההטיות המוצלחות על ידי PCR. א) מלאי המקפיא של דגימות השליטה הצומדות והשליליות הושלכו על לוחות אגר ונבחרה מושבה (אדומה) לבידוד DNA.
1. הגדרת
- Autoclave כ 1L של לוריא-ברטאני בינוני (LB). זה סטרילי LB ישמש כדי להפוך כ 5 מ"ל של LB המכיל 0.3 mM חומצה diaminopimelic (DAP).
- לאסוף את הצלחות הבאות: צלחות אגר LB עם 1X טט ו 0.3 mM DAP, צלחות אגר LB עם 1X טט בלבד, ו צלחות אגר LB עם 1X Amp / Tet בלבד.
- ודא כי כמה גליצרל וקופסה של טיפים פיפטה פלסטיק מעוקר ?...
אם ההטיה הצליחה, מוצר PCR בגודל 500 בסיסים של הלהקה ייבחן בבאר שבה נטען תגובת PCR 1 (ובכן #2 באיור 3B), בעוד שלא יתבונן רצועות בבאר שבה נטען תגובת PCR 3 (ובכן #4 באיור 3B). נוכחותה של להקה זו מאשרת את ההעברה המוצלחת של הגן עמידות אמפיצלין, ובכך מעניקה עמידות אמפיצלין לזן J53 של E. coli.
...הטיות הוא תהליך טבעי של העברת גנים אופקית הנשען על קשר ישיר בין תא לתא של תא תורם ותא נמען. תהליך זה משותף בין כל סוגי החיידקים והיה אינסטרומנטלי באבולוציה חיידקית, בעיקר עמידות לאנטיביוטיקה. במעבדה, הטיות יכולות לשמש כשיטה יעילה להעברת גנים שהיא הרבה פחות מפריעה בהשוואה לטכניקות אחרות. מח...
- Lederberg J, Tatum, E.L. Gene recombination in Escherichia coli Nature. 1946;158:558.
- Holmes R.K. J, M.G. Genetics: Exchange of Genetic Information. 4th Edition ed. Baron S, editor. Galveston, TX: University of Texas Medical Branch at Galveston; 1996.
- Cruz F, Davies, J. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends in Microbiology. 2000;8:128-33.
- Llosa M, Cruz, F. Bacterial conjugation: a potential tool for genomic engineering. Ressearch in Microbiology. 2005;156:1-6.
- Lacroix B, Citovsky, V. Transfer of DNA from Bacteria to Eukaryotes. mBio. 2016;7(4):1-9.
- Llosa M, et al. Bacterial conjugation: a two-step mechanism for
- DNA transport. Molecular Microbiology. 2002;45:1-8.
- Grohmann E, Muth, G., Espinosa, M. Conjugative Plasmid Transfer in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 2003;67:277-301.
- Firth N, Ippen-Ihler, K, Skurray, RA. Structure and function of the F factor and mechanism of conjugation. Escherichia coli and salmonella: cellular and molecular biology. 1996;2:2377-401.
- Smillie C, Garcillan-Barcia MP, Francia MV, Rocha EPC, De La Cruz F. Mobility of Plasmids. Microbiology and Molecular Biology Reviews. 2010;74(3):434-52.
- Cascales E. Definition of a Bacterial Type IV Secretion Pathway for a DNA Substrate. 2004;304(5674):1170-3.
- Wang P, Yu Z, Li B, Cai X, Zeng Z, Chen X, et al. Development of an efficient conjugation-based genetic manipulation system for Pseudoalteromonas. Microbial Cell Factories. 2015;14(1):11.
- Yi H, Cho YJ, Yong D, Chun J. Genome Sequence of Escherichia coli J53, a Reference Strain for Genetic Studies. Journal of Bacteriology. 2012;194(14):3742-3.
- Baumann RLB, E. H.; Wiseman, J. S.; Vaal, M.; Nichols, J. S. Inhibition of Escherichia coli Growth and Diaminopimelic Acid Epimerase by 3-Chlorodiaminopimelic Acid. Antimicrobial Agents and Chemotherapy 1988;32:1119-23.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved