0:01
Concepts
3:53
Preparation of Donor and Recipient Strains
6:01
Conjugation
9:27
Data Analysis by Polymerase Chain Reaction (PCR)
11:29
Results
Conjugación: Un método para transferir resistencia a ampicilina de un donante a una E. Coli receptora
Fuente: Alexander S. Gold1, Tonya M. Colpitts1
1 Departamento de Microbiología, Escuela de Medicina de la Universidad de Boston, Laboratorios Nacionales de Enfermedades de Infecciones Emergentes, Boston, MA
Descubierto por primera vez por Lederberg y Tatum en 1946, la conjugación es una forma de transferencia de genes horizontal entre bacterias que se basa en el contacto físico directo entre dos células bacterianas (1). A diferencia de otras formas de transferencia de genes, como la transformación o la transducción, la conjugación es un proceso natural en el que el ADN se secreta de una célula donante a una célula receptora de manera unidireccional. Esta direccionalidad y la capacidad de este proceso para aumentar la diversidad genética de las bacterias ha dado a la conjugación la reputación como una forma de "mate" bacteriano, que se cree que ha contribuido en gran medida al reciente aumento de los antibióticos resistentes bacterias (2, 3). Mediante el uso de presiones selectivas, por ejemplo el uso de antibióticos, la conjugación ha sido manipulada para su uso en el entorno de laboratorio, lo que la convierte en una poderosa herramienta para la transferencia horizontal de genes entre bacterias, y en algunos casos de bacterias a levaduras, plantas y animales células (4). Aparte de las aplicaciones en el laboratorio, la transferencia del gen de la bacteria-eucariota por conjugación es una emocionante vía de transferencia de ADN con una multitud de posibles aplicaciones biotécnicas e implicaciones naturales (5).
Se cree que la conjugación funciona mediante un "mecanismo de dos pasos" (6). En primer lugar, antes de que se pueda transferir cualquier ADN, la célula donante debe hacer contacto directo de célula a célula con el receptor. Este proceso se ha caracterizado mejor en bacterias gramnegativas, la más estudiada de las cuales es Escherichia coli. El contacto célula a célula se establece mediante la presencia de una compleja red de filamentos extracelulares en el donante conocido como sex pilus, un elemento conjugado codificado por el gen transferible conocido como factor F (fertilidad) (7, 8). Además de establecer el contacto entre el donante y el receptor, varias proteínas se transportan a través del pilus sexual al citoplasma receptor, formando un conducto del sistema de secreción tipo IV (T4SS) entre las dos células, una estructura necesaria para el segundo paso de conjugación, transferencia de ADN (6). Al combinar esta función del sex pilus con la replicación del círculo rodante del ADN, la célula donante es capaz de transferir ADN en forma de un elemento transposable, como un plásmido o transposón, al receptor mediante un modelo de "disparo y bomba" (6). En este caso, el "disparo" es el transporte de la proteína piloto, con ADN vinculado, por el T4SS a la célula receptora, y el "bomba" es el transporte activo de ADN al receptor, un proceso que depende del T4SS y catalizado por el acoplamiento de proteínas (6). La maquinaria utilizada en este proceso se compone de un origen de la secuencia de transferencia (oriT), que debe ser proporcionada por el ADN en cis y genes trans, que codifican una relaxasa, complejo de formación de pares de parejas, y proteína de acoplamiento tipo IV, y puede estar presente en cis o trans (9). Esta relajara corta el sitio nic dentro de la secuencia de oriT y se une covalentemente al extremo de 5' de la hebra transferida para producir el relajante, un complejo de ADN-relaxasa de una sola cadena con otras proteínas auxiliares (9). Una vez formado, el relajantese se conecta al complejo de formación del par de apareamiento, a través de la proteína de acoplamiento tipo IV, que permite la transferencia del complejo ssDNA-relaxasa a las células receptoras por el T4SS (10). Una vez en el citoplasma del receptor, el ADN puede integrarse en el genoma del receptor o existir por separado en forma de plásmido, cualquiera de los cuales permite la expresión de sus genes.
En este experimento, se utilizó la cepa de donante de conjugación ampliamente utilizada E. coli WM3064 para transferir la codificación genética para la resistencia a la ampicilina a la cepa receptora E. coli J53. Mientras que ambas cepas de las bacterias gramnegativas eran resistentes a la tetraciclina, sólo la cepa de donante WM3064 tenía el gen de la resistencia a la ampicilina, codificado en el vector de transbordador pWD2-oriT, y era auxotrópico al ácido diaminopimélico (DAP) (11-13). Este experimento consistió en dos pasos principales, la preparación de cepas de donantes y receptores, seguido según la transferencia del gen de resistencia a la ampicilina del donante al receptor por conjugación (Figura 1).
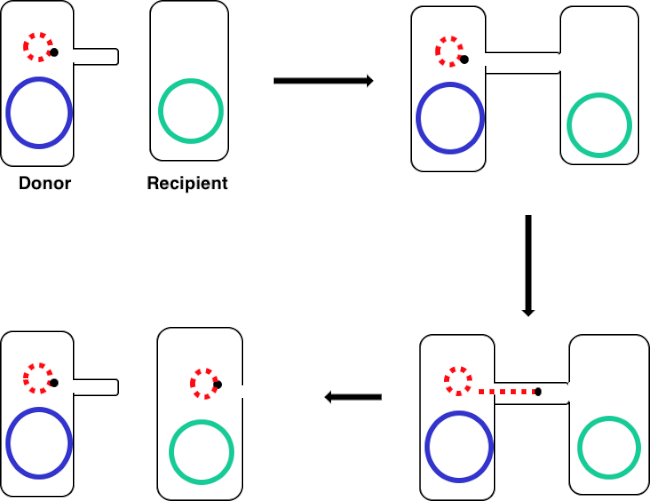
Figura 1: Esquema de conjugación. Este esquema muestra la transferencia exitosa de un plásmido, solo un ejemplo de un elemento de ADN transposable, de una célula donante a una célula receptora mediante conjugación. Tras el contacto con la célula receptora por la célula donante a través del sex pilus, el plásmido se replica mediante la replicación del círculo rodante, se mueve a través del complejo multiproteico que une las dos células y forma un nuevo plásmido de longitud completa en la célula receptora.
Al incubar una mezcla de células receptoras y donantes, y luego enchapar sucesivamente estas células en presencia de tetraciclina y DAP, esto permitió la transferencia exitosa del gen de resistencia a la ampicilina. Sucesivamente células de chapado cultivadas a partir de esta mezcla en presencia de tetraciclina y ampicilina, eliminaron todas las células del donante debido a la falta de DAP y cualquier célula receptora que no haya obtenido el gen de resistencia a la ampicilina, produciendo una cepa J53 estrictamente receptora bacterias que adquirieron resistencia a la ampicilina (Figura 2). Una vez realizada, la transferencia exitosa del gen de resistencia a la ampicilina fue confirmada por PCR. Dado que la conjugación tuvo éxito, la cepa J53 de E. coli contenía pWD2-oriT y era resistente a la ampicilina, y la codificación genética para esta resistencia es detectable por PCR. Sin embargo, de no tener éxito no habría habido detección del gen de resistencia a la ampicilina y la ampicilina seguiría funcionando como un antibiótico eficaz contra la cepa J53.
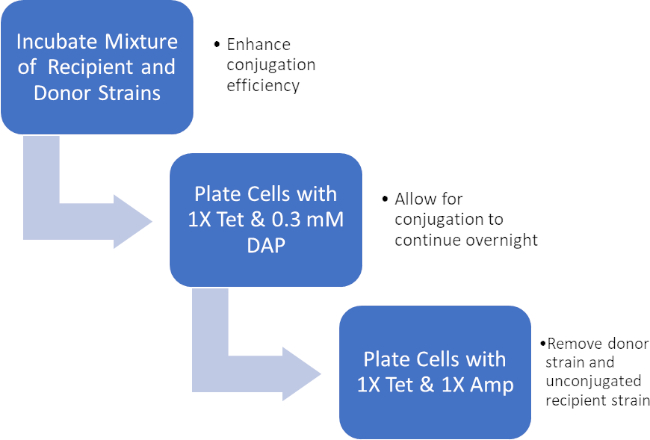
Figura 2: Esquema de protocolo. Este esquema muestra una visión general del protocolo presentado.
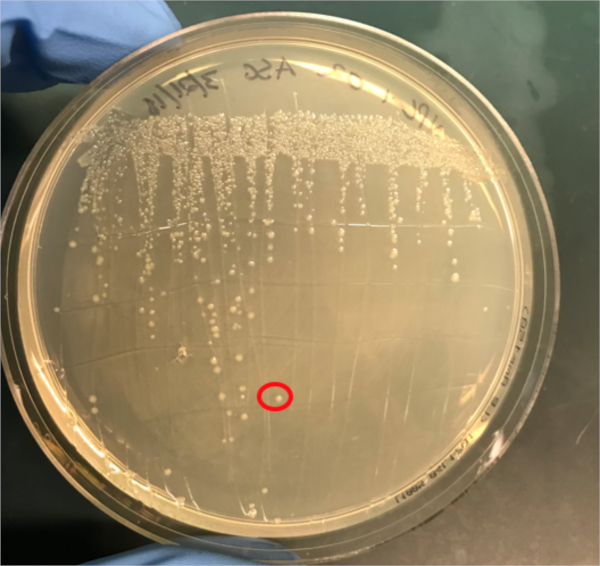
Figura 3A: La confirmación de la conjugación exitosa por PCR. A) Las existencias de congelador de las muestras de control conjugadas y negativas fueron rayadas en placas de agar y se seleccionó una colonia (roja) para el aislamiento del ADN.
1. Configuración
- Autoclave aproximadamente 1L de medio Luria-Bertani (LB). Este LB estéril se utilizará para hacer aproximadamente 5 ml de LB que contengan 0,3 mM de ácido diaminopimelico (DAP).
- Recoger las siguientes placas: placas de agar LB con 1X Tet y 0.3 mM DAP, placas de agar LB con 1X Tet solamente, y placas de agar LB con 1X Amp/Tet solamente.
- Asegúrese de que un poco de glicerol y una caja de puntas de pipeta de plástico preesterilizadas estén cerca. <...
Si la conjugación tuvo éxito, se observará un producto PCR de banda de par base 500 en el pozo en el que se cargó la reacción 1 de PCR (bien #2 en la Figura 3B), mientras que no se observará ninguna banda en el pozo en el que se cargó la reacción 3 de PCR (Bien #4 en la Figura 3B). La presencia de esta banda confirma la transferencia exitosa del gen de resistencia a la ampicilina, confiriendo así la resistencia a la ampicilina a la cepa J53 de E. coli.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
La conjugación es un proceso natural de transferencia de genes horizontal que se basa en el contacto directo de célula a célula de una célula donante y una célula receptora. Este proceso se comparte entre todo tipo de bacterias y ha sido fundamental en la evolución bacteriana, sobre todo en la resistencia a los antibióticos. En el laboratorio, la conjugación se puede utilizar como un método eficaz de transferencia de genes que es mucho menos disruptivo en comparación con otras técnicas. Fuera del laboratorio, ...
- Lederberg J, Tatum, E.L. Gene recombination in Escherichia coli Nature. 1946;158:558.
- Holmes R.K. J, M.G. Genetics: Exchange of Genetic Information. 4th Edition ed. Baron S, editor. Galveston, TX: University of Texas Medical Branch at Galveston; 1996.
- Cruz F, Davies, J. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends in Microbiology. 2000;8:128-33.
- Llosa M, Cruz, F. Bacterial conjugation: a potential tool for genomic engineering. Ressearch in Microbiology. 2005;156:1-6.
- Lacroix B, Citovsky, V. Transfer of DNA from Bacteria to Eukaryotes. mBio. 2016;7(4):1-9.
- Llosa M, et al. Bacterial conjugation: a two-step mechanism for
- DNA transport. Molecular Microbiology. 2002;45:1-8.
- Grohmann E, Muth, G., Espinosa, M. Conjugative Plasmid Transfer in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 2003;67:277-301.
- Firth N, Ippen-Ihler, K, Skurray, RA. Structure and function of the F factor and mechanism of conjugation. Escherichia coli and salmonella: cellular and molecular biology. 1996;2:2377-401.
- Smillie C, Garcillan-Barcia MP, Francia MV, Rocha EPC, De La Cruz F. Mobility of Plasmids. Microbiology and Molecular Biology Reviews. 2010;74(3):434-52.
- Cascales E. Definition of a Bacterial Type IV Secretion Pathway for a DNA Substrate. 2004;304(5674):1170-3.
- Wang P, Yu Z, Li B, Cai X, Zeng Z, Chen X, et al. Development of an efficient conjugation-based genetic manipulation system for Pseudoalteromonas. Microbial Cell Factories. 2015;14(1):11.
- Yi H, Cho YJ, Yong D, Chun J. Genome Sequence of Escherichia coli J53, a Reference Strain for Genetic Studies. Journal of Bacteriology. 2012;194(14):3742-3.
- Baumann RLB, E. H.; Wiseman, J. S.; Vaal, M.; Nichols, J. S. Inhibition of Escherichia coli Growth and Diaminopimelic Acid Epimerase by 3-Chlorodiaminopimelic Acid. Antimicrobial Agents and Chemotherapy 1988;32:1119-23.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved