0:02
Concepts
3:01
Preparation of Donor Phage Lysate
4:50
Transduction
8:39
Data Analysis by Quantitative Polymerase Chain Reaction
10:01
Results
Transduction via bactériophage : méthode de transfert de la résistance à l'ampicilline du donneur au receveur E. coli
Source: Alexander S. Gold1, Tonya M. Colpitts1
1 Département de microbiologie, Boston University School of Medicine, National Emerging Infections Diseases Laboratories, Boston, MA
La transduction est une forme d'échange génétique entre les bactéries qui utilise des bactériophages, ou phages, une classe de virus qui infecte exclusivement les organismes procaryotes. Cette forme de transfert d'ADN, d'une bactérie à l'autre par le phage, a été découverte en 1951 par Norton Zinder et Joshua Ledererg, qui ont appelé le processus de « transduction » (1). Les bactériophages ont été découverts pour la première fois en 1915 par le bactériologiste britannique Frederick Twort, puis découverts de façon indépendante en 1917 par le microbiologiste canadien Français Felix d'Herelle (2). Depuis lors, la structure et la fonction de ces phages ont été largement caractérisées (3), divisant ces phages en deux classes. Les premiers de ces cours sont les phages lytiques qui, lors de l'infection, se multiplient dans la bactérie hôte, perturbant le métabolisme bactérien, lysant la cellule et libérant des phages de descendance (4). En raison de cette activité antibactérienne et de la prédominance croissante des bactéries résistantes aux antibiotiques, ces phages lytiques se sont récemment avérés utiles comme traitement de remplacement pour des antibiotiques. La deuxième de ces classes sont les phages lysogéniques qui peuvent soit se multiplier dans l'hôte par le cycle lytique ou entrer dans un état de quiescent dans lequel leur génome est intégré dans celui de l'hôte (figure 1), un processus connu sous le nom de lysogénie, avec la capacité de phage production à être induite dans plusieurs générations ultérieures (4).
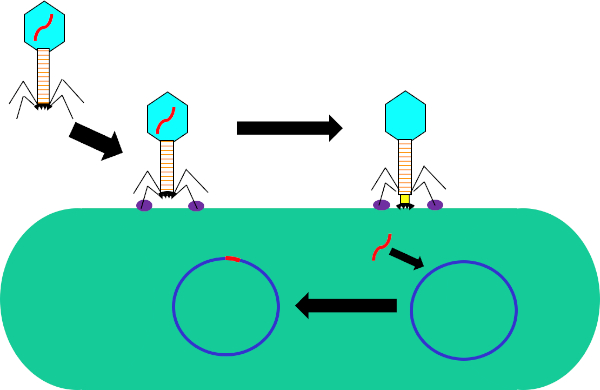
Figure 1 : Infection de la cellule hôte par bactériophage. Adsorption par le phage à la paroi cellulaire bactérienne par des interactions entre les fibres de la queue et le récepteur (violet). Une fois sur la surface de la cellule, le phage est irréversiblement attaché à la cellule bactérienne à l'aide de la plaque de base (noir) qui est déplacé vers la paroi cellulaire par la gaine contractile (jaune). Le génome phage (rouge) entre alors dans la cellule et s'intègre dans le génome de la cellule hôte.
Bien que la transduction bactérienne soit un processus naturel, l'utilisation de la technologie moderne a été manipulée pour le transfert de gènes en bactéries en laboratoire. En insérant des gènes d'intérêt dans le génome d'un phage lysogène, comme le phage, on est capable de transférer ces gènes dans les génomes des bactéries et, par conséquent, de les exprimer à l'intérieur de ces cellules. Alors que d'autres méthodes de transfert de gènes, telles que la transformation, utilisent un plasmide pour le transfert et l'expression des gènes, l'insertion du génome phage dans celui de la bactérie recevable a non seulement le potentiel de conférer de nouveaux traits à cette bactérie, mais permet également mutations naturelles et d'autres facteurs de l'environnement cellulaire pour modifier la fonction du gène transféré.
Par rapport à d'autres méthodes de transfert horizontal de gènes, comme la conjugaison, la transduction est assez souple dans les critères requis pour les cellules du donneur et du receveur. Tout élément génétique qui peut s'insérer dans le génome du phage utilisé peut être transféré de n'importe quelle souche de bactéries donneuses à n'importe quelle souche de bactéries receveurs tant que les deux sont permissifs au phage, nécessitant l'expression des récepteurs phages nécessaires sur le surfaces cellulaires. Une fois que ce gène est déplacé hors du génome du donneur et emballé dans le phage, il peut être transféré au receveur. Après la transduction, il est nécessaire de sélectionner pour les bactéries récepteurs qui contiennent le gène d'intérêt doivent être sélectionnés pour. Cela pourrait être fait par l'utilisation d'un marqueur génétique, comme un FLAG-tag ou polyhistidine-tag, pour marquer le gène d'intérêt, ou la fonction intrinsèque du gène, dans le cas des gènes qui codent pour la résistance aux antibiotiques. En outre, PCR pourrait être utilisé pour confirmer davantage la transduction réussie. En utilisant des amorces pour une région dans le gène d'intérêt et en comparant le signal à un contrôle positif, les bactéries qui ont le gène d'intérêt, et un contrôle négatif, les bactéries qui ont subi les mêmes étapes que la réaction de transduction sans phage. Bien que la transduction bactérienne soit un outil utile en biologie moléculaire, elle a joué et continue de jouer un rôle important dans l'évolution des bactéries, en particulier en ce qui concerne l'augmentation récente de la résistance aux antibiotiques.
Dans cette expérience, la transduction bactérienne a été utilisée pour transférer l'encodage génétique pour la résistance à l'ampicilline antibiotique de la souche W3110 d'E. coli à la souche J53 via le bactériophage P1 (5). Cette expérience se composait de deux étapes principales. Tout d'abord, la préparation du phage P1 contenant le gène de résistance à l'ampicilline de la souche du donneur. Deuxièmement, le transfert de ce gène à la souche receveuse par transduction avec le phage P1 (figure 1). Une fois effectué, le transfert réussi du gène de résistance à l'ampicilline pourrait être déterminé par qPCR (figure 2). Si la transduction était réussie, la souche J53 de E. coli serait résistante à l'ampicilline, et le gène conférant cette résistance détectable par qPCR. En cas d'échec, il n'y aurait aucune détection du gène de résistance à l'ampicilline et l'ampicilline fonctionnerait toujours comme un antibiotique efficace contre la souche J53.
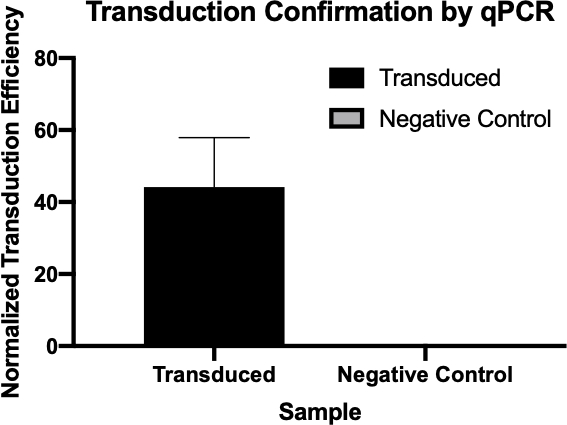
Figure 2 : Confirmation d'une transduction réussie par qPCR. En comparant les valeurs Cq détectées pour le gène d'intérêt de la réaction de transduction et de la réaction de contrôle négative, et en normalisant ces valeurs par rapport à un gène d'entretien ménager, on a pu confirmer que la transduction bactérienne a été réussie.
1. Mise en place
- Avant de commencer tout travail impliquant des microbes, stériliser l'espace de travail à l'aide de 70% d'éthanol. Utilisez toujours le PPE nécessaire (manteau de laboratoire et gants).
- Assurez-vous que les plaques d'agar LB avec 1x ampicilline, solution de lysate phage P1 disponible dans le commerce, chloroforme, 1 M de citrate de sodium, le glycérol, et une boîte de pointes de pipette en plastique pré-stérilisé et les épandeurs de cellules sont à portée ...
Le transfert de gènes vers et depuis les bactéries par bactériophage, bien qu'il s'avère un processus naturel, s'est avéré extrêmement utile pour une multitude de fins de recherche. Tandis que d'autres méthodes de transfert de gène telles que la transformation et la conjugaison sont possibles, la transduction utilise uniquement des bactériophages ; permettant non seulement l'intégration des gènes dans le génome hôte, mais aussi la livraison de gènes à plusieurs bactéries qui ne sont pas sensibles à d'au...
- Lederberg J, Lederberg E.M., Zinder, N.D., et al. Recombination analysis of bacterial heredity. Cold Spring Harbor symposia Quantitative Biol. 1951;16:413-43.
- Duckworth DH. "Who Discovered Bacteriophage?". Bacteriology Reviews. 1976;40:793-802.
- Yap ML, Rossman, M.G. Structure and Function of Bacteriophage T4. Future Microbiol. 2014;9:1319-27.
- Sulakvelidze A, Alavidze, Z., Morris, J. G. Bacteriophage Therapy Antimicrobial Agents and Chemotherapy 2001;45(3):649-59.
- Moore S. Sauer:P1vir phage transduction 2010 [Available from: https://openwetware.org/wiki/Sauer:P1vir_phage_transduction].
- Kobayashi A, et al. Growth Phase-Dependent Expression of Drug Exporters in
- Escherichia coli and Its Contribution to Drug Tolerance. Journal of Bacteriology. 2006;188(16):5693-703.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.
- Pálffy R. et al. Bacteria in gene therapy: bactofection versus alternative gene therapy. Gene Ther. 2006 13:101-5.
- O'Neill JM, et al. Intestinal delivery of non-viral gene therapeutics: physiological barriers and preclinical models. Drug Discovery Today. 2011;16:203-2018.
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved