11.17 : المواد الصلبة المعدنية
تتشكل المواد الصلبة المعدنية مثل بلورات النحاس والألومنيوم والحديد بواسطة ذرات معدنية. غالباً ما يوصف هيكل البلورات المعدنية بأنه توزيع موحد للنواة الذرية داخل “بحر” من الإلكترونات غير الموضعية. تتماسك الذرات الموجودة في مادة صلبة معدنية كهذه معاً بواسطة قوة فريدة تُعرف باسم الرابطة المعدنية والتي تؤدي إلى العديد من الخصائص المفيدة والمتنوعة.
تظهر جميع المواد الصلبة المعدنية موصلية حرارية وكهربائية عالية وبريق معدني وقابلية للتطويع. كثير منهم قاسٍ جداً وقوي جداً. بسبب قابليتها للطرق (القدرة على التشوه تحت الضغط أو الطرق)، فإنها لا تتحطم، وبالتالي، فإنها تصنع مواد بناء مفيدة. تختلف نقاط انصهار المعادن على نطاق واسع. الزئبق سائل في درجة حرارة الغرفة، وتذوب المعادن القلوية إلى أقل من 200 °C. تحتوي العديد من معادن ما بعد الانتقال أيضاً على نقاط انصهار منخفضة، بينما تذوب المعادن الانتقالية عند درجات حرارة أعلى من 1000 °C. تعكس هذه الاختلافات الاختلافات في قوة الترابط المعدني بين المعادن.
خصائص المواد الصلبة المعدنية
نظراً لتركيبها البلوري، تُظهر المواد الصلبة المعدنية بعض الخصائص الفريدة المرتبطة بالهيكل وقد تم وضعها في الجدول في الجدول التالي.
| نوع صلب | نوع الجسيمات | نوع عوامل الجذب | الخصائص | أمثلة |
| معدني | ذرات العناصر الكهربية الإيجابية | روابط معدنية | لامع، قابل للطرق، مرين، ينفذ الحرارة والكهرباء جيداً، وصلابة متغيرة ودرجة حرارة انصهار | Cu ، Fe ، Ti ، Pb ، U |
التركيب البلوري للمواد الصلبة المعدنية: تغليف محكم
يمكن أن تحتوي المواد الصلبة التي تتكون من ذرات متطابقة على نوعين من الترتيبات: مربعة أو متراصة (الشكل 1). نظراً لأن التعبئة القريبة تزيد من التجاذبات الإجمالية بين الذرات وتقليل إجمالي الطاقة بين الجزيئات ، فإن الذرات في معظم المعادن تتراكم بهذه الطريقة.

Figure 1.مربع مقابل مجموعة متقاربة مغلقة.
وجدنا نوعين من التعبئة الأقرب في الهياكل المعدنية البلورية البسيطة: التعبئة الأقرب سداسية الشكل (HCP)، والتعبئة الأقرب التكعيبية (CCP). كلاهما يتكون من طبقات متكررة من ذرات مرتبة سداسية. في كلا النوعين، توضع طبقة ثانية (ب) على الطبقة الأولى (أ) بحيث تلامس كل ذرة في الطبقة الثانية ثلاث ذرات في الطبقة الأولى. يتم وضع الطبقة الثالثة بإحدى طريقتين.
في HCP، تكون الذرات الموجودة في الطبقة الثالثة أعلى الذرات مباشرةً في الطبقة الأولى (أي أن الطبقة الثالثة هي أيضًا من النوع A)، ويتكون التراص من النوع A والنوع B المترابطين (على سبيل المثال ، ABABAB⋯) (الشكل 2 أ).
في CCP، لا تكون الذرات الموجودة في الطبقة الثالثة فوق الذرات في أي من الطبقتين الأوليين (أي الطبقة الثالثة من النوع C)، ويتكون التراص من النوع A والنوع B والنوع C المتقارب طبقات معبأة (مثل ABCABCABC⋯) (الشكل 2 ب). الترتيبات المكعبة المتمركزة على الوجه (FCC) وترتيبات CCP هي في الواقع نفس الهياكل مع تعبئة مضغوطة للذرات، وتشغل 74٪ من الحجم.
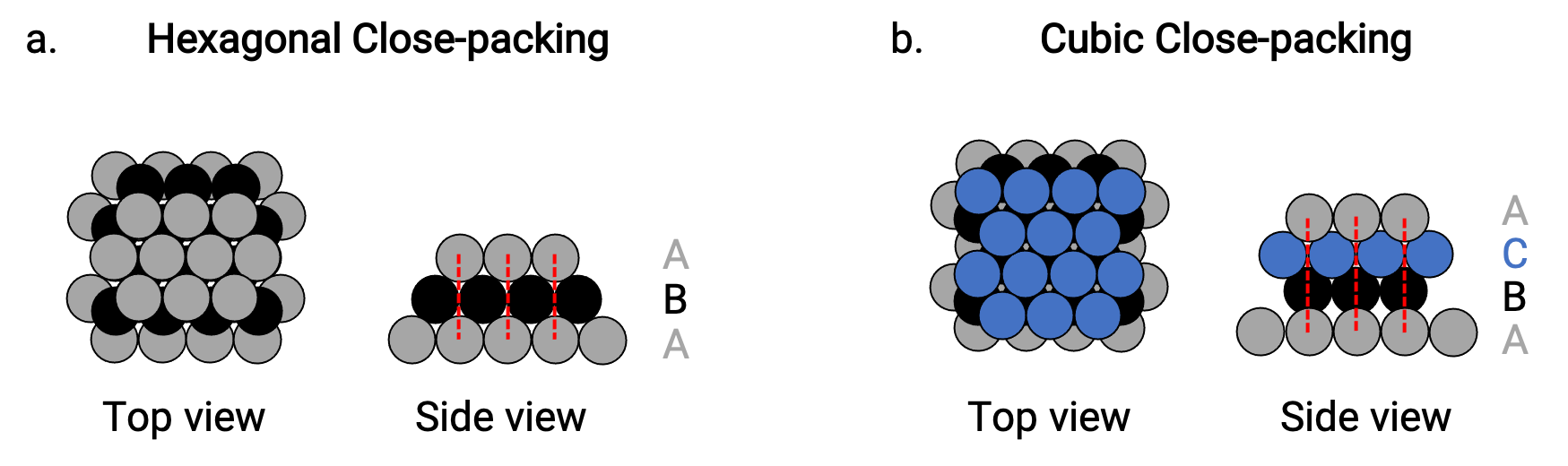
Figure 2. (a) يتكون التغليف القريب السداسي من طبقتين متناوبتين (ABABAB…). المكعب (b) المقرب المكعب يتكون من ثلاث طبقات متناوبة (ABCABCABC…).
في كلا نوعي التعبئة، تلامس كل ذرة ست ذرات في طبقتها الخاصة، وثلاث في الطبقة أعلاه، وثلاث في الطبقة التي تحتها. وبالتالي فإن كل ذرة تلامس 12 بالقرب من الجيران وبالتالي يكون لها رقم تنسيق 12.
يتبلور حوالي ثلثي جميع المعادن في المصفوفات الأكثر حزماً بأرقام تناسقية من 12. المعادن التي تتبلور في هيكل HCP تشمل Cd و Co و Li و Mg و Na و Zn والمعادن التي تتبلور في تشتمل بنية CCP على Ag و Al و Ca و Cu و Ni و Pb و Pt.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Sections 10.5 The Solid State of Matter, and 10.6 Lattice Structures in Crystalline Solids.
Tags
From Chapter 11:

Now Playing
11.17 : المواد الصلبة المعدنية
Liquids, Solids, and Intermolecular Forces
18.0K Views

11.1 : مقارنة جزيئية بين الغازات والسوائل والمواد الصلبة
Liquids, Solids, and Intermolecular Forces
40.1K Views

11.2 : القوى بين الجزيئية مقابل القوى الجزيئية
Liquids, Solids, and Intermolecular Forces
84.8K Views

11.3 : القوى بين الجزيئات
Liquids, Solids, and Intermolecular Forces
56.1K Views

11.4 : مقارنة القوى بين الجزيئيات
Liquids, Solids, and Intermolecular Forces
43.5K Views

11.5 : التوتر السطحي والعمل الشعري واللزوجة
Liquids, Solids, and Intermolecular Forces
27.3K Views

11.6 : انتقالات المرحلة
Liquids, Solids, and Intermolecular Forces
18.6K Views

11.7 : انتقالات المرحلة: التبخير والتكثيف
Liquids, Solids, and Intermolecular Forces
17.0K Views

11.8 : ضغط البخار
Liquids, Solids, and Intermolecular Forces
33.9K Views

11.9 : معادلة كلاوزيوس-كلايبرون
Liquids, Solids, and Intermolecular Forces
55.1K Views

11.10 : انتقالات المرحلة: الذوبان والتجميد
Liquids, Solids, and Intermolecular Forces
12.2K Views

11.11 : انتقالات المرحلة: التصاعد والترسب
Liquids, Solids, and Intermolecular Forces
16.5K Views

11.12 : منحنيات التسخين والتبريد
Liquids, Solids, and Intermolecular Forces
22.2K Views

11.13 : مخطّطات المرحلة
Liquids, Solids, and Intermolecular Forces
38.8K Views

11.14 : تراكيب المواد الصلبة
Liquids, Solids, and Intermolecular Forces
13.6K Views
See More
Copyright © 2025 MyJoVE Corporation. All rights reserved