13.1 : معدّل التفاعل
معدل التفاعل هو التغير في كمية المادة المتفاعلة أو المنتج لكل وحدة زمنية. لذلك يتم تحديد معدلات التفاعل عن طريق قياس الاعتماد الزمني لبعض الخصائص التي يمكن أن تكون مرتبطة بكميات المادة المتفاعلة أو المنتج. معدلات التفاعلات التي استهلاك أو إنتاج المواد الغازية ، على سبيل المثال، يتم تحديدها بشكل ملائم عن طريق قياس التغيرات في الحجم أو الضغط.
التمثيل الرياضي للتغير في تركيز المواد المتفاعلة والنواتج، بمرور الوقت، هو التعبير المعدل للتفاعل. تشير الأقواس إلى التركيزات المولية ، ويشير رمز دلتا (Δ) إلى “التغيير في.”
على سبيل المثال، تركيز بيروكسيد الهيدروجين، H2O2 ، في محلول مائي يتغير ببطء بمرور الوقت حيث يتحلل وفقًا للمعادلة:
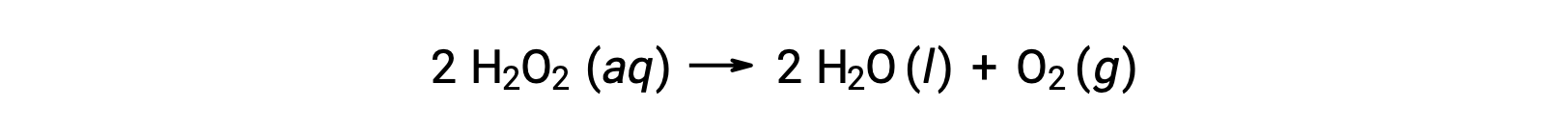
يمكن التعبير عن معدل تحلل بيروكسيد الهيدروجين من حيث معدل تغير تركيزه:

وهكذا ، فإن[H2O2]t1 يمثل التركيز المولي لبيروكسيد الهيدروجين في وقت آخر t2؛ وبالمثل، يمثل [H 2 O 2 ] t 2 التركيز المولي لـ بيروكسيد الهيدروجين في وقت لاحق t 2 ؛ و Δ[H2O2] يمثل التغير في التركيز المولي لبيروكسيد الهيدروجين خلال الفترة الزمنيةΔt (أي t2 − t1). نظرًا لأن تركيز المادة المتفاعلة ينخفض مع استمرار التفاعل، فإن Δ[H2O2] هي كمية سالبة. معدلات التفاعل هي، حسب الاصطلاح، كميات موجبة، ولذا فإن هذا التغيير السلبي في التركيز مضروب في −1.
متوسط معدل التفاعل ومعدل التفاعل الفوري
تختلف معدلات التفاعل مع الوقت وتنخفض مع استمرار التفاعل. يمكن حساب متوسط معدل التفاعل على مدى فترة زمنية باستخدام التركيزات في بداية ونهاية هذه الفترة، والتي يتغير خلالها معدل التفاعل. في أي وقت محدد، يُعرف المعدل الذي يسير فيه التفاعل باسم معدله اللحظي. المعدل اللحظي للتفاعل عند “الوقت صفر,” عندما يبدأ التفاعل، يكون معدله الأولي.
يمكن تحديد معدل التفاعل الفوري بإحدى الطريقتين. إذا سمحت الظروف التجريبية بقياس تغيرات التركيز على فترات زمنية قصيرة ، فإن حساب المعدلات المتوسطة يوفر تقديرات تقريبية جيدة بشكل معقول للمعدلات الآنية. بدلاً من ذلك ، يمكن استخدام إجراء رسومي. على سبيل المثال ، في مثال تحلل بيروكسيد الهيدروجين ، من خلال رسم تركيز بيروكسيد الهيدروجين مع الوقت ، يمكن حساب معدل التحلل الفوري لـ H2O2 في أي وقت ‘t’ من منحدر الظل المرسوم على المنحنى في ذلك الوقت.
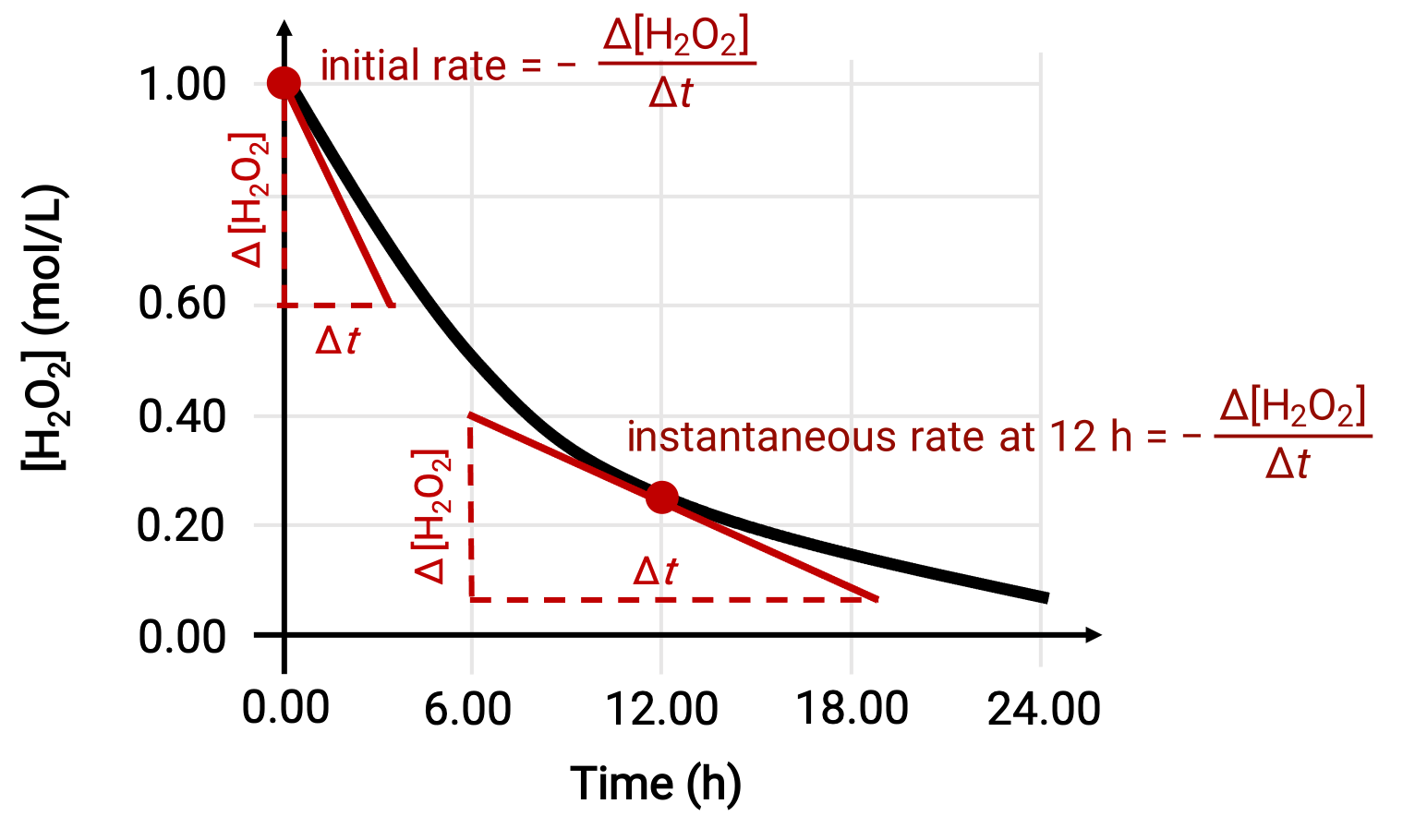
يوضح هذا الرسم البياني مخططًا للتركيز مقابل الوقت لحل 1.000 M من H2O2. المعدل في أي وقت يساوي سالب ميل خط مماس للمنحنى في ذلك الوقت. يتم عرض الظل في t = 0 ساعة (“المعدل الأولي”) وعند t = 12 ساعة (“المعدل الفوري” عند 12 ساعة).
المعدلات النسبية لردود الفعل
يمكن التعبير عن معدل التفاعل على أنه التغيير في تركيز أي مادة متفاعلة أو منتج. بالنسبة إلى أي تفاعل معين ، ترتبط جميع تعبيرات المعدل هذه ببعضها البعض وفقًا لقياسات العناصر المتفاعلة. معدل التفاعل العامaA ⟶ bB يمكن التعبير عن B من حيث الانخفاض في تركيز A أو زيادة تركيز B. وترتبط هاتان التعبيرات المعدلان بقياسات العناصر المتكافئة للتفاعل ، حيث:
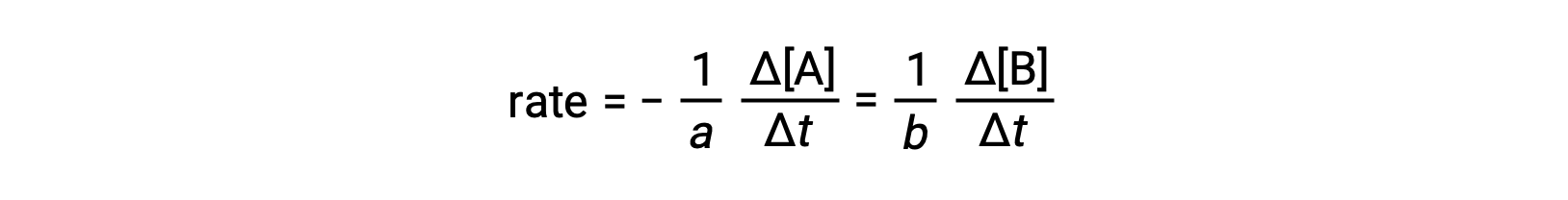
لاحظ أنه تم تضمين علامة سالبة كعامل لحساب الإشارات المعاكسة لتغييرات المقدار (كمية المادة المتفاعلة تتناقص أثناء زيادة كمية المنتج).
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 12 Introduction andOpenstax, Chemistry 2e, Section 12.1: Chemical Reaction Rates.
From Chapter 13:

Now Playing
13.1 : معدّل التفاعل
Chemical Kinetics
51.3K Views

13.2 : قياس معدّلات التفاعل
Chemical Kinetics
24.5K Views

13.3 : قانون التركيز والمعدّل
Chemical Kinetics
30.1K Views

13.4 : تحديد ترتيب التفاعل
Chemical Kinetics
55.1K Views

13.5 : قانون المعدّل المتكامل: اعتماد التركيز على الوقت
Chemical Kinetics
34.5K Views

13.6 : نصف عمر التفاعل
Chemical Kinetics
34.3K Views

13.7 : نظية الاصطدام
Chemical Kinetics
81.1K Views

13.8 : مخطّطات أرهينيوس
Chemical Kinetics
38.6K Views

13.9 : آليات التفاعل
Chemical Kinetics
25.4K Views

13.10 : خطوات تحديد المعدّل
Chemical Kinetics
31.7K Views

13.11 : التحفيز
Chemical Kinetics
26.6K Views

13.12 : الانزيمات
Chemical Kinetics
80.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved