13.1 : Reaksiyon Hızı
Reaksiyon hızı, birim zamanda bir reaktan veya ürün miktarındaki değişikliktir. Bu nedenle reaksiyon hızları, reaktan veya ürün miktarları ile ilgili olabilecek bazı özelliklerin zamana bağlılığı ölçülerek belirlenir. Örneğin, gaz halindeki maddeleri tüketen veya üreten reaksiyon hızları, hacim veya basınçtaki değişiklikler ölçülerek uygun şekilde belirlenir.
Zaman içinde reaktanların ve ürünlerin konsantrasyonundaki değişimin matematiksel temsili, reaksiyon için hız ifadesidir. Parantezler molar konsantrasyonları gösterir ve delta (Δ) sembolü “değişimi” belirtir.
Örneğin, sulu bir çözelti içindeki hidrojen peroksit, H2O2'nin konsantrasyonu, denkleme göre ayrışırken zamanla yavaşça değişir:
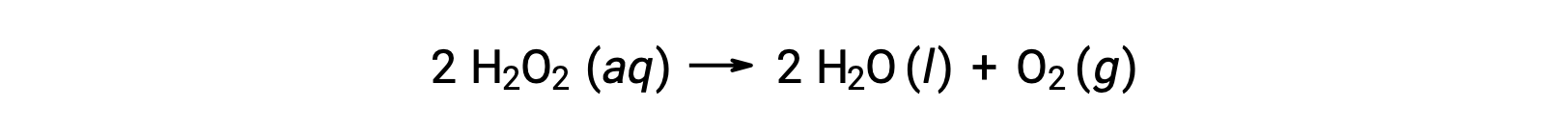
Hidrojen peroksidin parçalanma hızı, konsantrasyonunun değişim hızı cinsinden ifade edilebilir:

Dolayısıyla [H2O2]t1, t1 zamanında hidrojen peroksitin molar konsantrasyonunu temsil eder; benzer şekilde [H2O2]t2, daha sonraki bir t2 zamanındaki hidrojen peroksit molar konsantrasyonunu temsil eder; ve Δ[H2O2], Δt zaman aralığı boyunca hidrojen peroksitin molar konsantrasyonundaki değişimi temsil eder (yani, t2−t1). Reaksiyon ilerledikçe reaktan konsantrasyonu azaldığından, Δ[H2O2] negatif bir miktardır. Reaksiyon oranları, geleneksel olarak pozitiftir. miktarları ve dolayısıyla konsantrasyondaki bu negatif değişiklik −1 ile çarpılır.
Ortalama reaksiyon hızı ve anlık reaksiyon hızı
Reaksiyon oranları zamanla değişir ve reaksiyon ilerledikçe azalır. Bir zaman aralığı boyunca ortalama bir reaksiyon hızı, reaksiyon hızının değiştiği bu periyodun başındaki ve sonundaki konsantrasyonlar kullanılarak hesaplanabilir. Herhangi bir belirli zamanda, bir reaksiyonun ilerleme hızı, anlık hızı olarak bilinir. Reaksiyon başladığında “sıfır anında” bir reaksiyonun anlık hızı, başlangıç hızıdır.
Bir reaksiyonun anlık hızı, iki yoldan biriyle belirlenebilir. Deneysel koşullar, kısa zaman aralıklarında konsantrasyon değişikliklerinin ölçülmesine izin veriyorsa, ortalama oranların hesaplanması, anlık oranların makul ölçüde iyi tahminlerini sağlar. Alternatif olarak bir grafik prosedür kullanılabilir. Örneğin, hidrojen peroksit ayrışma örneğinde, zamana karşı hidrojen peroksit konsantrasyonunun grafiğini çizerek, H2O2'nin anlık ayrışma hızı, o anda eğriye çizilen bir tanjantın eğiminden ‘t’ herhangi bir zamanda hesaplanabilir.
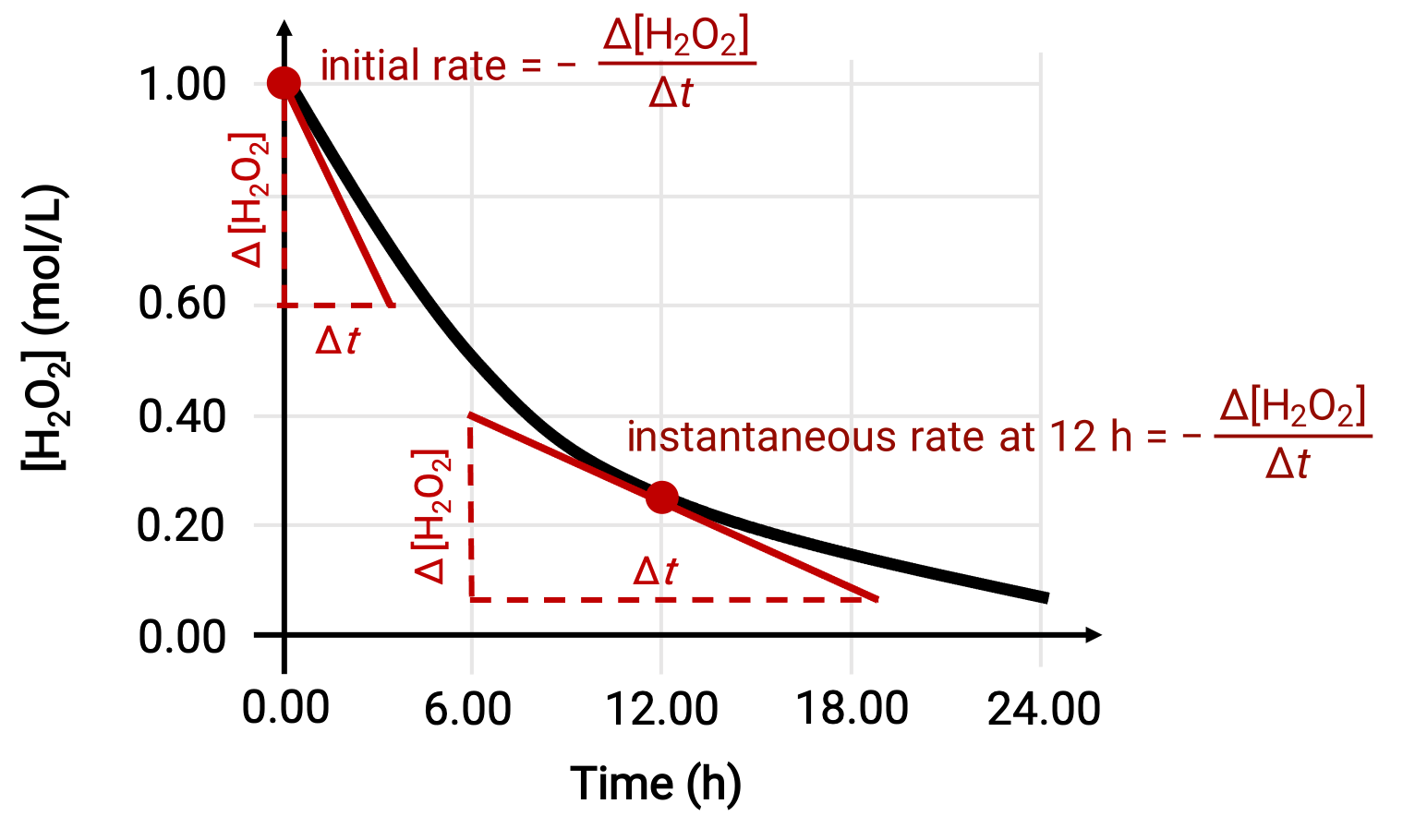
Bu grafik 1,000 M H2O2 çözeltisi için zamana karşı konsantrasyon grafiğini gösterir. Herhangi bir zamandaki oran, o andaki eğriye teğet olan bir doğrunun eğiminin negatifine eşittir. Teğetler t = 0 sa (başlangıç hızı) ve t = 12 sa (12 saate anlık hız) ile gösterilir.
Bağıl Reaksiyon Hızları
Bir reaksiyonun hızı, herhangi bir reaktan veya ürünün konsantrasyonundaki değişiklik olarak ifade edilebilir. Verilen herhangi bir reaksiyon için, bu hız ifadelerinin tümü, reaksiyon stokiyometrisine göre birbiriyle ilişkilidir. Genel reaksiyon aA ⟶ bB hızı, A konsantrasyonundaki azalma veya B konsantrasyonundaki artış olarak ifade edilebilir. Bu iki hız ifadesi reaksiyonun stokiyometrisi ile ilgilidir, burada:
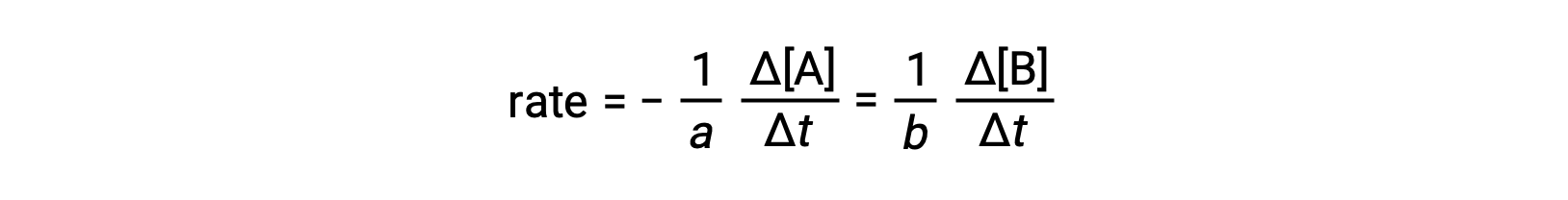
İki miktar değişikliğinin zıt işaretlerini hesaba katmak için bir faktör olarak negatif işaretin dahil edildiğine dikkat edin (ürün miktarı artarken reaktan miktarı azalmaktadır).
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Chapter 12 Introduction andOpenstax, Chemistry 2e, Section 12.1: Chemical Reaction Rates.
Bölümden 13:

Now Playing
13.1 : Reaksiyon Hızı
Kimyasal Kinetik
51.3K Görüntüleme Sayısı

13.2 : Reaksiyon Hızını Ölçme
Kimyasal Kinetik
24.5K Görüntüleme Sayısı

13.3 : Hız Yasasının Konsantre Hali
Kimyasal Kinetik
30.1K Görüntüleme Sayısı

13.4 : Dereceli Reaksiyonları Tanımlama
Kimyasal Kinetik
55.1K Görüntüleme Sayısı

13.5 : Entegre Oran Yasası: Konsantrasyonun Zamana Bağımlılığı
Kimyasal Kinetik
34.5K Görüntüleme Sayısı

13.6 : Bir Reaksiyonun Yarı Ömr
Kimyasal Kinetik
34.3K Görüntüleme Sayısı

13.7 : Reaksiyon Oranında Sıcaklık Bağımlılığı
Kimyasal Kinetik
81.1K Görüntüleme Sayısı

13.8 : Arrhenius Grafikleri
Kimyasal Kinetik
38.6K Görüntüleme Sayısı

13.9 : Reaksiyon Mekanizmaları
Kimyasal Kinetik
25.4K Görüntüleme Sayısı

13.10 : Oran Belirleyici Adımlar
Kimyasal Kinetik
31.7K Görüntüleme Sayısı

13.11 : Kataliz
Kimyasal Kinetik
26.6K Görüntüleme Sayısı

13.12 : Enzimler
Kimyasal Kinetik
80.7K Görüntüleme Sayısı
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır