بالنسبة لتفاعلات الطور الغازي، يمكن التعبير عن ثابت التوازن إما من حيث التركيزات المولية (Kc) أو الضغوط الجزئية (Kp) من المواد المتفاعلة والمنتجات. يمكن اشتقاق العلاقة بين قيمتي K هاتين القيمتين ببساطة من معادلة الغاز المثالية وتعريف المولارية. وفقًا لمعادلة الغاز المثالية:
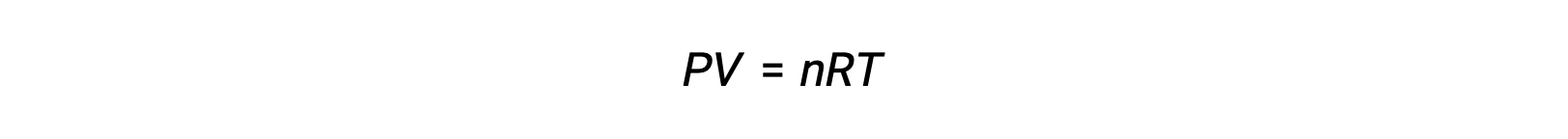
يُعزى التركيز المولي أو المولارية على عدد المولات مقسومًا على الحجم:
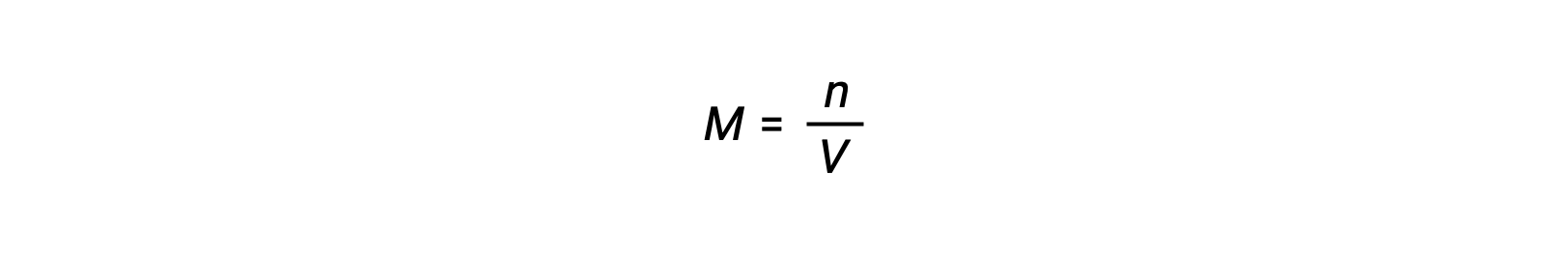
فإذاً,
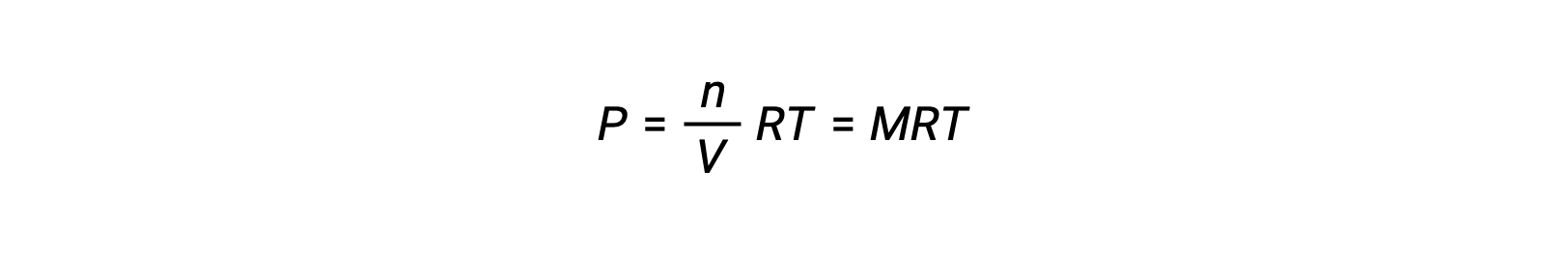
حيث أن P هو الضغط الجزئي، V هو الحجم، n هو عدد المولات، R هو ثابت الغاز، T هو درجة الحرارة، و M هو التركيز المولي.
لتفاعل الطور الغازي: m A + n B ⇌ x C + y D
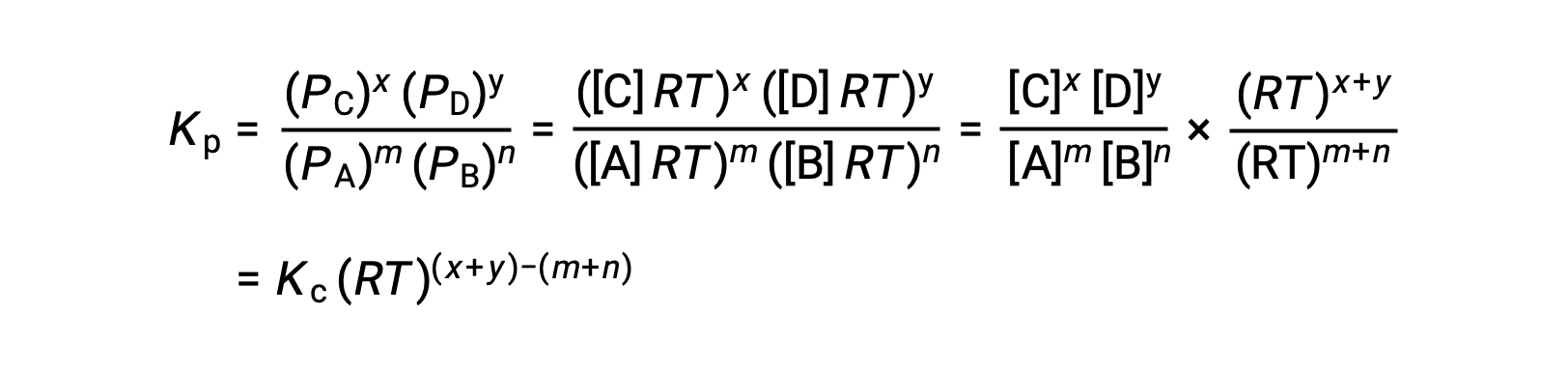
وهكذا، فإن العلاقة بينKc و KP هي
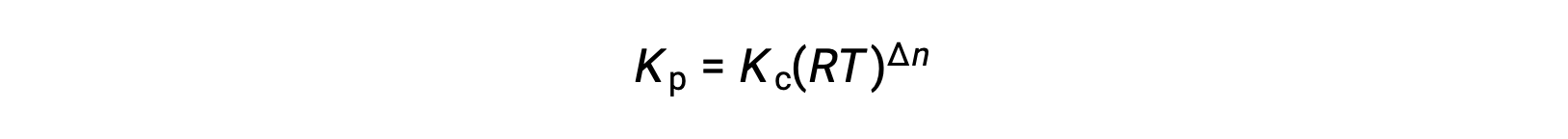
حيث أن Δn هو الفرق في الكميات المولية من المنتج والغازات المتفاعلة، في هذه الحالة:
p style="text-align: center">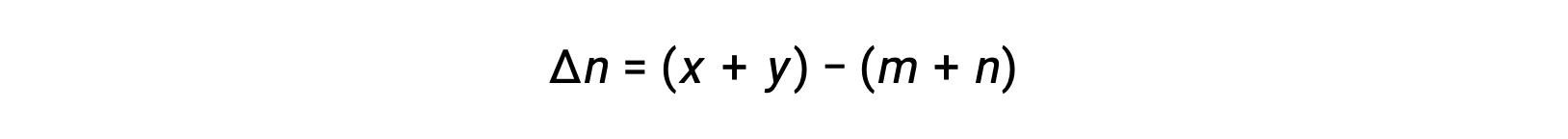
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
From Chapter 14:

Now Playing
14.3 : التوازن اللتفاعلات الغازية والتفاعلات غير المتجانسة
Chemical Equilibrium
23.2K Views

14.1 : التوازن الديناميكي
Chemical Equilibrium
48.5K Views

14.2 : ثابت التوازن
Chemical Equilibrium
45.0K Views

14.4 : حساب ثابت التوازن
Chemical Equilibrium
29.7K Views

14.5 : حاصل قسمة التفاعل
Chemical Equilibrium
47.1K Views

14.6 : حساب تركيزات التوازن
Chemical Equilibrium
46.0K Views

14.7 : مبدأ لوشاتيليير: تغيير التركيز
Chemical Equilibrium
56.3K Views

14.8 : مبدأ لوشاتيليير: تغيير الحجم (الضغط)
Chemical Equilibrium
33.2K Views

14.9 : مبدأ لوشاتيليير: تغيير درجة الحرارة
Chemical Equilibrium
28.2K Views

14.10 : الافتراض الصغير
Chemical Equilibrium
45.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved