بالمقارنة مع الماء النقي، تكون قابلية ذوبان المركب الأيوني أقل في المحاليل المائية التي تحتوي على أيون شائع (واحد ينتج أيضًا عن طريق انحلال المركب الأيوني). هذا مثال لظاهرة تُعرف باسم التأثير الأيوني المشترك، وهو نتيجة لقانون العمل الجماعي الذي يمكن تفسيره باستخدام مبدأ ȃلو شاتيلير’ ضع في اعتبارك انحلال يوديد الفضة:
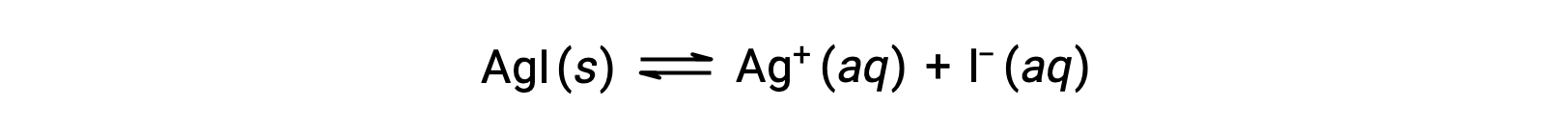
قد يتم إزاحة توازن الذوبان هذا إلى اليسار عن طريق إضافة أيونات الفضة أو اليوديد، مما يؤدي إلى ترسيب AgI وانخفاض تركيزات Ag+ and I– المذابة. في المحاليل التي تحتوي بالفعل على أي من هذه الأيونات، قد يتم إذابة كمية أقل من AgI مقارنة بالحلول التي لا تحتوي على هذه الأيونات.
يمكن أيضًا تفسير هذا التأثير من حيث التأثير الكلّي كما هو موضح في تعبير منتج الذوبان:
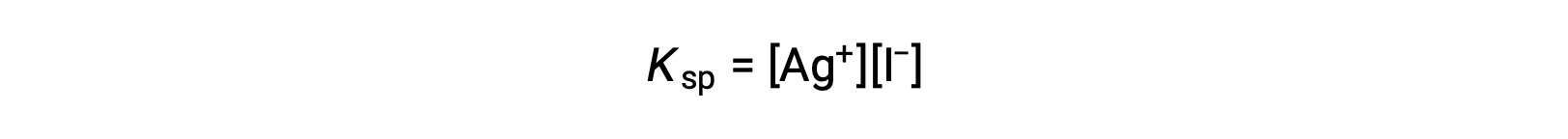
الناتج الحسابي للفضة ومولاريات أيون اليوديد ثابت في خليط التوازن بغض النظر عن مصدر الأيونات، وبالتالي يجب موازنة الزيادة في تركيز أيون’ واحد بانخفاض نسبي في الآخر. < / ص>
دور الترسيب في معالجة مياه الصرف الصحي
موازنة الذوبان هي أدوات مفيدة في معالجة المياه العادمة التي تتم في المنشآت التي قد تعالج المياه البلدية في مدينة أو بلدة. على وجه التحديد، يتم استخدام الترسيب الانتقائي لإزالة الملوثات من مياه الصرف قبل إطلاقها مرة أخرى في المسطحات المائية الطبيعية. على سبيل المثال، غالبًا ما توجد أيونات الفوسفات (PO43−) في المياه التي يتم تصريفها من مرافق التصنيع. تؤدي وفرة الفوسفات إلى نمو الطحالب الزائدة، مما يؤثر على كمية الأكسجين المتاحة للحياة البحرية بالإضافة إلى جعل المياه غير مناسبة للاستهلاك البشري.
تتمثل إحدى الطرق الشائعة لإزالة الفوسفات من الماء في إضافة هيدروكسيد الكالسيوم أو الجير Ca(OH)2. نظرًا لأن الماء يصبح قاعديًا أكثر، تتفاعل أيونات الكالسيوم مع أيونات الفوسفات لإنتاج هيدروكسيل أباتيت، Ca5(PO4)3·OH، والتي تترسب بعد ذلك من المحلول:
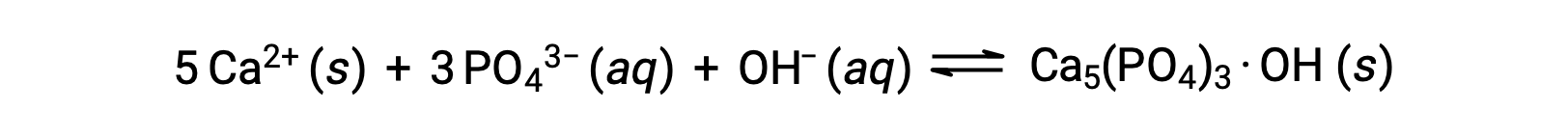
نظرًا لأن كمية أيون الكالسيوم المضافة لا تؤدي إلى تجاوز نواتج الذوبان لأملاح الكالسيوم الأخرى، فإن الأنيونات الموجودة في تلك الأملاح تظل متخلفة في مياه الصرف. ثم تتم إزالة الراسب بالترشيح، ويعود الماء إلى درجة حموضة محايدة عن طريق إضافة CO2 في عملية إعادة كربنة. يمكن أيضاً استخدام مواد كيميائية أخرى لإزالة الفوسفات عن طريق الترسيب، بما في ذلك كلوريد الحديد (III) وكبريتات الألومنيوم.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
From Chapter 16:

Now Playing
16.11 : العوامل المؤثّرة على الذويان
Acid-base and Solubility Equilibria
32.8K Views

16.1 : تأثير الأيون الشائع
Acid-base and Solubility Equilibria
40.7K Views

16.2 : المحاليل المنظِّمة
Acid-base and Solubility Equilibria
163.1K Views

16.3 : معادلة هندرسون هاسلبالخ
Acid-base and Solubility Equilibria
67.8K Views

16.4 : حساب تغيرات الرقم الهيدروجيني (pH) في محلول منظِّم
Acid-base and Solubility Equilibria
52.3K Views

16.5 : فعالية المحلول المنظِّم
Acid-base and Solubility Equilibria
48.3K Views

16.6 : حسابات المعايرة: حمض قوي-قاعدة قوية
Acid-base and Solubility Equilibria
28.8K Views

16.7 : حسابات المعايرة: حمض ضعيف-قاعدة ضعيفة
Acid-base and Solubility Equilibria
43.6K Views

16.8 : المؤشّرات
Acid-base and Solubility Equilibria
47.6K Views

16.9 : معايرة حمض بوليبروتيك
Acid-base and Solubility Equilibria
95.5K Views

16.10 : توازنات الذوبان
Acid-base and Solubility Equilibria
51.4K Views

16.12 : تكوين الأيونات المعقّدة
Acid-base and Solubility Equilibria
23.0K Views

16.13 : ترسيب الأيونات
Acid-base and Solubility Equilibria
27.3K Views

16.14 : التحليل النوعي
Acid-base and Solubility Equilibria
19.9K Views

16.15 : منحنيات معايرة القاعدة الحمضية
Acid-base and Solubility Equilibria
125.8K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved