A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أساليب التلاعب التجريبية بعد Transection العصب البصري الثدييات في الجهاز العصبي المركزي
* These authors contributed equally
In This Article
Erratum Notice
Summary
العصب البصري transection هو النموذج المستخدم على نطاق واسع من اصابة الجهاز العصبي المركزي للبالغين. هذا نموذج مثالي لأداء عدد من المعالجات التجريبية التي تستهدف الشبكية عالميا أو تستهدف مباشرة السكان من الخلايا العصبية جرح العقدة الشبكية.
Abstract
خلايا الشبكية العقدة (RGCs) هي الجهاز العصبي المركزي الخلايا العصبية التي خرج المعلومات البصرية من الشبكية إلى الدماغ عبر العصب البصري. يمكن الوصول إلى العصب البصري ضمن المدار من العين ومقطوع تماما (axotomized) ، قطع المحاوير من سكان RGC بأكمله. العصب البصري transection هو نموذج يمكن استنساخه من خلية موت مبرمج العصبية في الجهاز العصبي المركزي للبالغين 1-4. هذا النموذج هو جاذبية خاصة لأن الغرفة الزجاجية للعين بمثابة كبسولة لتسليم المخدرات إلى شبكية العين ، مما يتيح التلاعب التجريبية عن طريق الحقن داخل المقلة. نشر المواد الكيميائية من خلال السائل الزجاجي يضمن أن تعمل على السكان RGC بأكمله. ويمكن أيضا النواقل الفيروسية ، أو قصيرة البلازميدات الرناوات التدخل (siRNAs) يتم تسليمها إلى الغرفة الزجاجية لتصيب خلايا الشبكية أو transfect 12/05. وtropism عالية من الغدة المرتبطين بها نواقل (AAV) فيروسات هو مفيد لRGCs الهدف ، مع معدل الاصابة تقترب من 90 ٪ من الخلايا بالقرب من موقع الحقن 6 ، 7 ، 13-15. وعلاوة على ذلك ، يمكن RGCs transfected بشكل انتقائي من خلال تطبيق siRNAs ، البلازميدات أو ناقلات فيروسية إلى نهاية قطع من العصب البصري 16-19 أو عن طريق الحقن في ناقلات هدفهم في أكيمة متفوقة 10. هذا يسمح للباحثين لدراسة آليات أفكارك في عدد سكان العصبية دون آثار جرح التباس على الخلايا العصبية المارة أخرى أو الدبقية المحيطة بها. RGC موت الخلايا المبرمج كانت فيه خصلة الوقت طبعا حيث يتم تأخير موت الخلية 3-4 أيام postaxotomy ، وبعد ذلك تتحول هذه الخلايا بسرعة. وهذا يوفر نافذة للتلاعب تجريبية موجهة ضد المتورطين في مسارات موت الخلايا المبرمج. وتجرى المناورات التي تستهدف بشكل مباشر RGCs من الجدعة مقطوع العصب البصري في وقت axotomy ، مباشرة بعد قطع العصب. في المقابل ، عندما يتم تسليم المواد عبر طريق العين ، ويمكن حقنها قبل الجراحة أو في غضون 3 أيام الأولى بعد الجراحة ، وذلك قبل الشروع في موت الخلايا المبرمج في RGCs axotomized. في هذه المادة ، ونحن عدة طرق لإثبات التلاعب التجريبية بعد transection العصب البصري.
Protocol
1. تقنية جراحية
- وينبغي إجراء تجارب على استخدام تقنية العقيم والبروتوكولات التالية استخدام الحيوانات لمؤسسة معينة. ويجب أن الأدوات والمواد (المحاليل والمواد اختبار ، واستشفاف والإبر وغيرها) ملامسة الأنسجة الحية تكون معقمة لمنع العدوى والآثار السلبية على رفاهية الحيوان والتأثيرات السلبية المحتملة على هذه الدراسة.
2. خدر
- وسوف تكون مخدرة الفئران باستخدام نظام المرذاذ isoflurane البيطرية. استخدام الطبي الأكسجين الصف بمعدل 0.8 لتر / دقيقة لتبخير الغاز isoflurane. وضع الحيوانات في المربع التخدير المرفقة والطلب في تركيز isoflurane من 4 ٪ حتى التنفس قد تباطأ والحيوان هو رزين.
- المقبل ، والتبديل تدفق الغاز الى غاز مرفق قناع للإطار التجسيمي ووضع الحيوان في الجهاز التجسيمي. تحويل تركيز isoflurane أسفل إلى 2 ٪ ورصد التخدير. قد الحيوانات الكبيرة (> 300g) تتطلب تركيز أعلى من isoflurane. وينبغي رصد تخدير خلال الجراحة والدواء isoflurane تبعا لذلك. وينبغي أن عمق ومعدل التنفس تقييم مستمر ، ويجب أن يتم تنفيذ إصبع التقييم قرصة (كل 5 دقائق) لعدم وجود الألم العميق.
- بمجرد اكتمال عملية جراحية ، إيقاف isoflurane والسماح للحيوان للأوكسجين التنفس لعدة دقائق قبل إزالة من الجهاز التجسيمي. ينبغي الحفاظ على درجة حرارة الجسم من خلال تغطية الحيوانية ببطانية جراحية و / أو استخدام بطانية تنظيم التدفئة أثناء الجراحة.
3. التحضير للحقن حقنة داخل بصري
- أولا ، تجميع نظام حقنة لأداء حقن العين. ويستخدم 10 ميكرولتر RN Gastight الحقنة هاملتون 1701 للحقن. إزالة أية إبرة أو RN الحاضر الجوز في نهاية الحقنة.
- إدراج الطويق PFA في كأس PEEK الطويق من المناسب الضغط. ثم إدراج تركيب الكامل في نهاية حقنة والمسمار الجوز RN فضفاضة أكثر من رأس.
- إدراج واحدة من نهاية الأنبوب PEEK 16/01 بوصة في ضغط المناسب ، من خلال فتحة في الجوز RN. تأكد من الجذور تماما أنابيب PEEK. تشديد الجوز RN لضغط الطويق ، وختم الأنابيب PEEK.
- تنفيذ الخطوة 3.2 على طرفي مقرنة مزدوجة الزجاج RN. نعلق نهاية خالية من أنابيب نظرة خاطفة إلى واحدة من نهاية مقرنة مزدوجة الزجاج RN من خلال تشديد الجوز RN.
- وسوف micropipette الزجاج سحبت شكل الإبرة وللبرميل للنظام الحقن. استخدام 1.5 مم OD أنابيب زجاجية سميكة الجدران الشعرية لتلفيق الماصات الزجاج ، وإدراج ماصة الزجاج في نهاية خالية من الزجاج المزدوج مقرنة RN. تشديد الجوز RN لإصلاح ماصة في المكان.
- غيض غرامة micropipettes الزجاج سحبت هو عادة صغير جدا لإجراء عمليات الحقن داخل المقلة. من أجل إنشاء غيض من القطر المناسب ، وكسر غيض من الزجاج ماصة تحت التوجيه البصري ، وذلك باستخدام الميكروسكوب الجراحي. هي مناسبة تماما في نهاية متجمد من الزجاج شريحة عينة لكسر ماصة. عقد ماصة بزاوية وفرك غيض على طول صقيع زجاج لخلق فاصل. من الناحية المثالية ، ينبغي أن الطرف المشطوف النهائي قليلا. ان الامر قد يستغرق عدة محاولات لإنتاج معلومات جيدة ، وسحب ذلك ماصات متعددة قبل الاستخدام.
- نظام الحقن الهيدروليكي. لذا ، يجب ملء المحقنة ، PEEK رابط الأنابيب ، والزجاج المزدوج مقرنة RN وmicropipette الزجاج مع الزيوت المعدنية قبل الاستخدام. استخدام عدة الاشعال من الحقنة شركة هاميلتون (PRMKIT) ، وملء محقنة فتيلة مع الزيوت المعدنية. استخدام إبرة قطرها كبيرة للسماح بمرور سهلة من النفط اللزج. استبدال الإبرة مع الإبرة 90030 هاملتون التي تناسبها داخل برميل من الحقنة هاميلتون 10 ميكرولتر. المقبل ، وضع الحاجز المطاطي على الإبرة 90030 هاملتون ، من أجل توفير ختم بينما حقن الزيوت المعدنية.
- إدراج 90030 هاميلتون إبرة المحقنة فتيلة في الجزء الخلفي للبرميل من 10 المحاقن هاميلتون ميكرولتر من نظام الحقن. اضغط على الحاجز مشددة ضد نهاية حقنة لإنشاء الختم.
- خفض ببطء الغطاس. سترى تمرير الزيت المعدني من خلال العناصر الزجاجية لنظام الحقن ، وملء أخيرا ماصة الزجاج. دفع كل من النفط من خلال نظام حقن من أجل إزالة أي فقاعات الهواء على طول القناة. إذا حقنة ملء ينفد من الزيوت المعدنية ، وسحب الإبرة ببطء بينما الاستغناء باستمرار النفطية للحيلولة دون تشكيل فقاعة الهواء. الملء المحقنة فتيلة وحقن مرة أخرى.
- عندما يملأ النظام بأكمله مع الزيوت المعدنية وفقاعة مجانا ، إدراج المكبس الأصلي للحقنة هاميلتون 10 ميكرولتر. كساد الغطاس حتى نهاية رحلتها من أجل إزالة الزيوت المعدنية إضافية من النظام. مسح الزجاج النظيفة وmicropipette نهاية حقنة نظيفة مع الايثانول 70 ٪.
- Withdraث الغطاس من المحقنة إلى العلامة 2 ميكرولتر على برميل. وسوف نهاية micropipette الزجاج يمتلئ الهواء توفير منطقة عازلة بين الزيوت المعدنية والسوائل المراد حقنها. ويمكن الآن للبرميل ماصة يتم شغلها عن طريق وضع نهاية micropipette في الحل المطلوب ، وسحب الغواص من الحقنة هاملتون. لا تضخ أكثر من 4-5 ميكرولتر من الحل في العين الفئران البالغين.
4. حقن العين الداخلي : استهداف الشبكية عالميا
- مع تخدير الحيوان والمضمون في إطار التجسيمي (كما هو موضح في القسم 2) ، واستخدام قطرة العين Alcaine إلى تخدير موضعي القرنية. فتح الجفون بأصابعك ومكان قطرة واحدة من الحل مخدر على سطح القرنية.
- الحقن يتطلب شخصين : واحد لإدراج ماصة الزجاج في غرفة الزجاجية والحفاظ على موقف ماصة ، وأخرى لخفض الغطاس على الحقنة التي توفر الحل المنشود.
- تحت قبضة الجراحية ، المجهر micropipette الزجاج المزدوج والزجاج RN مقرنة مع أصابعك. نشر الجفون مع أصابع يدك حرة ، وتشكيل "V" الشكل قبالة موقع الحقن. من خلال تطبيق الجر إلى الأجفان ، وسوف تكون مرتفعة للعين خارج المدار ، وفضح السطح الخلفي وراء حوف. من خلال خلق "V" مع شكل الأصابع المقابلة لموقع الحقن ، ويتم تشكيل مهد للعين عند توفير الاستقرار عن طريق الحقن.
- بلطف إدراج غيض من خلال الزجاج micropipette الملتحمة ، في منطقة خالية من الأوعية الدموية ، ومن خلال الصلبة ، في زاوية الهبوط. ينبغي أن تشعر أنك صغير "البوب" عندما تخترق ماصة صلبة. إدراج ماصة في زاوية الهبوط قليلا يقلل من فرصة إصابة العدسة عند إدخال الإبرة.
- يجب على الشخص الذي يمسك حقنة حقن الآن ميكرولتر 4 من الحل بالضغط على المكبس إلى العلامة 2 ميكرولتر على حقنة. ينبغي أن تأخذ حقن حوالي 1-2 ثانية في المجموع. عن طريق الحقن بمعدل بطيء جدا> 3 ثوان يقلل من انتشار الأولي من الحل من خلال الغرفة الزجاجية. سوف تكون قادرا على رؤية حل من خلال حقن بيغ الغرفة الزجاجية تحت المجهر ، وبالتالي التحقق من نجاح العملية.
- عقد micropipette المطرد لنحو 5 ثوان ثم بالانسحاب ، في نفس الاتجاه كما تم إدراج الإبرة. سوف يعود الملتحمة رفرف فوق فتحة صغيرة ، مما يساعد على اغلاق ثقب الصلبة.
- تغطي سطح القرنية مع مرهم العين للعين (دموع Naturale PM) من أجل منع جفاف القرنية خلال الانتعاش ، والعودة الى قفص الحيوانات الانتعاش.
- وينبغي أن تدار المسكنات بعد الجراحة وفقا للمبادئ التوجيهية للسلطات بلدكم رعاية الحيوانات ، وينبغي رصدها بعناية الحيوانات بعد الجراحة.
5. استهداف انتقائي خلايا الشبكية العقدة من القرمة العصب البصري
- تطبيق استشفاف ، والمخدرات ، وبلاسميدات وsiRNAs أو ناقلات فيروسية إلى جذع العصب البصري ، وبعد axotomy والأهداف مباشرة خلايا الشبكية العقدة من خلال النقل إلى الوراء. ويتم إنجاز هذا بواسطة تنفيذ أولا transection العصب البصري وفقا "لبروتوكول Transection العصب البصري" (22).
- هناك طريقتين رئيسيتين لتحقيق هذا الإجراء : جلفوم به ، أو عن طريق الحقن المباشر في العصب البصري.
- الأسلوب جلفوم مشابه لاقتفاء أثر رجعي ، ولكن عندما تقديم العلاجات التجريبية في العصب البصري من المستحسن أن يتم قبل تسمية خلايا العقدة عن طريق حقن الشبكية استشفاف الوراء في الأسبوع 1 أكيمة متفوقة قبل axotomy. وهذا أمر مهم لخلية تتبع لأنه ، في بعض الحالات العصبية استشفاف يمكن أن تتداخل مع نقل المواد التجريبية إلى الوراء أو العكس بالعكس.
- مباشرة بعد قطع العصب البصري ، يتم وضع قطعة صغيرة من جلفوم غارقة في الحل التجريبي عبر العصب البصري جدعة مقطوع. ثم يتم إرجاع محتويات موقعها المداري السابقة. عندما عاد العين الى موقف محايد من الضروري استخدام ملقط لدفع جزء من جلفوم أسفل إلى المدار ، وضمان ان يبقى على نهاية العصب البصري.
- تقنية الحقن أكثر فعالية لإيصال المواد التي يجب الوصول إلى السيتوبلازم من محور عصبي لكي يتم نقلها عن طريق تدفق retrogradely جبلة المحوار. ويشمل هذا siRNAs والبلازميدات ، وفي بعض الحالات النواقل الفيروسية. ويستخدم 50-10 حقنة لحقن هاميلتون ميكرولتر الحل المنشود في العصب البصري مقطوع.
- قبضة حافة العصب البصري مع غرامة ملقط دومون الحافة. إدراج نهاية الإبرة في العصب البصري ، وبالتوازي مع العصب ، حتى شطبة لم يعد مرئيا. وسيتم إدخال الإبرة المغطى من كل جانب على العصب. إبرة مع شطبة قصيرة أمر مرغوب فيه.
- ن مرة واحدةيتم إدراج eedle في الأعصاب ، والضغط برفق على جانبي العصب مع ملقط غيض الجميلة وتضخ ربع الحل في حين تناوب المحقنة واحد بدوره في اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة ربع العداد.
- يستمر تكرار الخطوة حتى 5،7 كنت قد أكملت دورة كاملة من إبر وحقن محتويات الحقنة. للحصول على أفضل النتائج لضخ ما مجموعه 10 ميكرولتر من محلول باستخدام gastight 10 المحاقن هاميلتون ميكرولتر.
- إزالة غيض من حقنة من العصبية. مغادرة حقن السوائل الزائدة التي قد رجع من العصب داخل المدار حيث سيؤدي ذلك إلى تشكيل تجمع إضافية لامتصاص نهايات المحاور العصبية.
- عودة محتويات المدارية الى مكانه الاصلي ، وأغلق الجرح ، والسماح للحيوان لاسترداد.
- وينبغي أن تدار المسكنات بعد الجراحة وفقا للمبادئ التوجيهية للسلطات بلدكم رعاية الحيوانات ، وينبغي رصدها بعناية الحيوانات بعد الجراحة.
6. ممثل النتائج :
حقن العين تستهدف جميع الخلايا في شبكية العين على الصعيد العالمي ، وتعمل بشكل جيد بالنسبة للمواد الخاضعة للتسليم RGCs جريح منذ توجد خلايا العقدة العصبية في طبقة أعمق من شبكية العين ، بالقرب من الغرفة الزجاجية. ويمكن أيضا أن تستهدف RGCs مباشرة من خلال تقديم المواد إلى جذع العصب البصري مقطوع. يمكن استهداف RGCs Fluorogold المسمى retrogradely باستخدام الببتيدات ، والمخدرات ، وناقلات ، وبلاسميدات ، أو siRNAs من الجذع العصبية كما هو موضح في الشكل 1. 1A - C الرقم يدل على توطين الببتيد Cy3 المسمى في somata من RGCs التي كانت تسمى قبل عن طريق حقن Fluorogold في أكيمة متفوقة. تم حقن Cy3 الببتيد المسمى في العصب البصري مباشرة بعد axotomy ، وكان تصوير شبكية العين على قيد الحياة من أجل منع الببتيدات من الرشح من خلال تثبيت الأنسجة. الرقم F - 1D يدل على توطين Cy3 siRNAs المسمى والتتبع الوراء Fluorogold في RGCs axotomized. تم حقن Cy3 siRNAs المسمى في الجذع العصب البصري مباشرة بعد axotomy ، وكان تصوير شبكية العين على قيد الحياة.
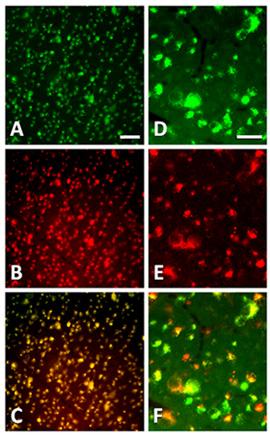
الشكل 1. micrographs Epifluorescence من RGCs في شبكية العين flatmounted في 1 بعد يوم وaxotomy حقن إما الببتيد المسمى أو siRNAs في جذع العصب البصري. (أ) إلى الوراء في وضع العلامات Fluorogold RGCs axotomized في postaxotomy 1 اليوم (B) في مضان Cy3 RGCs التالية نقل إلى الوراء من الببتيدات المسمى (1) ، بعد يوم والحقن axotomy الببتيد في العصب البصري. (C) تراكب من (أ) و (B) مما يدل على الانتقائية للتوطين Cy3 الببتيد المسمى في RGCs المسمى Fluorogold. (مدافع) وشغل أيضا على جثث خلية Fluorogold RGCs المسمى (D) مع Cy3 siRNAs المسمى (E) يحقن في العصب البصري جدعة 24 ساعة في وقت سابق ، كما هو مبين في تراكب (F). شريط النطاق في ميلان هو 50 ميكرومتر. شريط النطاق في DF هو 20 ميكرومتر.
Access restricted. Please log in or start a trial to view this content.
Discussion
العصب البصري transection هو نموذج للتكرار للغاية من الخلايا العصبية الكبار الجهاز العصبي المركزي. التلاعب التجريبية أظهر في هذه المخطوطة تسمح بدراسة آليات لموت الخلايا المبرمج RGC بعد الاصابة.
حقن العين مفيدة لاستهداف العالمية للشبكي...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
ويؤيد حزب كوسوفو الديمقراطي بمنحة التشغيل CIHR (MOP 86523)
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Alcaine Eye Drops | Alcon | ||
| Tears Naturale P.M. | Alcon | ||
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| 10 μl Hamilton Syringe (1701RN; 26s/2”/2) | Hamilton Co | 80030 | |
| 1/16 inch Compression Fittings | Hamilton Co | 55751-01 | |
| 1/16 inch OD, 0.010 inch ID, PEEK Tubing | Supelco, Sigma-Aldrich | Z226661 | |
| Dual RN Glass Coupler | Hamilton Co | 55752-01 | |
| Mineral Oil Priming Kit: includes syringe, needles, rubber septa | Hamilton Co | PRMKIT |
References
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Arai-Gaun, S. Heme oxygenase-1 induced in muller cells plays a protective role in retinal ischemia-reperfusion injury in rats. Invest Ophthalmol Vis Sci. 45, 4226-4232 (2004).
- Bainbridge, J. W., Tan, M. H., Ali, R. R. Gene therapy progress and prospects: the eye. Gene Ther. 13, 1191-1197 (2006).
- Polo, A. D. i Prolonged delivery of brain-derived neurotrophic factor by adenovirus-infected Muller cells temporarily rescues injured retinal ganglion cells. Proc Natl Acad Sci U S A. 95, 3978-3983 (1998).
- Herard, A. S. siRNA targeted against amyloid precursor protein impairs synaptic activity in vivo. Neurobiol Aging. 27, 1740-1750 (2006).
- Koeberle, P. D., Bahr, M. The upregulation of GLAST-1 is an indirect antiapoptotic mechanism of GDNF and neurturin in the adult CNS. Cell Death Differ. 15, 471-483 (2008).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Naik, R., Mukhopadhyay, A., Ganguli, M. Gene delivery to the retina: focus on non-viral approaches. Drug Discov Today. 14, 306-315 (2009).
- van Adel, B. A. Delivery of ciliary neurotrophic factor via lentiviral-mediated transfer protects axotomized retinal ganglion cells for an extended period of time. Hum Gene Ther. 14, 103-115 (2003).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Allocca, M. AAV-mediated gene transfer for retinal diseases. Expert Opin Biol Ther. 6, 1279-1294 (2006).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Res. 48, 353-359 (2008).
- Garcia-Valenzuela, E. Axon-mediated gene transfer of retinal ganglion cells in vivo. J Neurobiol. 32, 111-122 (1997).
- Koeberle, P. D., Wang, Y., Schlichter, L. C. Kv1.1 and Kv1.3 channels contribute to the degeneration of retinal ganglion cells after optic nerve transection in vivo. Cell Death Differ. 17, 134-144 (2010).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Leon, S. Lens injury stimulates axon regeneration in the mature rat optic nerve. J Neurosci. 20, 4615-4626 (2000).
- Mansour-Robaey, S. Effects of ocular injury and administration of brain-derived neurotrophic factor on survival and regrowth of axotomized retinal ganglion cells. Proc Natl Acad Sci U S A. 91, 1632-1636 (1994).
- D'Onofrio, P. M., Magharious, M. M., Koeberle, P. D. Optic Nerve Transection: A Model of Adult. J Vis Exp. , Forthcoming Forthcoming.
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Methods for Experimental Manipulations after Optic Nerve Transection in the Mammalian CNS
Posted by JoVE Editors on 5/31/2011. Citeable Link.
null
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved