Method Article
حفز الكميات وتحليل تشكيل HO - نوكلياز داخلية Translocations الصبغية التي ستراند ، واحدة في التخمير السكيراء الجعوية
In This Article
Summary
في مقايسة إزفاء HO - حفز مراقبين منفردة الجديلة الصلب بعد إنشاء فواصل المزدوج حبلا الحمض النووي في مواضع متعددة في ضعفاني السكيراء الجعوية. قد يكون هذا النموذج آلية إعادة ترتيب الجينوم في الخلايا الجسمية العالي حقيقيات النوى عقب التعرض لجرعات عالية من الإشعاعات المؤينة.
Abstract
Genetic variation is frequently mediated by genomic rearrangements that arise through interaction between dispersed repetitive elements present in every eukaryotic genome. This process is an important mechanism for generating diversity between and within organisms1-3. The human genome consists of approximately 40% repetitive sequence of retrotransposon origin, including a variety of LINEs and SINEs4. Exchange events between these repetitive elements can lead to genome rearrangements, including translocations, that can disrupt gene dosage and expression that can result in autoimmune and cardiovascular diseases5, as well as cancer in humans6-9.
Exchange between repetitive elements occurs in a variety of ways. Exchange between sequences that share perfect (or near-perfect) homology occurs by a process called homologous recombination (HR). By contrast, non-homologous end joining (NHEJ) uses little-or-no sequence homology for exchange10,11. The primary purpose of HR, in mitotic cells, is to repair double-strand breaks (DSBs) generated endogenously by aberrant DNA replication and oxidative lesions, or by exposure to ionizing radiation (IR), and other exogenous DNA damaging agents.
In the assay described here, DSBs are simultaneously created bordering recombination substrates at two different chromosomal loci in diploid cells by a galactose-inducible HO-endonuclease (Figure 1). The repair of the broken chromosomes generates chromosomal translocations by single strand annealing (SSA), a process where homologous sequences adjacent to the chromosome ends are covalently joined subsequent to annealing. One of the substrates, his3-Δ3', contains a 3' truncated HIS3 allele and is located on one copy of chromosome XV at the native HIS3 locus. The second substrate, his3-Δ5', is located at the LEU2 locus on one copy of chromosome III, and contains a 5' truncated HIS3 allele. Both substrates are flanked by a HO endonuclease recognition site that can be targeted for incision by HO-endonuclease. HO endonuclease recognition sites native to the MAT locus, on both copies of chromosome III, have been deleted in all strains. This prevents interaction between the recombination substrates and other broken chromosome ends from interfering in the assay. The KAN-MX-marked galactose-inducible HO endonuclease expression cassette is inserted at the TRP1 locus on chromosome IV. The substrates share 311 bp or 60 bp of the HIS3 coding sequence that can be used by the HR machinery for repair by SSA. Cells that use these substrates to repair broken chromosomes by HR form an intact HIS3 allele and a tXV::III chromosomal translocation that can be selected for by the ability to grow on medium lacking histidine (Figure 2A). Translocation frequency by HR is calculated by dividing the number of histidine prototrophic colonies that arise on selective medium by the total number of viable cells that arise after plating appropriate dilutions onto non-selective medium (Figure 2B). A variety of DNA repair mutants have been used to study the genetic control of translocation formation by SSA using this system12-14.
Protocol
1. ترددات إزفاء HO - حفز
- تلقيح 10-20 مستقلة الثقافات 1 مل من YPGly / لاك المتوسطة (1 ٪ خلاصة الخميرة ، ببتون 2 ٪ ، 3 ٪ والجلسرين اكتات 3 ٪) مع المستعمرات واحد من النمط الجيني المطلوب. احتضان الثقافات بين عشية وضحاها ، أو لوقت كاف للتوصل إلى كثافة خلية من 8 7 - 1x10 5x10 حوالي خلية / مل ، وعند 30 درجة مئوية على محور دوار ، أو التحريض لطيف.
- إضافة اللبن للثقافات إلى تركيز النهائي من 2 ٪ للحث على HO نوكلياز داخلية الموجه DSBs في Δ3 - his3 '(الكروموسوم الثالث) وhis3 Δ5 -' (XV كروموسوم) ركائز إزفاء.
- احتضان لمدة 4 ساعات في 30 درجة مئوية على محور دوار ، أو التحريض لطيف.
- بعد 4 ساعات ، التخفيفات لوحة مناسبة للثقافات على YPD (1 ٪ خلاصة الخميرة ، ببتون 2 ٪ ، 2 ٪ سكر العنب) لانتاج ما يقرب من 100-200 المستعمرات في لوحة ، وعدد كاف من الخلايا على الحامض الاميني المتوسطة التي تفتقر إلى تسفر عن ملاحظتها عدد من المستعمرات + صاحب المؤتلف. احتضان لوحات عند 30 درجة مئوية لمدة يومين أو ثلاثة أيام.
ملاحظة : الخطوة 1.4 يصف تقرير الترددات إزفاء في ظل ظروف انتقائية من قبل الطلاء ثقافات المتوسط على الحامض الاميني مفتقدة. ويمكن أيضا أن يكون هذا الاختبار التي أجريت تحت ظروف غير انتقائية من قبل الطلاء على YPD الثقافات ، ومن ثم طبق الطلاء المستعمرات التي تنشأ على صاحب لوحات يومين إلى ثلاثة أيام في وقت لاحق. هذه الطرق انتاج ترددات مماثلة من إزفاء (الشكل 2C).
- تحديد تواتر إزفاء بقسمة عدد المستعمرات بدئية الحامض الاميني على العدد الكلي للخلايا قابلة للحياة مطلي (يحدده التخفيفات الطلاء على YPD). تحديد وتيرة وسيطة إزفاء و 95 فاصل الثقة 15 ٪.
2. الطلاء الكفاءة
- إزالة قسامة من الخلايا من كل ثقافة بين عشية وضحاها ، وتحديد عدد الخلايا التي كتبها العد عدادة الكريات (باكستر للرعاية الصحية شركة Catolog # : B3178 - 1).
- صفيحة حوالي 100-200 الخلايا باستخدام التخفيف المناسبة على YPD. احتضان لمدة يومين أو ثلاثة أيام في 30 درجة مئوية (على سبيل المثال للحصول على ثقافة ذات الكثافة خلية من خلايا 1x10 8 / مل ، وينبغي للمرء أن لوحة 100-200 ميكرولتر من التخفيف 10-5 في لوحة).
- إضافة اللبن 20 ٪ من الثقافات إلى تركيز النهائي من 2 ٪.
- بعد 4 ساعات ، إزالة قسامة من الخلايا من كل ثقافة ، وتحديد عدد الخلايا التي كتبها العد عدادة الكريات ، وطبق ما يقرب من 100-200 الخلايا باستخدام التخفيف المناسبة على YPD. احتضان لمدة يومين أو ثلاثة أيام في 30 درجة مئوية.
- تحديد كفاءة الطلاء بقسمة عدد المستعمرات التي تظهر على YPD من قبل عدد من الخلايا مطلي ، وهذا حاصل ضرب 100. تحديد نسبة وسيطة مع فاصل الثقة 95 ٪.
3. تحليل الجينوم جنوب لطخة
- حدد واحد + مستعمرة صاحب المؤتلف من كل محاكمة مستقلة وإعداد الحمض النووي الجينومي 16.
- خلاصة ما يقرب من 4 ميكروغرام من الحمض النووي مع نوكلياز داخلية تقييد BamHI.
- BamHI هضمها شظايا منفصلة على agarose هلام 0.7 ٪ ، ونقلها إلى غشاء النايلون المشحونة إيجابيا (N + Hybond ، وجنرال الكتريك للرعاية الصحية رمز المنتج : RPN303B) 17.
- هجن مع التحقيق الذي تجريه ف المسمى 32 التي حصل عليها فتيلة العشوائي (أمرشام العلوم البيولوجية رمز المنتج : RPN1604) مع نسخة 1.8 BamHI / BamHI كيلوبايت الجينوم تحتوي على الجين HIS3.
- تصور شظايا من الحمض النووي عن طريق تصوير الإشعاع الذاتي أو phosphorimaging.
4. تحليل الكروموزوم وصمة عار به فصل الصبغيات في كفاف ، فرضت الحقل الكهربائي متجانسة (الشيف) :
- اعداد مختارة من الكروموسومات recombinants + بلده في المقابس agarose 18 :
- تنمو ثقافة السائل من tXV + مرشحه ثالثا : تحتوي على كروموسوم المؤتلف في 5 مل من YPD إلى حوالي 1-2 × 10 8 خلية / مل. :
- تدور باستمرار وغسل الخلايا 2 مرات مع EDTA 50 مم.
- Resuspend الخلايا في ما يقرب من 200 ميكرولتر من EDTA 50 مم ، ودافئة إلى 50 درجة مئوية.
- إضافة حجم مساو من المنصهر 2 ٪ (W / V) منخفضة ذوبان agarose جلبت إلى 50 درجة مئوية ، ومزيج دقيق.
- الاستغناء عن حوالي 80 aliquots ميكرولتر في قوالب المكونات ، والسماح لهم لتبرد لمدة 30 دقيقة على 4 درجات مئوية.
- بثق المقابس من العفن في صحن 12 - جيدا. يمكن وضع ما يصل إلى خمسة في كل المقابس جيدا.
- أضف 3 مل من محلول spheroplasting الطازجة (14 ملم 2 - β - المركابتويثانول ، 20 ملي EDTA ، 0.5 ملغ / مل Zymolyase 20T ، 10 ملي تريس ، حمض الهيدروكلوريك ، ودرجة الحموضة 7.5 ، 1 م سوربيتول) إلى كل بئر. احتضان عند 37 درجة مئوية لمدة 4 ساعات مع الإثارة لطيف.
- إزالة حل spheroplasting واستبدالها مع 3 مل من محلول LDS (10 ملي تريس ، حمض الهيدروكلوريك ، ودرجة الحموضة 8.0 ، 100 ملي EDTA ، 1 ٪ (W / V) ليثيوم دوديسيل سلفات ، adjusالرقم الهيدروجيني إلى 8.0 طن). احتضان عند 37 درجة مئوية لمدة 15 دقيقة مع الإثارة لطيف.
- إزالة LDS حل واستبدال أخرى قسامة 3 مل من LDS. احتضان عند 37 درجة مئوية خلال الليل مع طيف الانفعالات.
- LDS إزالة واستبدالها مع 3 مل من NDS X 0.2 (0.6 ز قاعدة تريس ، 93 غرام الصوديوم EDTA ثنائي الهيدروكسيل ، 5 ز N - Lauroyl ساركوزين ، وضبط درجة الحموضة إلى 8.0 ، أحضر إلى 500 مل مع DH 2 O). يحضن في درجة حرارة الغرفة لمدة 30 دقيقة مع الإثارة لطيف. إزالة NDS ، وكرر 2 مرات.
- إزالة NDS واستبدالها مع TE مل 3. يغسل مع الانفعالات طيف لمدة 30 دقيقة في درجة حرارة الغرفة. كرر 4 مرات.
- مخزن المقابس عند 4 درجة مئوية في 2 مل من TE. المقابس يمكن الاحتفاظ لمدة تصل الى عام.
- الكروموسومات منفصلة على agarose هلام 1 ٪ باستخدام بيو راد CHEF - DRII الجهاز عند 14 درجة مئوية (كتالوج # : 170-3612).
المعلمات : 1 بلوك الأول : 70S وقت التبديل ، 15H في 6V/cm.
2 بلوك الثاني : 120s وقت التبديل ، 11H في 6V/cm
- تصور الكروموسومات التي تلطيخ مع بروميد إيثيديوم 1μg/ml لمدة 30 دقيقة ، مع اضاءة 60 مللي جول للأشعة فوق البنفسجية في Stratalinker الأشعة فوق البنفسجية (Stratagene) ، وتلطيخ دي لمدة 30 دقيقة في DH 2 O. اضاءة إيثيديوم بروميد ملطخة النكات الكروموسومات الحمض النووي للسماح لنقل فعال للغشاء.
- نقل الصبغيات لغشاء موجبة الشحنة (N + Hybond ، وجنرال الكتريك للرعاية الصحية رمز المنتج : RPN303B) من عمل شعري في ظروف تغيير طبيعة (0.4N هيدروكسيد الصوديوم ، 1.5M كلوريد الصوديوم).
- هجن مع التحقيق الذي تجريه ف المسمى 32 التي حصل عليها فتيلة العشوائي (أمرشام العلوم البيولوجية رمز المنتج : RPN1604) مع 1.8 كيلوبايت استنساخ الجينوم BamHI / BamHI تحتوي على الجين HIS3 17.
- الكروموزومات التي تصور أو تصوير الإشعاع الذاتي phosphorimaging.
5. ممثل النتائج :
ويصور تمثيل رسومي للمقايسة إزفاء على مستوى الكروموسومات (الشكل 1). يتم أيضا عرض تخطيطي للإجراء التجريبي (الشكل 2A). نحن مصممون على حد سواء قبل والكفاءة الطلاء بعد تحريض بقسمة العدد الكلي للخلايا قابلة للحياة مستعمرة ، والتي تشكل من قبل عدد من الهيئات خلية في ثقافة الاعتماد التي يحددها عدادة الكريات (الشكل 4B). وقبل والكفاءة الطلاء بعد الاستقراء لا تختلف كثيرا عن البرية من نوع الخلايا (ع = 0.1400 القيمة) (الجدول 1).
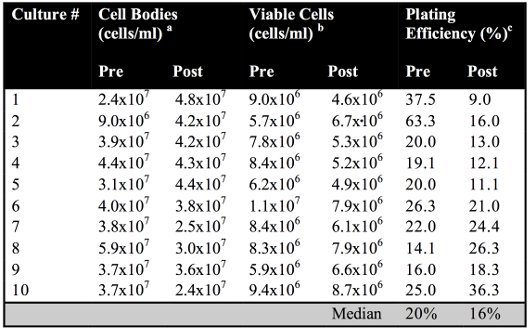
الجدول 1. قبل وبعد الطلاء الكفاءة التعريفي في البرية من نوع الخلايا.
ويتم تحديد عدد من الهيئات وخلية في الملليمتر الواحد من قبل عدد عدادة الكريات.
ب يتم تحديد عدد من الخلايا قادرة على البقاء في الملليمتر الواحد من خلال طلاء التخفيفات المناسبة على غير الانتقائي لإنتاج المتوسطة ~ 100-200 المستعمرات.
(ج) قبل الكفاءة ، ونحن مصممون الطلاء بعد تحريض بقسمة مجموع عدد قابلة للحياة وتشكيل مستعمرة ، والخلايا على العدد الكلي للأجسام الخلايا في الثقافة ، التي تحددها العد عدادة الكريات.
هذا يشير إلى أن وجود أو عدم وجود إما كروموسوم إزفاء لا يؤثر على القدرة على البقاء على قيد الحياة تشكيل جهاز تسوية المنازعات. ويمكن حساب تواتر الصبغيات translocations بقسمة عدد من المستعمرات بدئية الحامض الاميني من العدد الكلي للخلايا قابلة للحياة التي يحددها الطلاء على YPD (الشكل 2B). ويمكن إجراء هذا الاختبار الوراثي باستخدام سلالات مختلفة لتحديد كيفية فقدان وظيفة البروتين يؤثر على منطقة أفريقيا جنوب الصحراء (أي rad51Δ -- / --). ويمكن عندئذ تحديد الترددات إعادة التركيب في سلالات مختلفة من رسوم بيانية للمقارنة الاختلافات في قدرة هذه السلالات لإصلاح HO - نوكلياز داخلية DSBs الناجم عن منطقة أفريقيا جنوب الصحراء (الشكل 2C). والترددات التي تم الحصول عليها إزفاء مع سلالة مضاعفا من النوع البري تحت انتقائية (2.2x10 -2) وغير الانتقائية (2.17x10 -2) ظروف لا تختلف إحصائيا عن بعضها البعض (ع = 0.9131 قيمة) ، في حين أن الحصول على الترددات إزفاء انتقائي (6.0x10 -2) وغير انتقائي (11.9x10 -2) مع rad51Δ -- / -- زيجوت متماثلة الألائل كانت مشابهة ولكن مختلفة إحصائيا (P = 0.0089 القيمة). الحصول على الترددات سواء بشكل انتقائي (ع القيمة = 0.0001) وغير انتقائية (ع القيمة = 0.0002) مع ° rad51 -- / -- زيجوت متماثلة الألائل كانت مختلفة عن تلك التي تم الحصول عليها إحصائيا باستخدام ظروف المقابلة مع سلالة من النوع البري.
يمكن المفترضة إزفاء الحاملة للاستنساخ مزيد من الدراسة من قبل لطخة جنوب الجينومية وتحليلات لطخة الكروموسومات (الشكل 3). لتحليل الجنوبية ، يتم هضم الحمض النووي الجيني مع نوكلياز داخلية BamHI قبل agarose هلام إستشراد ، النشاف والتهجين إلى 32ف المسمى 1.8kb HIS3 التحقيق لتصور التشخيص 0.8 كيلوبايت his3Δ200 ، 1.7 كيلوبايت his3 - Δ3 '، 4 كيلوبايت tIII : الخامس عشر ، 5 ك tXV : الثالث ، و 8 كيلوبايت his3 - Δ5' شظايا (الشكل 3B.1) . يمكن تحضير الكروموسومات سليمة ، مفصولة CHEF (الشكل 3B.2) ، نشف لالنايلون والمهجنة مع 32 ف المسمى 1.8 كيلوبايت HIS3 التحقيق لتصور 1.1 ميغابايت سليمة XV كروموسوم ، 0.8 ميغابايت tXV : كروموسوم إزفاء الثالث ، و 0.6 ميغابايت tIII : كروموسوم إزفاء الخامس عشر ، والثالث على حالها 0.3 ميغابايت الصبغي (الشكل 3B.3). تصور المتوقع خريطة رسومية BamHI نوكلياز داخلية ، يهضم شظايا الحمض النووي الجيني ، والأصل والكروموسومات المؤتلف ، ويصور (3A الشكل).

الشكل 1. تشكيل الصبغيات إزفاء بواسطة حبلا واحدة الصلب (جنوبي). 1) يتم إنشاؤها في DSBs his3 - Δ3 'وhis3 - Δ5' ركائز (الصبغيات الخامس عشر والثالث ، على التوالي) قبل نوكلياز داخلية HO بعد إضافة اللبن إلى الثقافات. 2) يتم تجهيزها لتوليد DSBs 3 "واحد فروع في نهايات الكروموسومات المكسورة. 3) آلات anneals SSA 311 تكميلية أو 60 النوكليوتيدات واحد الذين تقطعت بهم السبل HIS3 متواليات شكلت في كل من ركائز إعادة التركيب. تتم إزالة ذيول غير المتجانسة التي شكلت الصلب على الهضم نوكلياز داخلية. قد التكميلية four يتدلى على شظايا غليان في الصبغية المتبقية التي شكلتها HO - نوكلياز داخلية يصلب الهضم أيضا. 4) ربط يختتم خلق الجينات HIS3 سليمة وtXV : الثالث كروموسوم إزفاء بواسطة SSA. يمكن تحديد هذه الخلايا تحمل الكروموسوم عليها في قدرتها على النمو المتوسطة على الحامض الاميني مفتقدة. قد تولد أيضا ربط tIII متبادلة : كروموسوم إزفاء الخامس عشر من خلال آلية NHEJ الشبيهة.
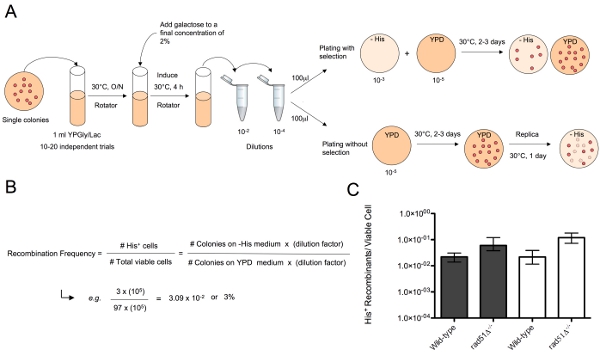
الشكل 2. مقايسة لتحديد تواتر إزفاء بواسطة SSA ألف) واحد مل YPGly / لاك الثقافات تلقيح مع المستعمرات واحدة من الخلايا لتحديد النمط الجيني ونمت على كثافة مناسبة من 8 7 - 1x10 5x10 حوالي خلية / مل. يضاف اللبن إلى تركيز النهائي من 2 ٪ إلى إنشاء DSBs على ركائز إعادة التركيب على الكروموسومات الثالث والخامس عشر. لإجراء فحص تحت شروط انتقائية ، يتم إجراء التخفيفات المناسبة بحيث يتم مطلي حوالي 100-200 الخلايا على YPD ومطلي عدد كاف من الخلايا على الحامض الاميني المتوسطة التي تفتقر إلى تسفر عن عدد من المستعمرات ملاحظتها + صاحب المؤتلف. لإجراء الفحص دون انتقاء ، ومطلي حوالي 100-200 الخلايا على YPD ، ونمت لمدة يومين أو ثلاثة أيام لالمستعمرات واحد ثم طبق مطلي على الحامض الاميني المتوسطة معدومة. ب) يمكن تحديد تواتر إزفاء بقسمة عدد المستعمرات التي تنمو على لوحات من قبل صاحب الكسر التي تنمو على YPD. C) والترددات إزفاء من سلالات مختلفة من التركيب الوراثي (أي نوع البرية وrad51Δ -- يمكن رسوم بيانية) لمقارنة الاختلافات في قدرة هذه السلالات لإصلاح DSBs بواسطة SSA -- /.
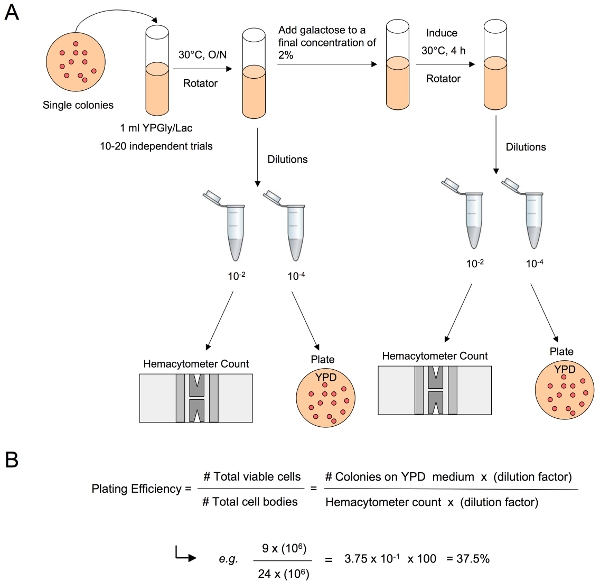
الشكل 3. تحديد كفاءة الطلاء (أ) ان يتخذ قسامة من الخلايا من الثقافة بين عشية وضحاها وذلك قبل وآخر التعريفي DSB ، يتم إجراء التخفيفات المناسبة ، تليها العد عدادة الكريات لتحديد العدد الكلي للهيئات خلية لكل مل من الثقافة. ومطلي التخفيفات المناسبة على غير انتقائية المتوسطة لتحديد العدد الكلي للخلايا قابلة للحياة لكل لتر ، عن طريق عد المستعمرات التي تظهر على YPD. (B) ثم يتم تحديد كفاءة الطلاء بقسمة العدد الكلي للخلايا قابلة للحياة على العدد الكلي للأجسام الخلايا ، وهذا حاصل ضرب 100.
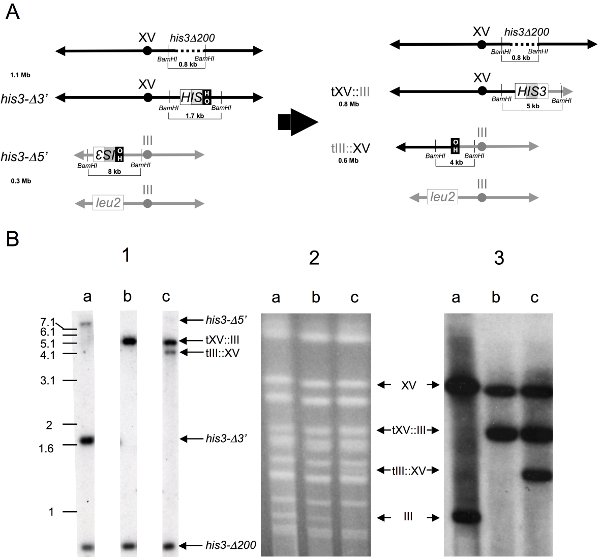
الشكل 4. الكشف عن الأحداث التي وصمة عار إزفاء الكروموسومات جنوب الجينومية وتحليلات لطخة الصبغي.
أ) تمثيل رسومي من الكروموسومات ذات الصلة قبل (يسار) وبعد تشكيل إزفاء (يمين).
يتم سرد الأحجام من الوالد والمؤتلف في الكروموسومات megabase أزواج (MB). يتم سرد الأحجام من الشظايا التي تحتوي على قيود ذات الصلة التي تم إنشاؤها بواسطة تسلسل الهضم BamHI من الحمض النووي الجيني من الأم وسلالات المؤتلف ، وكشف عن البقع بواسطة التهجين مع استنساخ 1.8 كيلوبايت HIS3 BamHI الجينومية ، في kilobase أزواج (KB). لم يتم رسمها الكروموسومات على نطاق كبير.
ب) تحليل المادية للاستنساخ إزفاء الحاملة المفترضة.
(1) لطخة تحليل الجينوم الجنوبية -- تم جمع الحمض النووي الجينوم ويتفاعل مع تقييد BamHI نوكلياز داخلية ، مجزأة الكهربائي بواسطة الجل ، BLOtted إلى النايلون ، والمهجنة إلى 32 ف المسمى 1.8 كيلوبايت HIS3 التحقيق لتصور شظايا التالية : 0.8 كيلوبايت his3Δ200 ، 1.7 كيلوبايت his3 - Δ3 '، 4 كيلوبايت tIII : الخامس عشر ، 5 ك tXV : الثالث ، و 8 كيلوبايت his3 - Δ5. حارات : أ) ضعفاني الأصل ، ب) صاحب + غير إزفاء متبادل المؤتلف ، ج) + صاحب إزفاء متبادل المؤتلف.
(2) CHEF المواد الهلامية -- أعدت الكروموسومات سليمة في المقابس agarose ، مفصولة CHEF ، ملطخة بروميد إيثيديوم وتصور تحت ضوء الأشعة فوق البنفسجية. حارات : كما ذكر أعلاه.
(3) البقع الصبغية -- تم فصلها لنشف الكروموسومات النايلون والمهجنة مع 32 ف المسمى 1.8 كيلوبايت HIS3 التحقيق لتصور الكروموسومات التالية : 1.1 ميجا بايت سليمة XV كروموسوم ، 0.8 ميغابايت tXV : كروموسوم إزفاء الثالث ، و 0.6 ميغابايت tIII : XV إزفاء كروموسوم ، و 0.3 ميغابايت سليمة الكروموسوم الثالث. حارات : كما ذكر أعلاه.
Discussion
جرعات عالية من الإشعاعات المؤينة تمثل مخاطر عدم الاستقرار المتأصلة في الجينوم من خلال توليد عدد كبير من DSBs 19. الجينوم حقيقية النواة تزخر تسلسل المتكررة التي هي ركائز ممتازة لتوليد translocations وإعادة ترتيب الجينوم أخرى 20،21. ويلاحظ في كثير من الأحيان عن طريق الموارد البشرية translocations الكروموسومات عند إدخال DSBs بين متواليات تكرارية 12،21،22. أدلة دامغة تشير إلى أن الكثير من عدم الاستقرار الجيني المرتبطة اللوكيميا والأورام اللمفاوية ويمكن أن يعزى إلى translocations الكروموسومات ، مسلطا الضوء على أهمية فهم كيفية حدوث هذه الآلية في حقيقيات النوى 22،23. قمنا بتطوير نظام الخميرة في مهدها لدراسة تشكيل الصبغيات إزفاء بواسطة جهاز تسوية المنازعات الناجمة عن الموارد البشرية بين المناطق قصيرة من التماثل على الكروموسومات المختلفة التي تشبه في الحجم العناصر المتكررة في جميع أنحاء متفرقة الخميرة والجينوم البشري.
في مقايسة ، ويقع على الركيزة his3 - Δ3 'إزفاء على نسخة واحدة من الكروموسوم الخامس عشر. الآخر his3 أليل (his3 - Δ200) قد حذف من 1KB ~ المروج HIS3 وتسلسل الترميز الذي يمنع هذا التسلسل من أن تستخدم كنموذج لإصلاح 24. يقع على الركيزة his3 - Δ5 "في موضع LEU2 على نسخة واحدة من الكروموسوم الثالث ، مع نسخة أخرى من كروموسوم الثالث يحتوي على LEU2 أليل دون تغيير (الشكل 1). أدرجت نوكلياز داخلية HO - الغالاكتوز محرض الكاسيت التعبير ملحوظ مع KAN - MX في الموضع الرابع TRP1 الصبغي (trp1 : GAL - HO - KAN - MX). ويحيط كل ركيزة من خلال تسلسل إزفاء الاعتراف HO - نوكلياز داخلية يمكن أن تكون مستهدفة من قبل لإحداث انشقاق التعبير عن الجينات HO من خلال إضافة اللبن إلى المتوسط. بعد الانقسام الناجم HO - نوكلياز داخلية في his3 - Δ3 'وhis3 - Δ5' ركائز ، يمكن استخدام الخلايا كفاءة الجهاز المشتركة قصيرة من تسلسل تناظر HIS3 (311 سنة مضت أو غليان 60) لإصلاح الكروموزومات تخللتها الموارد البشرية ، وتوليد كروموسوم إزفاء مع أليل HIS3 12-14،25 سليمة.
لأن الأصل عدم الخلايا نسخة سليمة من الجين HIS3 ، فهي غير قادرة على النمو على صاحب المتوسط. يمكن تحديد الخلايا الوحيدة التي خضعت لهذا الحدث إزفاء على الحامض الاميني المتوسطة معدومة. لذا ، يمكن حساب تواتر الصبغيات translocations بقسمة عدد من المستعمرات بدئية الحامض الاميني على العدد الكلي للخلايا قابلة للحياة مطلي ، والتي تحددها الطلاء على YPD. ويمكن بعد ذلك الحمض النووي الجينومية والكروموسومات سليمة يمكن عزلها عن المستعمرات + ممثل له ، وجود كروموسوم إزفاء التحقق من جنوب الجينومية وتحليلات لطخة الصبغي.
وقد سمح لنا تحليلا دقيقا لجمع معلومات مهمة إضافية حول مقايسة 12. وقد وفرت جنوب لطخة تحليل الجينوم أدلة على أن هناك عدة قطاعات كاملة تقريبا من الصبغيات الخامس عشر والثالث بعد 30 دقيقة من HO - نوكلياز داخلية الاستقراء ، وبالتالي ليس هناك أي خلفية هامة من ركائز الكروموسومات غير المصقول في عدد السكان (G. مانثي Bailis & A. ، لم تنشر النتائج). الجينومية تحليلات لطخة الجنوبية وصاحب كروموسوم -- الناجين تشير إلى أن تفقد الخلايا بشكل متكرر واحد ، وأخرى ، أو كليهما الكروموسومات قص وتبقى قابلة للحياة (L. A. Bailis ويديل ، ونتائج غير منشورة). الأهم من ذلك ، الكفاءات الطلاء يعادل تقريبا على غير انتقائية المتوسط قبل وبعد تحريض من التعبير HO - نوكلياز داخلية تشير إلى أن أيا من الفشل في إصلاح الكروموزومات مكسورة ، أو فشل في الاحتفاظ الكروموسومات إزفاء يؤثر على القدرة على البقاء على قيد الحياة تشكيل جهاز تسوية المنازعات. تمشيا مع هذا ، tXV : لقد ثبت الثالث كروموسوم إزفاء أن تكون غير مستقرة في الخلايا الإنقسامية في غياب التحديد. وقد تجلى ذلك من خلال تنامي tXV : الثالث الذي يشتمل recombinants + بلده بين عشية وضحاها غير انتقائي ، والطلاء واحد على المستعمرات غير انتقائية لوحات ، والطلاء على طبق متوسط انتقائية تفتقر الحامض الاميني. وكان عشرة إلى 70 ٪ من المستعمرات الناتجة عن هذه اللوحات فقدت tXV : كروموسوم إزفاء الثالث (N. Pannunzio Bailis & A. ، نتائج غير منشورة).
إزفاء الكروموسومات التي تم إنشاؤها بواسطة الأشعة تحت الحمراء التعرض في البشر مماثلة يحمل عدم الاستقرار 26. هذا يشير إلى أن تشكيل إزفاء قد تسهم في احداث تكون الأورام في وقت مبكر عن طريق تعزيز فقدان تغاير الزيجوت. الثانية ، تحليلات واسعة النطاق الوراثية والجزيئية تشير إلى أن منطقة أفريقيا جنوب الصحراء ، وإنشاء آلية فعالة وغير المحافظ اجباريا للموارد البشرية ، هو الآلية الأساسية لتكوين الموارد البشرية إزفاء التي أعقبت إنشاء في وقت واحد على اثنين من الكروموزومات DSBs 12،27،28. ويشترك هذاnsistent مع الحقائق أن جرعات كبيرة من الأشعة تحت الحمراء في نتيجة كثافة DSBs كافية لإنشاء فواصل المتاخمة لمتواليات تكرارية متعددة في الجينوم الخميرة ، وارتفاع وتيرة تشكيل إزفاء بواسطة الموارد البشرية. معا ، هذه الملاحظات تشير إلى أن تأثير الأشعة تحت الحمراء أنكجنيك التعرض في البشر ، قد جزئيا ، نتيجة لإصلاح DSBs بواسطة آلية فعالة للموارد البشرية التي تولد translocations أنه ، من خلال عدم الاستقرار الكامنة ، وتعزيز التغيرات الجينية التي تكون الأورام الاطلاق. لأنه غالبا ما تستخدم لعلاج الإشعاع سرطان إعادة ترتيب الجينوم ، التي تنتج عن إصلاح الناجمة عن الاشعاع DSBs يمكن أن تسهم في توليد السرطانات الثانوية التي تنشأ في كثير من الأحيان المرضى. وبالتالي ، قد يكون هذا النموذج يساعدنا على اكتساب فهم أفضل للأساس الوراثية والجزيئية للاستجابة للعلاج السريري مهم الأشعة تحت الحمراء.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من جانب صناديق من المعاهد الوطنية للصحة والبحوث معهد بيكمان في مدينة الأمل. نود أن نشكر المقيمين على تعليقاتهم البناءة التي الوضوح وأضاف أن المخطوطة.
Materials

References
- Sen, S. K. Human genomic deletions mediated by recombination between Alu elements. The American Journal of Human Genetics. 79, 41-53 (2006).
- Han, K. Alu recombination-mediated structural deletions in the chimpanzee genome. Plos Genetics. 3, 1939-1949 (2007).
- Zhang, F. Copy number variation in human health, disease, and evolution. Annual Review of Genomics and Human Genetics. 10, 451-481 (2009).
- Goodier, J. L., Kazazian, H. H. Retrotransposons revisited: The restraint and rehabilitation of parasites. Cell. 135, 23-35 (2008).
- Lanktree, M., Hegele, R. Copy number variation in metabolic phenotypes. Cytogenet Genome Res. 123, 169-175 (2008).
- Mullighan, C. Genome-wide analysis of genetic alterations in acute lymphoblastic leukaemia. Nature. 446, 758-764 (2007).
- Mattarucchi, E. Microhomologies and interspersed repeat elements at genomic breakpoints in chronic myeloid leukemia. Genes Chromosomes Cancer. 47, 625-632 (2008).
- Stenger, J. Biased distribution of inverted and direct Alus in the human genome: implications for insertion, exclusion, and genome stability. Genome Res. 11, 12-27 (2001).
- Hedges, D., Deininger, P. Inviting instability: Transposable elements, double-strand breaks, and the maintenance of genome integrity. Mutat Res. 616, 46-59 (2007).
- Symington, L. Role of RAD52 epistasis group genes in homologous recombination and double-strand break repair. Microbiol Mol Biol Rev. 66, 630-670 (2002).
- Lewis, L., Resnick, M. Tying up loose ends: nonhomologous end-joining in Saccharomyces cerevisiae. Mutat Res. 451, 71-89 (2000).
- Pannunzio, N. R., Manthey, G. M., Bailis, A. M. RAD59 is required for efficient repair of simultaneous double-strand breaks resulting in translocations in Saccharomyces cerevisiae. DNA Repair (Amst). 7, 788-800 (2008).
- Nicholas, R., Pannunzio, G. M. M., Bailis, A. M. RAD59 and RAD1 cooperate in translocation formation by single-strand annealing in Saccharomyces cerevisiae. Curr Genet. 56, 87-100 (2010).
- Manthey, G. M., Bailis, A. M. Rad51 Inhibits Translocation Formation by Non-Conservative Homologous Recombination in Saccharyomyces cerevisiae. Plos One. 5, (2010).
- Knight, W. Confidence Intervals for the Median: Two sided Symmetric --95 or Better. , Available from: http://www.math.unb.ca/~knight/utility/MedInt95.htm (2006).
- Hoffman, C. S., Winston, F. A ten-minute DNA preparation from yeast efficiently releases autonomous plasmids for transformation of Escherichia coli. Gene. 57, 267-272 (1987).
- Sambrook, J., MacCallum, P., Russell, D. Molecular Cloning: A Laboratory Manual. , 3rd edition, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (2001).
- Iadonato, S. P., Gnirke, A. RARE-cleavage analysis of YACs. Methods Mol. Biol. , 75-85 (1999).
- Argueso, J. L. Double-strand breaks associated with repetitive DNA can reshape the genome. Proc. Natl. Acad. Sci. U. S. A. , 11845-11850 (2008).
- Batzer, D. A. Alu repeats and human disease. Molecular Genetic Metabolism. 67, 183-193 (1999).
- Fasullo, M., Dave, P., Rothstein, R. DNA-damaging agents stimulate the formation of directed reciprocal translocations in Saccharomyces cerevisiae. Mutat. Res. 314, 121-133 (1994).
- Richardson, C., Jasin, M. Frequent chromosomal translocations induced by DNA double-strand breaks. Nature. 405, 697-700 (2000).
- Look, A. T. Genes altered by chromosomal translocations in leukemias and lymphomas. The Genetic Basis of Human Cancer. , McGraw Hill. (2002).
- Fasullo, M. T., Davis, R. W. Direction of chromosome rearrangements in Saccharomyces cerevisiae by use of his3 recombinational substrates. Mol. Cell. Biol. 8, 4370-4380 (1988).
- Manthey, G. M., Naik, N., Bailis, A. M. Msh2 Blocks an Alternative Mechanism for Non-Homologous Tail Removal during Single-Strand Annealing in Saccharomyces cerevisiae. PLoS One. 4, e7488-e7488 (2009).
- Muller, I. Time-course of radiation-induced chromosomal aberrations in tumor patients after radiotherapy. Int. J. Radiation Oncology Biol. Phys. 63, 1214-1220 (2005).
- Lin, F. L., Sperle, K., Sternberg, N. Model for homologous recombination during transfer of DNA into mouse L cells: role of DNA ends in the recombination process. Mol. Cell. Biol. 4, 1020-1034 (1984).
- Ivanov, E. L. Genetic Requirements for the single-strand annealing pathway of double-strand break repair in Saccharyomyces cerevisiae. Genetics. 142, 693-704 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved