Method Article
HO-Endonuclease Oluşum kantitasyonu ve Analiz Tavlama Tek-Strand kromozomal Translokasyonlar Uyarılmış Saccharomyces cerevisiae
Bu Makalede
Özet
HO-uyarılmış translokasyon tahlil tek iplikli DNA, çift iplikli tatili diploid birden fazla lokusların kurulmasından sonra tavlama izler Saccharomyces cerevisiae. Bu mekanizma, iyonlaştırıcı radyasyon yüksek dozlarda maruz kalma yüksek ökaryotlar somatik hücre genomu düzenlenmeleri model olabilir.
Özet
Genetik çeşitlilik sık tekrarlayan elemanlarla her ökaryotik genom mevcut dağınık arasındaki etkileşim yoluyla ortaya çıkan genomik düzenlenmeleri tarafından aracılık eder. Bu süreç 1-3 arasında ve organizmalar içinde çeşitlilik oluşturmak için önemli bir mekanizma. Dahil olmak üzere bir çok çizgi ve Sines 4 retrotransposon kökenli yaklaşık% 40 tekrarlayan dizisi, insan genomu oluşur. Gen dozaj ve insanlar 6-9 otoimmün ve kardiyovasküler hastalıklar 5, yanı sıra kansere yol açabilir ifade bozabilir translokasyonlar dahil olmak üzere genom düzenlenmeleri, bu tekrarlanan elemanları arasında Alım Satım olayları neden olabilir.
Alım Satım tekrarlanan elemanları arasında çeşitli şekillerde ortaya çıkar. Mükemmel (ya da mükemmele yakın) homoloji paylaşan dizileri arasında Exchange homolog rekombinasyon denilen bir süreç (İK) tarafından oluşur. Buna karşılık, homolog olmayan uç (NHEJ) katılmadan, döviz 10,11 için az ya da hiçbir dizisi homoloji kullanır. HR birincil amacı, mitotik hücrelerde çift iplikli endojen üretilen anormal DNA replikasyonu ve oksidatif lezyonlar sonları (DSBs) veya iyonize radyasyon (IR), ve diğer eksojen DNA zararlı maddeler maruz kalma tamir etmektir.
Testin Burada anlatılan, DSBs galaktoz-indüklenebilir HO-endonükleaz (Şekil 1) diploid hücrelerinde iki farklı kromozom bölgeleri aynı anda rekombinasyon substratlar kıyısında oluşturulur . Kırık kromozom onarım tavlama (SSA), tek iplikli kromozom translokasyonları üretir, homolog kromozom uçları bitişik dizileri bir süreç kovalent tavlama için sonraki katıldı. Substratların his3-Δ3 HIS3 allel kesilir ', 3 içerir ve yerli HIS3 lokus kromozom XV bir kopyasını yer almaktadır. His3-Δ5 ', ikinci substrat kromozom III bir kopyasını LEU2 lokustaki bulunan ve 5 içeren' HIS3 allel kesilir. Her iki substratlar HO-endonükleaz kesi için hedef olabilir HO endonükleaz tanıma sitesi tarafından çevrili. MAT lokus yerli HO endonükleaz tanıma siteleri, kromozom III hem kopya, tüm suşlarda silinmiş. Bu rekombinasyon yüzeyleri ve diğer tahlil müdahale kırık kromozom uçları arasındaki etkileşimi önler. KAN-MX işaretlenmiş galaktoz-indüklenebilir HO endonükleaz ifade kaset kromozom IV TRP1 lokustaki eklenir. Yüzeylerde payı 311 bp veya SSA tarafından onarım için İK makine tarafından kullanılabilir HIS3 kodlama dizisi 60 bp. İK kırık kromozom onarmak için bu yüzeylerin hücreler sağlam bir HIS3 allel ve tXV şekli: III kromozom translokasyonu orta eksik histidin (Şekil 2A) büyümeye yeteneği ile seçilebilir. İK tarafından Translokasyon frekans seçici besiyeri seçici olmayan, orta (Şekil 2B) üzerine uygun seyreltiler kaplama sonra ortaya çıkan canlı hücreler toplam sayısına göre ortaya çıkan histidin prototrophic kolonilerin sayısına bölünmesiyle hesaplanır . Bu sistemi kullanarak 12-14 SSA tarafından çeşitli DNA onarım mutantlar translokasyon oluşumunun genetik kontrol çalışması için kullanılır olmuştur.
Protokol
1. HO-uyarılmış translokasyon frekansları
- Istenilen genotip tek koloniler YPGly / Lac orta (% 1 maya özü,% 2 pepton,% 3 gliserol ve% 3 laktat) 10-20 bağımsız 1 ml kültürleri inoküle edin. 30 ° C rotator, ya da yavaşça sallanarak, yaklaşık 5x10 7-1x10 8 hücre / ml bir hücre yoğunluğu ulaşmak için yeterli bir süre için, bir gecede veya kültürler inkübe edin .
- His3 Δ3 '(kromozom III) ve his3 Δ5' (kromozom XV) translokasyon substratlar HO endonükleaz-yönettiği DSBs ikna etmek için son konsantrasyonu% 2 kültürlere galaktoz ekle.
- 4 saat boyunca inkübe 30 ° C rotator veya yavaşça sallanarak.
- 4 saat sonra, uygun dilüsyonları YPD üzerine kültürleri (% 1 maya özü,% 2 pepton, 2% dekstroz) plaka gözlemlenebilir verim yaklaşık 100 ila 200 plaka başına koloniler ve hücrelerin yeterli sayıda orta eksik histidin üzerine verim Onun + rekombinant kolonilerin sayısı. 30 plaka inkübe ° C'de 2-3 gün.
NOT: Adım 1.4 orta eksik histidin üzerine kültürler kaplama translokasyon frekanslarının belirlenmesi seçici koşullar altında açıklanmıştır. Bu testte de 2-3 gün sonra tabak-Onun üzerine ortaya çıkan koloniler sonra çoğaltma kaplama kaplama kültürleri üzerine YPD seçici olmayan koşullar altında yapılan ve olabilir. Bu yöntemler translokasyon benzer frekansları (Şekil 2C) üretir.
- Kaplama canlı hücrelerinin toplam sayısı (YPD kaplama dilüsyonları tarafından belirlenir) histidin prototrophic kolonilerin sayısı bölerek translokasyon sıklığını belirlemek. Medyan translokasyon sıklığı ve% 95 güven aralığı 15 belirleyin.
2. Kaplama verimliliği
- Her gecede kültür hücreleri bir kısım çıkarın ve hemasitometre sayımı (Baxter Healthcare Corporation Katalog #: B3178-1) hücre sayısını belirlemek.
- Plaka yaklaşık 100 200 hücre YPD üzerine uygun bir seyreltme kullanarak. 2-3 gün boyunca 30 ° C'de (örneğin, bir hücre yoğunluğu 1x10 8 hücre / ml ile bir kültür, bir plaka, plaka başına 10-5 seyreltme ul 100-200) .
- ,% 2 final konsantrasyon kültürleri ila% 20 galaktoz ekleyin.
- 4 saat sonra, her kültürden bir kısım hücreler kaldırmak hemasitometre sayısına göre hücre sayısını belirlemek ve YPD üzerine uygun bir seyreltme plaka yaklaşık 100 ila 200 hücre. 2-3 gün süreyle inkübe 30 ° C.
- YPD kaplama hücrelerinin sayısına göre görünen ve 100 ile bu katsayı ile çarpımı kolonilerin sayısı bölerek kaplama etkinliğini belirlemek. % 95 güven aralığı ile medyan yüzdesi belirleyin.
3. Genomik Southern blot analizi
- Her bir bağımsız deneme bir tek Onun + rekombinant koloni seçin ve genomik DNA 16 hazırlamak.
- BamHI kısıtlama endonükleaz ile DNA yaklaşık 4 mg Digest.
- Ayrı BamHI% 0.7 agaroz jel üzerinde parçaları sindirilir ve pozitif yüklü bir naylon membran (Hybond N +, GE Healthcare Ürün Kodu: RPN303B) transfer 17 .
- HIS3 gen içeren 1.8 kb BamHI / BamHI genomik klon: random priming (RPN1604 Amersham Biosciences Ürün Kodu) tarafından elde edilen 32 P-işaretli prob ile melezleşme.
- Otoradyografi veya phosphorimaging DNA parçaları gözünüzde canlandırın.
4. Kromozom blot analizi ayrılmış kromozom kullanılarak bir kontur kenetli homojen elektrik alan (CHEF):
- Agaroz fişler 18 seçilen Onun + rekombinantlar kromozom hazırlayın:
- + Aday tXV bir sıvı kültür büyütün: III yaklaşık 1-2 x YPD 5 ml rekombinant kromozom içeren 10 8 hücre / ml.
- Spin ve hücreler 50 mM EDTA ile 2 kez yıkayın.
- Süspanse edin hücreleri ve 50 mM EDTA yaklaşık 200 ul ° C - 50 sıcak
- Düşük erime agaroz 50 ° C, iyice karıştırın getirdi% 2 erimiş eşit hacmi (w / v) ekleyin.
- Fiş kalıplar içine yaklaşık 80 ul alikotları koyun ve onlara 4 30 dakika soğumasını bekleyin ° C.
- Extrude 12-iyi bir çanak içine kalıp takılır. En fazla beş fişler her bir kuyunun içine yerleştirilebilir.
- Her iyi 3 ml taze hazırlanmış spheroplasting çözüm (2 β-mercaptoethanol 14 mM, 20 mM EDTA, 0.5 mg / ml Zymolyase 20T, 10 mM Tris-HCl, pH 7.5, 1 M Sorbitol) ekleyin. Yavaşça sallanarak ile 37 ° C'de 4 saat inkübe edin.
- Spheroplasting çözüm çıkarın ve LDS çözümü (3 ml yerine 10 mM Tris-HCl, pH 8.0, 100 mM EDTA,% 1 (w / v) Lityum Dodesil Sülfat, adjus8.0 t pH). 37 ° C'de 15 dakika yavaşça sallanarak inkübe.
- LDS çözüm çıkarın ve 3 ml LDS başka bir kısım ile değiştirin. Yavaşça sallanarak ° C gecede 37 inkübe edin.
- LDS çıkarın ve 0,2 X NDS (0.6 g Tris Baz, 93 g disodyum EDTA Dihidrat, 5 g N-Lauroyl sarkozin, 8.0 pH ayarı dH 2 O ile 500 ml) 3 ml ile değiştirin. Yavaşça sallanarak 30 dakika oda sıcaklığında inkübe edin. NDS çıkarın ve 2 kez tekrarlayın.
- NDS çıkarın ve 3 ml TE ile değiştirin. Oda sıcaklığında 30 dakika boyunca yavaşça sallanarak ile yıkayınız. 4 kez tekrarlayın.
- Mağaza 4 fişler ° C TE 2 ml. Fiş bir yıl kadar tutabilirsiniz.
- 14 yaşında bir Bio-Rad CHEF-DRII aparatı kullanarak% 1 agaroz jel üzerinde ayrı kromozom ° C (Katalog no: 170-3612).
Parametreler: 1. Blok: 70s geçiş süresi 6V/cm az 15 saat.
2. Blok: 120s geçiş süresi, 6V/cm az 11h
- 30 dakika 1μg/ml etidyum bromür ile boyanarak UV Stratalinker (Stratagene) UV 60 mJ ile aydınlatarak, kromozom görselleştirmek, ve 30 dakika dH 2 O için de boyama Membran verimli transferi için izin etidyum bromür boyanmış kromozom nickler DNA aydınlatarak.
- Denatüre koşulları kılcal eylem (0.4N NaOH, 1,5 M NaCl) pozitif yüklü bir membran (RPN303B. Hybond N +, GE Healthcare Ürün Kodu) kromozom aktarın.
- HIS3 gen 17 içeren bir 1.8 kb BamHI / BamHI genomik klon: random priming (RPN1604 Amersham Biosciences Ürün Kodu) tarafından elde edilen 32 P-işaretli prob ile melezleşme.
- Otoradyografi veya phosphorimaging kromozom gözünüzde canlandırın.
5. Temsilcisi Sonuçlar:
Translokasyon testinin grafiksel gösterimi kromozom (Şekil 1) tasvir edilmiştir. Deneysel işlemin şematik (Şekil 2A) görüntülenir. Her iki indüksiyon öncesi ve sonrası kaplama verimliliği yaşayabilir, koloni oluşturan hücrelerin hücre gövdeleri kültür hemasitometre sayımı (Şekil 4B) tarafından belirlenen toplam sayısı toplam sayısına bölünmesiyle belirlenir. Indüksiyon öncesi ve sonrası kaplama verimliliği yabani tip hücrelerin (p-değeri = 0,1400) (Tablo 1) anlamlı derecede farklı değildi.
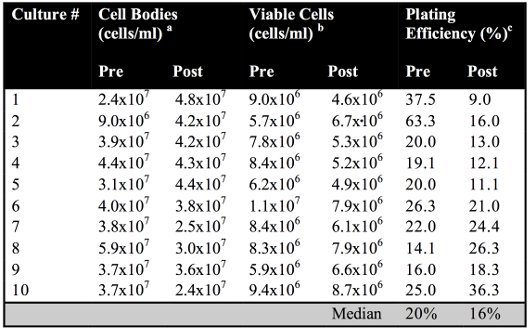
Tablo 1. Ön ve yabani tip hücrelerin sonrası indüksiyon kaplama verimliliği.
hemasitometre sayısı mililitrede hücre gövdeleri bir numara tarafından belirlenir.
b sayısı mililitrede canlı hücreler non-selektif ortam üzerine uygun seyreltiler kaplama ~ 100-200 koloniler tarafından belirlenir.
c pre-ve post-indüksiyon kaplama verimleri toplam sayısına bölünmesiyle belirlenir yaşayabilir, koloni oluşturan, hemasitometre sayısı tarafından belirlenen hücre kültür kuruluşları, toplam sayısına göre hücreler.
Bu yeteneği DSB oluşumu hayatta kalmak için her iki translokasyon kromozom varlığı ya da yokluğu etkilemez göstermektedir. Kromozomal translokasyonların frekans YPD üzerine kaplama (Şekil 2B) tarafından belirlenen toplam sayısına göre canlı hücreler histidin prototrophic kolonilerin sayısına bölünmesiyle hesaplanır. (- / - Yani rad51Δ) Bu testte protein fonksiyon kaybı SSA nasıl etkilediğini belirlemek için farklı genotip suşu kullanılarak yapılan olabilir. Farklı türlerin tespit Rekombinasyon frekansları sonra SSA (Şekil 2C) ve HO-endonükleaz indüklenen DSBs onarmak için bu suşların yeteneği farklılıkları karşılaştırmak için grafikle gösterilebilir. Translokasyon frekansları seçici seçici altında yabani tip diploid suşu (2.2x10 -2) ve koşulları (2.17x10 -2), non-selektif ile elde Translokasyon frekansları elde ederken, birbirlerinin (p-değeri = 0,9131) istatistiksel olarak farklı değildi (6.0x10 -2) ve non-seçici (11.9x10 -2) rad51Δ - / - homozigot benzer ancak istatistiksel olarak anlamlı fark vardı (p-değeri = 0,0089). / - Rad51 ° ile frekansları seçici hem de (p-değeri = 0.0001) ve seçici olmayan (p-değeri = 0.0002) elde edilen homozigot yabani tip suşu ile ilgili koşullar kullanılarak elde edilen istatistiksel olarak farklı idi.
Olası translokasyon taşıyan klonların daha genomik Southern blot ve kromozomal leke analizleri (Şekil 3) tarafından incelenebilir. Güney analizi için, genomik DNA, agaroz jel elektroforezi önce BamHI endonükleaz ile 32 blot ve hibridizasyon sindirilirParçaları (Şekil 3B.1) 1.8kb HIS3 prob tanı 0,8 kb his3Δ200, 1,7 kb his3-Δ3 ':: XV, 5 kb tXV: III, 8 kb his3-Δ5, 4 kb tIII görselleştirmek için P-etiketli . P-CHEF (Şekil 3B.2) ile ayrılmış, sağlam kromozomlar hazırlanan naylon için, lekelenen ve 32 melezleşmiştir olabilir etiketli 1,8 kb HIS3 prob görselleştirmek için 1.1 Mb sağlam kromozom XV, 0.8 Mb tXV: III translokasyon kromozom, 0.6 Mb tIII: XV translokasyon kromozom ve 0.3 Mb sağlam kromozom III (Şekil 3B.3). Bir grafik harita BamHI endonükleaz sindirilir genomik DNA parçaları, ve ebeveyn ve rekombinant kromozomlar, (Şekil 3A) tasvir edilmiştir bekleniyor tasvir.

Şekil 1. Tek iplikli translokasyon kromozom Oluşumu (SSA) tavlama 1) DSBs kültürlere galaktoz Ayrıca aşağıdaki his3 Δ3 ve his3-Δ5 'yüzeyler (sırasıyla kromozom XV ve III) HO endonükleaz tarafından oluşturulur. 2) DSBs kırık kromozomların ucunda 3 'tek-ipliklerini oluşturmak için işlenir. 3) SSA makine tavlarıdır 311 tamamlayıcı veya rekombinasyon yüzeylerin her birinde oluşan 60 nükleotid tek telli HIS3 dizileri. Endonükleaz sindirim tavlama üzerine oluşmuş homolog olmayan kuyrukları tarafından kaldırılır. HO-endonükleaz sindirim oluşturduğu kalan kromozom parçaları üzerinde Tamamlayıcı dört bp çıkıntılar da tavlama. SSA tarafından III translokasyon kromozom: 4) ligasyon sağlam bir HIS3 gen ve tXV oluşturulması sonucuna varmıştır. Bu kromozom taşıyan hücreler orta eksik histidin büyümeye yeteneklerine göre seçilebilir. NHEJ-benzeri bir mekanizma ile XV translokasyon kromozom: ligasyonu da karşılıklı tIII oluşturabilir.
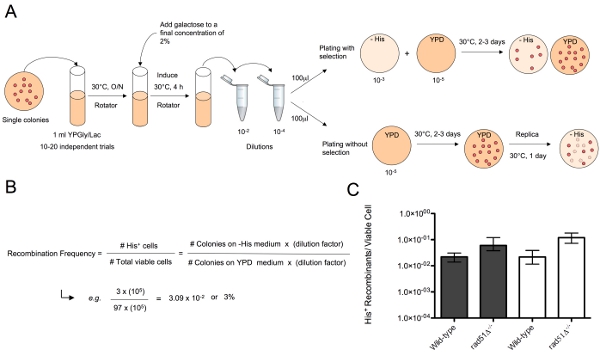
Şekil 2. SSA tarafından translokasyon sıklığı belirlemek için Testi A) Bir ml YPGly / Lac kültürlerin seçkin bir genotip hücreleri tek koloniler ile aşılanmış ve yaklaşık 5x10 7-1x10 8 hücre / ml uygun bir yoğunluk büyüdü. Galaktoz, kromozomları III ve XV rekombinasyon substratlar DSBs oluşturmak için son konsantrasyonu% 2 eklenir. Seçici koşullar altında tahlil yapmak, uygun dilüsyonları yaklaşık 100 ila 200 hücre YPD üzerine kaplama olduğu gibi yapılır ve yeterli sayıda hücre Onun + rekombinant koloniler gözlemlenebilir bir verim orta eksik histidin üzerine kaplanmıştır. Seçim olmadan tahlil yapmak, yaklaşık 100 ila 200 hücre YPD üzerine kaplamalı orta yoksun histidin üzerine kaplama tek koloniler ve sonra çoğaltma 2-3 gün için yetiştirilir. B) Translokasyon frekans YPD yetişen fraksiyonu Onun plakalar büyüyecek kolonilerin sayısına bölünmesiyle belirlenir. C) farklı genotip (yani Wild-tip ve rad51Δ suşlarının translokasyon Frekanslar - / -) SSA DSBs onarmak için bu suşların yeteneği farklılıkları karşılaştırmak için grafikle gösterilebilir.
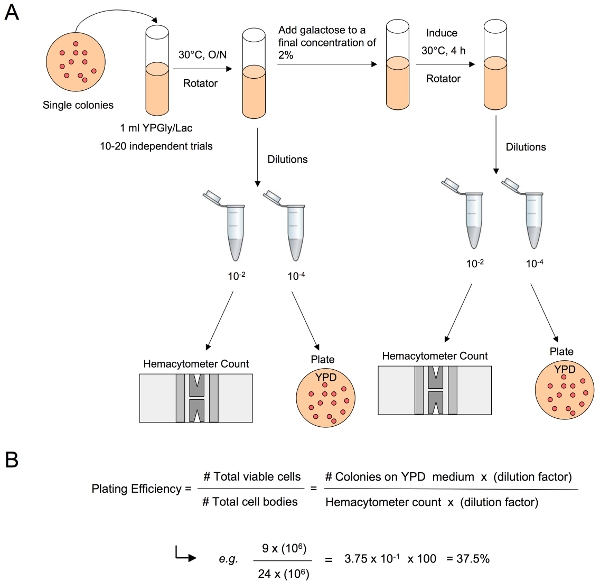
Şekil 3. Kaplama verimliliği belirlenmesi. (A) hücrelerin bir kısım gecede önce kültür ve sonrası DSB indüksiyon alınır, uygun dilüsyonları kültür ml başına hücre gövdeleri toplam sayısını belirlemek için bir hemasitometre sayı ile takip yapılır. Uygun dilüsyonları YPD görünen koloniler sayma, canlı hücreler ml başına toplam sayısı belirlemek için non-selektif ortam üzerine kaplanmıştır. (B) kaplama verimliliği sonra canlı hücreleri hücre gövdeleri toplam sayısına göre toplam sayısına bölünmesiyle ve bu sayının 100 ile çarpılarak belirlenir.
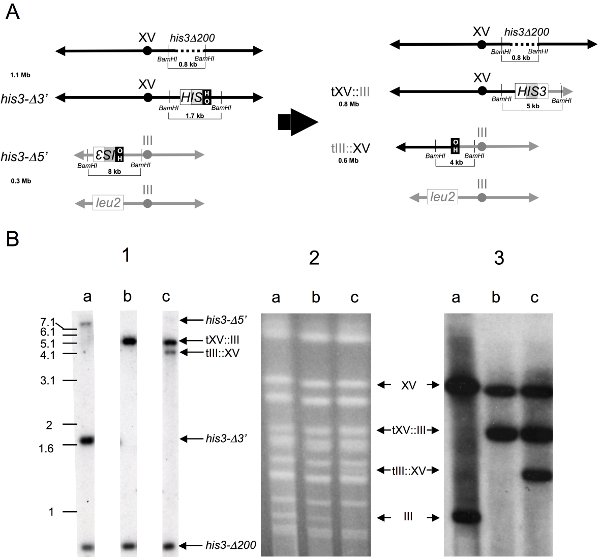
Şekil 4. Genomik Southern blot ve kromozom leke analizleri kromozomal translokasyon olayların tespiti.
A) Grafik önce ilgili kromozom temsili (solda) ve (sağda) translokasyon oluşumundan sonra.
Üst ve rekombinant kromozomlar Büyüklükleri megabase-çift (Mb) yer almaktadır. , Genomik DNA BamHI sindirim ebeveyn ve rekombinant suşlar tarafından oluşturulan ilgili dizilerini içeren kısıtlama parçalarının boyutları ve 1.8 kb BamHI HIS3 genomik klon hibridizasyon tarafından lekeler ortaya, kilobaz-çift (kb) yer almaktadır . Kromozomlar ölçekli çizilmiş değildir.
B) Fiziksel varsayılan translokasyon taşıyan klonların analizi.
(1) Genomik Southern blot analizi - Genomik DNA, jel elektroforezi, blo tarafından fraksiyone, BamHI restriksiyon endonükleaz ile toplanır ve sindirilmiş oldunaylon tted, aşağıdaki parçaları görselleştirmek için bir 32 P etiketli 1.8 kb HIS3 prob melezleşmiştir: 0,8 kb his3Δ200, 1,7 kb his3-Δ3 ', 4 kb tIII: XV, 5 kb tXV: III ve 8 kb his3-Δ5 '. Lanes: rekombinant bir) ana diploid, b) Onun rekombinant + olmayan resiprokal translokasyon, c) Onun + karşılıklı translokasyon.
(2) CHEF jeli - Bozulmamış kromozom etidyum bromür ile boyanmış, CHEF ayrılmış, agaroz fişleri hazırlanmış ve UV ışık altında görüntülendi. Lanes: Yukarıdaki gibi.
(3) Kromozom leke - Ayrı kromozom naylon, lekelenen ve 32 P etiketli 1.8 kb HIS3 probu ile aşağıdaki kromozom görselleştirmek için melezleşmiştir: 1.1 Mb sağlam kromozom XV, 0.8 Mb tXV: III translokasyon kromozom, 0.6 Mb tIII: XV translokasyon kromozom ve 0.3 Mb sağlam kromozom III. Lanes: Yukarıdaki gibi.
Tartışmalar
Yüksek dozda iyonize radyasyon, DSBs 19 çok sayıda üretimi ile genom istikrarsızlık içsel bir risk mevcut . Ökaryotik genomların translokasyonlar ve diğer genomik düzenlenmeleri 20,21 üretmek için mükemmel yüzeyler tekrarlanan dizileri ile doludur. DSBs tekrarlayan dizileri arasında 12,21,22 sunulduğunda İK tarafından kromozomal translokasyonlar sık görülmektedir. Ezici bir delil anlayışının önemini vurgulayan, bu mekanizmanın ökaryotlar 22,23 nasıl oluşur, lösemiler ve lenfomalar kromozom translokasyonları isnat edilebilir ile ilişkili genomik instabilite bu kadar göstermektedir . Biz tomurcuklanan maya maya ve insan genomları boyunca dağınık tekrarlayan elemanlarla boyutu benzer farklı kromozomlar üzerinde homoloji kısa bölgeler arasında DSB-indüklenen İK translokasyon kromozom oluşumunu incelemek için bir sistem geliştirdik.
Tayininde, his3-Δ3 'translokasyon substrat kromozom XV bir kopyası yer alıyor. Diğer his3 allel (his3 Δ200) 24 onarım için bir şablon olarak kullanılan bu sıra engeller HIS3 organizatörü ve kodlama sırası ~ 1KB silme vardır. His3 Δ5 'substrat, kromozom III diğer kopyası ile değiştirilmemiş LEU2 allel (Şekil 1) içeren, kromozom III bir kopyasını LEU2 lokusu yer almaktadır . KAN-MX ile işaretlenmiş bir galaktoz-indüklenebilir HO endonükleaz ifade kaset kromozom IV (: GAL-HO-KAN-MX trp1) TRP1 lokus içine yerleştirildi. Her translokasyon Yüzey galaktoz eklenmesiyle orta HO gen ekspresyonu uyararak bölünme için hedef olabilir HO-endonükleaz tanıma sırası ile çevrili. His3 Δ3 ve his3 Δ5 'substratlar HO-endonükleaz indüklenen bölünme sonra, hücreleri verimli bir translokasyon kromozomu üreten İK kırık kromozom onarmak için HIS3 dizi homoloji paylaşılan kısa yolu (311 baz puan (bp) ya da 60 baz puan (bp)) kullanabilirsiniz sağlam bir HIS3 allel 12-14,25.
Ana hücreleri HIS3 geni bozulmamış bir kopyasını eksikliği nedeniyle, orta His-büyümek mümkün değildir. Translokasyon olayı geçiren hücreler orta eksik histidin için seçilebilir. Bu nedenle, kromozomal translokasyonların frekans histidin prototrophic kolonilerin sayısı YPD üzerine kaplama tarafından belirlenir kaplama canlı hücreler, toplam sayısına bölünmesiyle hesaplanır. Genomik DNA ve sağlam kromozomlar sonra temsili Onun + koloniler ve genomik Güney ve kromozom blot analizleri ile doğrulanır translokasyon kromozom varlığı izole edilebilir.
Dikkatli analiz testinin yaklaşık 12 ek önemli bilgiler toplamak için bize izin verdi. Genomik Southern blot analizi HO-endonükleaz indüksiyon 30 dakika sonra XV ve III kromozom neredeyse tam bir kesim var olduğunu kanıtlar sunmuştur ve böylece kesilmemiş kromozom substratların anlamlı bir arka plan (G. Manthey & A. Bailis, nüfus yayınlanmamış sonuçlar). Onun Genomik Güney ve kromozom leke analizleri - kurtulanların hücreleri sık sık, diğeri ya da her iki kesim kromozom kaybeder ve canlı kalır (L. Liddell & A. Bailis, yayımlanmamış sonuçlar) gösterir . Önemlisi, non-selektif ortamda neredeyse eşdeğer kaplama verimleri HO-endonükleaz ifade indüksiyon öncesi ve sonrası translokasyon kromozom korumak için kırık kromozom onarım yetersizliği, ne de başarısızlık ne DSB oluşumunu hayatta kalmak için yeteneğini etkiler gösterir. Bununla uyumlu olarak, tXV: III translokasyon kromozom seçim olmaması mitotik hücrelerde istikrarsız olacağı gösterilmiştir. Bu tXV büyüyen gösterilmiştir: III-seçici olmayan bir gecede Onun + rekombinantlar içeren non-selektif plakalar üzerine tek koloniler kaplama ve histidin eksik seçici besiyeri üzerine çoğaltma kaplama. : III translokasyon kromozom (N. Pannunzio & A. Bailis, yayımlanmamış sonuçlar): On% 70 bu levhaların kaynaklanan kolonilerin tXV kaybetmişti.
Translokasyon kromozom insanlarda IR maruz tarafından oluşturulan benzer bir istikrarsızlık 26 sergilerler. Bu translokasyon oluşumu heterozigosite kaybı teşvik ederek erken tümörogenez olaylara katkıda bulunabilir göstermektedir. İkincisi, geniş genetik ve moleküler analizler SSA, HR verimli ve zorunlu olmayan muhafazakar bir mekanizma, iki kromozom 12,27,28 DSBs eş zamanlı oluşturulması aşağıdaki İK translokasyon oluşumunun birincil mekanizma olduğunu düşündürmektedir . Bu işbirliğibulgu ile nsistent IR HR maya genomu birden fazla tekrarlanan dizileri bitişik kesmeleri oluşturmak için yeterli DSBs bir yoğunluk ve yüksek frekans translokasyon oluşumu sonucu yüksek dozda. Birlikte, bu gözlemlerin öneririz onkojenik insanlarda IR maruz kalmanın etkisi, kısmen, kendi içsel istikrarsızlık ile, lansman tümörogenez genetik değişiklikler teşvik translokasyonlar oluşturduğu İnsan Kaynakları verimli bir mekanizma ile DSBs onarım sonucu. Radyasyon, radyasyona bağlı DSBs onarım sonucu hastaların sık sık ortaya çıkan ikincil kanserlerin nesil katkıda bulunabilir genellikle kanser, genom düzenlenmeleri tedavisinde kullanılan olduğundan. Böylece, bu model bize, IR tedavisi için önemli bir klinik yanıt, genetik ve moleküler temeli bir anlayışa yardımcı olabilir.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma, Sağlık ve City of Hope Beckman Araştırma Enstitüsü Ulusal Sağlık Enstitüleri fonları tarafından desteklenmiştir. Değerlendirenler yazının netlik eklendi yapıcı yorumlar için teşekkür etmek istiyorum.
Malzemeler

Referanslar
- Sen, S. K. Human genomic deletions mediated by recombination between Alu elements. The American Journal of Human Genetics. 79, 41-53 (2006).
- Han, K. Alu recombination-mediated structural deletions in the chimpanzee genome. Plos Genetics. 3, 1939-1949 (2007).
- Zhang, F. Copy number variation in human health, disease, and evolution. Annual Review of Genomics and Human Genetics. 10, 451-481 (2009).
- Goodier, J. L., Kazazian, H. H. Retrotransposons revisited: The restraint and rehabilitation of parasites. Cell. 135, 23-35 (2008).
- Lanktree, M., Hegele, R. Copy number variation in metabolic phenotypes. Cytogenet Genome Res. 123, 169-175 (2008).
- Mullighan, C. Genome-wide analysis of genetic alterations in acute lymphoblastic leukaemia. Nature. 446, 758-764 (2007).
- Mattarucchi, E. Microhomologies and interspersed repeat elements at genomic breakpoints in chronic myeloid leukemia. Genes Chromosomes Cancer. 47, 625-632 (2008).
- Stenger, J. Biased distribution of inverted and direct Alus in the human genome: implications for insertion, exclusion, and genome stability. Genome Res. 11, 12-27 (2001).
- Hedges, D., Deininger, P. Inviting instability: Transposable elements, double-strand breaks, and the maintenance of genome integrity. Mutat Res. 616, 46-59 (2007).
- Symington, L. Role of RAD52 epistasis group genes in homologous recombination and double-strand break repair. Microbiol Mol Biol Rev. 66, 630-670 (2002).
- Lewis, L., Resnick, M. Tying up loose ends: nonhomologous end-joining in Saccharomyces cerevisiae. Mutat Res. 451, 71-89 (2000).
- Pannunzio, N. R., Manthey, G. M., Bailis, A. M. RAD59 is required for efficient repair of simultaneous double-strand breaks resulting in translocations in Saccharomyces cerevisiae. DNA Repair (Amst). 7, 788-800 (2008).
- Nicholas, R., Pannunzio, G. M. M., Bailis, A. M. RAD59 and RAD1 cooperate in translocation formation by single-strand annealing in Saccharomyces cerevisiae. Curr Genet. 56, 87-100 (2010).
- Manthey, G. M., Bailis, A. M. Rad51 Inhibits Translocation Formation by Non-Conservative Homologous Recombination in Saccharyomyces cerevisiae. Plos One. 5, (2010).
- Knight, W. Confidence Intervals for the Median: Two sided Symmetric --95 or Better. , Available from: http://www.math.unb.ca/~knight/utility/MedInt95.htm (2006).
- Hoffman, C. S., Winston, F. A ten-minute DNA preparation from yeast efficiently releases autonomous plasmids for transformation of Escherichia coli. Gene. 57, 267-272 (1987).
- Sambrook, J., MacCallum, P., Russell, D. Molecular Cloning: A Laboratory Manual. , 3rd edition, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (2001).
- Iadonato, S. P., Gnirke, A. RARE-cleavage analysis of YACs. Methods Mol. Biol. , 75-85 (1999).
- Argueso, J. L. Double-strand breaks associated with repetitive DNA can reshape the genome. Proc. Natl. Acad. Sci. U. S. A. , 11845-11850 (2008).
- Batzer, D. A. Alu repeats and human disease. Molecular Genetic Metabolism. 67, 183-193 (1999).
- Fasullo, M., Dave, P., Rothstein, R. DNA-damaging agents stimulate the formation of directed reciprocal translocations in Saccharomyces cerevisiae. Mutat. Res. 314, 121-133 (1994).
- Richardson, C., Jasin, M. Frequent chromosomal translocations induced by DNA double-strand breaks. Nature. 405, 697-700 (2000).
- Look, A. T. Genes altered by chromosomal translocations in leukemias and lymphomas. The Genetic Basis of Human Cancer. , McGraw Hill. (2002).
- Fasullo, M. T., Davis, R. W. Direction of chromosome rearrangements in Saccharomyces cerevisiae by use of his3 recombinational substrates. Mol. Cell. Biol. 8, 4370-4380 (1988).
- Manthey, G. M., Naik, N., Bailis, A. M. Msh2 Blocks an Alternative Mechanism for Non-Homologous Tail Removal during Single-Strand Annealing in Saccharomyces cerevisiae. PLoS One. 4, e7488-e7488 (2009).
- Muller, I. Time-course of radiation-induced chromosomal aberrations in tumor patients after radiotherapy. Int. J. Radiation Oncology Biol. Phys. 63, 1214-1220 (2005).
- Lin, F. L., Sperle, K., Sternberg, N. Model for homologous recombination during transfer of DNA into mouse L cells: role of DNA ends in the recombination process. Mol. Cell. Biol. 4, 1020-1034 (1984).
- Ivanov, E. L. Genetic Requirements for the single-strand annealing pathway of double-strand break repair in Saccharyomyces cerevisiae. Genetics. 142, 693-704 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır