Method Article
التنميط بروتيوم الأكسدة والاختزال ثيول استخدام الطيف النظائر كتلة توصيف
In This Article
Summary
ورفع مستوى رد الفعل أنواع الاكسجين عندما تواجه الخلايا ظروف الإجهاد. هنا نعرض على سبيل المثال من تلطيخ diaminobenzidine 3'-3 "فضلا عن cysTMT وضع العلامات وقياس الطيف الكتلي لمحة عن بروتيوم الأكسدة في الزائفة syringae تعامل أوراق الطماطم.
Abstract
الزائفة syringae الكهروضوئية DC3000 السلالة. الطماطم ليس فقط يسبب مرض جرثومي بقعة في lycopersicum مغد ولكن أيضا على أنواع الكرنب، وكذلك على thaliana Arabidopsis، وهو نبات المضيف لين العريكة وراثيا 1،2. تراكم أنواع الاكسجين التفاعلية (ريوس) في النبتات تلقيح مع DC3000 يشير إلى وجود دور للروس في تحوير موت الخلايا نخرية خلال مرض جرثومي بقعة من الطماطم 3. ويتم إنتاج بيروكسيد الهيدروجين، وهو مكون من روس، بعد تلقيح نباتات الطماطم مع الزائفة 3. ويمكن الكشف عن بيروكسيد الهيدروجين باستخدام وصمة عار 3'-3 النسيجية "diaminobenzidine (DAB) 4. DAB تلطيخ يتفاعل مع بيروكسيد الهيدروجين لإنتاج البني وصمة عار على ورقة 4 الأنسجة. ROS بدور تنظيمي للبيئة الأكسدة الخلوية، والتي يمكن تغيير حالة الأكسدة من بروتينات معينة 5. السيستين هو حمض أميني مهم حساسة للالأكسدة التغييرات. تحت أكسدة خفيفة، وأكسدة عكسها الجماعات السيستين سلفهيدريل بمثابة المجسات الأكسدة ومحولات الطاقة إشارة إلى أن تنظيم مجموعة متنوعة من العمليات الفيزيولوجية 6،7. جنبا إلى جنب كتلة علامة (TMT) الكواشف تمكين المتزامنة وتحديد الكميات المضاعفة من البروتينات في عينات مختلفة باستخدام جنبا إلى جنب قياس الطيف الكتلي 8،9. والسيستين التفاعل TMT (cysTMT) الكواشف تمكين وضع العلامات انتقائية والكميات النسبية للالسيستين التي تحتوي على الببتيدات من ما يصل الى ستة العينات البيولوجية. كل علامة cysTMT إسوي الضغط له نفس كتلة الأم الاسمي، وتتكون من مجموعة سلفهيدريل التفاعل، وهي ذراع هل MS-محايدة وافاد مراسل MS / MS 10. بعد وضع العلامات، وكانت العينات التي تخضع لعملية الهضم البروتيني. وقد أثرى الببتيدات السيستين المسمى باستخدام الراتنج التي تحتوي على المضادة للTMT الأجسام المضادة. خلال MS / MS تحليل، سلسلة من الأيونات مراسل (أي 126-131 دا) تنشأ في المنطقة كتلة منخفضة، وتوفير المعلومات عن الكميات النسبية.سير العمل غير فعالة للحد من تعقيد العينة، وتحسين المدى الديناميكي ودراسة التعديلات السيستين. هنا نقدم تحليل البروتين الأكسدة من الطماطم DC3000 الباسيفيكي المعالجة (ريو غراندي) يترك باستخدام تكنولوجيا cysTMT. هذا أسلوب الإنتاجية العالية لديه القدرة على أن تطبق على دراسة أخرى الأكسدة التنظيم العمليات الفيزيولوجية.
Protocol
1. تزايد اعداد الشتلات والبكتيريا
- ونبتت شتلة في خليط التربة MetroMix 500 (شركات مؤسسات بريتون وودز) في غرفة نمو (160 الفوتونات μmol م -2 ث -1 مع الضوئية من ضوء ساعة 8 الى 22 درجة مئوية و 16 ساعة مظلمة عند 20 درجة مئوية لمدة 1 أسبوع. النسبية تم تعيين نسبة الرطوبة الى 70٪. وتسقى الشتلات مع الاستفادة من المياه حسب الحاجة للحفاظ على التربة من أن تصبح جافة.
- ثم تزرع الشتلات اثنين مشابهة من حيث الحجم إلى 4 قدور قطر "الذي يحتوي على 500 MetroMix التربة ونمت ل3 أسابيع إضافية في نفس الظروف 1.1.
- الزائفة syringae (PST) هو في البداية T-يشوبه على الملوك باء متوسط (KBM) لوحات (للتر الواحد: 20 ز البروتيوز ببتون، 0.1975 ز MgSO 4، والجلسرين بنسبة 1٪، 1.5 غرام K 2 هبو 4، 18 غراما أجار)، ونمت ل يومين في 28 درجة مئوية. ويتم جمع ومستعمرة واحدة، ويخلط السائل إلى الملوك 300μl B متوسطة (20 ز البروتيوز ببتون، 0.1975 ز MgSO 4 ، و 10 مل من الجلسرين، و 10 مل من K 100X 2 الأوراق المالية 4 هبو (1.5 غرام من K 2 هبو 4 في 10 مل من H 2 O)، وتنتشر في الصعود إلى الملوك B لوحة متوسطة. وهذا المثقف في أكثر من ليلة 28 درجة مئوية.
- يتم تحضير اللقاح البكتيريا عن طريق كشط البكتيريا مثقف من لوحة KBM إلى 20 مل O. 2 H وأعدت OD 600 من 0،03 (~ 10 6 خلية / مل) في 1 لتر من عازلة تلقيح (10 ملم MgCl 2 + 400 ميكرولتر Silwett-70). وقد أعد العازلة تلقيح ناقص بكتيريا من أجل حل الرقابة.
2. تلقيح الطماطم مع O PST و H 2 2 ملون نسيجي كيميائي
- تم تلقيح النباتات أربعة أسابيع من العمر بواسطة غمس في حل تلقيح أعلاه لمدة 30 ثانية. وضعت أكياس من البلاستيك واضحة على النباتات مباشرة بعد التلقيح.
- diaminobenzidine 3'-3 "(DAB) وصمة عار وأعدت 11 (1 ملغ / مل DAB في H 2 O، ودرجة الحموضة 3.8 (حمض الهيدروكلوريك)) 3 دAYS استخدام من قبل لتحقيق الإذابة كاملة. وقد هزت حل لخلط في درجة حرارة الغرفة.
- اربع وعشرين ساعة بعد العلاج، وتمت إزالة ورقة توسعت بشكل كامل، وضعت في DAB وصمة البشرة الجانب الأعلى، وفراغ تسلل لمدة 15 دقيقة. ثم وضعت الأوراق في الظلام في درجة حرارة الغرفة أكثر من ليلة لتلطيخ.
- ويترك يغلى في الايثانول 95٪ لمدة 10 دقيقة، ثم تحفظ في الايثانول 75٪.
3. بروتين استخراج
- بعد الحصاد، وطحن أوراق الطماطم إلى مسحوق ناعم مع النيتروجين السائل باستخدام هاون ومدقة.
- عن 0.5 غرام من الأنسجة، إضافة 1.25 مل تريس درجة الحموضة 8.8 مخزنة الفينول و 1.25 مل / 0.5 غ من استخراج العازلة (0.1 م تريس، حمض الهيدروكلوريك درجة الحموضة 8.8، 10 ملي EDTA، 0.9 م السكروز) ثم متابعة دقيقة لطحن بضعة في دخن غطاء محرك السيارة.
- نقل إلى استخراج أنبوب الطرد المركزي Oakridge (ثيرمو فيشر شركة Nalgene العلمية)، وتستنهض الهمم لمدة 2 ساعة في درجة حرارة الغرفة.
- الطرد المركزي في 5000 XGو 15 درجة مئوية لمدة 10 دقيقة. نقل مرحلة أعلى الفينول إلى أنبوب نظيف جديد.
- استخراج النسخ استخراج المرحلة المائية مع حجم مساو العازلة الفينول؛ تحريض على شاكر لمدة 30 دقيقة. الطرد المركزي ونقل استخراج لأنبوب جديد الصقر.
- كرر الخطوة السابقة مرة أخرى ونقل إلى أنبوب استخراج Oakridge جديد.
- يعجل الفينول البروتينات المستخرجة من خلال إضافة 5 مجلدات من 0.1 خلات الأمونيوم M في الميثانول بنسبة 100٪ (المخزنة عند درجة حرارة -20 درجة مئوية). دوامة واحتضانها عند درجة حرارة -20 درجة مئوية ليلة وضحاها.
- جمع بيليه بروتين عن طريق الطرد المركزي في 20000 XG، 4 درجة مئوية لمدة 20 دقيقة.
- غسل 2 مرات بيليه مع خلات الأمونيوم 0.1M الباردة في الميثانول ومرات 2 مع الأسيتون الباردة بنسبة 80٪. إضافة 1.5 مل الباردة الايثانول 70٪ لبيليه وتعليق. نقل إلى أنبوب microcentrifuge 2 مل (الولايات المتحدة الأمريكية العلمية)، وأجهزة الطرد المركزي في 14000 دورة في الدقيقة، 4 درجة مئوية لمدة 20 دقيقة. إزالة الايثانول.
- تجف لفترة وجيزة بيليه في المكثف SpeedVac وحل في extr بروتينالعازلة العمل، على سبيل المثال استخراج البروتين ReadyPrep الكاشف كيت 3 (8 M اليوريا، الفصلان 4٪، 40 مم تريس القاعدة، 2 M ثيوريا) (بيو راد). الطرد المركزي في 14000 دورة في الدقيقة و 20 درجة مئوية لمدة 30 دقيقة لتشكيل بيليه. جمع وطاف.
- قياس تركيز البروتين باستخدام فحص بروتين CB-X وفقا لدليل الشركة المصنعة (جينو التكنولوجيا).
4. تحضير العينة ووضع العلامات الببتيد مع cysTMTs
- تحضير عينة من البروتين بتركيز 2-5 ميكروغرام / ميكروليتر. هنا نستخدم 100 ميكروغرام من البروتين لكل علامة الشامل، و 20 ميكرولتر-50 عينات ميكرولتر. لهذه التجربة تم استخدام كافة العلامات 6.
- إضافة حجم مساو من عازلة الألكلة (100 مم تريس، حمض الهيدروكلوريك pH7.5، 200 ملي مول iodoacetamide) على عينة من البروتين لمنع مجموعة ثيول مجانا. وينبغي إعداد عازلة جديدة. يتم تنفيذ ألكلة على 37 درجة مئوية لمدة 1 ساعة.
- ترسيب البروتين وذلك بإضافة 1 مل من البرد الأسيتون 80٪ عند درجة حرارة -20 درجة مئوية ليلة وضحاها. بيليه البروتين بواسطة الطرد المركزي في 14000دورة في الدقيقة، 4 درجة مئوية لمدة 20 دقيقة. يغسل 3 مرات بيليه مع الأسيتون 80٪ vortexing في كل مرة. إزالة طاف والسماح الهواء بينما الجافة على الجليد.
- Resuspend لبيليه في 50 العازلة تحلل ميكرولتر (6 م اليوريا، 50 مم قاعدة تريس، 1 ملم EDTA). ثم يضاف 0،5 ميكرولتر من تريس 100 ملم (2-Carboxyethyl) الفوسفين (TCEP) للحد من السندات ثاني كبريتيد التي تفرخ لمدة ساعة في درجة حرارة الغرفة.
- تعد به من خلال إضافة 20 ميكرولتر من الأسيتونيتريل للأنابيب الكاشف إلى ذوبان العلامات. دوامة وتدور إلى أسفل.
- تغسل TCEP اضافية باستخدام Microcon 3KD جهاز فلتر الطرد المركزي (ميليبور). إضافة 50 عينة ميكرولتر إلى عمود 3KD Microcon، و 50 العازلة تحلل ميكرولتر إلى العمود. الطرد المركزي لمدة 15 دقيقة في 10000 XG و 4 درجات مئوية. كرر هذه الخطوة ليصبح المجموع ثلاث مرات. إزالة عمود وعكس في أنبوب نظيف. أجهزة الطرد المركزي لمدة 5 دقائق في 1000 XG و 4 درجات مئوية.
- التحقق من درجة الحموضة. إذا لزم الأمر، وضبط درجة الحموضة إلى 7،0-8،0 مع حمض الهيدروكلوريك 1 م.
- إضافة 5 ميكرولتر من cysTMتي كاشف على كل عينة (طقم كاشف cysTMT يوفر 20 ميكرولتر به لمدة تصل الى 500 ميكروغرام من البروتين، وهذا أسلوب يستخدم 100 ميكروغرام من البروتين، وبالتالي فإننا نستخدم خمس من العلامة). السماح للتفاعل والمضي قدما لمدة 2 ساعة في درجة حرارة الغرفة.
- تم الجمع بين عينات مع الواق عينة Laemmli (بيو راد) في نسبة 1:1.
5. إزالة من غير رد فعل بطاقة تقطير عينة
- تم غليه العينات لمدة 5 دقائق وفصلها عن مادة هلامية مسبقة الصنع بولكرلميد 12٪ (بيو راد). وتشطف الجل ثلاث مرات في 5 دقائق مع تصفية O 2 H وملطخة الأزرق Coomassie (بيو راد) لمدة 1 ساعة. كان جل دي الملطخة بين عشية وضحاها مع H 2 O.
- وقد تم جمع اثني عشر الكسور من كل حارة هلام. وتم تحديد الكسور من قبل فرقة تركيزات بروتين. ومقطعة إلى قطع 1MM الكسور وجمعها في أنبوب 1.5 مل.
- وكانت القطع جل دي الملطخة باستخدام الأسيتونيتريل 50٪ و 0.1 بيكربونات الأمونيوم M في H 2 O. يجب تكرار هذه الخطوة حتى تتم إزالة اللون الأزرق من القطع هلام (~ 3-4 مرات، لمدة 15 دقيقة كل مرة).
- وتجفف قطع جل دي الملطخة باستخدام الأسيتونيتريل 100٪ (تشمل قطع جل) لمدة 15 دقيقة، طاف بعدا، والقطع تجفف باستخدام SpeedVac.
- حل التربسين (Promega) الساعة 1:10 (التربسين: البروتين) نسبة في نفس وحدة التخزين (المجمعة كما وصفت عينة) من 25 ملم بيكربونات الأمونيوم. على سبيل المثال، 600 عينة بروتين ميكروغرام مع حجم من 500 ميكرولتر يحتاج إلى 60 ميكروغرام التربسين المنحل في 500 ميكرولتر من 25 ملم بيكربونات الأمونيوم.
- إضافة إلى حل التربسين القطع جل وتعيين على الجليد لإعادة ترطيب. إذا لم تتم تغطية قطع بإضافة 50 بيكربونات الأمونيوم العازلة ملي. بعد معالجة الجفاف، في احتضان 37 درجة مئوية ل12-16 ساعة.
- إزالة مستخلص بروتين السائل من عينات المحتضنة.
- وقف رد فعل وإزالة أي هضم البروتينات المتبقية من خلال تغطية قطع هلام مع حمض الفورميك بنسبة 5٪، 50٪ الأسيتونيتريل .. هز قطع هلام لمدة 20 دقيقة في غرفة الشركة المصرية للاتصالاتmperature. نقل طاف للأنابيب بروتين العينة المستخرجة من 5.7. كرر الإجراء استخراج مرتين. تجفيف الببتيدات المستخرجة باستخدام SpeedVac.
6. إثراء عينة من cysTMT إعتبر-الببتيدات
- إضافة الانحدار المضادة للTMT الراتنج لأنابيب 0.5 مل لالطين 50٪. (تم تحديد التدرج من تركيز الفرقة في هلام تجزئة، وإذا جمع جزء يتكون من الفرقة المظلمة، هناك حاجة إلى مزيد من الراتنج. الكسور مع أضعف فرق تتطلب كميات أقل من راتنج كما أن هناك أقل من البروتين).
- ثم يتم غسل الراتنج ثلاث مرات مع حجم عمود واحد من 1X تريس مخزنة المالحة (TBS) (25 مم تريس، كلوريد الصوديوم 0.15 متر، ودرجة الحموضة 7.2) (الحرارية البروتين المنتجات بيرس البحث العلمي).
- إضافة 200 1xTBS ميكرولتر إلى كل عينة. ثم تضاف عينات لمكافحة TMT الراتنج (الحرارية البروتين المنتجات بيرس بحوث العلمية)، وتحريكها في درجة حرارة الغرفة لمدة 2 ساعة تلاه التأرجح بين عشية وضحاها في 4 درجة مئوية.
- إضافة إلى عينة العمود (وRMO البروتين المنتجات بيرس البحث العلمي).
- غسل كل عمود ثلاث مرات مع TBS 200 1X ميكرولتر. ثم تبعتها هذا مع الغسيل ثلاث مرات مع الفصول 0.05٪ (الذائبة في TBS 1X).
- ثم يتم غسل العمود ثلاث مرات مع اليوريا M 4 في TBS 1X. ثم يتم استخدام مائتي microliters من H 2 O لغسل العمود ثلاث مرات.
- ومزال كل عينة ثلاث مرات مع 200 ميكرولتر العازلة شطف 50٪ (50٪ الأسيتونيتريل، TFA 0.4٪).
- ثم تجفف العينات في فراغ المكثف.
7. تحليل الطيف الكتلي
- Resuspend العينات في 12 ميكرولتر من الأسيتونيتريل 3٪ مع حمض الفورميك بنسبة 0.1٪ وحقن 5 ميكرولتر مباشرة على 1 Eksigent NanoLC-1D عمود الضغط العالي اللوني السائل (AB SCIEX، الولايات المتحدة الأمريكية).
- سيتم فصل الببتيدات على الثاني Proteopep معرف العمود C18 ميكرون 75 × 20 سم (هدف جديد، الولايات المتحدة الأمريكية) باستخدام الانحدار 4-60٪ (A: الأسيتونيتريل 3٪، وحمض الفورميك بنسبة 0.1٪، (ب): الأسيتونيتريل 97٪، الفورميك بنسبة 0.1٪ حامض)في 3 ميكروليتر / دقيقة خلال 60 دقيقة.
- وقد استخدم العلم الحرارية LTQ Orbitrap XL مطياف الكتلة للكشف عن الببتيدات باستخدام الأعلى 2 × 3 التجربة التي تتكون من مرحلة واحدة MS تليها اكتساب من 3 MS / MS الأطياف مع ارتفاع الطاقة C-فخ التشرذم (HCD) التفكك تليها 3 MS / MS مع التصادم الناجم عن تفكك (CID) لتحديد بروتين. وكانت المعلمات في هذا الوضع: عرض العزلة: 3.0 م / ض، والطاقة الاصطدام: 50٪ (10٪ مع خطوتين). وقد تم اختيار الببتيدات فقط على نحو مضاعف، وبثلاثه مشحونة للتجزئة. تم تعيين معلمات استبعاد ديناميكية ل: كرر العد = 1؛ المدة كرر = 60؛ استبعاد حجم قائمة = 500؛ استبعاد مدة = 28. القيم المستهدفة هي كما يلي: MS = 5 ه 5؛ MS / MS (HCD) = 1 ه 5. تم تعيين أوقات نقل أيون إلى 500 لFTMS و 300 ل MS / MS (HCD). وطلب من اثنين من microscans لأطياف HCD.
8. البحث في قاعدة البيانات وتحديد الكميات
- كانت البيانات التي يحصل عليها إدارة البحث الجنائي وHCD 1nalyzed الحرارية باستخدام مكتشف بروتيوم العلمية البرمجيات 1.2 (الحرارية البروتين المنتجات بيرس البحث العلمي) من خلال سير العمل المتشعبة التي نفذت مراسل ايون المقسم الى كميات صغيرة (20 التسامح الشامل جزء من المليون من الأيونات شظية) لقياس نسبة. جزء مستقل معالجة مرض التصلب العصبي المتعدد الأطياف 2 من خلال الطيف محدد، الطيف الامور الى حالة طبيعية، والعقد الهامور الطيف.
- ثم تم تفتيش بيانات ضد SEQUEST محرك البحث. وقد استخدم جزء من المليون الشامل 20 التسامح. وحددت التعديلات ثابتة إلى كاشف cysTMT (304.18 دا) والتعديلات الديناميكية وشملت الفسفرة والأكسدة ميثيونين (15.99 دا). وتألفت قاعدة بيانات مخصصة لlycopersicum مغد باستخدام الحمض النووي الريبي البيانات (مع حوالي 350،000 مقالات من جامعة هارفرد) واستخدم 13 في كلتا الحالتين.
9. ممثل النتائج
صورة ممثل لمحطة مراقبة الطماطم ورقة ورقة الزائفة هو تلقيحهو مبين في الشكل رقم 1. ويلاحظ وجود فرق بين الرقابة والمعالجة الزائفة أوراق المعالجة. بعد يتم إزالة الأوراق وملطخة باستخدام DAB، عملية اجتثاث تلطيخ يسمح لوصمة عار النسيجية تظهر علامات ريوس في نسيج الورقة (الشكل 2). 2A الشكل هو ممثل من ورقة سيطرة مع عدم وجود تلطيخ. 2B الشكل هو ممثل من ورقة تعامل مع تلطيخ الزائفة وإيجابية لإنتاج 2 H 2 O. ويرد على سبيل المثال من الناتج بروتيوم البيانات اكتشف من البروتين الأكسدة تفاضلي ينظم في الشكل 3. هذا البروتين هو معروف الأكسدة فيريدوكسين-1 البروتين المنظم 14 ولقد ثبت أن تلعب دورا في الدفاع عن النفس ضد الطماطم الزائفة الكهروضوئية syringae 15. ويستخدم كثافة الذروة بين السيطرة وتلقيح العينات للحصول على تقدير نسبي، والتي أظهرت تغيرات كبيرة في ferredoxفي تنظيم الأكسدة-1 (P <0.05). قمم عالية الكثافة تشير إلى أن يتأكسد هذا البروتين استجابة لمعالجة العوامل المسببة للأمراض. الشكل 4 مثالا للناتج بروتيوم البيانات اكتشف من البروتين الذي لديه تنظيم الأكسدة مماثل من بروتين بين السيطرة وعينة تلقيح. قمم من كثافة مماثلة تشير إلى وجود السندات ثاني كبريتيد التي لا تنظمها تغيير في العلاج. إن أسلوب تحدث ثورة في كيفية كشف العلماء cysteines استجابة الأكسدة وdisulfides 10.

الشكل 1. صورة ممثل تلقيح الطماطم يترك حل مع سيطرة (A) والزائفة (B).

الشكل 2. صورة ممثل تلطيخ DAB من الطماطم تلقيح يترك حل مع سيطرة (A) والزائفة (B). تم صبغ الأوراق باستخدام diaminobenzidine 3'-3 ". تمت إزالة الكلوروفيل من أوراق مسلوقة في الايثانول 95٪. تلطيخ الظلام يدل على وجود H 2 O 2. يترك سوى تلقيح مع بكتيريا ثقافة وأظهرت تلطيخ الظلام.
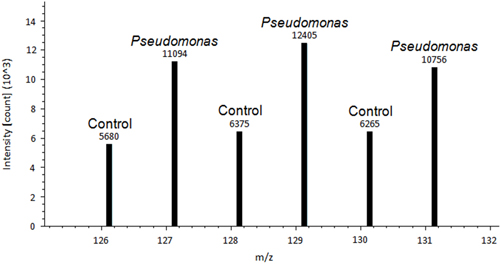
الشكل 3. مثال على الناتج بروتيوم البيانات اكتشف من فيريدوكسين-1، الأكسدة تفاضلي بروتين ينظم 14. ويستخدم كثافة ذروة فوق كل الذروة لالكمي المطلق. ويستخدم كثافة الذروة بين السيطرة وعينات تلقيحالقياس الكمي لأداء نسبي.

الشكل 4. مثال على الناتج بروتيوم البيانات اكتشف من البروتين الذي لديه كثافة مماثلة الذروة بين السيطرة وعينة تلقيح. قمم من كثافة مماثلة تشير إلى وجود السندات ثاني كبريتيد التي لا تنظمها تغيير في العلاج.
Discussion
هذا البروتوكول يوفر معلومات عن أداء تلطيخ DAB، فضلا عن cysTMT المسمى الكمي السيستين الأكسدة. هذه الإجراءات هي مفيدة في دراسة إنتاج ريوس، فضلا عن تأثير ذلك على تنظيم البروتينات عندما يتم تلقيح مغد lycopersicum مع syringae الزائفة. الطرق الواردة في هذا البروتوكول توفير وسيلة لفحص عينات ريوس في ورقة كاملة في الطريقة التي تسبب أقل قدر من الضرر على الأنسجة ورقة. الإجراء وضع العلامات يوفر وسيلة لفحص الأكسدة يحتمل البروتينات تنظم من خلال استخدام أسلوب وضع العلامات السيستين. هذا مفيد عند النظر في مرحلة مبكرة من الاستجابة للضغط النفسي.
ويمكن استخدام أساليب مثل علامة تقارب النظائر تلوينها (ICAT) وcysTMT في دراسة إمكانية تنظيم الأكسدة البروتينات في عينات بيولوجية. ICAT يسمح وضع العلامات والمقارنة بين عينتين 12. كلا أساليب تسمية cysteines حرة ويمكن استخدامها لبروتين quantificأوجه 10،12. ومع ذلك، فإن طريقة cysTMT يسمح للانخفاض في اختلاف التجارب وكذلك الإرسال المتعدد 10. عدد العلامات المتاحة يسمح للباحثين لتشمل مكررات أو عينات متعددة في تصميمها التجريبية. وجود المزيد من عينات يوفر احتمال وجود عدد أكبر من البروتينات التي تم تحديدها. ومن المآخذ الرئيسية لتقنية cysTMT هو أنه ينال من الجودة الشاملة لتحديد بروتين بسبب الخطوات تخصيب انتقائية لcysTMT المسمى-الببتيدات (6،5-6،6). عدد الببتيدات لتحديد بروتين يعتمد بشكل كبير على عدد من بقايا السيستين في تسلسل البروتين. ويمكن التغلب على هذه المشكلة عن طريق تقديم جزء من العينة تريبسيني قبل التخصيب لقياس الطيف الكتلي تحديد بروتين.
نظرا لطبيعة التصميم التجريبي، وكذلك آلية وضع العلامات التي تستخدم أسلوب cysTMT، خطوات معينة حاسمة. أثناء أداء preci بروتينpitation وبيليه الغسيل (3.9) من المهم للحفاظ على عينات من الفتور على الجليد للحد من تدهور البروتين. خلال وضع العلامات cysTMT، إزالة كاشف الحد من (4.6) مهم جدا لأنه قد يتعرض لوضع العلامات عينات عكس ذلك. وضع العلامات العكس هو ممكن إذا خفض كاشف لا يزال في العينة. إذا خفضت عينات بعد وضع العلامات، يمكن إزالة العلامة cysTMT. مرة واحدة يتم إضافة تسميات للعينات، لا بد من التحقق من مستوى الرقم الهيدروجيني (4.7) من أجل الحصول على أفضل كفاءة وضع العلامات. وبالإضافة إلى ذلك، وتحليل البيانات تعتمد على ما هو مطلوب من الباحث والهدف النهائي في استخدام بروتوكول. كما أنها تعتمد على البرمجيات المستخدمة في كل برنامج لديه خوارزميات مختلفة.
هذه التجربة تستخدم الممرض بوصفه elicitor لزيادة الإنتاج من الأنواع المؤكسدة رد الفعل في الطماطم، ومع ذلك، يمكن قياس غيرها من الاستجابات للوائح الأكسدة وفقا لذلك. هذا التصميم التجريبي غير قابلة للتكيف مع النباتية الأخرى والنظم الحيوانية.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر الدكتور غريغ مارتن (جامعة كورنيل) وجماعته لتوفير سلالة DC3000، وبذور الطماطم، وتقديم المشورة. وهم يودون أيضا أن أشكر الدكتور تشونغ لين مذكرة تفاهم للمساعدة في بروتوكول DAB وشعبة البروتيوميات في مركز الجبهة المتحدة المتعدد التخصصات للبحوث التكنولوجيا الحيوية للحصول على المساعدة في تطوير أسلوب. تم تعديل بروتوكول لاستخراج البروتين من Hurkman وتاناكا 16. تم تعديل بروتوكول بشأن وضع العلامات cysTMT، الخطوات من 4 إلى 6 على أساس المنتج الأصلي بيرس الحرارية العلمية فيشر دليل 17. وقد تم تمويل هذا العمل من قبل المؤسسة الوطنية للعلوم (MCB 0818051 لتشن S).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| MetroMix 500 | شركات مؤسسات بريتون وودز | TX-500 | |
| 3،3 '-Diaminobenzidine | سيغما الدريخ | D8001 | |
| ReadyPrep عدة استخراج متسلسل الكاشف 3 | الحيوي راد | 163-2104 | |
| CB-X بروتين مقايسة | التوالد التكنولوجيا | 786-12X | |
| cysTMT الكواشف | الحرارية البروتين المنتجات بيرس البحث العلمي | 90071 | |
| Laemmli عينة الواق | الحيوي راد | 161-0737 | |
| الحيوي الآمن Comassie (G-250 وصمة عار) | الحيوي راد | 161-0786 | |
| Microcon 3KD عمود | ميليبور | 42403 | |
| يجمد مكافحة TMT الراتنج | الحرارية البروتين المنتجات بيرس البحث العلمي | 90076 | |
| عمود الطرد المركزي | الحرارية البروتين المنتجات بيرس البحث العلمي | 89896 | |
| Proteopep العمود الثاني C18 | جديد الهدف | PFC7515-PP2-10 | |
| NanoLC-1D HPLC | AB Sciex | 90389 | |
| LTQ Orbitrap XL | الحرارية العلمية | 0020137580 | |
| SpeedVac | Labconco | 7812013 | |
| بروتيوم مكتشف 1،2 البرمجيات | الحرارية البروتين المنتجات بيرس البحث العلمي | ||
| التربسين | Promega | V5111 | |
| Oakridge أنبوب جهاز طرد مركزي | الحرارية العلمية Nalgeشركة الشرق الأدنى | 3139-0050 | |
| أنبوب Microcentrifuge (2ml) | الولايات المتحدة الأمريكية والعلم | 1620-2700 | |
| 12٪ مصغرة متلون TGX سابقة الصب جل | الحيوي راد | 456-1043 | |
| أعلى النموذج > الحيوي الآمن Coomassie StainBottom من نموذج | الحيوي راد | 161-0786 | |
| TMT تخصيب عدة | الحرارية البروتين المنتجات بيرس البحث العلمي | 90077 |
References
- Almeida, N. F. A draft genome sequence of Pseudomonas syringae pv. tomato T1 reveals a type III effector repertoire significantly divergent from that of Pseudomonas syringae pv. tomato DC3000. Mol. Plant Microbe Interact. 22, 52-62 (2009).
- Preiter, K. Novel virulence gene of Pseudomonas syringae pv. tomato strain DC3000. J. Bacteriol. 187, 7805-7814 (2005).
- Apostol, I., Heinstein, P. F., Low, P. S. Rapid stimulation of an oxidative burst during elicitation of cultured plant cells: role in defense and signal transduction. Plant Physiol. 90, 109-116 (1989).
- Orozco-Cardenas, M., Ryan, C. A. Hydrogen peroxide is generated systemically in plant leaves by wounding and systemin via the octadecanoid pathway. Proc. Natl. Acad. Sci. U.S.A. 96, 6553-6557 (1999).
- Tonks, N. K. Redox redux: revisiting PTPs and the control of cell signaling. Cell. 121, 667-670 (2005).
- Alvarez, S., Wilson, G. H., Chen, S. Determination of in vivo disulfide-bonded proteins in Arabidopsis. J. Chromatogr. B. 877, 101-104 (2009).
- Apel, K., Hirt, H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annu. Rev. Plant Biol. 55, 373-399 (2004).
- Dayon, L. Relative quantification of proteins in human cerebrospinal fluids by MS/MS using 6- plex isobaric tags. Anal. Chem. 80, 2921-2931 (2008).
- Thompson, A. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Anal. Chem. 75, 1895-1904 (2003).
- Rosenblatt, M. A novel cysteine-reactive tandem mass tag reagent for subproteome labeling, enrichment and quantitation. , TP169 (2010).
- Clark, J. Phenotypic analysis of Arabidopsis mutants: diaminobenzidine stain for hydrogen peroxide. Cold Spring Harb. Protoc. , (2009).
- Sethuraman, M. Isotope-Coded affinity tag (ICAT) approach to redox proteomics: identification and quantification of oxidant-sensitive cysteine thiols in complex protein mixtures. J. Proteome Res. 3, 1228-1233 (2004).
- Asso, M. EPR and redox characterization of ferredoxins I and II from Desulfovibrio vulgaris Miyazaki. Biochem. Biophys. Res. Commun. 211, 198-204 (1995).
- Huang, H. e. Disease resistance to bacterial pathogens affected by the amount of ferredoxin-I proteins in plants. Mol. Plant Pathol. 8, 129-137 (2007).
- Hurkman, W., Tanaka, C. Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis. Plant Physiol. 81, 802-806 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved