Method Article
4D التصوير تعدد الوسائط من
In This Article
Summary
التصوير المتعدد طريقة هو نهج قيمة لدراسة الاستعمار الجرثومي في نماذج حيوانية صغيرة. هذا البروتوكول يحدد إصابة الفئران مع إضاءة الحيوية الليمونية rodentium ورصد الطولي للاستعمار الجرثومي باستخدام مركب ضوء منتشر 3D التصوير المقطعي التصوير مع μCT التصوير لخلق فيلم 4D من C. rodentium عدوى.
Abstract
يحدد هذا البروتوكول الخطوات اللازمة لرصد طوليا عدوى بكتيرية إضاءة الحيوية باستخدام مركب ضوء منتشر 3D التصوير المقطعي التصوير مع متكامل μCT (DLIT-μCT) واستخدام لاحقة من هذه البيانات لتوليد الأبعاد (4D) فيلم أربعة من دورة العدوى. لتطوير الأفلام عدوى 4D وللتحقق من صحة التصوير DLIT-μCT للدراسات عدوى بكتيرية باستخدام IVIS الطيف CT، كنا العدوى مع إضاءة الحيوية C. rodentium، والذي يسبب محدودة ذاتيا التهاب القولون في الفئران. في هذا البروتوكول، ونحن الخطوط العريضة إصابة الفئران مع إضاءة الحيوية C. rodentium ورصد غير الغازية من الاستعمار يوميا التصوير DLIT-μCT وتعداد بكتيريا من البراز لمدة 8 أيام.
استخدام الطيف IVIS CT يسهل سلس المشارك التسجيل من بالاشعة الضوئية وμCT باستخدام منصة التصوير واحد. انخفاض جرعة طريقة μCT تمكن التصوير من الفئرانفي نقاط زمنية متعددة خلال العدوى، وتوفير توطين تشريحية مفصلة من البؤر الجرثومية إضاءة الحيوية في 3D دون التسبب في الأعمال الفنية من الإشعاع التراكمي. الأهم من ذلك أن الأفلام 4D من الفئران المصابة توفير أداة تحليلية قوية لرصد ديناميات الاستعمار الجرثومي في الجسم الحي.
Introduction
النماذج الحيوانية الصغيرة، ولا سيما تلك التي تستخدم الفئران، وتستخدم بشكل روتيني للتحقيق المرضية البكتيرية أو لاختبار استراتيجيات التدخل للعدوى، مثل المضادات الحيوية، البروبيوتيك، البريبايوتكس واللقاحات 1-7. لقراءات تجريبية الرئيسي من الإصابات الحيوانية الصغيرة هي الحمل الممرض، توطين المكاني والزماني للعدوى، وتغييرات على الاستجابة المناعية للكائن مصاب. في الجسم الحي التصوير الضوئي هو أداة قيمة لبحوث أمراض المعدية، ويمكن استخدامها لمراقبة متعددة قراءات تجريبية من خلال استخدام جينات مراسل (البروتينات وسيفيراز، فلوري، بيتا اكتاماز، الخ)، والأصباغ الفلورية، النانوية أو تحقيقات chemiluminescent تستهدف بروتين، عملية بيولوجية، أو الكائنات الحية الدقيقة 6.
التصوير تلألؤ بيولوجي (BLI) هو طريقة التصوير الضوئية المستخدمة لرصد الاستعمار من الحيوانات الصغيرة، مثل الفئران والجرذان، من قبل البكتيريا المسببة للأمراضريا 3،6،8،9. يصاب الفئران مع البكتيريا المؤتلف معربا عن وسيفيراز، مثل لوكس CDABE الاوبرون من luminescens Photorhabdus. ثم يمكن الكشف عن هذه البكتيريا من خلال إنتاجها باستخدام ضوء CCD مقرها في الجسم الحي نظام التصوير 3،6،9. الأهم من ذلك، فقط الكائنات الحية الدقيقة الفعالة عملية الأيض هي إضاءة الحيوية (BL)، وهذا يعني تم الكشف عن الخلايا البكتيرية فقط قابلة للحياة عن طريق هذه المنهجية 10،11. باستخدام 2D BLI، موقع المصدر BL يستدل من سطح الحيوان حيث ينبعث إشارة 8. توطين التشريحية الدقيقة للبؤر BL في الجسم الحي لابد من تحديدها من خلال تحليل فيفو السابقين من الأجهزة 3،6،9 وفي المقابل، مركب ضوء منتشر 3D التصوير المقطعي (DLIT) يمكن استخدامها لتجميع إعادة الإعمار 3D الكمي للBL مصدر 12. يتم تنفيذ DLIT من خلال جمع الصور التي يتم التقاطها باستخدام BL المرشحات الضوئية تعريف الفرقة تمرير الضيقة وإدخال في وقت لاحق لهم في منتشر البصرية التصوير المقطعي 3D إعادة الإعمار الخوارزمية 1،7،12،13.
حاليا، التصوير متعدد طريقة هي المنهجية الوحيدة المتاحة للحصول صحيح توطين التشريحية غير الغازية من بؤر إضاءة الحيوية في الجسم الحي دون الحاجة إلى تحليل فيفو السابقين. في الآونة الأخيرة، كنا مجموعة من DLIT المشترك مسجل لدى μCT التصوير لتقييم الليمونية rodentium (C. rodentium) ديناميات الاستعمار بعد العلاج الوقائي مع بكتيريا بروبيوتيك 7. C. rodentium هو الممرض المعوية محددة الفئران تستخدم لعدوى الإنسان نموذج مع ممرض للأمعاء وenterhemorrhagic كولاى 14. C. عدوى rodentium تسبب التهاب القولون الغشائي، التي ترتبط عادة مع معتدل فقدان الوزن والاسهال والاستقطاب TH1 الاستجابة المناعية والتغيرات المرضية متميزة، بما في ذلك القولون تضخم سرداب وربط والأضواء الآفة formatiفي 14. بالإضافة إلى هذا، C. وقد المرضية rodentium درس بعناية باستخدام BLI وديناميات الاستعمار في الفئران C57BL/6J موثقة توثيقا جيدا، مما يجعل هذه البكتيريا والكائنات الحية الدقيقة نموذج مثالي للاستخدام مع متعددة طريقة التصوير 3،4،7.
هذا البروتوكول هو أول من الخطوط العريضة لمنهجية للتصوير DLIT-μCT متكاملة من عدوى بكتيرية باستخدام منصة واحدة تعدد الوسائط والتصوير، وIVIS الطيف CT، وتوليد فيلم 4D تظهر ديناميات الحقيقية لهذه العدوى غير جراحية.
Protocol
1. الفئران التحضير
- شراء أو تولد ما يكفي من 18-20 غرام الفئران C57BL/6J المطلوبة للدراسة.
- في حالة شراء الفئران من مورد خارجي، في أعقاب نقل إلى مرفق، روض الفئران لمدة 1 أسبوع على الغذاء تعقيمها والمياه لتحقيق الاستقرار في مجهريات البقعة الأمعاء.
- تزن، الشق الأذن، وفصل العدد المطلوب من الفئران في قفص.
- في اليوم السابق للإصابة، قبل تنفيذ أي تخدير، والتحقق من أن هناك كافية من الأوكسجين وisoflurane وطوال مدة الإجراء. إذا لزم الأمر، إضافة المزيد من isofluorane أو استبدال أسطوانات الأكسجين. وفي وقت لاحق، والتحقق من وزن الزبالين مخدر، إذا كانوا قد حصل على أكثر من 50 غرام منذ استخدامها لأول مرة، التخلص منها واستبدالها مع الزبالين الطازجة.
- الفئران خدر باستخدام 3٪ isofluorane في XGI-8 التخدير النظام ويزيل الشعر باستخدام VEET لمدة 7 دقائق.
- ملاحظات:
- إزالة الشعر شامل أمر ضروري، خاصة فيالفئران السوداء كما الميلانين في الفراء خفف بشكل كبير من إشارة إضاءة الحيوية 3،15.
- إزالة الشعر من الفئران يستمر عادة 8-10 أيام قبل أن يبدأ الفراء لتنمو. لأداء 4D التصوير تعدد الوسائط على مدى فترات أطول، ويزيل الشعر الفئران عند الحاجة بحيث مجال الاهتمام هو عارية لجلسات التصوير.
- يتم إيواء الفئران في مستوى السلامة الأحيائية 2 (BSL-2) منشأة الاحتواء.
2. إعداد الخلايا البكتيرية
- إعداد ما يكفي لوريا Burtani مرق ولوحات أجار تستكمل مع كاناميسين [50 ميكروغرام مل -1] المطلوبة للدراسة وتخزينها في 4 درجات مئوية حتى المطلوبة.
- قبل يوم من العدوى ذوبان الجليد على cryovial من C. rodentium سلالة ICC180 وعلى الفور إضافة واحد cryobead إلى 15 مل مرق LB تستكمل مع كاناميسين [50 ميكروغرام مل -1] والثقافة بين عشية وضحاها في 220 دورة في الدقيقة، 37 درجة مئوية. كعنصر تحكم عن تلوث المتوسط، إعداد إضافيةuninoculated 15 مل مرق LB تستكمل مع كاناميسين [50 ميكروغرام مل -1] والثقافة في 220 دورة في الدقيقة، 37 درجة مئوية.
- في صباح اليوم التالي (~ 16 ساعة)، والتحقق من السيطرة المتوسطة لالتعكر كدليل على نمو البكتيريا. إذا كان عنصر التحكم هو واضح، ونقل ثقافة ICC180 إلى أنبوب فالكون والطرد المركزي في 4000 دورة في الدقيقة. وفي وقت لاحق، وغسل بيليه البكتيرية في برنامج تلفزيوني. ثم في resuspend 1.5 مل PBS (1/10 عشر للحجم الأصلي للLB تستكمل مع كاناميسين) وتخلط جيدا لخلق اللقاح البكتيري.
- للتحقق من أن ICC180 تم تربيتها بشكل صحيح وإضاءة الحيوية قبل العدوى من الفئران، صورة اللقاح في IVIS الطيف CT باستخدام BLI والإعداد لصناعة السيارات في الصورة الحية معالج 4.3.1 كما هو موضح سابقا 1.
ملاحظة:- سلالة ICC180 هو مشتق من إضاءة الحيوية البرية نوع C. rodentium ICC169 2. هذه السلالة البكتيرية لديه لوكس CDABE الاوبرون بما في ذلك Kإدراج anamycin الجينات المقاومة إلى جين كاذب من xylE في كروموسوم 2.
- تنفيذ جميع زراعة البكتيرية باستخدام تقنيات العقيم القياسية وإذا لزم الأمر إما شراء المواد الاستهلاكية العقيمة / الكواشف أو الأوتوكلاف قبل استخدامها.
- في الخطوة 2.4، القراءة تلألؤ بيولوجي (P / S / سم 2 / ريال سعودي) ويمكن أن تستخدم لتقدير أعداد البكتيريا قبل إصابة الفئران.
3. إصابة الفئران مع إضاءة الحيوية C. rodentium وتقييم استعمار الجرثومي
- قبل الإصابة، والتحقق من أن هناك كافية من الأوكسجين وisoflurane وطوال مدة الإجراء. إذا لزم الأمر، إضافة المزيد من isofluorane أو استبدال أسطوانات الأكسجين. وفي وقت لاحق، والتحقق من وزن الزبالين مخدر، إذا كانوا قد حصل على أكثر من 50 غرام منذ استخدامها لأول مرة، التخلص منها واستبدالها مع الزبالين الطازجة.
- الفئران خدر مع 3٪ isofluorane باستخدام XGI-8 Anaestheنظام SIA لتوفير ضبط النفس الإنسانية.
- مزيج اللقاح البكتيري بدقة واستخلاص 0.2 مل (حوالي 5 × 10 9 كفو ICC180) في حقنة.
- إزالة الفئران من نظام التخدير واحد في وقت والقفا لهم من قبل يمسك بحزم على الجلد خلف الرقبة مع الإبهام والسبابة.
- دفع الإبرة بالتزقيم نحو سقف الفم، على اللسان، وأسفل المريء وحقن اللقاح البكتيري في المعدة.
- بعد أنبوب تغذية عن طريق الفم للفئران، ورصد مشية والتنفس لعلامات الضائقة التي يمكن أن تكون علامة على أن اللقاح البكتيري قد تم تسليمها إلى الرئتين. الموت ببطء أي الفئران التي تم تلقيح في الرئتين.
- الفئران غير المصابة التغذية الأنبوبية مع 200 ميكرولتر PBS بمثابة السيطرة على السيارة، كما هو موضح في الخطوات 3،1-3،6.
- لتأكيد أنه تم تنفيذ أنبوب تغذية عن طريق الفم بشكل صحيح، صورة المصابة وهمية الفئران المصابة في IVIS الطيف CT باستخدام BLI والإعداد لصناعة السيارات في الحيصورة المعالج 4.3.1 كما هو موضح سابقا 1.
- تحديد أعداد البكتيريا قادرة على البقاء في اللقاح عن طريق التخفيف المتسلسل في برنامج تلفزيوني وشاهد في ثلاث نسخ على أجار LB تستكمل مع كاناميسين [50 ميكروغرام مل -1].
- حساب عدد ICC180 وت م / مل من خلال ايجاد التخفيف حيث هناك ما يقرب من المستعمرات 5-50 وحساب عدد المستعمرات من كل بقعة في ذلك تخفيف وتسجيل التخفيف الذي المستعمرات احصي جرا. وفي وقت لاحق، وحساب متوسط عدد كفو (من اماكن ثلاثة) وتتضاعف هذه القيمة من قبل عامل التخفيف 50 (كل بقعة هو 20 ميكرولتر من العينة الأصلية مل 1) وتخفيف احصي المستعمرات على، وإعطاء وت م / مل.
- رصد الاستعمار من الفئران يوميا عن طريق جمع البراز من كل الماوس إلى أنبوب إيبندورف سبق وزنه (وزنه على التوازن الدقيق) وتمييع 1/10 في برنامج تلفزيوني يعتمد على وزن العينة (0.1 مل ز -1).
- تحديد أعداد البكتيريا قادرة على البقاء فيالبراز عن طريق التخفيف المتسلسل في برنامج تلفزيوني وشاهد في ثلاث نسخ على أجار LB تستكمل مع كاناميسين [50 ميكروغرام مل -1].
- حساب عدد من البكتيريا قادرة على البقاء في كل غرام من البراز باتباع الخطوة 3.9، ثم ضرب عدد من وت م / مل من قبل عامل التخفيف البرازي في برنامج تلفزيوني (الخطوة 3.10) من 0.1 مل ز -1 لإعطاء وت م / ز.
- لتحديد أن الفئران تم تلقيح مع نقية ICC180 الثقافة وأن جميع المستعمرات هي إضاءة الحيوية. تأخذ لوحات أجار من الخطوة 3.8، تقييم مورفولوجيا مستعمرة بكتيرية إما عن طريق العين أو اختيار مستعمرة ممثل من لوحة وتحليل بواسطة المجهر الضوئي. إذا لزم الأمر، وتحديد البكتيريا يمكن أن يقوم بها سلالة محددة مستعمرة PCR لتقييم نقاء الثقافة. وفي وقت لاحق، صورة لوحات في IVIS الطيف CT باستخدام BLI كما هو موضح في الخطوة 3.7 وتحقق من أن 100٪ من المستعمرات على لوحة هي إضاءة الحيوية.
ملاحظات:- في الخطوة 3.4، عند إدخال إبرة التغذية الأنبوبية، إذا كنت تشعر المقاومة لا قوة إبرة التغذية الأنبوبية، وهذا يسبب اللقاح للذهاب إلى الرئتين. بدلا من ذلك، إعادة إدراج الإبرة وحاول بلطف مرة أخرى.
- الخطوة 3.1 هو اختياري، ويمكن أن يكون عن طريق الفم الفئران gavaged بدون تخدير تبعا لسياسة الرفق بالحيوان المعاهد.
- يجب مطلي البراز الخروج في اليوم التي يتم جمعها. C. سوف rodentium تنمو حتى إذا تركت في 4 درجات مئوية خلال الليل في برنامج تلفزيوني وسوف يتسبب في القياس الكمي للوت م / ز البراز لتكون غير صحيحة.
4. يوميا مركب ضوء منتشر 3D التصوير المقطعي التصوير مع μCT التصوير (DLIT-μCT) من الفئران المصابة
اعتبارات رعاية الحيوان: DLIT-μCT ينطوي التصوير الضوئي DLIT متكاملة مع بسرعة، منخفضة من الإشعاع جرعة μCT الفحص (~ 23 MGY لفحص الماوس اثنين، ~ 53 MGY لمسح ماوس واحدة) من حيوان يجمد. هذه الجرعة يتراكم مع كل دورة التصوير، وبالتالي فإن الهدف من ذلك هو الحفاظ على جرعة والصغرىث ممكن (ودائما أقل بكثير من الجرعة المميتة، 50/30) في حين لا يزال إنجاز الدراسة. في بعض الحالات، إذا لم يكن هناك علامة على الإصابة في فحص BLI التقليدية من الفئران، والفحص μCT يمكن تجنبها لمزيد من تقليل الجرعة. على الرغم من تحفظ الجرعة عند أدنى مستوى ممكن، في دراسات لفترات طويلة إذا كان هناك أي قلق حول التعرض للإشعاع، سيتم اعدام الفئران في أول بادرة من أعراض ضارة أو في نهاية فترة التصوير μCT.
- قبل التصوير، تهيئة IVIS الطيف CT وتحقق من أن يشتبك سلامة الأشعة السينية تعمل وأن مرحلة ساخنة هو في درجة الحرارة الصحيحة (37 درجة مئوية) للتصوير. وفي وقت لاحق، والتحقق من مستوى isoflourane في نظام التخدير والوزن من الزبالين مخدر. إذا لزم الأمر، إضافة المزيد من isofluorane وإذا اكتسبت الزبالين أكثر من 50 غرام منذ استخدامها لأول مرة، التخلص منها واستبدالها مع الزبالين الطازجة.
- إعداد الطيف CT بحيث المعلمات التصوير التيتشغيل ميزة التعرض التلقائي في العيش 4.3.1 صورة هي الأمثل للتصوير وسيفيراز البكتيرية. اختر تحرير> تفضيلات> واقتناء السيارات نافذة التعرض. ثم حدد> تتراوح القيم> إكسب. الوقت (ثانية) وتعيين> ماكس. ل300S. وأخيرا، حدد> الهدف عدد (الحد الأدنى)> الانارة وتعيين إلى 10،000 التهم الموجهة إليه.
- إدراج منصة واحدة التصوير الماوس في الطيف CT وراسيا عليه في التخدير.
- التبديل على سلامة التعشيق X-ray و تهيئة IVIS.
- مرة واحدة وقد تم تهيئة IVIS الطيف CT، خدر الفئران مع isofluorane 3٪ باستخدام AN-8 XGI نظام التخدير لتوفير ضبط النفس الإنسانية.
- لتحديد ما إذا كان من الضروري إجراء فحص DLIT-μCT، قبل صورة الفئران باستخدام BLI كما هو موضح سابقا 1، في منصة واحدة التصوير الماوس. إذا تم الحصول على إشارة قوية الماوس هو مناسبة لDLIT التصوير. ترك الماوس تخدير في واحدة الماوس التصوير المنهاجم بعد BLI مسح جاهزة للDLIT-μCT.
- استخدام معالج التصوير في البرنامج صورة حية 4.3.1 لانشاء الفحص DLIT-μCT. معالج التصوير تلقائيا يحدد مجال الرؤية، والتعرض الوقت، و توقف و binning لDLIT وفوف، وقت التعرض، ومجموعات التصفية وbinning للتصوير μCT لتقديم أفضل إشارة إلى نسبة الضوضاء. عند المطالبة من قبل معالج التصوير، وتشمل فقط 560، 580، 600، و 620 مرشحات الانبعاثات نانومتر، واختيار واحد الماوس μCT المسح الضوئي. ثم انقر فوق> اكتساب لبدء التصوير.
- عودة الماوس تخدير إلى قفصه بعد التصوير، وإزالة منصة واحدة التصوير الماوس من الطيف CT وتطهير باستخدام 1٪ ثلاثي الجينات. إذا لزم الأمر، استبدل وسادة رغوة أن الماوس يتوضع على لتقليل مخاطر التلوث المتبادل بين الفئران.
- صورة الفئران يوميا ما يصل إلى يوم 8 إصابة آخر (PI) باستخدام DLIT-μCT، كما هو موضح في الخطوات 4،1-4،8، لتوليد بيانات التصوير الطولي المطلوب لإجراء 4D موتتنافس للعدوى.
ملاحظة:- في الخطوة 4.7، نوصي استخدام 560-620 المرشحات الانبعاثات نانومتر إلى صورة تلألؤ بيولوجي البكتيرية. على الرغم من أن ذروة تلألؤ بيولوجي البكتيرية حوالي 485 نانومتر، وذلك بسبب البصريات الأنسجة (التوهين كبير من الفوتونات أزرق / أخضر من قبل الأنسجة الفئران)، فمن المهم استخدام الفوتونات برتقالي / أحمر لاعادة البناء 3D كما أنها تسهل حساب عمق إشارة .
- تحتاج إعدادات التعرض 'تلقائي' في المعيشة 4.3.1 صورة للDLIT إلى تعديل لتحسين كمية من الفوتونات القبض ووقت التصوير الأقصى المستخدمة لكل مجموعة التصفية.
- فمن الضروري فقط لأداء وصفت BLI قبل التصوير في الخطوة 4.6 عندما يكون الباحث ليس متأكدا مما إذا كان هناك إشارة إضاءة الحيوية التي يمكن كشفها، على سبيل المثال عند استخدام نموذج عدوى جديدة.
5. إعادة الإعمار 3D من DLIT-μCT التصوير البيانات
- مفتوح للمعيشة صورة البرنامج 4.3.1 وحدد>؛ تصفح وفتح المجلد الذي يحتوي على ملفات DLIT-μCT.
- فتح ملف DLIT-μCT في الحي متصفح الصورة، على سبيل المثال C. rodentium يوم 1 PI بالضغط تحميل.
- في لوحة أداة تحديد> تضاريس سطح> الماوس عاري، وضبط عتبة، ثم انقر فوق> توليد السطح. وإذا كانت إعادة الإعمار سطح ناجحا يتم عرض مخطط السطح في إطار عرض 3D.
- لعرض مسح μCT المقدمة في إطار عرض 3D، وإخفاء الخطوط العريضة السطح (فوق> أدوات 3D البصرية وإلغاء تحديد> كائن العرض السطح)، أو تقلل من التعتيم السطح (فوق> أدوات 3D البصرية وضبط> شريط التمرير التعتيم).
- لتوفير توطين تشريحية مفصلة لإعادة الإعمار 3D DLIT فمن الضروري أن يغير البيانات الحجمي 3D (μCT المسح) بحيث لا هيكل عظمي الماوس، مرئيا وأنها على النقيض الأمثل. انقر فوق> أدوات تعدد الوسائط 3D والرسم البياني اختر <لوغاريتمي، Gradient الإضاءة والجودة ودينويسي. وأخيرا، وضبط شريط التمرير الرسم البياني إلى اليمين ومشاهدة الحجمي 3D التغيير النقيض البيانات. الحفاظ على ضبط البيانات حتى فقط العظام هي واضحة للعيان. إذا رغبت في تغيير اللون للحصول على النقاط وظيفة نقل على الرسم البياني.
- التالية Select> DLIT إعادة الإعمار 3D في لوحة أداة وتأكد من أن فقط 560، تم اختيارها 580، 600، و 620 نانومتر مجموعات التصفية، وهي مطلوبة من أجل التصوير وسيفيراز الجرثومي في الجسم الحي،. انقر فوق> ابدأ. سوف تظهر في القائمة إطار معاينة البيانات تظهر الآن إشارات BL تصفيتها طيفيا من الماوس التي تم تصويرها في 2D. وthresholded هذه الإشارات تلقائيا من قبل البرنامج، ولكن يمكن ضبطها يدويا إذا لزم الأمر باستخدام علامات التبويب في الجزء السفلي من القائمة. عتبة يحدد كثافة البيانات الحد الأدنى (ممثلة كنسبة مئوية من الحد الأقصى للإشارة في الصورة) والتي سيتم إدراجها كبيانات في اعادة الاعمار.
- التالية Select> DLIT 3D إعادة الإعمار في لوحة أداة والتحقق من أن الخصائص البصرية المستخدمة لإعادة إعمار DLIT صحيحة. حدد علامة التبويب خصائص> وتأكد من أن إعدادات خصائص الأنسجة ومن المقرر أن الأنسجة الماوس، يتم تعيين الطيف مصدر للبكتيريا.
- انقر فوق> إعادة بناء لتنفيذ إعادة الإعمار DLIT.
- لتوليد DLIT-μCT 3D انقر فوق فيلم> أدوات> 3D الرسوم المتحركة وحدد> الإعداد المسبق صور متحركة> CCW Y-المحور و> مجموع المدة> 10 ثانية (25 لقطة في الثانية الواحدة). مرة واحدة في الإعدادات للرسوم المتحركة 3D هي الصحافة الصحيح> تسجيل وحفظ اعادة البناء 3D DLIT-μCT كملفات افي المسمى مع التجربة، مجموعة والوقت نقطة في مجلد منفصل.
ملاحظة:- ومن المهم عند تنفيذ عمليات إعادة البناء 3D من البيانات DLIT-μCT إلى استخدام جهاز كمبيوتر مع الذين يعيشون 4.3.1 صورة وحزمة الخدمة 1 مثبتة وأن جهاز كمبيوتر لديه بطاقة رسومات مناسبة لتشغيل متعدد طريقة برامج التصوير. الويمكن تحميل البرنامج، وترد مواصفات GPU في ملاحظات الإصدار ( http://www.caliperls.com/support/software-downloads.htm ).
- إذا ظهرت اعادة البناء 3D DLIT-μCT إلى الوراء بعد أن أنقذ، جهاز الكمبيوتر الخاص بك يعمل بنظام التشغيل إصدار قديم من برنامج تشغيل الرسومات، وهذا يمكن تصحيحه عن طريق تحميل التحديث من موقع الصانعين.
- في الخطوة 5، نقدم الإعدادات المفضلة لدينا لتوليد 3D اعادة البناء DLIT-μCT. ومع ذلك، هناك عدة نقاط خلال اعادة البناء 3D حيث المعلمات التي لم يتم مناقشتها في هذا البروتوكول يمكن تعديلها. للحصول على دليل شامل لاعادة البناء 3D باستخدام المعيشة 4.3.1 صورة يرجى الرجوع إلى الصانعين دليل التعليمات.
- فمن المهم لخلق 3D اعادة البناء باستخدام إعدادات مماثلة في أداة التصوير متعدد طريقة بحيث تكون قابلة للمقارنة. بالإضافة إلىهذا، عند إنشاء اعادة البناء 3D DLIT-μCT، فإنه من المهم لجعل أشرطة الفيديو باستخدام نفس عدد الإطارات في الثانية ومجموع المدة (طول)، وإلا فإن توقيت فيديو 4D ليست متجانسة.
6. جيل من فيلم 4D من C. عدوى rodentium
- يصف بشكل واضح كل من عمليات إعادة البناء 3D DLIT-μCT مع التجربة الصحيحة، نقطة زمنية ومجموعة في مجلد يسهل الوصول إليه.
- إنشاء ملف جديد في برنامج Windows Movie Maker لايف وإدراج عمليات إعادة البناء DLIT-μCT في الترتيب الزمني من يوم 1 PI باستخدام علامة التبويب أدوات من المجلد أعدت في الخطوة 6.1.
- إضافة تعليق إلى بداية كل فيديو واصفا نقطة زمنية، على سبيل المثال يوم 1 PI من خلال تحديد الفيديو DLIT-μCT المناسبة ثم تحديد الصفحة الرئيسية> إضافة تسمية توضيحية. يظهر مربع النص على الشاشة، حيث يتم إضافة وسيلة الإيضاح المناسبة. ضبط حجم الخط والنمط واللون، والتبرير باسم DesIRED باستخدام علامات التبويب متطابقة إلى Microsoft Word في شريط الأدوات البرمجيات. وأخيرا، نقل التسمية التوضيحية إلى أعلى الزاوية اليسرى من شريط الفيديو.
- كرر الخطوة 7.3 لجميع من أشرطة الفيديو DLIT-μCT.
- إضافة صفحة العنوان، على سبيل المثال C. rodentium أيام عدوى 1-8 بالضغط الصفحة الرئيسية> العنوان. يظهر مربع النص على الشاشة حيث يتم إضافة العنوان المناسب لشريحة فارغة. ضبط حجم الخط والنمط واللون، ومبرر كما تريد باستخدام علامات التبويب متطابقة إلى Microsoft Word في شريط الأدوات البرمجيات.
- حفظ المشروع كمشروع صانع الفيلم * المشاركة المتناقصة في المجلد المناسب مع عنوان الفيلم. هذه الخطوة ضرورية إذا كنت ترغب في تعديل الفيلم.
- حفظ الفيلم كملف WMV. انقر فوق القائمة صانع الفيلم> حفظ الفيلم> لجهاز الكمبيوتر.
- تحويل ملف صانع الفيلم باستخدام تحويل الملف إلى. افي أو نوع آخر ملف مناسب متوافق مع جهاز الكمبيوتر الخاص بك.
ملاحظات:- فمن المستحسن أن السينما 4Dيتم إنشاؤها على جهاز كمبيوتر مع تثبيت ويندوز لايف موفي ميكر ( http://windows.microsoft.com/en-GB/windows7/products/features/movie-maker ) وبرنامج الوسائط المتعددة جيد قادر على اللعب. WMV أو. أنواع ملفات AVI.
النتائج
إصابة الفئران C57BL/6J مع 5 × 10 9 كفو C. rodentium هو نموذج العدوى البكتيرية وصفا جيدا والنتائج في عدوى الجهاز الهضمي محدودة ذاتيا أن القمم بين 6-8 أيام إصابة آخر وتستمر ما بين 3 إلى 4 أسابيع 2،14. يقتصر العدوى إلى تجويف الأمعاء من قبل النظام المناعي الفئران ونتيجة لذلك، يتم تسليط البكتيريا باستمرار في البراز. الاستعمار من الفئران عن طريق C. rodentium يمكن رصدها غير جراحية عن طريق التعداد الجرثومي المباشر من البراز، أو التصوير تلألؤ بيولوجي 2،3.
هذا المخطوط الخطوط العريضة لبروتوكول الأمثل لأداء 3D و 4D تعدد الوسائط التصوير من C. rodentium داخل الفئران لمراقبة الحمولة الجرثومية والتوطين خلال العدوى. النتائج المعروضة في الشكل 1 تدليل على الضوابط المطلوبة لنجاح 4D التصوير. قبل إصابة الفئران لا بد من ردعالألغام أن اللقاح البكتيري المستخدم هو إضاءة الحيوية (الشكل 1A) وأنه في أعقاب بالتزقيم عن طريق الفم من الفأرة مع إضاءة الحيوية C. rodentium، أن إشارة يمكن ملاحظتها في المعدة من الحيوان وليس في الرئتين (1B الشكل) 16.
بالإضافة إلى رصد الاستعمار البكتيري باستخدام التصوير تلألؤ بيولوجي، انها ممارسة جيدة لتحديد أعداد البكتيريا في البراز؛ الذي يستخدم بوصفه القياس غير المباشر من الاستعمار الجرثومي في الغشاء المخاطي الهضمي الشكل 2 يوضح الحمولة الجرثومية نموذجي في البراز المأخوذة من 8 C57BL6 / J. الفئران التي قد اصيبوا بالعدوى مع ~ 5 × 10 9 كفو ICC180 ومراقبتها لمدة 8 أيام PI الزيادات الاستعمار من يوم 2 حتى يوم PI 6-7 حيث القمم العدوى في ~ 5 × 10 10 وت م / ز، وهو ما يتماشى مع التقارير السابقة 2،3،17.
للتأكيد على أهمية EVALUAتينغ قد تولدت من انتشار العدوى في ماوس واحدة، أرقام 1B و 3 وكذلك شريط فيديو 1 من نفس الماوس بعد C. عدوى rodentium، كما هو موضح أعلاه. كان يستخدم يوميا DLIT-μCT لتقييم التوزيع المكاني للإضاءة الحيوية البكتيريا داخل هذا الفأر، وذلك باستخدام هيكل عظمي كمرجع التشريحية. الشكل 3 يوضح اعادة اعمار DLIT-μCT على فأرة الحاسوب C57BL/6J المصابين ICC180 في 3 نقاط رئيسية PI الوقت ويمكن ملاحظة يوم 3 PI صغيرة إضاءة الحيوية البؤر في القولون، والتي تظهر زيادة معتدلة في كثافة تلألؤ بيولوجي من قبل يوم 5 PI مع تغيير طفيف في التوزيع المكاني. في يوم 7 PI لاحظنا زيادة كبيرة في تلألؤ بيولوجي وإضاءة الحيوية بؤر انتشار عبر القولون بأكمله.
فيديو 1 هو عبارة عن تجميع 3D اعادة البناء DLIT-μCT من أيام 1-8 PI مع ICC180 ويوضح C.rodentium داخل القناة الهضمية الداني بين أيام PI 1-2 الذي ينتشر إلى القولون في يوم 3 من PI أيام 4-6 PI الأرقام البكتيرية في القولون التوسع حتى بلغ ذروته في يوم 7 PI حيث يغطي البؤر البكتيرية القولون بأكمله. في يوم 8 PI اثنين فقط البؤر البكتيرية مميزة موجودة في القولون القريبة والبعيدة. القدرة على عرض إعادة الإعمار 3D كامل في كل نقطة زمنية في الترتيب الزمني يمثل أداة قوية لتحليل التفاعلات الممرض المضيف وأسهل لتفسير من 3D لا يزال من نفس مجموعة البيانات.
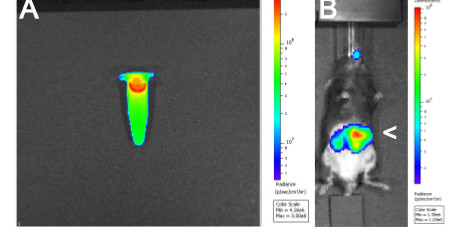
الشكل 1. التصوير تلألؤ بيولوجي من 2D A) إضاءة الحيوية C. rodentium ICC180 اللقاح وباء) ماوس بعد أنبوب تغذية عن طريق الفم مع 200 ميكرولتر من اللقاح. رأس السهم (>) يوضح إضاءة الحيوية C. rodentium EM> في المعدة.
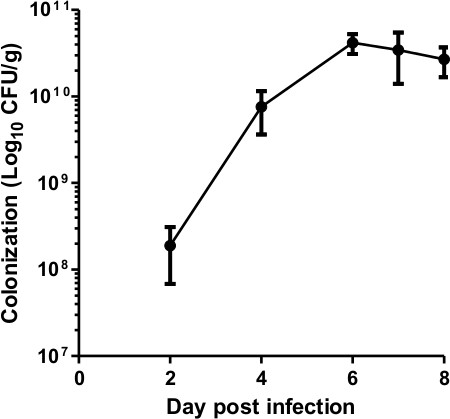
الشكل 2. C. ديناميات الاستعمار rodentium. الكمي لC. مستعمرة rodentium تشكيل وحدات من البراز لمدة 8 أيام PI
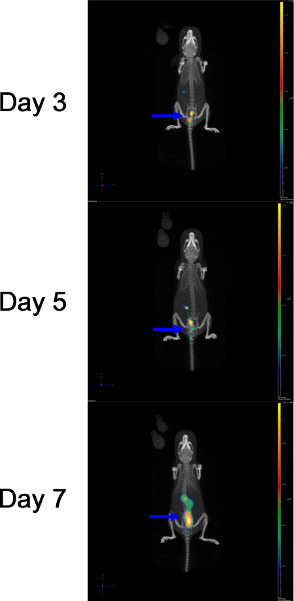
الشكل (3). ضوء منتشر التصوير المقطعي-μCT المسح الضوئي من إضاءة الحيوية C. عدوى rodentium من الماوس واحد رصدها في يوم 3 و 5 و 7 PI السهم (>) يوضح الاستعمار القولون. انقر هنا لعرض أكبر شخصية .
فيديو 1.ع: / www.jove.com/files/ftp_upload/50450/LAB_MEDIA_50450_Frankel_Video1.wmv "الهدف =" _blank "> اضغط هنا لمشاهدة الفيديو. 4D فيلم لحدوث العدوى rodentium من الماوس واحد رصدها من أيام 1-8 PI
Discussion
و4D فيلم من عدوى بكتيرية يوفر أداة مفيدة لتصور وتفسير كميات كبيرة من البيانات التصوير متعدد الطريقة بسرعة وسهولة. هذه التقنية تسهل تحليل مفصل لكيفية انتشار العدوى من خلال الماوس الفردية، ويمكن استخدامها للتحقيق في كيفية حذف المضيفة أو الجينات البكتيرية أو خاصة تدخل استراتيجيات تأثير الحمولة الجرثومية، والتوزيع، وتوطين خلال دراسة طولية 7. كما تقدم أشرطة الفيديو هذه الوسائل التعليمية المفيدة وسيلة لنشر المعلومات للجمهور.
وهناك العديد من الخطوات الحاسمة في هذا البروتوكول، ويمكن أن تؤثر على نوعية البيانات التي تم الحصول عليها من DLIT-μCT التصوير والقدرة على تجميع الفيديو 4D من العدوى. أهم جزء من هذا البروتوكول هو عدوى ناجحة ومتجانسة من الفئران مع C. rodentium. فمن الضروري أن الفئران المستخدمة في الدراسة هي بين 18-20 غرام وأن البكتيرياوأعدت طازجة قيحة ريال وحوالي 5 × 10 9 كفو، كما هو موضح سابقا 2،3. قبل العدوى من الفئران من المهم للتأكد من أن اللقاح هو إضاءة الحيوية باستخدام الطيف CT ومرة واحدة وقد تم إعداد اللقاح، فإنه يجب المتجانس باستمرار قبل gavaged كل فأر لضمان أن الفئران تلقي جرعات المعدية مماثلة. وقد تم تحسين التصوير DLIT-μCT من الفئران بحيث تكون وظيفة تعرض السيارات في الجلوس صورة 4.3.1 برنامج يحدد تلقائيا المعلمات التصوير الأمثل للإشارة إلى أن تكون أعلى بكثير من الضجيج. ومع ذلك، يعتمد وظيفة تعرض السيارات على إعدادات يحددها المستخدم والمعلمات التي تحتاج إلى تعديل كما هو موضح في الإجراء. والفشل في القيام بذلك يؤدي في صور الفقراء مع عدد قليل من الفوتونات التي تم جمعها والتي لا تؤدي إلى تقدم واضح في الإصابة، كما تمت برمجة إعدادات المصنع الطيف CT للautoexposure للأورام التصوير معربا عنluciferase يراعة. إجراء عمليات إعادة البناء باستخدام 560-620 نانومتر تقديم أفضل اتفاق بين بيانات محاكاة ومحسوبة، وبالتالي، هي أكثر موثوقية البيانات أن تدرج في إعادة الإعمار.
وجود قيود على استخدام DLIT-μCT هو أن الإشعاع المؤين من الفحص μCT يسبب أضرار الإشعاع شبه القاتلة التي هي عملية تراكمية خلال دراسة طولية 18. يمكن التعرض للإشعاع المميتة دون إضعاف الاستجابة المناعية، وتسبب التلف في الحمض النووي، وموت الخلايا المبرمج في الأعضاء الداخلية 19. في نهاية المطاف، يمكن التراكمي أضرار الإشعاع شبه قاتلة تتسبب في وفاة إذا كانت الجرعة المميتة، 50/30 الإشعاعات المؤينة يتم تجاوز، وهي تتراوح بين 5 إلى 7 جراى اعتمادا على سلالة الماوس وعمر الفئران المستخدمة 18،20،21. على الرغم من بعض الضرر الجزيئية من الإشعاع المؤين يمكن أن يشفي، لأن المبدأ الأساسي هو تقدير متحفظ جرعة، وهذا ما لا تحتسب عادة لفي تخطيط الدراسة. بدلا من ذلك، فإن الهدف هو البقاء بقدر بيلآه هذه الحدود ممكن في حين لا يزال تحقيق أهداف الدراسة. هذا مهم بشكل خاص في هذه الدراسة بسبب الاستجابة المناعية الطبيعية للعدوى، قد تردد من التصوير، وحقيقة أن المعدلة وراثيا، والمناعية تتكون، أو الحيوانات المصابة بشدة أن تكون أكثر عرضة للإشعاع المؤين.
عند التخطيط للتجربة لتوليد فيلم 4D من العدوى، فمن المهم النظر في طول التجربة، وعدد من μCT بمسح المطلوبة خلال هذه الفترة وLD 50/30 للإشعاع المؤين للسلالة الماوس المستخدمة. آخر قيود المحتملة لDLIT-μCT هو قوة التعبير مراسل داخل السلالة البكتيرية المستخدمة، لأن هذا سوف يؤثر حدود الكشف البكتيرية وأوقات التصوير. فمن المستحسن جدا أن باحثين استخدام التحقق من صحة السلالات البكتيرية التي هي خبيثة تماما، ولكن الأمثل لالقصوى لوكس الاوبرون التعبير، كما هو موضح سابقا لBLI2،3.
التحذير واحدة إلى التصميم الحالي لل4D التصوير هو أن كل فيلم تتألف من فرد بالاشعة DLIT-μCT التي لها توسيع نطاق الفوتون مختلفة. هذا يمكن أن تجعل من الصعب تفسير الصور إذا التغييرات إلى توطين BL البؤر، أو شدته خفية، أو إذا كان هناك واحدة مكثفة BL التركيز تحيط بها عدة بؤر ضعيفة. لذلك، لتصورات طولية، فمن المهم للحفاظ على لون القضبان متناسقة عبر نقاط زمنية.
ويمكن تطبيق مفهوم فيلم 4D العدوى إلى أي الممرض الجرثومي المسمى بشكل مناسب. سوف التنمية المستقبلية لهذه التقنية تهدف إلى استخدام التصوير المقطعي مضان (فليت) وكذلك DLIT لتسهيل التحقيق في الاستجابات المضيفة للإصابة باستخدام مزيج من مسببات الأمراض البكتيرية إضاءة الحيوية والحقن الفلورسنت بالقرب من الأشعة تحت الحمراء تحقيقات للتحقيق استجابات المضيف للإصابة. وبالإضافة إلى ذلك، في هذا البروتوكول ونحن فقطوصف استخدام البكتيريا إضاءة الحيوية لخلق أفلام 4D من العدوى. ومع ذلك، في بعض الحالات قد يكون من الضروري استخدام الفلورسنت البكتيريا المسمى، على سبيل المثال المفتاحية iRFP، بحيث مراسل تلألؤ بيولوجي يمكن استخدامها للتحقيق في علم الوراثة المضيف خلال العدوى. الأهم من ذلك، فإن استخدام التصوير متعدد طريقة الجمع بين DLIT / فليت-μCT تسمح لنا للتحقيق غير جراحية معلمات متعددة أثناء العدوى البكتيرية، والتي سوف تساهم بشكل كبير في الحد، والصقل، واستبدال استخدام الحيوانات في البحوث العلمية على النحو المبين في مبادرة NC3R لل( http://www.nc3rs.org.uk/ ).
Disclosures
وترعى الإنتاج وحرية الوصول إلى هذه المقالة عن طريق PERKINELMER.
الكتاب كيفن P، وفرانسيس، جيف Meganck وChaincy كو هم موظفون من الفرجار-A شركة PERKINELMER.
أجريت جميع التجارب على الحيوانات وفقا للحيوانات الإجراءات العلمية لعام 1986 وتمت الموافقة من قبل لجنة المراجعة الأخلاقية المحلية.
Acknowledgements
ومرفق في التصوير المجراة في امبريال كوليدج تم تمويله من قبل لجنة نهر الميكونج.
Materials
| Name | Company | Catalog Number | Comments |
| Bioluminescent C. rodentium | Frankel lab | ICC180 | Wiles et al., 2004 |
| Veet | Boots | Optimal depilation time is 7 min. Depilation works better if the cream is rubbed in well. | |
| Isofluorane (100% v/v) | Abbott | B506 | |
| Medical Oxygen | BOC Medical | Size F Cylinder. Note: an appropriate regulator is required. | |
| Luria Bertani broth | Merck | 1.10285.0500 | 25 g in 1L Demineralised water. |
| Luria Bertani agar | Merck | 1.10283.0500 | 37 g in 1L Demineralised water. |
| Kanamycin sulphate | Sigma (Fluka) | 60615 | |
| 50 ml Polypropylene conical Falcon tubes | BD (Falcon) | 352070 | |
| Universals | Corning (Gosselin) | E5633-063 | |
| 1 ml syringe | BD (Plastipak) | 300013 | |
| Oral dosing needle (16G x 75 mm) curved | Vet Tech | DE005 | |
| Microbanks (Cryovial) | Pro-Lab Diagnostics | PL.170/Y | |
| IVIS Spectrum CT | Caliper- a PerkinElmer Company | 133577 Rev A/ Spectrum CT | |
| 6kVA UPS | Caliper- a PerkinElmer Company | ||
| XGI-8 anesthesia system | Caliper- a PerkinElmer Company | 118918 | |
| XAF-8 Anaesthesia filter charcoal | Caliper- a PerkinElmer Company | 118999/00 | |
| Living Image v4.3.1 SP1 | Caliper- a PerkinElmer Company | ||
| Benchtop shaking incubator | New Brunswick Scientific | Innova 44 | |
| |||
References
- Chang, M. H., Cirillo, S. L., Cirillo, J. D. Using Luciferase to Image Bacterial Infections in Mice. J. Vis. Exp. (48), e2547 (2011).
- Wiles, S., Pickard, K. M., Peng, K., MacDonald, T. T., Frankel, G. In vivo bioluminescence imaging of the murine pathogen Citrobacter rodentium. Infect Immun. 74, 5391-5396 (2006).
- Wiles, S., et al. Organ specificity, colonization and clearance dynamics in vivo following oral challenges with the murine pathogen Citrobacter rodentium. Cell Microbiol. 6, 963-972 (2004).
- Wiles, S., Dougan, G., Frankel, G. Emergence of a 'hyperinfectious' bacterial state after passage of Citrobacter rodentium through the host gastrointestinal tract. Cell Microbiol. 7, 1163-1172 (2005).
- Fanning, S., et al. Bifidobacterial surface-exopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection. Proc. Natl. Acad. Sci. U.S.A. 109, 2108-2113 (2012).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Collins, J. W., et al. Pre-treatment with Bifidobacterium breve UCC2003 modulates Citrobacter rodentium-induced colonic inflammation and organ specificity of infection. Microbiology. , 10-1099 (2012).
- Contag, C. H., et al. Photonic detection of bacterial pathogens in living hosts. Mol. Microbiol. 18, 593-603 (1995).
- Hardy, J., et al. Extracellular replication of Listeria monocytogenes in the murine gall bladder. Science. 303, 851-853 (2004).
- Szittner, R., Meighen, E. Nucleotide sequence, expression, and properties of luciferase coded by lux genes from a terrestrial bacterium. J. Biol. Chem. 265, 16581-16587 (1990).
- Andreu, N., Fletcher, T., Krishnan, N., Wiles, S., Robertson, B. D. Rapid measurement of antituberculosis drug activity in vitro and in macrophages using bioluminescence. J. Antimicrob. Chemother. 67, 404-414 (2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007 (2007).
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940 (2012).
- Mundy, R., MacDonald, T. T., Dougan, G., Frankel, G., Wiles, S. Citrobacter rodentium of mice and man. Cell Microbiol. 7, 1697-1706 (2005).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Mol. Imaging Biol. 13, 1114-1123 (2011).
- Wiles, S., Crepin, V. F., Childs, G., Frankel, G., Kerton, A. Use of biophotonic imaging as a training aid for administration of substances in laboratory rodents. Lab Anim. 41, 321-328 (2007).
- Crepin, V. F., et al. Dissecting the role of the Tir:Nck and Tir:IRTKS/IRSp53 signalling pathways in vivo. Mol. Microbiol. 75, 308-323 (2010).
- Willekens, I., et al. Evaluation of the radiation dose in micro-CT with optimization of the scan protocol. ContrastMedia Mol. Imaging. 5, 201-207 (2010).
- Boone, J. M., Velazquez, O., Cherry, S. R. Small-animal X-ray dose from micro-CT. Mol Imaging. 3, 149-158 (2004).
- Sato, F., Sasaki, S., Kawashima, N., Chino, F. Late effects of whole or partial body x-irradiation on mice: life shortening. Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 39, 607-615 (1981).
- Kohn, H. I., Kallman, R. F. The influence of strain on acute x-ray lethality in the mouse. II. Recovery rate studies. Radiat. Res. 6, 329-338 (1957).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved