Method Article
المثبطة تشكيل المشبك في الثقافة المشارك نموذجي يتضمن المتوسطة GABAergic شائك الخلايا العصبية وخلايا HEK293 وإذ يعرب ستابلي GABA
In This Article
Summary
الآليات الجزيئية التي تنسق تشكيل نقاط الاشتباك العصبي GABAergic المثبطة أثناء تطور الجنين غير معروفة الى حد كبير. لدراسة هذه العمليات، قمنا بتطوير نظام نموذجي المشارك الثقافة التي تضم الخلايا العصبية الجنينية المتوسطة GABAergic شائك مثقف مع ستابلي الكلى الجنينية البشرية 293 (HEK293) معربا عن الخلايا الوظيفية مستقبلات GABA A.
Abstract
Inhibitory neurons act in the central nervous system to regulate the dynamics and spatio-temporal co-ordination of neuronal networks. GABA (γ-aminobutyric acid) is the predominant inhibitory neurotransmitter in the brain. It is released from the presynaptic terminals of inhibitory neurons within highly specialized intercellular junctions known as synapses, where it binds to GABAA receptors (GABAARs) present at the plasma membrane of the synapse-receiving, postsynaptic neurons. Activation of these GABA-gated ion channels leads to influx of chloride resulting in postsynaptic potential changes that decrease the probability that these neurons will generate action potentials.
During development, diverse types of inhibitory neurons with distinct morphological, electrophysiological and neurochemical characteristics have the ability to recognize their target neurons and form synapses which incorporate specific GABAARs subtypes. This principle of selective innervation of neuronal targets raises the question as to how the appropriate synaptic partners identify each other.
To elucidate the underlying molecular mechanisms, a novel in vitro co-culture model system was established, in which medium spiny GABAergic neurons, a highly homogenous population of neurons isolated from the embryonic striatum, were cultured with stably transfected HEK293 cell lines that express different GABAAR subtypes. Synapses form rapidly, efficiently and selectively in this system, and are easily accessible for quantification. Our results indicate that various GABAAR subtypes differ in their ability to promote synapse formation, suggesting that this reduced in vitro model system can be used to reproduce, at least in part, the in vivo conditions required for the recognition of the appropriate synaptic partners and formation of specific synapses. Here the protocols for culturing the medium spiny neurons and generating HEK293 cells lines expressing GABAARs are first described, followed by detailed instructions on how to combine these two cell types in co-culture and analyze the formation of synaptic contacts.
Introduction
GABA هو واحد من أقدم النواقل العصبية الموجودة في المخ الجنينية، التي سبقت العصبي مثير الأكثر وفرة الغلوتامات 1. خلال التنمية، GABA depolarizes ويثير الخلايا العصبية غير الناضجة، ولعب دورا رئيسيا في تنظيم تكاثر الخلايا والهجرة وتشكيل الشبكات العصبية دون إحداث التحفيز الزائدة. في الدماغ الكبار، وتحول احتمال انعكاس لمستقبلات GABA A قنوات لإمكانات أكثر سلبية بسبب انخفاض في تركيز الخلايا كلوريد. يحدث هذا التحول بنسبة تصل التنظيم من البوتاسيوم كلوريد المشارك نقل (KCC2)، الذي ينقل كلوريد خارج الخلية، وبالتوازي، أسفل تنظيم نقل الصوديوم والبوتاسيوم والكلوريد (NKCC1)، التي لديها تأثير معاكس 2.
في الدماغ، GABA يرتبط في المقام الأول إما GABA A أو B مستقبلات GABA للتوسط سريع أو بطيء تثبيط متشابك، الخاصة بكللاي. GABA A روبية هي فئة من المستقبلات التي تعرف أيضا باسم ionotropic heteropentameric أو السيستئين حلقة القنوات الأيونية يجند بوابات. مطلوبة جزيئين من GABA لتفعيل مستقبلات، وهو نفاذا إلى أيونات الكلوريد وإلى درجة أقل، أيونات البيكربونات. الزيادة في كلوريد تصرف يقلل من فعالية إزالة إستقطاب، أحداث مثير في تفعيل عصبون بعد المشبكي 3.
منذ فترة طويلة معترف بها التنوع الهيكلي للGABA A روبية باعتباره عاملا رئيسيا في تحديد مداها واسعة من الخصائص الفنية والدوائية. مواطن GABA A-روبية هي pentamers مغاير مكونة من وحدات فرعية مع الإسوية متعددة تصنف على أنها: α (1-6)، β (1-3)، γ (1-3)، δ، ε، وπ θ 3، مع شيوعا طوبولوجيا الغشاء يتكون مجال كبير N-محطة خارج الخلية، أربعة مجالات الغشاء (ذاكرات)، ومجال الخلايا الرئيسي بين ذاكرات 3 و 4 4. وβ3 وγ2 مفارز ضرورية لتثبيط متشابك وبقاء الكائن الحي، لأن الفئران الحاملة الحذف الجيني لهذه مفارز تموت بعد الولادة 5،6. في المقابل، الإسوية الفردية α فرعية مهمة لوظيفة من الاتصالات متشابك محددة في الدماغ مرتبطة مع سلوكيات مختلفة مثل القلق، والتخدير، والإثارة، وغيرها، ولكن ليست، بشكل فردي، ضرورية لحياة 7-9. GABA A روبية هي المواقع الرئيسية لعمل لمجموعة متنوعة من العقاقير المهدئة مع قوي، منوم، مزيل القلق وآثار مضاد، مثل البنزوديازيبينات، الباربيتورات، والمسكنات neurosteroids 7،10،11.
يحتوي متشابك GABA A روبية عادة فرعية γ2، وهما مفارز β (الأكثر شيوعا β2 أو β3) واثنين من مفارز α (α1، α2، α3 أو α5) 12،13. الطبقة السائدة من مستقبلات خارج متشابك تحتوي الوحيدات δ في تركيبةمع اثنين من مفارز α (α4 أو α6)، واثنين من مفارز β (β2 أو β3) 14. توطين التحت خلوية من GABA A روبية لمحاور عصبية، التشعبات أو سوما، والإدراج في غشاء البلازما تعتمد على وجود β-مفارز 15،16. ومع ذلك، دمج انتقائي من مختلف GABA A R فرعية في أنواع متميزة من نقاط الاشتباك العصبي يرتبط بشكل جيد مع وجود مفارز α محددة (α1، α2، α3 أو α5) 7،17،18. الأهم من ذلك، حذف أو α2 α1 الوحيدات في الفئران يسبب تغيرات التركيبية في نقاط الاشتباك العصبي المثبطة 19. هذا يشير إلى أن GABA روبية أنفسهم قد تلعب دورا مباشرا في تنظيم تشكيل المشبك.
الأدلة تشير إلى أن التنمية المشبك GABAergic هو تسلسل المشارك منسقة بدقة من الأحداث، والتي على حد سواء الأهداف العصبية اتصلت من قبل أنواع مختلفة من المحاور العصبية المثبطة والمستقبلات التي تتجمع فيكل فئة من المشبك المثبط انتقائية وانسجاما وظيفيا 17،20-22. هذا مبدأ أساسي من خصوصية في نقاط الاشتباك العصبي GABAergic يثير تساؤلا عن كيفية الشركاء قبل وبعد المشبكي تعترف بعضها البعض أثناء بدء الاتصالات متشابك.
في المختبر تم تطبيقها المقايسات شارك في ثقافة بنجاح لدراسة بعض الآليات لتشكيل المشبك واختبار دور الفرد البروتينات التي تغطي شق متشابك في هذه العملية. واحد من عبر متشابك التفاعل تركيبات البروتين المشتركة التي تعمل ثنائي إتجاهي للتوسط تشكيل المشبك والنضج، هي Neurexins (Nrxns) وNeuroligins (NLS). Nrxns هي البروتينات التي تظهر قبل المشبكي الربط البديلة داخل laminin-نيوريكسين الجنس هرمون ملزم المجالات البروتين، مما أدى إلى العديد من الأشكال الإسوية المختلفة 23. بينما Nrxns أيضا تتفاعل مع بروتينات أخرى، ويعتقد أن NLS أن تكون السلطة الفلسطينية بعد المشبكي في كل مكان منrtners 24. معا تسهم هذه البروتينات لعقد الأغشية قبل المشبكي وبعد المشبكي في وثيقة وجامدة بدل 25. والإسوية الأكثر وفرة هما NL-1 وNL-2 والتي هي موجودة في نقاط الاشتباك العصبي مثير والمثبطة، 26 على التوالي. استخدمت واحدة من أقدم النظم نموذج التعاون الثقافة، وتهدف إلى تحقيق التفاعل البروتين عبر متشابك، وأنواع مختلفة من الخلايا غير العصبية، وخطوط الخلايا الأكثر شيوعا الخالدة مثل الكلى الجنينية البشرية (كلوة) 293 الخلايا، لNL- عبر صريح 2. عندما كانت هذه الخلايا المستزرعة مع الخلايا العصبية جسري، لوحظ تراكم البروتينات قبل المشبكي على مقربة من سطح الخلايا كلوة، مشيرا إلى تشكيل الاتصالات مثل المشبك. إضافة للذوبان β-نيوريكسين لهذه الثقافات المشتركة تحول دون تشكيل الاتصالات، مما يشير إلى أن التفاعلات العابرة للمتشابك بين Nrxns وNLS ضرورية لتشكيل اتصال متشابك 27. وعلاوة على ذلك، والتعبير عابرةمن β-COS نيوريكسين في خلايا (C V-1 (قرد) في يا rigin، وتحمل المادة الوراثية S V40) شارك في تربيتها مع glutamatergic الحصين فصلها وGABAergic الخلايا العصبية التي يسببها التعبير من البروتين gephryin بعد المشبكي ومفارز GABA A R γ2 وα2 في نقاط الاتصال بين هذه الخلايا النوعين 28. مثال آخر على نموذج التعاون ثقافة المستخدمة لدراسة تشكيل المشبك تشارك HEK293 الخلايا، عابر مع GABA A مفارز α2 R / β3 / γ2 وNL-2، والتي يقطنها خليط سكاني من الخلايا العصبية طائي 29. وخلصت هذه الدراسة إلى أن التعبير عن NL-2 هو شرط مطلق لتشكيل الوصلات العصبية المثبطة.
α1 ومع ذلك، في دراسة شارك في الثقافة الأخيرة، ستابلي / β2 / γ2 GABA A عثر روبية في الخلايا HEK293 أن تكون كافية للحث على نقاط الاشتباك العصبي وظيفية عندما شارك في تربيتها مع ميد GABAergicالخلايا العصبية الشوكية البوتاسيوم، دون الحاجة للبروتينات التصاق عبر متشابك أو بعد المشبكي إضافية. ومع ذلك، لوحظ وجود زيادة بارزة في تشكيل المشبك وقوة عندما كان يشارك أعربت-NL-2 مع GABA A 30 روبية. هذا يدل على أن هذا النظام نموذج التعاون ثقافة مزاياه على الأنظمة النموذجية التي سبق وصفها، من الواضح أكثر وزيادة حساسية وموثوقية الكشف عن اتصال متشابك. اثنين من العوامل الهامة المساهمة في التحسن الشامل في الكشف عن اتصالات متشابك هي: ط) استخدام ستابلي خطوط الخلايا HEK293 مع التعبير عال وثابت من مفارز GABA A R على سطح الخلايا الفردية. هذا التناسق يسهل مقارنات كمية بين مختلف الظروف المشارك الثقافة. ب) استخدام السكان نقية من GABAergic الخلايا العصبية الشوكية المتوسطة مثقف من المخطط الجنيني 31 يزيل التعقيدات والالتباسات الناتجة عن استخدام السكان العصبية المختلط وألووفاء سلطان، على سبيل المثال، اختيار الأنسب بعد المشبكي أنواع GABA A R التي يمكن مقارنتها مع بعضها البعض خلال تشكيل المشبك.
ويعتقد تكوين نقاط الاشتباك العصبي لإشراك العديد من الإشارات العابرة للمتشابك داخل المجمعات التصاق الخلية قبل وبعد المشبكي. نظرا لطبيعة ثنائية الاتجاه من إشارات متشابك والأعداد الهائلة من جزيئات التصاق الخلية، فمن الصعب تحديد المكونات الرئيسية المشاركة في تشكيل المشبك. وبالتالي، transfecting واحد بروتين التصاق الخلية إلى خلية غير العصبية (في هذه الحالة، وهما الأهداف بعد المشبكي الأكثر انتشارا لGABAergic الخلايا العصبية الشوكية المتوسطة في الجسم الحي، α1 / β2 / γ2 أو α1 / β3 / γ2 GABA A روبية 32) إلى حد كبير يقلل من تعقيد الإشارات العابرة للمتشابك المتاحة على السطح بعد المشبكي ويسمح التحليل الكمي الدقيق لفعالية هذا البروتين في تعزيز تشكيل المشبك.
Protocol
سبراج داولي الفئران أو BAB / ج الفئران الفطرية (هارلان، المملكة المتحدة؛ وكان عدد الإناث الحوامل المستخدمة 30) وتم إيواء والتضحية وفقا لوزارة الداخلية البريطانية [وتوجيه مجلس الجماعات الأوروبية من 24 نوفمبر 1986 (86/609 / EEC) ] المبادئ التوجيهية. تمت الموافقة على المشروع رسميا من قبل مدرسة UCL لجنة أخلاقيات الصيدلة.
1. إعداد الآلات، الثقافة المتوسطة، وأطباق
- تشغيل وتنظيف غطاء تدفق الصفحي مع 70٪ من الإيثانول من أجل العمل تحت ظروف معقمة في كل الأوقات.
- إعداد HEK293 خلية ثقافة المتوسط، التي تحتوي على Dulbecco لتعديل النسر المتوسطة 7.4 درجة الحموضة (DMEM، 500 مل)، L-الجلوتامين (2 ملي)، البنسلين (50 وحدة / مل)، الستربتومايسين (50 ميكروغرام / مل)، ومصل بقري جنيني (10 ٪).
ملاحظة: البنسلين والستربتومايسين والمهيجات. - إعداد الخلايا العصبية مستنبت المصل خالية، تحتوي على Neurobasal المتوسطة ودرجة الحموضة 7.4 (500 مل)، B27 الملحق (25 مل)، L-الجلوتامين (2 ملي)، البنسلين(50 وحدة / مل)، الستربتومايسين (50 ميكروغرام / مل)، والسكر (6 ملم).
- إعداد 500 مل من HEPES مخزنة محلول ملحي (HBSS)، التي تحتوي على HBSS 10X الأسهم (50 مل)، HEPES (1 M) (5 مل) والماء (445 مل)، ودرجة الحموضة 7.4.
- الفوسفات مخزنة الأوتوكلاف محلول ملحي (PBS، ودرجة الحموضة 7.4، 1 L)، المياه (1 لتر)، coverslips الزجاج (13 مليمتر في القطر) والماصات الزجاج باستور لتعقيم لهم.
2. إعداد HEK293 خط الخلية مستقرة وإذ يعرب α1 / β3 / γ2-GABA A روبية
- لوحة 2X10 6 خلايا HEK293 إلى 10 سم العقيمة لوحة زراعة الأنسجة واحتضان عند 37 درجة С في ترطيب 5٪ ثاني أكسيد الكربون (CO 2) الغلاف الجوي (CO 2 حاضنة) من أجل الوصول إلى 70-90٪ confluency بين عشية وضحاها.
- في اليوم التالي، بالنقل خلايا HEK293 مع GABA A R α1 الوحيدات [كدنا] في pcDN 3.1 (+) التعبير ناقلات دمج ثنائي السلفات G418 (الجدول 1) مقاومة الجينات،وβ3 فرعية [كدنا GABA A R في ناقلات التعبير دمج phleomycin D1 (الجدول 1) مقاومة الجينات (سواء في إطار تنظيم والفيروس المضخم للخلايا البشرية فوري المبكر (CMV) مروج)، وذلك باستخدام صياغة الحويصلية الموجبة، الذي المجمعات مع سلبا اتهم جزيئات الحمض النووي (الجدول 1) وفقا لبروتوكول الشركة المصنعة.
- لفترة وجيزة، إضافة 500 ميكرولتر من متوسطة خفض المصل (الرقم الهيدروجيني 7.4، الجدول 1) و 7.5 ميكروغرام لكل [كدنا] بناء على العقيمة أنبوب 15 مل الطرد المركزي، تليها 15 ميكرولتر من liposomal ترنسفكأيشن التخزين المؤقت كاشف، وتخلط بلطف قبل يترك في درجة حرارة الغرفة ل 5 دقائق.
- إلى هذا الخليط، إضافة 8.75 ميكرولتر من liposomal ترنسفكأيشن الكاشف وتخلط بلطف قبل ترك في درجة حرارة الغرفة لمدة 30 دقيقة. بعد ذلك، أضف 3 مل من HEK293 خلية ثقافة المتوسط (دون مضادات حيوية)، ماصة محتويات أنبوب الطرد المركزي صعودا وهبوطا مرتين، حوالةص قطرة من الحكمة على خلايا تنمو في طبق 10 سم زراعة الأنسجة، واحتضان لمدة 48 ساعة عند 37 ° С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- غسل الخلايا HEK293 بلطف مع PBS العقيمة، ودرجة الحموضة 7.4، وتمييع الخلايا HEK293 transfected إلى 10 سم أطباق زراعة الأنسجة الجديدة، من خلال النسب التالية: 1: 3، 1: 5، 1: 7، 01:10، 01:15 و01:20. وهذا يضمن أن الخلايا لن تصبح متموجة بشكل مفرط.
- بدء اختيار الخلايا HEK293 التعبير عن كل مفارز GABA A R بإضافة 800 ميكروغرام / مل من كل علامة اختيار المضادات الحيوية، G418، وPhleomycin D1، إلى مستنبت. احتضان الخلايا عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 الحاضنة) واستبدال المتوسطة التي تحتوي على المضادات الحيوية (10 مل) كل أيام 2.
- عندما تبدأ مستعمرات صغيرة بيضاء لتشكيل (عادة بعد حوالي 7 أيام)، اختر بعناية مستعمرة واحدة من كل من الأطباق وجمع ذلك باستخدام معقم P1000ماصة. نقلها إلى بئر واحدة من 24 لوحة جيدا زراعة الأنسجة التي تحتوي على 500 ميكرولتر من المتوسطة و resuspend بواسطة pipetting المتوسطة صعودا وهبوطا بعناية. ضمان أن يتم نقل واحد بالضبط مستعمرة في كل بئر (ينصح مجموعه من 5-20 المستعمرات). احتضان الخلايا عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 الحاضنة) واستبدال المتوسطة التي تحتوي على المضادات الحيوية كل أيام 2.
- مرة واحدة تصبح المستعمرات 70-80٪ متموجة، ماصة بلطف المتوسطة صعودا وهبوطا لإزاحة الخلايا من الجزء السفلي من لوحة 24-جيدا زراعة الأنسجة. نقل وتقسيم تعليق الخلايا بين 2 آبار في 6 جيدا وحة زراعة الأنسجة. احتضان الخلايا عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 الحاضنة) واستبدال المتوسطة التي تحتوي على المضادات الحيوية كل أيام 2.
- مرة واحدة 70-80٪ متموجة، وجمع الخلايا من 1 من 2 الآبار التي تحتوي على الخلايا التي تنشأ من نفس القولون واحدذ وإعداد لست] البروتين. لفترة وجيزة، وغسل خلايا 2X مع برنامج تلفزيوني، ودرجة الحموضة 7.4، وإضافة 200 ميكرولتر من 2٪ دوديسيل كبريتات الصوديوم (SDS) في برنامج تلفزيوني، ودرجة الحموضة 7.4. جمع المحللة وتحويلها إلى أنبوب microcentrifuge. قياس تركيز البروتين باستخدام BCA البروتين كاشف (انظر الجدول 1) وفقا لبروتوكول الشركة المصنعة. تحليل التعبير عن α1 وβ3 مفارز مستقبلات GABA A التي كتبها SDS / صفحة وimmunoblotting باستخدام الأجسام المضادة فرعية محددة (أرنب المضادة للα1 محددة والأرانب الأجسام المضادة GABA A R مكافحة β3 محددة، انظر الجدول رقم 1 للحصول على معلومات حول هذه الأجسام المضادة).
- طرد ونقل الحيوانات المستنسخة الإيجابية فقط من الآبار المتبقية إلى 6 سم أطباق أكبر زراعة الأنسجة. احتضان الخلايا عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 الحاضنة) واستبدال المتوسطة التي تحتوي على المضادات الحيوية كل أيام 2.
- تدريجيا توسيع مستعمرات الخلايا شالتانجو اختيار المضادات الحيوية بنقلهم إلى 10 سم أطباق زراعة الأنسجة، وأخيرا إلى قوارير زراعة الأنسجة (T-75 قوارير). احتضان الخلايا عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 الحاضنة) واستبدال المتوسطة التي تحتوي على المضادات الحيوية كل أيام 2.
- لوحة 70،000 الخلايا من كل مستعمرة على coverslips الزجاج (13 مليمتر في القطر) وإصلاح الخلايا لتحليل التعبير سطح الخلية وشارك في توطين مفارز GABA A R كتبها المناعي.
- حدد استنساخ الإيجابي للخلايا HEK293 معربا عن مستويات عالية من كلا α1 ومفارز β3 من GABA A المستقبلات، لوحة 2 × 10 6 خلايا إلى 10 سم صحن زراعة الأنسجة عقيمة واحتضان عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي ( CO 2 الحاضنة) بين عشية وضحاها. تأكد من أن الخلايا المحتضنة في المضادات الحيوية التي تحتوي على (G418 وPhleomycin D1) المتوسطة في جميع الأوقات.
- في اليوم التالي، بالنقل كلوة293 الخلايا مع GABA A R γ2s فرعية [كدنا] في pcDNA ™ 3.1 (+) ناقلات التعبير دمج هيغروميسين ب مقاومة الجينات باستخدام غير liposomal الدهن ترنسفكأيشن الكاشف (الجدول 1).
ملاحظة: هذه الطريقة ترنسفكأيشن يسمح أفضل البقاء وأعلى كفاءة التعبير عن البروتينات الخارجية في بطء متزايد خطوط الخلايا مستقرة وهي تحت اختيار مستمرة مع المضادات الحيوية. - في العقيمة 15 مل أنبوب الطرد المركزي، إضافة 250 ميكرولتر من محسن والتكثيف DNA عازلة (الجدول 1) و 1.4 ميكروغرام من γ2s مستقبلات GABA A [كدنا فرعية. إضافة 11.2 ميكرولتر من محسن ودوامة لمدة 1 ثانية قبل أن تترك في درجة حرارة الغرفة لمدة 5 دقائق.
- إضافة 35 ميكرولتر من غير liposomal كاشف ترنسفكأيشن الدهون ودوامة لمدة 10 ثانية قبل أن تترك في درجة حرارة الغرفة لمدة 10 دقيقة. إضافة 3 مل من G418 / Phleomycin D1 تحتوي على المديين المتوسط وماصة محتويات أنبوب الطرد المركزي صعودا وهبوطا مرتين فرنكاخام نقله إسقاط الحكيم على خلايا تنمو في 10 سم لوحة زراعة الأنسجة. احتضان الخلايا لمدة 48 ساعة عند 37 ° С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- غسل الخلايا برفق مع برنامج تلفزيوني العقيمة وتمييع لهم في 10 سم أطباق زراعة الأنسجة الجديدة، من خلال النسب التالية: 1: 3، 1: 5، 1: 7، 01:10، 01:15 و 01:20.
- تبدأ مجموعة من الخلايا α1 / β3-HEK293 التعبير الوحيدات γ2s بإضافة 800 ميكروغرام / مل من علامة اختيار المضادات الحيوية هيغروميسين باء لG418 / Phleomycin D1 تحتوي على المتوسط. استبدال المتوسطة القديم مع G418 جديدة / Phleomycin D1 / هيغروميسين B-تحتوي على المتوسط (10 مل) كل أيام 2.
- كرر الخطوات 2،7 حتي 2،12، في ظل اختيار مستمرة في G418 / Phleomycin D1 / هيغروميسين B-تحتوي على خلية ثقافة المتوسط.
- تخزين الحيوانات المستنسخة الإيجابية في -140 درجة مئوية مجانا المضادات الحيوية في المزارع الخلوية المتوسطة و 10٪ ثنائي ميثيل سلفوكسيد (DMSO) لاستخدامها في المستقبل.
- اختبار مستوىالتعبير عن α1، β3 وγ2s مفارز GABA A R كتبها immunoblotting والمناعي في كل استنساخ التالية إزالة الجليد، لأن التعبير يمكن أن تتغير نظرا لانخفاض بقاء الخلايا تحت اختيار المضادات الحيوية.
3. صيانة HEK293 خطوط الخلايا
- تذويب قارورة السيطرة HEK293 الخلايا أو تلك التي تعبر عن إما α1 / β2 / γ2-GABA A روبية (الجدول 1) أو α1 / β3 / γ2-GABA A روبية (المذكورة أعلاه) في 10 مل من مستنبت الخلية في 15 مل العقيمة أنبوب الطرد المركزي. الطرد المركزي في 440 x ج لمدة 5 دقائق لإزالة DMSO الزائد.
- إزالة الخلايا وطاف resuspend في 1 مل من مستنبت خلايا جديدة.
- أولا إضافة 9 مل من جديد خلية ثقافة المتوسط لطبق 10 سم زراعة الأنسجة المغلفة مع بولي-D-ليسين (0.1 ملغ / مل) ثم 1 مل من الخلايا معلق. تستنهض الهمم بلطف، جنبا إلى جنب، لتفريق الخلايا واحتضان عند 37 ° С في ترطيب5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- في اليوم التالي، ونضح وسيلة لإزالة أي حطام خلية واستبدالها مع 10 مل من جديد HEK293 خلية ثقافة المتوسط.
- تحديد خطوط الخلايا مستقرة مع المضادات الحيوية لإزالة أي خلايا التي لا تعبر عن مفارز GABA A R، وبالتالي تفتقر أيضا التعبير عن علامات مقاومة المضادات الحيوية. للخط / β2 / γ2 خلية مستقرة α1، استبدل المتوسطة الطبيعي الطازج مع مستنبت الخلية التي تحتوي G418 (800 ميكروغرام / مل). للخط α1 / β3 / خلية γ2، مع استبدال الطازجة مستنبت الخلية التي تحتوي G418 (800 ميكروغرام / مل)، Phleomycin D1 (800 ميكروغرام / مل)، وهيغروميسين ب (800 ميكروغرام / مل). تنبيه! G418 هو مصدر إزعاج و هيغروميسين B هو تآكل، سامة ومهيجة.
- مرور خلايا في طبق نسيج الثقافة الجديد من قبل البذر في مناطق ذات كثافة منخفضة بمجرد تحقيق> 70٪ confluency. نضح 10 مل من مستنبت الخلية ويغسل مرتين لفترة وجيزة معبرنامج تلفزيوني، ودرجة الحموضة 7.4. إضافة 1 مل من EDTA-التربسين حل، حل التربسين البروتيني (التربسين 0.05٪) والكالسيوم 2+ خالب EDTA (0.02٪) في برنامج تلفزيوني، ودرجة الحموضة 7.4، لفصل الخلايا من الطبق. التربسين-EDTA تنبيه! الحل هو مصدر إزعاج.
- إضافة 10 مل من مستنبت الخلية التي تحتوي على المضادات الحيوية الصحيحة، إلى الطبق ونضح الخلايا. الطرد المركزي الخلايا في 440 x ج لمدة 5 دقائق و resuspend لهم في 5 مل من مستنبت الخلية.
- مرور الخلايا باستخدام 01:10 التخفيف جديدة في قارورة زراعة الأنسجة (T-75 قارورة) التي تحتوي على مستنبت خلايا جديدة والمضادات الحيوية الصحيحة. احتضان الخلايا عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 الحاضنة) واستبدال المتوسطة كل يومين. مرور الخلايا عند> 70٪ متكدسة (راجع الخطوة 2.8).
4. إعداد المتوسطة GABAergic شائك العصبية الثقافة
- تحت ظروف معقمة إعداد، نحن 24لوحة ليرة لبنانية مع بولي-L-ليسين (0.1 ملغ / مل) -coated coverslips (13 مليمتر في القطر)، واحتضان عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- في اليوم التالي، نضح مع ماصة الزائدة بولي-L-ليسين وغسل coverslips مع اثنين جيزة 10 ثانية واثنين من 5 دقائق يغسل طويلة مع الماء المعقم. إضافة laminin (0.01 ملغ / مل) بين عشية وضحاها، واحتضان عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- تطهير منطقة تشريح مع الايثانول 70٪ وجمع مجموعة من الأدوات مثل ملقط تشريح الأنسجة المنحنية والمستقيمة، ومقص، وملاقط، ووضعه في الايثانول 70٪ لتعقيم أدوات تشريح تماما.
- وضع حامل الفئران / الماوس الموت الرحيم مع CO 2 على ظهرها وتنظيف الجلد على البطن مع الايثانول 70٪. قرصة الجلد مع ملاقط وقطع حول البطن خلال الجلد والعضلات والغشاء البريتوني، لكشف الأعضاء الداخلية والرحممع الأجنة بوضوح. استخراج الأجنة (E16-17) من الرحم ووضعها في طبق بتري مع برنامج تلفزيوني المبردة.
- وضع الأجنة في غطاء تدفق الصفحي واقطع رؤوسهم، وجمع رؤساء في طبق بتري جديد مع HBSS المبردة.
- تحت المجهر تشريح، تشريح خارج العقول باستخدام ملقط المنحنية والمستقيمة. وضع العقول في طبق بتري جديدة تحتوي على HBSS المبردة.
- تفصل بين نصفي الكرة المخية وإزالة بعناية السحايا. قطع على طول خط الحصين والقشرة قشر العودة إلى الكشف عن المخطط. مراقبة المخطط باعتباره بنية بيضاء مخططة في الجزء الأمامي من الكرة الأرضية.
- تشريح الجسم المخطط وتقطع الى قطع صغيرة جدا (1 - 2 مم في القطر) واستخدام باستور ماصة مصقول النار لجمع المواد إلى العقيمة 15 مل أنبوب الطرد المركزي مع إجمالي حجم 1 مل. النار تلميع يضمن يتم جمع المواد دون التلف.
- باستخدام TI-مصقول النارص من ماصة باستور، نضح الخلايا وإطلاق سراحهم 8-10 مرات. اتخاذ ماصة جديدة مع طرف النار طلاء ما يقرب من 30٪ من قطرها الأصلي (1 ملم)، يسحن الحل مزيد من 4-6 مرات حتى يبدو متجانس.
- تصفية الخلايا باستخدام 100 ميكرومتر النايلون مصفاة خلية في أنبوب الطرد المركزي معقمة جديدة.
- عد الخلايا مع عدادة الكريات وصفيحة 70،000 الخلايا في 500 ميكرولتر من الخلايا العصبية مستنبت لكل بئر في 24 لوحة جيدا زراعة الأنسجة. تستنهض الهمم اليسار إلى اليمين الآبار واحتضان عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة) لمدة 14 يوما في المختبر (DIV).
- بعد 7 أيام، والتحقق من نقاء الثقافات العصبية، وإذا الخلايا الدبقية موجودة، إضافة السيتوزين β-D-الأرابينوزيد (ARA-ج؛ 5 ميكرومتر) إلى الآبار لوقف انتشارها. للقيام بذلك، وإزالة 250 ميكرولتر من الخلايا العصبية مستنبت (7.4 درجة الحموضة) من كل بئر وإضافة 250 ميكرولتر من متوسطة جديدة تحتوي علىجي آرا-C. تنبيه! آرا-C هو مصدر إزعاج.
5. شارك في إعداد ثقافة
- في يوم 11 من ثقافة العصبية، ومعطف لوحة 6 جيدا مع بولي-D-ليسين (0.1 ملغ / مل) تحت ظروف معقمة واحتضان بين عشية وضحاها في 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- في اليوم التالي (يوم 12 من ثقافة العصبية)، نضح الزائد بولي-D-ليسين وغسل الآبار لفترة وجيزة و2X 2X لمدة 5 دقائق مع الماء المعقم قبل إضافة جديدة خلية ثقافة المتوسط (دون مضادات حيوية) لمعطف الآبار مع كمية صغيرة من المصل من المتوسط.
- نضح مستنبت من قارورة زراعة الأنسجة (T-75). شطف الخلايا مرتين مع برنامج تلفزيوني قبل إضافة 1 مل من الكالسيوم 2+ / المغنيسيوم 2+ -chelating كيل EDTA (0.48 ملم) والتي بلطف وغير إنزيمي تنأى الخلايا. تحريض الخلايا لفصل لهم من أسفل القارورة الأنسجة.
- إضافة 10 مل من خلية ثقافة المتوسط (بدون المضادات الحيوية لأن هذا قد تتداخل مع ترنسفكأيشن)، نضح خلايا ومكان في أنبوب الطرد المركزي معقمة. بيليه الخلايا في 440 x ج لمدة 5 دقائق باستخدام سرعة منخفضة المقعد العلوي الطرد المركزي.
- إزالة طاف و resuspend الخلايا في 1 مل من مستنبت خلايا جديدة. باستخدام عدادة الكريات، عد الخلايا وطبق في كثافة 3 × 10 5 خلايا لكل بئر في لوحة 6 جيدا. تستنهض الهمم بلطف واحتضان لمدة 24 ساعة عند 37 ° С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- في اليوم التالي (يوم 13 من ثقافة العصبية) عابر بالنقل الخلايا HEK293 مع mCherry [كدنا] في pcDNA3 التعبير بناء liposomal ترنسفكأيشن باستخدام الكاشف. لفترة وجيزة، في أنبوب microcentrifuge العقيمة، إضافة 500 ميكرولتر من انخفاض متوسط المصل و 5 ميكروغرام من mCherry [كدنا]. إضافة 5 ميكرولتر من liposomal التخزين المؤقت كاشف ومزيج بلطف قبل يترك في درجة حرارة الغرفة لمدة 5 دقائق.
- إضافة 8.75 ميكرولتر من liposomal ترنسفكأيشن reagوالأنف والحنجرة ومزيج بلطف قبل ترك في درجة حرارة الغرفة لمدة 30 دقيقة. ماصة محتويات أنبوب microcentrifuge صعودا وهبوطا مرتين، ونقل التسرب من الحكمة أن كل بئر على 6 جيدا وحة زراعة الأنسجة واحتضان عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- في اليوم التالي (يوم 14 من ثقافة العصبية)، نضح HEK293 زراعة الخلايا المتوسطة من كل من الآبار 6 ويغسل جيدا مرتين كل فترة وجيزة مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4). إضافة 300 ميكرولتر من الكالسيوم 2+ / المغنيسيوم 2+ كيل -chelating EDTA (0.48 ملم) و 200 ميكرولتر من التربسين-EDTA (0،02-0،48 مم) حل كل بئر واحتضان عند 37 درجة С لمدة 5 دقائق.
- إضافة 1 مل من جديد HEK293 خلية ثقافة المتوسط لكل بئر (هذا يروي التربسين) ونضح خلايا منفصلة في العقيمة 15 مل أنبوب الطرد المركزي. الطرد المركزي الخلايا في 440 x ج لمدة 5 دقائق في درجة حرارة الغرفة، وإزالة طاف. resuspend وبيليه في 500 ميكرولتر من الخلايا العصبية مستنبت (7.4 درجة الحموضة).
- باستخدام عدادة الكريات، عد الخلايا والبذور في مناطق ذات كثافة من 30000 خلية لكل بئر في 24-جيدا نسيج لوحة الثقافة التي تحتوي على الخلايا العصبية. تستنهض الهمم لوحة لتفريق الخلايا واحتضان المشارك الثقافات عند 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة) لمدة 24 ساعة.
6. تحليل للاتصالات متشابك ونشاطهم
- بعد 23 ساعة في الثقافة المشتركة، والتحقيق في تشكيل الاتصالات "نشطة" بين GABAergic شائك الخلايا العصبية والخلايا المتوسطة HEK293 باستخدام تعتمد على النشاط امتصاص المضادة للsynaptotagmin الأجسام المضادة نطاق محدد اللمعية مترافق مع صبغة الفلورسنت (Cy5، انظر الجدول 1) .
ملاحظة: إن الأضداد تكتسب فقط الوصول إلى المجال اللمعية من synaptotagmin، التي يرتبط عندما يكون هناك استمرارية بين التجويف حويصلة متشابك والفضاء خارج الخلية. يحدث هذا تحديدا خلال إطلاق الناقلات العصبيه، مما يجعل هذا antibODY علامة ممتازة للمحطات قبل المشبكي النشطة. - أولا شطف المشارك الثقافات مع الخلايا العصبية المتوسطة (Neurobasal والمتوسطة، ودرجة الحموضة 7.4؛ انظر الجدول 1) وإضافة الفأر المسمى Cy5 الأجسام المضادة المعادية للsynaptotagmin، مخففة في 1:50 المتوسطة العصبية (Neurobasal والمتوسطة، ودرجة الحموضة 7.4)، ل الثقافات، لمدة 30 دقيقة. احتضان الخلايا خلال هذه الفترة على 37 درجة С في ترطيب 5٪ CO 2 الغلاف الجوي (CO 2 حاضنة).
- لإزالة وصول الأجسام المضادة، وغسل الثقافات المشتركة لفترة وجيزة ثلاث مرات: أولا مع PBS الباردة العادي (درجة الحموضة 7.4)، والثانية مع PBS الباردة (درجة الحموضة 7.4) تحتوي على 200 ملي مول كلوريد الصوديوم، والثالث مع برنامج تلفزيوني عادي بارد (درجة الحموضة 7.4)
- إصلاح الخلايا مع 300 ميكرولتر من بارافورمالدهيد 4٪ / 4٪ السكروز في برنامج تلفزيوني (منهاج العمل، ودرجة الحموضة 7.4) لمدة 10 دقيقة مع الإثارة. غسل الخلايا لفترة وجيزة مرتين مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ثم مع اثنين من أطول 10 دقيقة يغسل.
- إضافة الجلايسين (0.3 M) إلى كل بئر لمدة 10 دقيقة مع الإثارة لإرواء PFA.
- غسل الخلايا brieflذ مرتين مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ثم مع اثنين من أطول 10 دقيقة يغسل قبل إضافة 300 ميكرولتر من عرقلة الحل (1٪ (ث / ت) ألبومين المصل البقري (BSA) في برنامج تلفزيوني، ودرجة الحموضة 7.4) للحد من الربط غير محددة ل الأجسام المضادة.
- نضح عرقلة الحل وإضافة خنزير غينيا الأضداد المضادة للGABA A R-γ2 موجهة ضد γ2 N-33 محطة النطاق (1: 3000 في برنامج تلفزيوني، ودرجة الحموضة 7.4) بين عشية وضحاها في 4 درجات С.
- في اليوم التالي، ونضح الأجسام المضادة الأولية من الآبار وغسل الخلايا لفترة وجيزة مرتين مع برنامج تلفزيوني ثم مع اثنين من أطول 10 دقيقة يغسل.
- Permeabilize الخلايا باستخدام تريتون X-100 (0.1٪) في عرقلة الحل لمدة 30 دقيقة في درجة حرارة الغرفة.
- غسل الخلايا لفترة وجيزة مرتين مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ثم مع اثنين من أطول 10 دقيقة يغسل قبل أن يضيف إما الماوس المضادة للحمض الجلوتاميك كربوكسيل (GAD) 65 الأضداد (1: 4000، الجدول رقم 1) أو الماوس مكافحة سينابسينات أنا الضد ( 1: 1000، الجدول 1) لمدة 120 دقيقة في غرفة رemperature.
- غسل الخلايا لفترة وجيزة مرتين مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ثم مع اثنين من أطول 10 دقيقة ثم يغسل إضافة عرقلة الحل لمدة 30 دقيقة في درجة حرارة الغرفة.
- الطرد المركزي الأجسام المضادة الثانوية المناسبة (عادة الماعز المضادة للخنزير غينيا مفتش مترافق إلى Cy5 والماعز المضادة للماوس مفتش مترافق لاليكسا فلور 488 أو الماعز المضادة للماوس مفتش اليكسا فلور 405، وكلها في 2 ميكروغرام / مل) لإزالة الركام من الأجسام المضادة في 21910 x ج لمدة 10 دقيقة، وإضافة الأجسام المضادة (1: 750) لعرقلة الحل. تنطبق على المناسبة الآبار لمدة 1 ساعة، وتغطي بورق الألمنيوم لحماية fluorophores من التعرض للضوء ويترتب photobleaching من.
- أخيرا، وغسل الخلايا لفترة وجيزة مرتين مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ثم مع اثنين من أطول 10 دقيقة يغسل لإزالة أي الضد الثانوية غير منضم وجبل لل coverslips باستخدام تصاعد كاشف (إطالة الذهب، الجدول 1) ما يقرب من 10 ميكرولتر في ساترة. سماح 24 ساعة لوضعت في درجة حرارة الغرفة بينما محمية من الضوء قبل ان ينتقل الى 4° С للتخزين على المدى الطويل.
- تحليل العينات باستخدام المجهر متحد البؤر المسح بالليزر مع هدف النفط الغمر 63X. ضمان ضوء المستويات ويتم تعديل الربح كاشف لتجنب التشبع.
- مراقبة الاتصالات مثل المشبك المحتملة ومناطق المشارك التعريب بين المحطات قبل المشبكي إيجابية لGAD65، سينابسينات أنا أو Cy5 المسمى مكافحة synaptotagmin وHEK293 الخلايا بعد المشبكي تصور من قبل مدينة دبي للإنترنت أو من قبل و Indictor فلوري mCherry.
- عد الاتصالات مثل المشبك المحتملة باستخدام سلسلة Z-كومة من المقاطع البصرية (8 - 10) من خلال عمق 5 - 4 ميكرون لكل خلية باستخدام برنامج التصوير.
النتائج
بروتوكول لهذه الخلايا العصبية-HEK293 نظام نموذج خلية ثقافة مشتركة تم ضبطها بدقة للسماح للبقاء الخلية الأمثل. في هذا النظام، وتشكيل الاتصالات مثل المشبك وتحليلها يعتمد على التعبير مستقر وثابت من كل ثلاث مفارز GABA A R التي تجمع إلى مستقبل وظيفي. ولذلك فمن المهم استخدام تحليل immunocytochemical لاختبار فرعية التعبير على سطح الخلية HEK293 قبل إضافتها إلى الثقافات العصبية. في هذه التجارب، تم الكشف عن التعبير سطح الخلية من α1، β2 ومفارز γ2 (الشكل 1A)، أو α1، β3 وγ2 مفارز (الشكل 1B)، وذلك باستخدام الأجسام المضادة فرعية محددة والتي ربط الحواتم خارج الخلية من هذه الوحدات الصغرى. وقد أظهر درجة عالية من التعاون بين هذه الترجمة مفارز على سطح HEK293.
بعد التأكد من التعبير السطحية وشارك في توطين GABA Aتم إعداد مفارز R في HEK293 الخلايا، شارك في الثقافات باستخدام HEK293 الخلايا معربا عن مفارز α1 / β2 / γ2 GABA A R والخلايا العصبية الشوكية المتوسطة مثقف لمدة 14 يوما (14 يوما في المختبر (DIV)). وحضنت الخلايا في الثقافة شارك لمدة 24 ساعة، الثابتة وتحليلها باستخدام مناعية والمجهري متحد البؤر. أشار تحليل الاتصالات التي GABAergic المحطات عصبي-GAD65 إيجابي شكلت اتصالات متقطعة فقط مع سيطرة HEK293 الخلايا (الشكل 2A، 2B). كان عدد من الاتصالات في الكشف عن 4 ساعات 7.3 ± 0.9 لكل خلية HEK293، وانخفض هذا العدد إلى 5.5 ± 0.5 اتصالات (يعني ± SEM) لكل خلية HEK293 في 24 ساعة بعد إضافة خلايا HEK293 إلى الخلايا العصبية مثقف. في المقابل، شكلت محطات GAD65 إيجابية GABAergic محور عصبي اتصالات عديدة مثل المشبك مع الخلايا HEK293 معربا عن GABA A روبية. بلغ عدد الاتصالات التي تم الحصول عليها في 4 ساعات بعد إضافة خلايا HEK293 28.3 ± 4.7 لكل خلية HEK293، وكان هذا الرقم زيادة أخرىد إلى 52.1 ± 6.3 (يعني ± SEM) لكل خلية HEK293 على مدار 24 ساعة في ثقافة مشتركة (الشكل 2A، 2B).
لتحديد ما إذا كانت هذه الاتصالات مثل المشبك كانت "نشطة"، أي دعم إطلاق الارسال الحويصلي، أضيف-الحويصلة اللمعية نطاق محدد مكافحة synaptotagmin Cy5 الأجسام المضادة مترافق إلى متوسطة المشارك الثقافة بعد 23 ساعة من الحضانة. أدرج هذه الأجسام المضادة إلا في المحطات العصبية قبل المشبكي عندما أشكال المسام بين التجويف حويصلة متشابك والسائل خارج الخلية في الشق متشابك خلال إطلاق ناقل عصبي. بعد الإفراج، ويغلق المسام، وترك synaptotagmin الأجسام المضادة الفلورسنت Cy5 مترافق تعلق synaptotagmin داخل الحويصلة. في هذه الطريقة، وصفت فقط الحويصلات تشارك بنشاط في إطلاق الناقلات العصبيه مع الأجسام المضادة. في هذه التجارب قليلة إذا كانت أي اتصالات بين السيطرة HEK293 الخلايا والمحطات العصبية الشوكية المتوسطة "نشطة & #8217. كما يتضح من عدم وجود التعاون بين التعريب قبل المشبكي GAD65 / synaptotagmin مضان وmCherry مضان في الخلايا HEK293 (الشكل 3A). في المقابل، تم تشكيل العديد من الاتصالات "نشطة" بين المحطات شائك الخلايا العصبية المتوسطة وα1 / β2 / γ2، معربا عن خلايا HEK293، كما يتضح من وجود درجة عالية من التعاون بين التعريب GAD65 / synaptotagmin وmCherry، أعرب تحديدا في الخلايا HEK293 ( الشكل 3B).
α1 لاختبار ما إذا كانت سلالة مختلفة من GABA A R يمكن أيضا تشجيع تشكيل مثل المشبك في المختبر، ولقد شارك في تربيتها / β3 / γ2 معربا عن الخلايا HEK293 مع الخلايا العصبية الشوكية المتوسطة. مرة أخرى، السيطرة HEK293 خلايا نادرا ما تلقى اتصالات مع سينابسينات إيجابي محطات قبل المشبكي تصل 10.8 ± 0.48 (يعني ± SEM) اتصالات لكل خلية HEK293 بعد 24 ساعة في الثقافة المشتركة (الشكل 4A اليسار، 4B). ومع ذلك، معربا عن خلايا HEK293α1 / β3 / γ2 GABA A روبية شكل أكثر بكثير الاتصالات مثل المشبك مع سينابسينات إيجابي محطات قبل المشبكي من الخلايا العصبية الشوكية المتوسطة تصل إلى 25.3 ± 0.27 (يعني ± SEM) اتصالات لكل خلية HEK293 بعد 24 ساعة في الثقافة المشتركة (الشكل 4A الحق، 4B). هذا يشير إلى أن α1 / β3 / γ2 GABA A روبية أعرب في الخلايا HEK293 هي أيضا قادرة على تشجيع تشكيل اتصال متشابك، وإن قوتها أقل من قوة من α1 / β2 / γ2 التي تحتوي على GABA A روبية.
هذه التجارب تشير إلى أن نظام نموذج التعاون ثقافة وضعت في مختبرنا يسمح التحليل الكمي لتشكيل اتصال متشابك في المختبر وكذلك تقييم مدى فعالية أنواع فرعية مختلفة من GABA A روبية في هذه العملية. هذه التجارب تثبت أن زيادة GABA A روبية، بالإضافة إلى كونها مكونات وظيفية هامة من نقاط الاشتباك العصبي GABAergic، قد تلعب دورا رئيسيافي عملية الاعتراف وتشكيل الاتصالات المشبكية بين الخلايا العصبية المثبطة والخلايا العصبية المستهدفة المناسبة، بشكل مستقل عن غيرها من البروتينات التصاق متشابك.
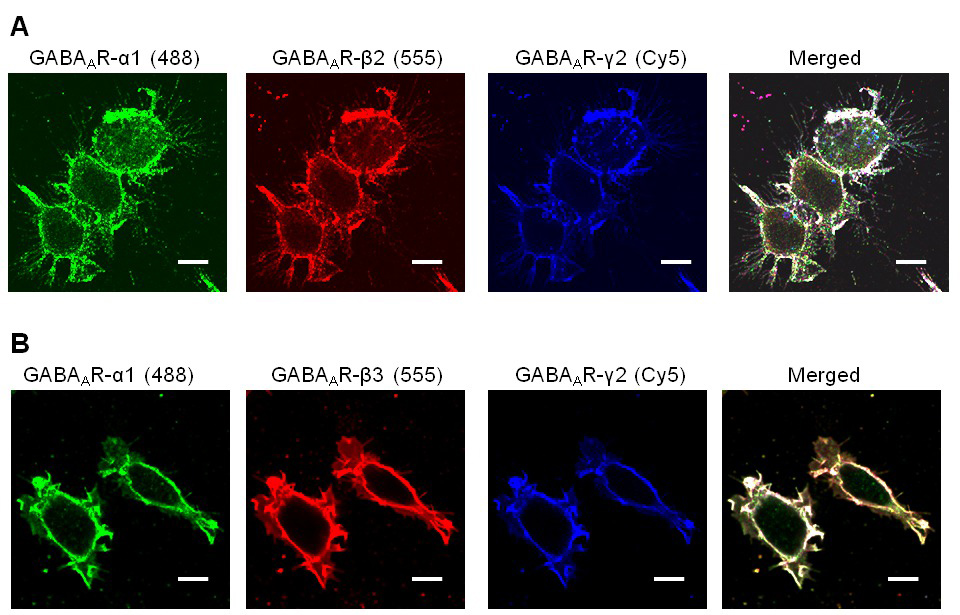
الشكل 1. Immunocytochemical تحليل التعبير عن GABA A α1 R / β2 / γ2 أو α1 / β3 / γ2 مستقرة في خطوط الخلايا HEK293. تم استخدام الأجسام المضادة الاعتراف المجالات خارج الخلية من مفارز GABA A R لمستقبلات التسمية التي أعرب عنها في سطح الخلية. ( أ) خط الخلية HEK293 التعبير α1 (اليكسا فلور 488)، β2 (اليكسا فلور 555) وγ2 (Cy5) عند مستويات مرتفعة. (ب) HEK293 خط خلية التعبير α1 (اليكسا فلور 488)، β2 (اليكسا فلور 555) وγ2 (Cy5)الوحدات الصغرى عند مستويات مرتفعة. شريط النطاق: 10 ميكرون الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 2. GABAergic الخلايا العصبية الشوكية المتوسطة تشكل الاتصالات مثل المشبك مع α1 / β2 / γ2- معربا عن الخلايا HEK293 في ثقافة مشتركة. (أ) وضع العلامات الفلورية محطات قبل المشبكي مع معاداة GAD65 الأجسام المضادة (باللون الأخضر) وخلايا HEK293 مع mCherry (في الحمراء، اليسرى) أو GABA A R γ2 فرعية (باللون الأزرق، يمين)، وكشف نقاط من شارك في التعريب بين هذه علامات تشير تشكيل الاتصالات مثل المشبك بعد 4 أو 24 ساعة في ثقافة مشتركة. شريط النطاق: 10 ميكرومتر (ب) تحليل الكمي لمثل المشبك التعاون ntacts. خلايا HEK293 تم تحديدها بناء على شكلها كما يتضح من التصوير مدينة دبي للإنترنت و / أو mCherry التعبير، وعدد من الاتصالات بين GAD-65 نقاط وإيجابية (باللون الأخضر) وسطح خلايا HEK293 تم عدها بالعين في كل قسم بصري ل سلسلة Z كومة (8 - 10) في خلية باستخدام برامج التصوير، وأعربت باسم عدد من الاتصالات / الخلية. ويوضح الرسم البياني عدد من الاتصالات بين الخلايا العصبية الشوكية المتوسطة والسيطرة HEK293 الخلايا (رمادي فاتح) أو α1 / β2 خلية / γ2-HEK293 (أسود) بعد 4 و 24 ساعة في ثقافة مشتركة (يعني ± SEM، ن = 8 في كل حالة من تجربتين مستقلة). تم تعديل هذا الرقم من فوكس وآخرون (2013) 30. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
الإعلان / 52115 / 52115fig3highres.jpg "العرض =" 600 "/>
الشكل 3. GABA A روبية تعزز تشكيل اتصالات متشابك النشطة. Immunolabeling من الاتصالات مثل المشبك تشكلت بعد 24 ساعة في الثقافة المشتركة بين الخلايا العصبية الشوكية المتوسطة المحطات الإيجابية لGAD65 (اليكسا فلور 405 السماوي) و (A) السيطرة HEK293 الخلايا، أو (ب) / β2 / γ2 خلايا HEK293 α1، سواء عابر مع mCherry بناء من (الحمراء). يتم تحديد الاتصالات النشطة من قبل المشارك التعريب بين الحويصلة اللمعية نطاق محدد الضد مكافحة synaptotagmin (Cy5) والأجسام المضادة GAD65 محددة سواء في محطات قبل المشبكي، وأعرب عن mCherry في الخلايا HEK293. شريط النطاق: 10 ميكرون الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
igure 4 "FO: محتوى العرض =" 6in "SRC =" / ملفات / ftp_upload / 52115 / 52115fig4highres.jpg "العرض =" 600 "/>
الرقم 4. GABAergic الخلايا العصبية الشوكية المتوسطة تشكل الاتصالات مثل المشبك مع α1 / β3 / فرعية γ2- معربا عن HEK293 الخلايا في ثقافة مشتركة. (أ) وضع العلامات الفلورية محطات قبل المشبكي مع مكافحة سينابسينات أنا الأجسام المضادة (باللون الأخضر)، والسيطرة HEK293 خلايا (إلى اليسار)، أو α1 / β3 / γ2 معربا عن الخلايا HEK293، سواء عابر مع mCherry (باللون الأحمر)، وكشف نقاط شارك في التعريب بين هذه العلامات تشير إلى تشكيل الاتصالات مثل المشبك بعد 24 ساعة في الثقافة المشتركة. شريط النطاق: 10 ميكرومتر (B). التحليل الكمي من الاتصالات مثل المشبك. وقد تم تحديد خلايا HEK293 من قبل mCherry التعبير، وأحصى عدد من الاتصالات بين نقاط وسينابسينات-I الإيجابية (باللون الأخضر) وسطح خلايا HEK293 بالعين في كل قسم الضوئية من سلسلة Z كومة (8-10) في خلية باستخدام برامج التصوير، ويعبر عنه عدد من الاتصالات / الخلية. ويوضح الرسم البياني عدد من الاتصالات بين الخلايا العصبية الشوكية المتوسطة والسيطرة HEK293 الخلايا (رمادي فاتح) أو α1 / β3 خلية / γ2-HEK293 (أسود) بعد 24 ساعة في الثقافة المشتركة (يعني ± SEM، ن = 8-12 خلايا في كل شرط، من تجربتين مستقلة). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
على الرغم من أن هذا البروتوكول ليس من الصعب من الناحية الفنية على القيام بها، وهناك العديد من الخطوات الهامة التي يجب اتباعها لتحقيق المقايسات شارك في ثقافة أدق وقابلة للتكرار. أولا، يجب أن يكون المصنف مثقف الخلايا العصبية الشوكية المتوسطة في كثافة مثلى. إذا المصنف قليلة جدا، الخلايا العصبية تميل إلى تطوير ببطء شديد، وخفضت إلى حد كبير بقاء. من ناحية أخرى، إذا كان المصنف كثيفة جدا، تميل إلى تجميع الخلايا العصبية التي التنازلات تحليل الاتصالات مع خلايا HEK293. ثانيا، فمن المستحسن للتعبير عابر مراسل الفلورسنت، أو GFP mCherry في الخلايا HEK293 التعبير عن ثابت GABA A روبية، قبل platting لهم في الثقافة المشتركة. وهذا يسمح بالاعتراف موثوق الخلايا HEK293، والتي يمكن أن يتعرض للخطر من خلال التشابه في الشكل والحجم بين هذه الخلايا والخلايا الدبقية على قيد الحياة نادرة في الثقافات العصبية. لتحقيق الكفاءة ترنسفكأيشن مع GFP أو mCherry [كدنا]، وخطوط الخلايا HEK293 يجب أن تكون في مرحلة النمو الأسي والمصنف في الكثافة المناسبة في 6 لوحات جيدا. سوف بذر متفرق تليها ترنسفكأيشن يسبب الخلايا لتنمو بشكل سيئ، في حين أن الإفراط في البذر ومنع الخلايا من تناول [كدنا]. من الناحية المثالية، ينبغي المصنف الخلايا بحيث تكون بين 70-90٪ متكدسة يوم ترنسفكأيشن. ثالثا، يجب أن يكون الأمثل ترنسفكأيشن لكل خط الخلية المستخدمة، وبعض خطوط الخلايا أكثر حساسية من غيرها. هذا لأن GABA التأسيسي تعبير R في الخلايا HEK293 يقلل من بقاء الخلية، وقدرة الخلايا على التعافي بعد ترنسفكأيشن. وعلاوة على ذلك، البقاء على قيد الحياة يعتمد على نوع من GABA A أعرب في الخلايا HEK293 روبية، مع بعض خطوط الخلايا يجري بشكل ملحوظ أكثر حساسية من غيرها. ترنسفكأيشن باستخدام liposomal الكاشف هو الطريقة المثلى للتعبير عن البروتينات الخارجية في خطوط الخلايا سريعة النمو، وتوفير كل ترنسفكأيشن كفاءة عالية ومستوى التعبير. ومع ذلك، وهذا كاشف يسبب الكثير من الضرر لخطوط الخلايا تنمو ببطء، لالتي نستخدمها بانتظام ترنسفكأيشن الكاشف غير liposomal. هذا يعمل بطريقة مشابهة للكاشف liposomal ولكن يتم تقليل كمية الحمض النووي المطلوبة لترنسفكأيشن كفاءة بكثير. وهذا يسمح بمزيد من بقاء الخلية (حوالي 80-90٪ مقارنة مع 60٪ باستخدام liposomal الكاشف) ولكن مع انخفاض كفاءة ترنسفكأيشن (60٪). وأخيرا، / β2 / γ2 HEK293 معربا عن الخلايا تضاف إلى الثقافات العصبية يحتاج عدد من السيطرة HEK293 أو α1 إلى أن يكون الأمثل. مضيفا قليل من الخلايا التنازلات التحليل الناجح من الاتصالات بين الخلايا HEK293 والخلايا العصبية، لأنها تصبح نادرة جدا. على العكس، مضيفا خلايا كثيرة HEK293 يسبب موت الخلايا العصبية في ساعات قليلة.
ينبغي من الناحية المثالية أن تكون مستعدة الجنينية الثقافات المتوسطة شائك الخلايا العصبية باستخدام أنسجة الجسم المخطط تشريح من عمر الجنين 15 - 17. ومع ذلك، فإنه غالبا ما يحدث أن الأجنة هي أصغر قليلا أو أكبر سنا من سن الأمثل. في هذه الحالة، المصنف على عدد من الخلايا العصبية في الثقافة سوفتحتاج إلى أن تكون متنوعة. الأنسجة التي هي أصغر من E15 قد تحتاج إلى المصنف في مناطق ذات كثافة أقل قليلا، في حين أن الأنسجة أقدم من E17 قد تحتاج إلى المصنف في مناطق ذات كثافة أعلى، للسماح بقاء الخلية الأمثل. وعلاوة على ذلك، الأرابينوزيد السيتوزين (ARA-C) قد تكون هناك حاجة إلى أن تضاف إلى الثقافات القديمة لمنع نمو الدبقية، التي هي أكثر وفرة في الأنسجة القديمة.
عند إنشاء المشارك الثقافات، فمن المهم أن لوحة العدد الأمثل من HEK293 transfected أو α1 / β2 / γ2 HEK293 الخلايا معربا، على النحو المذكور أعلاه. ومع ذلك، فإنه قد يكون من الضروري تحديد ذلك لكل خط الخلية الفردية، بسبب الاختلافات في بقائهم على قيد الحياة. عادة 30،000 الخلايا في حجم أقصى 50 ميكرولتر ينبغي أن يضاف إلى كل بئر من صحن 24-جيدا، والذي يحتوي بالفعل 500 ميكرولتر من الخلايا العصبية مستنبت، وهذا يضمن أن الخلايا العصبية المتوسطة مكيفة لا تضعف كثيرا وأن الشروط داخل كل تبقى ثابتة بشكل جيد إلى حد ما، على سبيل المثال تركيز عوامل النمو. مضيفا أحجام أكبر من 50 ميكرولتر من كل بئر قتل الخلايا العصبية عموما.
أحد العيوب الرئيسية لهذه التقنية المشارك الثقافة هي أن الثقافات العصبية يتم إنشاؤها من خلايا فصلها كما نمت أحادي الطبقة، وهو ما يعني أن الخلايا العصبية قد أزيلت من المكروية بشكل طبيعي وغير قادرين على تأسيس منظمة التشريحية الطبيعية. ولأنها تفتقر إلى التوصيلات المناسبة والمدخلات والجزيئات يفرز من الخلايا الأخرى التي قد تؤثر على المراحل الأولى للتنمية المشبك. على سبيل المثال، في الجسم الحي ومعصب الخلايا العصبية الشوكية المتوسطة كثيفة من قبل المدخلات glutamatergic من القشرة، المهاد ومناطق أخرى من الدماغ 34، ومع ذلك، في الثقافات العصبية لدينا نقاط الاشتباك العصبي glutamatergic لا تشكل بسبب تلف هذه المدخلات أثناء تشريح أنسجة الجسم المخطط. كيف غياب نقاط الاشتباك العصبي glutamatergic وظيفية في الخلايا العصبية مثقف شائك المتوسطة قسم الشؤون الماليةالنظام الأوروبي قدرتها على تشكيل نقاط الاشتباك العصبي GABAergic مع بعضها البعض و / أو خلايا HEK293 معربا عن GABA A روبية لا تزال مسألة مفتوحة. هذا السؤال يمكن معالجتها بسهولة عن طريق زراعة الخلايا العصبية الشوكية المتوسطة مع الخلايا العصبية glutamatergic القشرية مما يسمح لهم لتشكيل نقاط الاشتباك العصبي وظيفية 35 قبل إضافة خلايا HEK293. وثمة نهج بديل يتمثل في تصميم نظام نموذج التعاون ثقافة تقوم على الثقافات شريحة عضوي النمط، التي تحافظ على بعض من التهندس الخلوي والتي قد تكون مهمة لنضوج وتشكيل المشبك. ومع ذلك، والثقافات شريحة عضوي النمط لها neuropil كثيفة وغير المتجانسة التي يمكن أن تؤثر سلبا على أداء التحليل هنا. آخر العيب المهم استخدام المقايسات المشارك الثقافة هو أن GABA A روبية أعرب على سطح خلايا HEK293 لا تتجمع كما هي الحال في الخلايا العصبية، على الرغم من أن هذا لا يبدو أن تكون ضرورية لتشكيل المشبك إعطاء ما يكفي من التعبير ارتفاع سطح 30. على سبيل المثال، في صodent الدماغ والحصين في الثقافات، وجدت على α1 GABA A R فرعية في معظم نقاط الاشتباك العصبي GABAergic على جميع المجالات بعد المشبكي من الخلايا الهرمية. ومع ذلك، فإن α2 يقع تحديدا في مجموعة فرعية من نقاط الاشتباك العصبي على somata والتشعبات ولكن التخصيب في الجزء الأول محور عصبي، كما كشفت عنها المناعي والمجهر الإلكتروني 36. بالنظر إلى أن تشكيل المشبك في الثقافات المشتركة لا يزال من الممكن الكشف بشكل موثوق وتحليلها 30، وهذا يشير إلى أن كثافة GABA A روبية على سطح خلية من خلايا HEK293 قد تكون مشابهة ل، أو حتى أعلى من كثافة هذه المستقبلات داخل متشابك مجموعات في الخلايا العصبية. وهذا يمكن أن يفسر، جزئيا على الأقل، لماذا البروتينات متشابك التصاق، مثل neuroligin، والبروتينات كثافة بعد المشبكي، مثل gephyrin، ليست ضرورية لتشكيل المشبك في الثقافات المشتركة، إذا توافرت تجميعها بشكل مناسب GABA A روبية في كافية الكثافة.
تم توثيقه جيدا أن GABA A روبية هي هيكليا ووظيفيا غير متجانسة، وأن تكوين مستقبلات فرعية يحدد التعريب من التحت خلوية والخصائص الدوائية. على سبيل المثال، يعرف إدماج مفارز 2 أن يكون شرطا مسبقا لتوطين متشابك من GABA A روبية في حين الوحيدات موجودة بشكل حصري تقريبا في extrasynaptic GABA A روبية. ويعتقد أن المستقبلات التي تتضمن فقط αβ مجموعات أيضا لتكون مترجمة في الغالب إلى المجالات extrasynaptic 12- 14. ما إذا كان الحفاظ على هذه الخصوصية في نظام المشاركة في ثقافتنا يمكن اختبارها بسهولة عليها بنقل عابر 2 أو فرعية cDNAs في خطوط الخلايا HEK293 التعبير عن ثابت α و β مفارز، قبل إضافتها إلى الثقافات العصبية. وأشارت التجارب الأولية لدينا باستخدام هذا النهج أن الاتصالات متشابك تتشكل بسهولة إلا في وجود الوحيدات 2، مشيرا إلى أن SPECIficity وحظ في الجسم الحي من المرجح أن تكون محفوظة في المختبر (لا تظهر البيانات).
وعلاوة على ذلك، تتضمن GABA A مفارز α مختلفة روبية تكون مترجمة بشكل انتقائي لتشكيل اتصالات متشابك مع أنواع معينة من الخلايا العصبية قبل المشبكي. على سبيل المثال، في جلوبس الشاحبة، وجدت α1-GABA A روبية عموما في striatopallidal (STR-GP) وpalliopallidal (GP-GP) نقاط الاشتباك العصبي، التي تقع على التشعبات والمناطق الجسدية من الخلايا العصبية الشوكية المتوسطة، على التوالي. وتقع على α3-GABA A روبية في المناطق perisomatic من الخلايا العصبية الشوكية المتوسطة واتصلت قبل الضمانات GP محور عصبي المحلية، في حين أن α2-GABA A روبية تقع على التشعبات البعيدة من هذه الخلايا العصبية والاتصال في المقام الأول من قبل المدخلات من المخطط 32. كما تظاهر تعبيرا عن مفارز α محددة في أنواع مختلفة من نقاط الاشتباك العصبي والخلايا العصبية في الأجزاء المختلفة في مناطق أخرى من الدماغ مثل هيبocampus 21 و 18،20 القشرة المخية الحديثة. هذه النتائج تثير تساؤلا عن كيفية تتشكل المشابك المثبطة محددة في الدماغ. لا التصاق نوع معين من المحطة قبل المشبكي لحث إدخال أنواع فرعية محددة GABA A R إلى نقاط الاتصال؟ والمستقبلات الاتجار بهم إلى مواقع التحت خلوية محددة وفقا لتكوين فرعية لها، حيث من الإدراج غشاء البلازما هو شرط أساسي للالتصاق المحطات محور عصبي المنشأ معين؟ حتى الآن، هذه الأسئلة لا تزال دون إجابة. استخدام نموذج انخفاض أنظمة مثل نظام نموذج التعاون والثقافة، ويسمح لنا لبدء الإجابة عن هذه الأسئلة معقدة لأن النظام هو الانقياد بسهولة إلى ترنسفكأيشن بنيات الحمض النووي وتطبيق الكواشف، والأهم من ذلك، فهي مناسبة للتصوير الخلايا الحية تحليل 30. وهكذا، وذلك باستخدام هذا النظام نموذجا يمكننا البدء باختبار دور الجزيئات الفردية، بما في ذلك أنواع مختلفة من GABA A روبية، ونعرفن أن يكون حاضرا في الاتصالات متشابك. ميزة أخرى هي أن نقاط الاشتباك العصبي في هذا النموذج نموذج النظام بسرعة، في غضون دقائق إلى ساعات، وتخفيض مدة التجارب. تم توظيف أنظمة نموذج مماثل شارك في ثقافة بنجاح في الماضي للكشف عن جزيئات synaptogenic رواية 27،37،38.
فهم كيفية تطور الجهاز العصبي المركزي، ينضج وصلات بين الخلايا العصبية أشكال معقد جدا السيطرة عليها، على سبيل المثال، السلوك أو الإدراك، هو من الأهمية بمكان. وسيتم تحقيق هذا الهدف بعيد المنال إلا من خلال ترسيم الآليات الجزيئية التي تتحكم في خطوات فردية من الاعتراف والتواصل خلية الى خلية خلال التنمية. بسبب التعقيد الهائل، وتفاصيل هذه التفاعلات الجزيئية الخلوية متعددة يمكن حاليا دراستها بدقة إلا في انخفاض النظم. ومع ذلك، فإن القدرة على زيادة تعقيد هذه الأنظمة بالإعراب عن مجموعات متعددة من البروتينات ودراسة كيفيةتتفاعل لديه بعض المزايا مقارنة، على سبيل المثال، نهج حذف الوراثية. وذلك لأن تفسير دقيق للآثار حذف جين واحد في كثير من الأحيان للخطر بسبب التغيرات المرتبطة آليات تعويضية اخفاء آثار الآفات الأصلية، وخاصة في الدماغ النامية. تقنية بسيطة لكنها غنية بالمعلومات المشارك الثقافة الموصوفة هنا قد سمح لاكتشاف الدور الهيكلي للGABA A روبية في تشكيل المشبك وفتح إمكانية لمعرفة كيف GABA A روبية وغيرها من جزيئات الالتصاق الخلوي و / أو البروتينات المصفوفة متشابك تتفاعل مع بعضها البعض خلال synaptogenesis. البروتينات المصفوفة متشابك ذات أهمية خاصة نظرا لأنها في الآونة الأخيرة أظهرت أن تلعب دورا رئيسيا في تشكيل المشبك glutamatergic 39. تطوير المزيد من النماذج المشارك الثقافة هي مهمة لأنها لديها القدرة على دفع معرفتنا الآليات الجزيئية التي توجه «طبيعية و# 8217؛ نمو الدماغ وبالتالي زيادة فهمنا لكيفية تغيير هذه الآليات في العديد من الأمراض العصبية النمائية، مثل الصرع، والفصام، واضطرابات طيف التوحد وغيرها الكثير.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
نود أن نعترف بدعم مالي من MRC المملكة المتحدة (G0800498). نود أيضا أن نشكر الأستاذ JM Fritschy، جامعة زيوريخ، لتوفير GABA A -R فرعية محددة γ2 الأجسام المضادة وأستاذ R. هارفي، مدرسة الصيدلة، جامعة لندن، لتوفير pcDNA 3.1 (+) ناقلات التعبير التي تحتوي على مقاومة المضادات الحيوية الجينات لإنتاج ستابلي خطوط الخلايا HEK293.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM (Dulbecco's Modified Eagle Medium) | Life Technologies | 11960-044 | Warm in water bath at 37 °C before use |
| L-Glutamine | Life Technologies | 25030-024 | |
| Penicillin/Streptomycin | Life Technologies | 15070-063 | Danger: irritant |
| FBS (Fetal Bovine Serum) | Life Technologies | 10106-169 | |
| Neuralbasal | Life Technologies | 21103-049 | Warm in water bath at 37 °C before use |
| B27 Supplement | Life Technologies | 17504-044 | |
| Glucose | Sigma-Aldrich | G8769 | |
| HBSS (10X) | Life Technologies | 14180-046 | |
| HEPES (1M) | Life Technologies | 15630-056 | |
| PBS (1X) | Life Technologies | 10010-031 | |
| pcDNA 3.1(+) Mammalian Expression Vector (Geneticin-selection) | Life Technologies | V790-20 | |
| pcDNA 3.1(+) Mammalian Expression Vector (Zeocin-selection) | Life Technologies | V860-20 | |
| pcDNA 3.1(+) Mammalian Expression Vector (Hygromycin-selection) | Life Technologies | V870-20 | |
| Stable HEKα1β2γ2 line | Sanofi-Synthelabo, Paris | ||
| Poly-D-lysine | Sigma-Aldrich | P1149 | |
| G418 disulfate salt (Geneticin) | Sigma-Aldrich | G5013 | Danger: irritant |
| Phleomycin D1 (Zeocin) | Life Technologies | R25001 | |
| Hygromycin B | Life Technologies | 10687-010 | Danger: toxic, irritant and corrosive |
| Trypsin-EDTA | Life Technologies | 25300-054 | Warm in water bath at 37 °C before use. Danger: irritant. |
| Poly-L-lysine | Sigma-Aldrich | P6282 | |
| Laminin | Sigma-Aldrich | L2020 | |
| 100 μm Nylon Cell Strainer | VWR | 734-0004 | |
| Cytosine β-D-arabinofuranoside (Ara-C) | Sigma-Aldrich | C1768 | Danger: Irritant |
| Chelating agent (Versene) | Life Technologies | 15040-033 | |
| Liposomal transfection reagent (Lipofectamine LTX) with liposomal transfection buffering reagent (PLUS reagent). | Life Technologies | 15338-100 | Alternative transfection method: Effectene Reagent |
| Non-liposomal transfection reagent (Effectene reagent) | Qiagen | 301425 | |
| Reduced serum medium (Opti-MEM) | Life Technologies | 11058-021 | |
| Mouse anti-Synaptotagmin antibody conjugated to Cy5 | Synaptic Systems | 105311C5 | |
| Neurobasal A | Life Technologies | 10888-022 | |
| Sodium Chloride (NaCl) | VWR | 27810.364 | |
| Glycine | Sigma-Aldrich | G1726 | |
| BSA (Bovine Serum Albumin) | Sigma-Aldrich | A3294 | |
| Guinea pig anti-γ2 GABAA receptor antibody | Prof. Jean Marc Fritschy | N/A | (Institute of Zurich, Switzerland) Fritschy, JM and Mohler, H. J. Comp. Neurol. 359 (1), 154-194 (1995). |
| Triton X-100 | Promega | H5141 | |
| Mouse anti-Glutamate Decarboxylase (GAD)65 antibody | Merck Millipore | MAB351 | |
| Mouse anti-synapsin antibody | Synaptic Systems | 106-011 | |
| Mouse anti-β2/3 antibody (BD17) | Merck Millipore | MAB341 | |
| Rabbit anti-α1 GABAA receptor antibody | Professor Anne Stephenson | N/A | (UCL School of Pharmacy, London) FA Stephenson et al. J. Comp. Neurol. 416 (2), 158-172 |
| Goat anti-guinea pig conjugated to Cy5 antibody | Merck Millipore | AP1085 | |
| Goat anti-mouse Alexa Fluor 488 antibody | Merck Millipore | AP124S | |
| Goat anti-mouse Alexa Fluor 405 antibody | Life Technologies | A31553 | |
| Goat anti-mouse Alexa Fluor 555 antibody | Life Technologies | A21422 | |
| Goat anti-rabbit Alexa Fluor 488 antibody | Life Technologies | A11008 | |
| Mounting reagent (Prolong Gold) | Life Technologies | P36930 | Use at room temperature |
References
- Wang, D. D., Kriegstein, A. R. Defining the role of GABA in cortical development. J Physiol. 587, 1873-1879 (2009).
- Ben-Ari, Y., Khalilov, I., Kahle, K. T., Cherubini, E. The GABA excitatory/inhibitory shift in brain maturation and neurological disorders. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry. 18, 467-486 (2012).
- Structure Sieghart, W. pharmacology, and function of GABAA receptor subtypes. Adv Pharmacol. 54, 231-263 (2006).
- Unwin, N. Neurotransmitter action: opening of ligand-gated ion channels. Cell. 72, 31-41 (1993).
- Homanics, G. E., et al. Mice devoid of gamma-aminobutyrate type A receptor beta3 subunit have epilepsy, cleft palate, and hypersensitive behavior. Proceedings of the National Academy of Sciences of the United States of America. 94, 4143-4148 (1997).
- Gunther, U., et al. Benzodiazepine-insensitive mice generated by targeted disruption of the gamma 2 subunit gene of gamma-aminobutyric acid type A receptors. Proceedings of the National Academy of Sciences of the United States of America. 92, 7749-7753 (1995).
- Mohler, H. GABA(A) receptor diversity and pharmacology. Cell Tissue Res. 326, 505-516 (2006).
- Low, K., et al. Molecular and neuronal substrate for the selective attenuation of anxiety. Science. 290, 131-134 (2000).
- Rudolph, U., et al. Benzodiazepine actions mediated by specific gamma-aminobutyric acid(A) receptor subtypes. Nature. 401, 796-800 (1999).
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nat Rev Drug Discov. 10, 685-697 (2011).
- Hulst, C., Atack, J. R., Kooy, R. F. The complexity of the GABAA receptor shapes unique pharmacological profiles. Drug Discov Today. 14, 866-875 (2009).
- Essrich, C., Lorez, M., Benson, J. A., Fritschy, J. M., Luscher, B. Postsynaptic clustering of major GABAA receptor subtypes requires the gamma 2 subunit and gephyrin. Nat Neurosci. 1, 563-571 (1998).
- Schweizer, C., et al. The gamma 2 subunit of GABA(A) receptors is required for maintenance of receptors at mature synapses. Mol Cell Neurosci. 24, 442-450 (2003).
- Belelli, D., et al. Extrasynaptic GABAA receptors: form, pharmacology, and function. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12757-12763 (2009).
- Connolly, C. N., Wooltorton, J. R., Smart, T. G., Moss, S. J. Subcellular localization of gamma-aminobutyric acid type A receptors is determined by receptor beta subunits. Proceedings of the National Academy of Sciences of the United States of America. 93, 9899-9904 (1996).
- Connolly, C. N., Krishek, B. J., McDonald, B. J., Smart, T. G., Moss, S. J. Assembly and cell surface expression of heteromeric and homomeric gamma-aminobutyric acid type A receptors. J Biol Chem. 271, 89-96 (1996).
- Klausberger, T., Roberts, J. D., Somogyi, P. Cell type- and input-specific differences in the number and subtypes of synaptic GABA(A) receptors in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 2513-2521 (2002).
- Thomson, A. M., Jovanovic, J. N. Mechanisms underlying synapse-specific clustering of GABA(A) receptors. Eur J Neurosci. 31, 2193-2203 (2010).
- Fritschy, J. M., Panzanelli, P., Tyagarajan, S. K. Molecular and functional heterogeneity of GABAergic synapses. Cell Mol Life Sci. 69, 2485-2499 (2012).
- Ali, A. B., Thomson, A. M. Synaptic alpha 5 subunit-containing GABAA receptors mediate IPSPs elicited by dendrite-preferring cells in rat neocortex. Cereb Cortex. 18, 1260-1271 (2008).
- Thomson, A. M., Bannister, A. P., Hughes, D. I., Pawelzik, H. Differential sensitivity to Zolpidem of IPSPs activated by morphologically identified CA1 interneurons in slices of rat hippocampus. Eur J Neurosci. 12, 425-436 (2000).
- Nyiri, G., Freund, T. F., Somogyi, P. Input-dependent synaptic targeting of alpha(2)-subunit-containing GABA(A) receptors in synapses of hippocampal pyramidal cells of the rat. Eur J Neurosci. 13, 428-442 (2001).
- Treutlein, B., Gokce, O., Quake, S. R., Sudhof, T. C. Cartography of neurexin alternative splicing mapped by single-molecule long-read mRNA sequencing. Proceedings of the National Academy of Sciences of the United States of America. 111, 1291-1299 (2014).
- Siddiqui, T. J., Craig, A. M. Synaptic organizing complexes. Current opinion in neurobiology. 21, 132-143 (2011).
- Tanaka, H., et al. Higher-order architecture of cell adhesion mediated by polymorphic synaptic adhesion molecules neurexin and neuroligin. Cell reports. 2, 101-110 (2012).
- Krueger, D. D., Tuffy, L. P., Papadopoulos, T., Brose, N. The role of neurexins and neuroligins in the formation, maturation, and function of vertebrate synapses. Current opinion in neurobiology. 22, 412-422 (2012).
- Scheiffele, P., Fan, J., Choih, J., Fetter, R., Serafini, T. Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell. 101, 657-669 (2000).
- Graf, E. R., Zhang, X., Jin, S. X., Linhoff, M. W., Craig, A. M. Neurexins induce differentiation of GABA and glutamate postsynaptic specializations via neuroligins. Cell. 119, 1013-1026 (2004).
- Dong, N., Qi, J., Chen, G. Molecular reconstitution of functional GABAergic synapses with expression of neuroligin-2 and GABAA receptors. Mol Cell Neurosci. 35, 14-23 (2007).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. Eur J Neurosci. 38, 3146-3158 (2013).
- Ventimiglia, R., Lindsay, R. . Culturing nerve cells: Rat striatal neurons in low-density, serum-free culture. , 371-393 (1998).
- Gross, A., et al. Differential localization of GABA(A) receptor subunits in relation to rat striatopallidal and pallidopallidal synapses. Eur J Neurosci. 33, 868-878 (2011).
- Fritschy, J. M., Mohler, H. GABAA-receptor heterogeneity in the adult rat brain: differential regional and cellular distribution of seven major subunits. J Comp Neurol. 359, 154-194 (1995).
- Doig, N. M., Moss, J., Bolam, J. P. Cortical and thalamic innervation of direct and indirect pathway medium-sized spiny neurons in mouse striatum. The Journal of neuroscience : the official journal of the Society for Neuroscience. 30, 14610-14618 (2010).
- Lalchandani, R. R., Vicini, S. Inhibitory collaterals in genetically identified medium spiny neurons in mouse primary corticostriatal cultures. Physiological reports. 1, (2013).
- Nusser, Z., Sieghart, W., Benke, D., Fritschy, J. M., Somogyi, P. Differential synaptic localization of two major gamma-aminobutyric acid type A receptor alpha subunits on hippocampal pyramidal cells. Proceedings of the National Academy of Sciences of the United States of America. 93, 11939-11944 (1996).
- Linhoff, M. W., et al. An unbiased expression screen for synaptogenic proteins identifies the LRRTM protein family as synaptic organizers. Neuron. 61, 734-749 (2009).
- Pettem, K. L., Yokomaku, D., Takahashi, H., Ge, Y., Craig, A. M. Interaction between autism-linked MDGAs and neuroligins suppresses inhibitory synapse development. J Cell Biol. 200, 321-336 (2013).
- Wit, J., et al. Unbiased discovery of glypican as a receptor for LRRTM4 in regulating excitatory synapse development. Neuron. 79, 696-711 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved