Method Article
عزل وتوصيف الخلايا الأقمار الصناعية من عضلات الفئران رئيس قسيمي خيشومي
In This Article
Erratum Notice
Summary
يصف هذا البروتوكول عزل الخلايا الأقمار الصناعية من عضلات الرأس قسيمي خيشومي من الفئران القديم أسابيع 9. العضلات تنشأ من الأقواس خيشومي مختلفة. وفي وقت لاحق، والخلايا الأقمار الصناعية يتم تربيتها على طلاء بقعة من حجم ملليمتر لدراسة التمايز بهم. هذا النهج يتجنب التوسع والركض الخلايا الأقمار الصناعية.
Abstract
Fibrosis and defective muscle regeneration can hamper the functional recovery of the soft palate muscles after cleft palate repair. This causes persistent problems in speech, swallowing, and sucking. In vitro culture systems that allow the study of satellite cells (myogenic stem cells) from head muscles are crucial to develop new therapies based on tissue engineering to promote muscle regeneration after surgery. These systems will offer new perspectives for the treatment of cleft palate patients. A protocol for the isolation, culture and differentiation of satellite cells from head muscles is presented. The isolation is based on enzymatic digestion and trituration to release the satellite cells. In addition, this protocol comprises an innovative method using extracellular matrix gel coatings of millimeter size, which requires only low numbers of satellite cells for differentiation assays.
Introduction
حوالي 1: 500-1: 1000 حديثي الولادة يحمل شق تنطوي على الشفة و / أو الحنك المشقوق (CLP)؛ وبالتالي هذا هو تشوه خلقي الأكثر شيوعا لدى البشر 1. عضلات الحنك الرخو حاسمة لعمل اللهاة أثناء الكلام، والبلع، والمص. إذا شق الحنك الرخو هو الحاضر، يتم إدراج هذه العضلات بشكل غير طبيعي في نهاية الخلفي للعظم الحنكي.
اللهاة يتحرك صعودا وهبوطا خلال الكلام، ومنع الهواء من الفرار عن طريق الأنف. الأطفال الذين يعانون من شق في سقف الحلق لا تملك هذه وظيفة التحكم مما أدى إلى الظاهرة المعروفة باسم شراعي بلعومي الخلل 2،3. على الرغم من أن بروتوكولات العلاج هي المتغير، إصلاح جراحي من اللهاة يحدث في مرحلة الطفولة المبكرة (6-36 شهرا من العمر) 4. عضلات إدراجها بشكل غير طبيعي من اللهاة يمكن تصحيح جراحيا 5-7، ومع ذلك، استمر ضعف شراعي بلعومي 7٪ إلى 30٪من المرضى 2،3،8-10.
يتم تأسيس قدرة العضلات والهيكل العظمي لتجديد من خلال عمل الخلايا الأقمار الصناعية (المنبوذة) جيدا 11،12. على اصابة في العضلات، وتنشيط اللجان الدائمة والهجرة إلى موقع الإصابة. وبعد ذلك تتكاثر، التفريق، وتلتحم لتشكل myofibers جديدة أو إصلاح التالف منها 13. هادئة المنبوذة التعبير عن عامل النسخ Pax7 14،15، في حين نسلهم، وmyoblasts المتكاثرة، بالإضافة إلى التعبير عن تحديد عامل عضلي 1 (MyoD) 16. myoblasts التفريق تبدأ في التعبير عن myogenin (MyoG) 17. يتم وضع علامة على التمايز النهائي من myoblasts عن طريق تشكيل لmyofibers، والتعبير عن بروتينات العضلات محددة مثل الميوسين السلسلة الثقيلة (MyHC) 16،18.
في الآونة الأخيرة، وقد استخدمت عدة استراتيجيات في مجال الطب التجديدي لتحسين تجديد العضلات عضلات الأطراف 19-23. دراسات محددة بشأنعضلات الرأس قسيمي خيشومي مهمة أيضا لأنها أثبتت مؤخرا أنها تختلف عن غيرها من العضلات في عدة جوانب 24. وعلى النقيض من عضلات الأطراف، وقد اقترح أن عضلات الرأس قسيمي خيشومي تحتوي على أقل المنبوذة 25، تتجدد أبطأ، ويتم تشكيل النسيج الضام الليفي أكثر بعد إصابة 26 بالإضافة إلى ذلك، المتكاثرة المنبوذة من عضلات الرأس قسيمي خيشومي أعرب أيضا عن عوامل النسخ الأخرى. على سبيل المثال، يتم التعبير عن Tcf21، وهو عامل النسخ لتكوين العضلات القحفي بقوة في تجديد العضلات الرأس ولكن من الصعب في تجديد العضلات أطرافهم 25. في عضلات الحنك الرخو من المرضى CLP عادة ما تكون أصغر حجما ومنظمة تنظيما جيدا أقل بالمقارنة مع عضلات الحنك طبيعية 27،28. الألياف البطيئة والسريعة على حد سواء الموجودة في عضلات الحنك لينة ولكن الألياف البطيئة هي أكثر وفرة. في المقابل، العضلات المشقوقة تحتوي على نسبة عالية من الألياف السريعة وأيضا توريد الشعرية انخفاضمقارنة مع طبيعية عضلات الحنك الناعمة 29-31. الألياف السريعة أكثر عرضة للالناجم عن الانكماش إصابة 31-33. قد ضعف الإمداد الشعري المصاحب أيضا تعزيز التليف 34،35. كل هذه الجوانب يمكن أن تسهم في تجديد ضعف عضلات الحنك لينة بعد إغلاق الشق الجراحي 36. في ضوء ذلك، على بروتوكول لعزل وتوصيف العضلات رئيس قسيمي خيشومي المنبوذة أمر بالغ الأهمية. وهذا يوفر إمكانية لدراسة SC بيولوجيا عضلات الرأس قسيمي خيشومي. بالإضافة إلى ذلك، يمكن تطويرها علاجات جديدة تقوم على هندسة الأنسجة إلى تشجيع تجديد العضلات بعد جراحة في CLP وغيرها من الشروط المساس منطقة القحفي.
بشكل عام، SCS يمكن الحصول عليها بعد تفكك الأنسجة العضلية 14. تنميق، والهضم الأنزيمي، وسحن وعادة ما يطلب لاطلاق سراح المنبوذة من مكانها المناسب. المنبوذة يمكن تنقيته بواسطة قبل الطلاء على أطباق غير المصقول 14،37،38، الابactionation على Percoll 39،40، خلية أو fluorescent- أو المغناطيسية الفرز 41-43. نحن هنا نقدم بروتوكول الاقتصادي والسريع الجديد لعزل الخلايا الأقمار الصناعية من عضلات الرأس قسيمي خيشومي من الفئران الشباب البالغين. ويستند هذا البروتوكول على مخطوطة السابقة 14 وتكييفها خصيصا لعينات من الأنسجة الصغيرة. ووصف عزل المنبوذة من العضلات التمثيلية القادمة من شارع 1، 2 الثانية، و 4 الأقواس خيشومي عشر. بعد العزلة وقلة عدد الخلايا الأقمار الصناعية يتم تربيتها على الخلية البقع هلام مصفوفة من حجم ملليمتر لدراسة المفاضلة الخاصة بهم. هذا النهج يتجنب الحاجة إلى توسيع والركض الطوائف المنبوذة.
Protocol
وتمت الموافقة على جميع التجارب المذكورة هنا من قبل المجلس المحلي للتجارب على الحيوانات من رادبود جامعة نيميجن وفقا للقوانين واللوائح (RU-DEC 2013-205) الهولندية.
1. البقع خارج الخلية مصفوفة جل
- قم بالخطوات التالية قبل يوم واحد من العزلة:
- ذوبان الجليد قسامة خارج الخلية هلام مصفوفة (100 ميكرولتر) في 4 درجة مئوية لمدة لا تقل عن 1.5 ساعة. تمييع 01:10 في تعديل متوسطة النسر Dulbecco و. مع 4500 ملغ / L الجلوكوز، 4 مم L-الجلوتامين، و 110 ملغ / مل الصوديوم البيروفات (DMEM). الحفاظ على جل المصفوفة خارج الخلية في 4 ° C في جميع الأوقات. ملاحظة: التغيرات في درجات الحرارة المفاجئة سيؤدي إلى طلاء غير المتكافئة، وتشكيل الكريستال.
- الحفاظ على الخلية حل هلام مصفوفة المخفف على الجليد لمدة 15 دقيقة.
- قبل البرد وmicropipette 20 ميكرولتر لمدة 10 دقيقة.
- وضع الشرائح الغرفة 8 جيدا في طبق بيتري 100 ملم ونقل طبق على سطح بارد (على سبيل المثال حزمة الثلاجة) لمدة 10 دقيقة.
- استخدام micropipette قبل المبردة لوضع قطرة من 10 ميكرولتر المصفوفة خارج الخلية هلام في كل بئر. الحفاظ على طبق بيتري على سطح بارد لمدة لا تقل 7 دقيقة (الشكل 1A) آخر.
- تماما إزالة ما تبقى من خارج الخلية هلام مصفوفة (الشكل 1B)، وتجف الآبار عند 37 درجة مئوية خلال الليل.
2. تشريح رئيس العضلات (الماضغة، ذات البطنين، والرافعة للحفاف)
- قبل التشريح، وتجهيز 50 مل من الفوسفات مخزنة المالحة (PBS) تستكمل مع 2٪ البنسلين، الستربتوميسين (P / S). الحفاظ على الجليد.
- بعد القتل الرحيم من الفئران أحد الشباب الكبار (9 أسابيع) مع CO 2 / O 2، قطع رأس الرأس وإزالة الجلد من الرأس. نقل رئيس لPBS الجليد الباردة تستكمل مع 2٪ P / S في أنبوب 50 مل.
- العضلات الماضغة (مشتقة من القوس الخيشومي 1)
- وضع الرأس مع جانب واحد حتى على وسادة سيليكون ومع تحديد ن تحت الجلدeedles (الشكل 2A).
- تحديد الغدة النكفية والعصب الوجهي (الشكل 2A). فضح اللفافة العميقة التي تغطي الغدة. قطع اللفافة وإزالة الغدة باستخدام مقص تشريح. تحديد القناة السمعية الخارجية. تتبع العصب الوجهي من الثقبة الإبرية الخشائية وإزالة الفروع الزمنية، الوجني، والشدق بعناية مع شفرة مشرط رقم 15.
- الافراج عن رئيس سطحي من العضلة الماضغة عن طريق إزالة اللفافة. تحديد رؤساء كل من سطحي وعميق في العضلات الماضغة. تتبع رئيس سطحية حتى صفاق في وتر سميك إدراجها في عملية الوجني من الفك العلوي.
- فصل وتر من أصله في عملية الوجني مع ملقط على التوالي. قطع عليه بشفرة مشرط رقم 15 أو مقص تشريح وبعناية الحياة هو (الشكل 2B).
- تشريح الرأس سطحية من الماضغة حتى دخولها في زاوية والنصف السفلي من رانه الوحشي سطح الفرع من الفك السفلي بشفرة مشرط رقم 15 (الشكل 2C). الآن، وإزالة العضلات تماما.
- البطن الخلفي للعضلة ذات البطنين (مشتقة من القوس الخيشومي الثاني 2)
- وضع الرأس في موقف ضعيف على لوحة سيليكون وإصلاح مع الإبر تحت الجلد (الشكل 3A).
- إزالة الدهون تحت الجلد المغطي على حد سواء تحت اللسان والغدد تحت الفك السفلي. المقبل، وإزالة اللفافة السطحية والغدد باستخدام مقص تشريح. فضح العضلات ذات البطنين (الأمامي والخلفي بطن).
- عقد الوتر الأمامي للبطن الخلفي مع ملقط على التوالي، قطع عليه، وتشريح بعناية حتى أصله في الفقاعة الطبلية (الشكل 3B). تفعل الشيء نفسه في الجانب المقابل.
- الرافعة للحفاف العضلات (مشتقة من القوس الخيشومي 4)
- بعد تشريح البطن الخلفي للعضلة ذات البطنينوتوطين العضلة الإبرية اللامية، وسحب أفقيا، وإزالته (الشكل 4A) بعناية.
- توطين وتر من الرافعة للحفاف أن يدرج في الفقاعة الطبلية (الشكل 4A). تشريح بعناية وقطع عليه في كلا الجانبين.
- البحث في القصبة الهوائية والمريء الذي يعمل وراء ذلك. رفع المريء، وفضح البلعوم والحنجرة والحنك الرخو.
- حصر مجال اللهاة حيث يتم إدخال الحنكي الرافعة لشراع وقطع عليه فضفاض (الشكل 4B).
ملاحظة: مباشرة بعد التشريح، وإزالة وتر والنسيج الضام بعناية من كل العضلات تحت المجهر ستيريو. غمر جميع العينات بسرعة في الايثانول 70٪، ونقلها إلى PBS الجليد الباردة تستكمل 2٪ P / S في أنبوب 15 مل.
3. عزل الخلايا الأقمار الصناعية
- قم بالخطوات التالية لإعداد SC بمعزل عن 3 مجموعات من العضلات:
- إعداد 7.5 مل من 0.1٪ pronase في DMEM. تصفية حل من خلال مرشح 0.22 ميكرون. قبل الدافئة الحل عند 37 درجة مئوية في حمام مائي لمدة 10 دقيقة قبل العزلة.
- إعداد 35 مل من DMEM تستكمل مع 10٪ مصل الحصان (HS) و 1٪ P / S. قبل الدافئة أيضا عند 37 درجة مئوية في حمام مائي.
- إعداد 15 مل مستنبت الذي يتكون من DMEM تستكمل مع 20٪ مصل بقري جنيني (FBS)، و 10٪ HS، 1٪ P / S و 1٪ استخراج الجنين الدجاج (CEE). قبل الدافئة عند 37 درجة مئوية في حمام مائي.
- قبل معطف ستة الماصات البلاستيكية (10 مل) مع HS والجافة لمدة 10 دقيقة على الأقل قبل الاستخدام.
- في الثقافة هود، ونقل كل عضلة في بئر من لوحة 6 جيدا. باستخدام مقص تشريح، وقطع العضلات في قطع صغيرة من حوالي 2 مم. يجب الحرص على عدم تخطر على الأنسجة أكثر من اللازم.
- إضافة بعناية 2.5 مل من 0.1٪ محلول pronase إلى كل بئر واحتضان عند 37 درجة مئوية لمدة 60 دقيقة. يهز بلطف لوحة بعد 20، 40، و 60 دقيقة. ملاحظة: duratio بالضبطن من الحضانة يعتمد على عوامل مثل العمر والسلالة من الحيوانات.
- مراقبة تحت المجهر. تحقق شظايا العضلات ووقف الهضم الأنزيمي عند الحصول على حزم الألياف مظهر خففت (الشكل 5).
- إضافة 2.5 مل من DMEM تستكمل مع 10٪ HS و 1٪ P / S. نقل إلى أنبوب 15 مل وأجهزة الطرد المركزي أنابيب في 400 x ج لمدة 5 دقائق. تجاهل طاف عن طريق الترقيد.
- إضافة 5 مل DMEM تستكمل مع 10٪ HS و 1٪ P / S. ماصة الحل صعودا وهبوطا مع ماصة 10 مل من البلاستيك (سحن) لمدة 20 مرات على الأقل لتجانس الأنسجة.
- أنابيب الطرد المركزي في 200 x ج لمدة 4 دقائق. جمع طاف ونقل في أنبوب 15 مل.
- إضافة 5 مل DMEM تستكمل مع 10٪ HS و 1٪ P / S. ماصة مرة أخرى مع ماصة بلاستيكية سعة 10 مل حتى شظايا الأنسجة يمر بسهولة من خلال ماصة.
- أنابيب الطرد المركزي في 200 x ج لمدة 4 دقائق، وجمع طاف في أنبوب 15 مل.
- Pحزب التحرير مصفاة الخلية (40 ميكرون) على أنبوب 50 مل ونقل طاف تحتوي على خلايا نأت على التصفية. تغسل مع 1 مل DMEM لاسترداد الخلايا القصوى.
- أنابيب الطرد المركزي في 1000 x ج لمدة 10 دقيقة، وتجاهل طاف مع الماصة.
- Resuspend وبيليه في 300 ميكرولتر مستنبت وعدد الخلايا في عدادة الكريات.
4. تمايز الخلايا الأقمار الصناعية على البقع خارج الخلية مصفوفة جل
- تمييع تعليق خلية للحصول على 1.5 × 10 3 خلايا في 10 ميكرولتر من مستنبت.
- تأمين أغطية غرف الشرائح مع الشريط ووضع علامة على البقع مع علامة سوداء على الجانب السفلي من الزجاج الكائن.
- باستخدام micropipette، وضعت قطرة من 10 ميكرولتر الخلية تعليق على الفور جل المصفوفة خارج الخلية. الاختيار تحت المجهر ما إذا كان قد تم وضع قطرة من تعليق الخلية بشكل صحيح على الفور. احتضان لمدة ست ساعات في 37 ° C.
- حذرلاي إضافة 400 ميكرولتر من مستنبت (DMEM تستكمل مع 20٪ FBS، 10٪ HS، 1٪ P / S و 1٪ CEE) واحتضان لمدة ثلاثة أيام في 37 ° C.
ملاحظة: عند هذه النقطة، يتعرضون SC المعزولة حديثا لصدمة هائلة (الأنزيمية الهضم وسحن قاسية) وأنها بحاجة للتعافي. لا تخل الخلايا خلال الثلاث الأيام الأولى 37. بعد ذلك، يمكن تغيير مستنبت اعتمادا على نوع من التجربة.
يمكن المصنف البقع هلام المصفوفة خارج الخلية مع خلية كثافة عالية (1،5-2،5 × 10 3/20 ميكرولتر) للتمايز الفحص. مستنبت (DMEM تستكمل مع 20٪ FBS، 10٪ HS، 1٪ P / S و 1٪ استخراج الجنين الدجاج) يمكن استبدال كل يوم الثالث على التوالي. - بدلا من ذلك، إذا كان المطلوب التوسع والنجاح اتبع الخطوات التالية:
- ذوبان الجليد قسامة خارج الخلية هلام مصفوفة (500 ميكرولتر) في 4 درجة مئوية لمدة لا تقل عن 1.5 ساعة. تمييع 01:10 في DMEM واتباع التوصيات في نقطة 1.1.1.
- قبل البرد ماصة 10 مل لمدة 10 دقيقة في 4 و# 176؛ C.
- نقل ثلاثة قوارير T75 في الصعود إلى سطح بارد (على سبيل المثال حزمة الثلاجة) لمدة 10 دقيقة.
- استخدام ماصة قبل المبردة لوضع 1 مل المصفوفة خارج الخلية جل في كل قارورة. تأكد من أن السطح مغطاة بالكامل. الحفاظ على القوارير على سطح بارد لمدة لا تقل 7 دقيقة (الشكل 1A) آخر.
- تماما إزالة ما تبقى من خارج الخلية هلام مصفوفة مع ماصة 10 مل، وتجف الآبار عند 37 درجة مئوية لمدة 1 ساعة.
- بعد فرز، resuspend والمنبوذة المعزولة حديثا في 10 مل من مستنبت (DMEM تستكمل مع 20٪ FBS، 10٪ HS، 1٪ P / S و 1٪ استخراج الجنين الدجاج) والبذور في قوارير T75 قبل المغلفة.
- بعد ثلاثة أيام، وتغيير المتوسطة (وكل يوم الثالث) حتى 80٪ التقاء يتم التوصل إليه. لالركض، وغسل قوارير T75 ثلاث مرات مع برنامج تلفزيوني. التالي إضافة 1 مل 0،25٪ محلول التربسين واحتضان لمدة ثلاث دقائق في 37 ° C. resuspend في 9 مل من مستنبت (DMEM تستكمل مع 20٪ FBS، 10٪ HS، 1٪ P / Sو1٪ استخراج الجنين الدجاج) وأجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق. تجاهل طاف. بعد فرز، و resuspend 1 × 10 6 خلايا في 1000 ميكرولتر من مستنبت وتجميد الخلايا.
النتائج
باستخدام هذا البروتوكول، والعضلات الماضغة (جانب واحد) ينتج 0،8-1 × 10 6 خلايا، والعضلات ذات البطنين (الخلفي بطن) ينتج 1.5-2 × 10 5 خلايا، والرافعة لشراع الحنك عوائد العضلات 1-1.5 × 10 5 الخلايا. غلة خلية تعتمد على نوع العضلات، وإجهاد، وعمر الحيوان. وعلى سبيل المقارنة بين المجموعات العضلية الثلاثة، والمصنف المنبوذة المعزولة حديثا في كثافة الخلية نفسها (1.5 × 10 3/10 ميكرولتر). مباشرة بعد العزلة، وأكثر من 90٪ من الخلايا المعزولة حديثا تعبر عن Pax7 (الشكل 6).
كانت ملطخة يوم 4 و 7 و 10 الثقافات مع الأجسام المضادة ضد Pax7، MyoD، MyoG وMyHC المناعية. احصي خمسة حقول التعسفية في الثقافة باستخدام الهدف 20X. في يوم 4 باكس 7 و ميو D يعبر عنها في كل مجموعات العضلات (أرقام 6 و 7 و 8)، ولكن ذرية SatCs من الماضغة والعضلات ذات البطنين تبدأ مورينداتاهيتيانونيالغناء myogenin في وقت سابق من الرافعة للحفاف العضلات (الشكل 9). في يوم 10، وقللت من التعبير عن MyoG بقوة في جميع الفئات (الشكل 9). بعد أيام قليلة من البذر على الخلية البقع هلام مصفوفة، والخلايا المتكاثرة تبدأ في صهر وتشكيل myotubes متعددة الأنوية، التي تعبر عن السلسلة الثقيلة الميوسين. myotubes صغيرة واضحة للعيان في يوم 7 (الشكل 10). في يوم 10، الوخز في myotubes يمكن ملاحظة (فيديو 1).

الشكل 1: خارج الخلية البقع هلام مصفوفة في شريحة غرفة (A) لسهولة التلاعب، ووضع شريحة غرفة 8-جيدا في طبق بيتري 100 ملم. الماصة 10 ميكرولتر جل المصفوفة خارج الخلية في كل غرفة ووضعها على سطح بارد (7 دقائق). (B) الشريحة الغرفة بعد الزائدة خارج الخلية مصفوفة زتتم إزالة ايل.

الشكل 2: تشريح العضلات الماضغة (A) رئيس الحيوان في النظر الجانبي. الأذن (E)، الغدة النكفية (P) والعصب الوجهي (السابع). (B) وتري صفاق (تي) من رأس سطحي من العضلة الماضغة (السيدة) والعضلات الزمنية (T). فصل وتر من الإدراج مع ملقط. (C) تشريح بعناية العضلات حتى دخولها في الفرع للفك السفلي. E: الأذن، P: الغدة النكفية، والسابع: العصب الوجهي، T: العضلات الزمنية، السيدة: رئيس سطحي من العضلة الماضغة، الشركة المصرية للاتصالات: وتر، النائب: الرأس العميق للعضلة الماضغة.
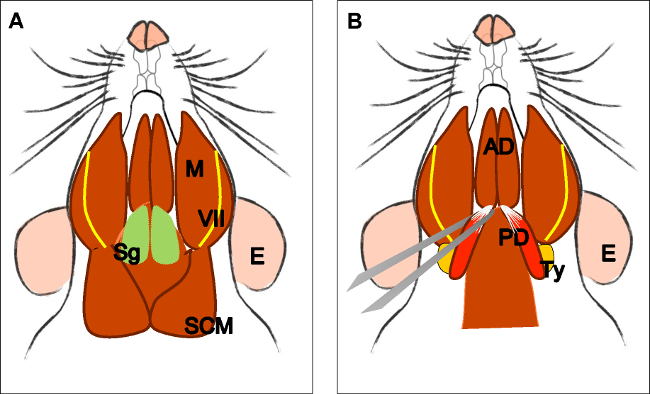
الرقم 3: تشريح البطن الخلفي للعضلة ذات البطنين (.A) رئيس الحيوان في موقف ضعيف. توطين الغدة تحت الفك السفلي (SG) والعضلات الماضغة (M)، العصب الوجهي (السابع) والعضلات القصية الترقوية الخشائية (SCM). إزالة الغدة تحت الفك السفلي. (B) المعربة الأمامية ذات البطنين العضلات (AD) والبطن الخلفي (PD). مع ملقط على التوالي، واتخاذ وتر الأمامي للبطن الخلفي، وقطع وتشريح بعناية حتى أصله في الفقاعة الطبلية (تاي). E: الأذن، الأمين العام: الغدة تحت الفك السفلي، والسابع: العصب الوجهي، M: العضلات الماضغة، SMC: عضلة القصية الترقوية الخشائية، AD: بطن العضلة ذات البطنين الأمامية، PD: الخلفية بطن العضلة ذات البطنين، تاي: الفقاعة طبل.
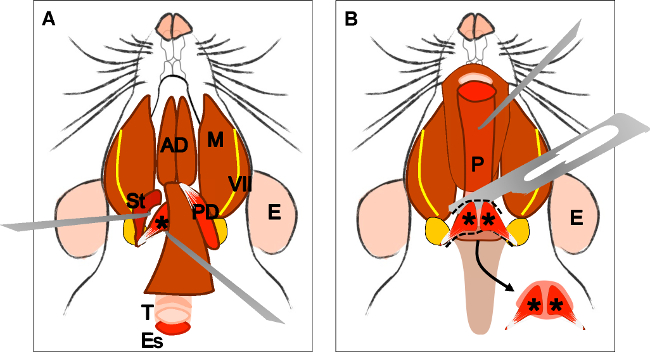
الرقم 4: تشريح العضلات الرافعة للحفاف (A) منظر عام بعد تشريح العضلات ذات البطنين (البطن الخلفي). العضلات الإبرية اللامية (القديس) ووتر من الرافعة لل يمكن أن تكون مترجمة للحفاف. ملاحظة القصبة الهوائية (T) والمريء (ES) يركض وراء ذلك. (B) بعد رفع القصبة الهوائية والمريء يتعرض البلعوم (P). ادراج الحنكي الرافعة لشراع الحنك الرخو في مرئيا الآن. السهم يشير إلى الحنك الرخو تشريح مع عضلات الحنك الرافعة لشراع في كلا الجانبين. E: الأذن، وسانت: العضلة الإبرية اللامية، السابع: العصب الوجهي، M: الماضغة العضلات، AD: بطن العضلة ذات البطنين الأمامية، PD: الخلفية بطن العضلة ذات البطنين، T: القصبة الهوائية، وفاق: المريء، P: البلعوم، * العضلة الرافعة للحفاف .

الشكل 5: مظهر من الأنسجة العضلية (A) قبل و (B) بعد الهضم الأنزيمي مع pronase. لاحظ أن تظهر حزم العضلات لتكون خففت بعد الهضم الأنزيمي.
ه = "دائما"> 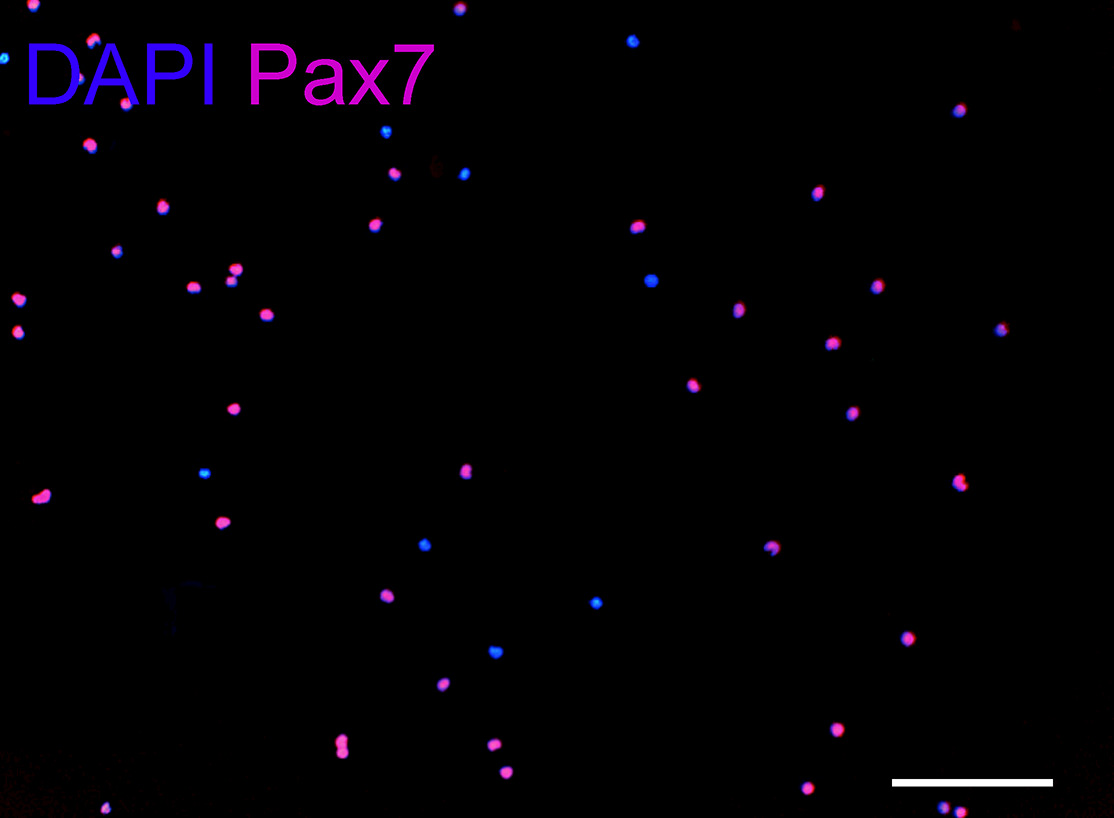
الشكل 6: باكس 7 المناعية المنبوذة المعزولة حديثا، وتطبيقها على الخلية هلام مصفوفة في نهاية العزلة (حوالي 6 ساعات بعد الهضم الأنسجة الأولي). احصي خمسة حقول التعسفية باستخدام الهدف 10X بمتوسط 210 خلية لكل حقل. ما يقرب من 90٪ من الخلايا باكس 7 إيجابي. دابي: الأزرق، Pax7: أحمر. شريط النطاق، 100 ميكرون.

الرقم 7: باكس 7، MyoD المناعية كانت ملطخة يوم 4 و 7 و 10 الثقافات مع الأجسام المضادة ضد Pax7، وMyoD المناعية. (A - C) و (D - F) photomicrographs التمثيلية لليوم 4 و 7 الثقافات من العضلات الماضغة. (G و H ) تم حساب عدد Pax7 + وMyoD + نوى في الحقل المجهري وكنسبة مئوية من مجموع عدد النوى (دابي). دابي: الأزرق، Pax7: أحمر، وMyoD: الأخضر. شريط جداول و 100 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

كانت ملطخة يوم 4 و 7 و 10 الثقافات مع الأجسام المضادة ضد Pax7، وMyoD المناعية - توزيع Pax7 ± / MyoD ± في الثقافات من الخلايا mononucleated في الثقافات من الماضغة، ذات البطنين والرافعة لشراع العضلات الحنكي (C A): الرقم 8. ويستند العدد الكلي للخلايا على من إجمالي عدد النوى (دابي). (D) الكمي بيانات Pax7 ± / MyoD ± سلليرة سورية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 9: المناعية Myogenin يوم 4 و 7 و 10 الثقافات كانت ملطخة مع الأجسام المضادة ضد Myogenin. (A - D) photomicrographs التمثيلية لليوم 4 و 7 الثقافات من العضلات الرافعة للشراع الحنكي. (E) عدد MyoG + نوى في الحقل المجهري وعدها وكنسبة مئوية من مجموع عدد النوى (دابي). الكمي (F) بيانات عن خلايا MyoG +. دابي: الأزرق وMyogenin: الأخضر. شريط جداول و 100 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذه شملت رقمه.

الرقم 10: الميوسين الثقيلة سلسلة المناعية يوم 4 و 7 و 10 الثقافات كانت ملطخة مع الأجسام المضادة ضد الميوسين السلسلة الثقيلة (MyHC). photomicrographs تمثيلية من يوم 4 و 7 و 10 الثقافات من ذات البطنين (DIG) في العضلات. في يوم 7، myotubes صغيرة موجودة وفي يوم 10 myotubes طويلة ومنظمة تنظيما جيدا جلية. شريط جداول و 200 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
الفيديو 1:.. myotube مركزيا الوخز وترد أمثلة من حقلين تمثيلية مع myotubes الوخز ليوم 10 الثقافات من العضلات ذات البطنين الرجاء انقر هنا لمشاهدة هذا الفيديو.
Discussion
المنبوذة من مختلف عضلات الرأس قسيمي خيشومي تم عزل من الفئران ويستار عمره 9 أسابيع واحد ومثقف مباشرة على المصفوفة خارج الخلية البقع هلام دون التوسع مسبق والركض. بعد العزلة، احصي الخلايا والمصنف في كثافة الخلية نفسها. لعزل موازية من ثلاث عضلات مختلفة، وهذه الطريقة تستغرق حوالي 4 ساعات. لتجنب التلوث الثقافة، خطوة حاسمة هي غسل السريع في الكحول 70٪ بعد تشريح العضلات.
خلال SC العزلة من المهم لقطع الأنسجة العضلية إلى قطع صغيرة (حوالي 2 مم)، ولكن تجنب الكثير من تنميق لأن هذا سيؤدي في الغلة الخلايا الصغيرة بسبب تلف الخلايا. أيضا، يجب أن يتم التحقق مدة الهضم الأنزيمي بعناية تحت المجهر لتجنب المزيد من الضرر. الهدف من الهضم هو الفصل بين myofibers. منذ أكثر من 90٪ من الخلايا المعزولة تعبر عن Pax7، لا يحتاج تنقية إضافية (الشكلان 6-8).هذا يتجنب خطوات تنقية إضافية في وسائل أخرى مثل قبل الطلاء على أطباق غير المصقول 14،37،38، تجزئة على Percoll 39،40، خلية أو fluorescent- أو المغناطيسية فرز 41،43. لسحن فمن الضروري للحث على القص بين شظايا الأنسجة وافتتاح طرف ماصة لأن هذا يسمح بالإفراج الميكانيكي للالمنبوذة. إذا كان سحن مع ماصة 10 مل (داخل القطر نصيحة: 1 مم) من الصعب، على بعد 5 مل (داخل القطر نصيحة: 2 مم) ماصة يمكن استخدامها لأول مرة. بدلا من ذلك، الزجاج الماصات باستور يمكن خفض في القطر المطلوب واستخدامها. وهذه طريقة بسيطة وفعالة ويسمح للعزلة في وقت واحد SC من عينات مختلفة من العضلات.
ويمكن أيضا لوحات ثقافة المنبوذة تكون مغلفة مع الجيلاتين أو الكولاجين، ولكن تظهر دراساتنا السابقة أن الخلية هلام مصفوفة هو أفضل بكثير للحفاظ على القدرة عضلي من الكولاجين 38. البقع هلام المصفوفة خارج الخلية منحجم ملليمتر (10 ميكرولتر / Ø 2 مم أو 20 ميكرولتر / Ø 4 مم) يسمح للدراسة انتشار والتفريق بين الطوائف المنبوذة مع عدد محدود من الخلايا. للمقايسة تمايز الخلايا حوالي 8 إلى 20 مرات أقل مطلوبة مقابل 24 لوحة جيدا (Ø 15.6 ملم)، وحوالي 80 إلى 200 مرة أقل مقارنة مع 35 ملم أطباق بتري (Ø 35 ملم) 14،38.
منذ الخلية هلام مصفوفة مكلف، هذا الأسلوب هو أيضا أكثر فعالية من حيث التكلفة. وبالإضافة إلى ذلك، فإن الشرائح غرفة يمكن الاستعاضة عن غطاء من البلاستيك زلات لزيادة خفض التكاليف. لإعداد جل المصفوفة خارج الخلية البقع تجفيف بين عشية وضحاها من الشرائح الغرفة أمر ضروري. كما الخلية البقع هلام مصفوفة شفافة، فمن الضروري للاحتفال البقع في الجانب السفلي باستخدام الإضاءة مرة أخرى. يتم إصلاح الدوائر الشرائح في طبق بيتري للتلاعب السهل. مزيد من التوسع زراعة الخلايا ليست ضرورية، والتي توفر إمكانية لدراسة المنبوذة من األصغرلير العضلات أو عينات العضلات الصغيرة. بدلا من ذلك، على سبيل المثال لPCR أو العضلات يبني إذا كانت هناك حاجة إلى المزيد من الخلايا، والمنبوذة المعزولة حديثا يمكن أولا أن تتوسع في قوارير T75 كما هو مبين أعلاه.
عزل المنبوذة باستخدام هذا البروتوكول ليست مناسبة لمزيد من التنقية مع التدفق الخلوي مباشرة بعد العزلة. عملية الهضم مع pronase يسبب الهضم واسعة من سطح المستضدات 14. يجب أولا أن توصف مصل الحصان ومصل بقري جنيني التي تستخدم لزراعة الخلايا بشكل صحيح قبل العزلة، وأرقام مختلفة أثرت بشكل مختلف myoblasts انتشار والتمايز.
في السنوات الأخيرة، هناك اهتمام متزايد في العضلات المستمدة من الأقواس الخيشومية والأديم المتوسط الرأس (مثل عضلات العين) 24. وقد تجلى بوضوح أن الرأس والأطراف العضلات تمتلك خصائص مختلفة للغاية. الماضغة العضلات من الحيوانات القديمة ويبدو أن إعادةتين قدرتها على التجدد بالمقارنة مع عضلات الطرف 25،26. المنبوذة من عضلات العين تمتلك تكاثر وتمايز قدرة قوية مماثلة لالمنبوذة من عضلات الرأس، وتظهر إمكانات engraftment أكبر من أطرافه العضلية SCS 24.
تكوين توزيع نوع من الألياف والميوسين يختلف بين المجموعات العضلية وأيضا بين الأنواع. العضلات القادمة من أول القوس الخيشومي في البشر تحتوي على الألياف على حد سواء البطيئة والسريعة (IIA فرعية وIIX)، myosins حديثي الولادة وmyosins نموذجية لتطوير عضلة القلب. في القوارض هذه العضلات تحتوي على حوالي 95٪ ألياف السريعة الميوسين IIA وبنك الاستثمار الدولي) 44-46. وتظهر الدراسات على العضلات الطيور التي المنبوذة من أنواع الألياف العضلية المختلفة تختلف في قدرة التمايز. المنبوذة من الألياف السريعة تفرق فقط في الألياف العضلية السريعة، في حين المنبوذة من الألياف البطيئة يمكن أن تفرق في كلا النوعين من الألياف 47. وبالإضافة إلى ذلك، فإن نسبة المنبوذة في العضلات بسرعةالألياف هي أقل مما كانت عليه في الألياف العضلية البطيئة 48،49. هذا يدل على أن يجب أن تؤخذ في توزيع نوع من الألياف بعين الاعتبار للدراسات على العضلات في منطقة القحفي. على غرار عضلات الحنك المشقوق، وLVP في القوارض يتضمن على وجه الحصر تقريبا الألياف السريعة 50. لهذا السبب، SCS من LVP هي مناسبة لدراسات ما قبل السريرية في مجال الحنك المشقوق.
هذا البروتوكول يتيح إمكانيات جديدة لدراسة المنبوذة المستمدة من عضلات الرأس قسيمي خيشومي أو غيرها من العضلات الصغيرة أو العضلات عينات أصغر. وهذا سيسهل تطوير علاجات جديدة لتحسين وتجديد العضلات في منطقة الوجه والفكين في ظروف مثل الشق الحلقي ولكن أيضا في ظروف أخرى تؤثر على العضلات الصغيرة.
Disclosures
The authors have no conflicting interests to disclose.
Acknowledgements
This study was funded by a Mosaic grant (017.009.009) from The Netherlands Organization for Scientific Research (NWO) and a Start grant (S-13-167C) for young investigators from the AO Foundation. Z.Y.R is supported by the National Institutes of Health (grant # AG021566, AG035377, NS090051).
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Erratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015. Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved