Method Article
Выделение и характеристика спутниковых клеток от Крыса Глава Branchiomeric мышц
В этой статье
Erratum Notice
Резюме
Этот протокол описывает выделение клеток из спутниковых branchiomeric мышц головы у 9-недельных крыс. Мышцы исходят из разных арок жаберных. Впоследствии, спутниковые клетки культивируют на месте покрытие миллиметрового размера, чтобы изучить их дифференциацию. Такой подход позволяет избежать расширения и пассирования сателлитных клеток.
Аннотация
Fibrosis and defective muscle regeneration can hamper the functional recovery of the soft palate muscles after cleft palate repair. This causes persistent problems in speech, swallowing, and sucking. In vitro culture systems that allow the study of satellite cells (myogenic stem cells) from head muscles are crucial to develop new therapies based on tissue engineering to promote muscle regeneration after surgery. These systems will offer new perspectives for the treatment of cleft palate patients. A protocol for the isolation, culture and differentiation of satellite cells from head muscles is presented. The isolation is based on enzymatic digestion and trituration to release the satellite cells. In addition, this protocol comprises an innovative method using extracellular matrix gel coatings of millimeter size, which requires only low numbers of satellite cells for differentiation assays.
Введение
О 1: 500 до 1: 1000 новорожденных обнаруживают щель с участием губы и / или неба (CLP); Таким образом, это наиболее распространенный врожденный порок в людях 1. Мышцы мягкого неба имеют решающее значение для функционирования мягкого неба во время речи, глотания, сосания и. Если расщелина мягкого неба присутствует, эти мышцы ненормально вставляется в задний конец небной кости.
Мягкое нёбо движется вверх и вниз во время речи, предотвращая воздух бежать через нос. Дети с расщелиной неба в не имеют этой функции управления в результате явления, известного как небно-глоточный дисфункции 2,3. Хотя протоколы лечения являются переменными, хирургическое вмешательство мягкого нёба происходит в раннем детстве (6-36 месяцев) 4. Аномально вставленные мышцы мягкого неба могут быть хирургическим путем 5-7, однако, небно-глоточный дисфункции сохраняется в 7% до 30%пациентов 2,3,8-10.
Возможность скелетных мышц регенерировать через действия клеток-сателлитов (СКС) хорошо известна 11,12. По травмы мышц, СК активируются и мигрируют к месту повреждения. Затем они размножаются, дифференцируются и сливаются, чтобы сформировать новые мышечные волокна или ремонт поврежденных них 13. Покоя СК выразить транскрипционный фактор Pax7 14,15, в то время как их потомство, пролиферирующие миобласты, дополнительно выразить миогенную фактор определения 1 (MyoD) 16. Различение Миобласты начать, чтобы выразить миогенин (MyoG) 17. Терминальной дифференцировки миобластов отмечен формирования мышечных волокон, и выражение специфических мышечных белков, таких как тяжелой цепи миозина (MyHC) 16,18.
Недавно несколько стратегии были использованы в регенеративной медицине для улучшения мышечной регенерации конечностей мышц 19-23. Конкретные исследованияbranchiomeric мышцы головы также важно, потому что это было недавно показано, что они отличаются от других мышц в нескольких аспектах 24. В отличие от мышц конечностей, было высказано предположение, что branchiomeric мышцы головы содержат меньше SCs 25, регенерации медленнее, и более волокнистой соединительной ткани образуется после травмы 26 Кроме того, пролиферирующие SCs из branchiomeric мышц головы также выразить другими факторами транскрипции. Например, Tcf21, транскрипционный фактор для формирования мышечной черепно сильно выражено в регенерации мышц головы, но вряд ли в регенерации конечностей мышцы 25. Мышцы мягкого неба в CLP пациентов, как правило, меньше и меньше хорошо организованная по сравнению с нормальными небных мышц 27,28. Медленные и быстрые волокна и присутствует в мягких мышц неба, но медленные волокна, более богатые. В отличие от этого, расщелина мышц содержат высокую долю быстрых волокон, а также сокращение предложения капиллярнойпо сравнению с нормальными мышцами мягкого неба 29-31. Быстрые волокна являются более склонными к сокращению поражении 31-33. Сопровождающий питания бедных капиллярной может также способствовать фиброз 34,35. Все эти аспекты могут способствовать плохой регенерации мягких мышц небной расщелины после хирургического закрытия 36. В связи с этим, протокол для выделения и характеристики branchiomeric глава СК мышц имеет решающее значение. Это дает возможность изучить биологию SC branchiomeric мышц головы. Кроме того, новые методы лечения, основанные на тканевой инженерии могут быть разработаны для способствовать регенерации мышц после операции в CLP и других условий компрометирующих черепно-лицевой области.
В общем, СК может быть получен после диссоциации мышечной ткани 14. Мясорубки, ферментативное расщепление и растирания, как правило, требуется, чтобы освободить SCs из своей ниши. СК может быть очищен предварительной металлизации на непокрытых блюд 14,37,38, FRactionation на Перколла 39,40, или fluorescent- или магнитно сортировки клеток 41-43. Здесь мы представляем новую экономическую и быстрый протокол для выделения клеток-сателлитов от branchiomeric мышц головы молодых взрослых крыс. Этот протокол основан на предыдущей рукописи 14 и специально адаптированной для маленькие образцы ткани. Изоляция СК представительных мышц, происходящих с 1-го, 2-го и 4-го жаберных дуг описаны. После выделения, небольшое число клеток-сателлитов культивируют на внеклеточных пятен матрица геля миллиметрового размера, чтобы изучить их дифференциации. Такой подход позволяет избежать потребность в расширении и пассирования СК.
протокол
Все эксперименты, описанные здесь, в соответствии с голландскими законами и правилами (RU-DEC 2013-205) были утверждены местным советом по эксперименты на животных из университета Неймегена.
1. внеклеточный матрикс геля Пятна
- Выполните следующие действия один день до изоляции:
- Оттепель аликвоту внеклеточного матрикса гель (100 мкл) при 4 ° С в течение по меньшей мере 1,5 ч. Развести 1:10 модифицированной среде Игла Игла; с 4500 мг / л глюкозы, 4 мМ L-глутамина, и 110 мг / мл пируват натрия (DMEM). Хранить внеклеточного матрикса гель при 4 ° С в любое время. Примечание: Резкие изменения температуры могут привести к неравномерному покрытию и образования кристаллов.
- Хранить разбавленный раствор внеклеточной матрицы геля на льду в течение 15 мин.
- Предварительно охладить 20 мкл микропипетки в течение 10 мин.
- Поместите 8-а слайды камеры в 100 мм чашки Петри и передачи блюдо на холодную поверхность (например, морозильник пакет) в течение 10 мин.
- Используйте предварительно охлажденной микропипетку чтобы поместить каплю 10 мкл внеклеточного матрикса геля в каждую лунку. Держите блюдо Петри на холодной поверхности, по крайней мере, еще 7 мин (рис 1А).
- Полное удаление оставшегося внеклеточного матрикса геля (Фигура 1В), и сухой лунки при 37 ° С в течение ночи.
2. Рассечение головы Мышцы (жевательные, двубрюшная и Levator Вели Палатини)
- Перед рассечением, готовят 50 мл фосфатно-солевом буфере (PBS) с добавлением 2% пенициллина-стрептомицина (P / S). Держите на льду.
- После эвтаназии одного молодого взрослой крысы (9 недель) с СО 2 / O 2, обезглавить голову и удалить кожу с головы. Передача голову ледяной PBS с добавлением 2% P / S в 50 мл пробирку.
- Жевательной мышцы (от 1-го жаберной дуге)
- Поместите голову одной стороны на силиконовой прокладки и закрепить подкожной пeedles (2А).
- Определить околоушной железы и лицевого нерва (рис 2а). Expose глубокую фасцию, покрывающую железу. Отрежьте панель и снимите сальник с помощью рассечение ножницами. Определить наружный слуховой канал. Проследите лицевого нерва из шилососцевидный отверстия и осторожно удалите временные, скуловые, щечные ветви и с лезвие скальпеля № 15.
- Освободите поверхностное глава жевательной мышцы путем удаления фасции. Определить и поверхностные и глубокие головы жевательной мышцы. не Проследите поверхностный голову, пока его толстым сухожильного апоневроза, вставленной в скуловой процессе верхней челюсти.
- Отделите сухожилия от места ее происхождения на скуловой процесса с прямыми щипцами. Разрежьте ее скальпелем № 15 или рассечение ножницами и осторожно жизни он (рис 2B).
- не Рассеките поверхностное глава жевательной до его установки под углом и нижней половине тон боковая поверхность ветви нижней челюсти с лезвием скальпеля № 15 (рис 2С). Теперь, полностью удалить мышцы.
- Задняя брюшко двубрюшной мышцы (от 2-й жаберной дуге)
- Поместите голову в положении лежа на спине на силиконовой прокладки и закрепить иглы для подкожных инъекций (рис 3а).
- Удалить подкожный жир, покрывающий как подъязычные и подчелюстные железы. Затем удалите поверхностную фасцию и желез, используя рассечение ножницами. Подвергать двубрюшная мышцы (передняя и задняя) живота.
- Держите переднюю сухожилия задней живот с прямыми щипцами, сократить его, и не рассекать осторожно, пока его происхождения в барабанной буллы (рис 3B). Сделайте то же самое на противоположной стороне.
- Levator Вели Палатини мышцы (от 4 жаберной дуге)
- После рассечения задней живот двубрюшной мышцы, Локализовать шилоподъязычная мышца, потяните его с боков, и осторожно снимите его (рис 4а).
- Локализация сухожилие поднимающей Вели Палатини, который вставляет в барабанной буллы (рис 4а). Тщательно препарировать и сократить его с обеих сторон.
- Посмотрите на трахею и пищевод, который проходит позади него. Поднимите пищевод, и выставить глотки, гортани и мягкого неба.
- Локализация область мягкого неба, где поднимающей Вели Палатини вставляется и сократить это свободный (рис 4B).
Примечание: Сразу после вскрытия, тщательно удалить сухожилия и соединительную ткань от каждой мышцы под микроскопом стерео. Погрузитесь все образцы быстро этанола 70%, и передавать их в ледяной PBS дополнен 2% P / S в 15 мл трубки.
3. Выделение клеток-сателлитов
- Выполните следующие действия по подготовке к изоляции SC от 3 групп мышц:
- Приготовьте 7,5 мл 0,1% проназы в DMEM. Фильтр решение через 0,22 мкм фильтр. Предварительно нагреть раствор при 37 ° С на водяной бане в течение 10 мин перед выделением.
- Подготовка 35 мл DMEM с добавлением 10% лошадиной сыворотки (HS) и 1% P / S. Кроме предварительно теплой при 37 ° С на водяной бане.
- Подготовка 15 мл культуральной среды, которая состоит из DMEM, дополненной 20% фетальной бычьей сыворотки (FBS), 10% HS, 1% P / S и 1% экстракта куриного эмбриона (СЕЕ). Предварительно теплой при 37 ° С на водяной бане.
- Предварительно пальто шесть пластиковых пипеток (10 мл) с HS и высохнуть в течение не менее 10 мин перед использованием.
- В капот культуры, передавать каждую мышцу в лунку 6-луночного планшета с. Использование рассечение ножницами, вырезать мышцы небольшими кусочками около 2 мм. Будьте осторожны, чтобы не пропустить через мясорубку ткани слишком много.
- Осторожно добавить 2,5 мл 0,1% раствора проназой в каждую лунку и инкубировать при 37 ° С в течение 60 мин. Слегка встряхните пластину после 20, 40 и 60 мин. Примечание: точное Длительностип инкубации зависит от таких факторов, как возраст и штамма животных.
- Монитор под микроскопом. Проверьте фрагменты мышц и остановить ферментативного расщепления, когда волокна пучки получить освободившуюся вид (рисунок 5).
- Добавить 2,5 мл DMEM с добавлением 10% HS и 1% P / S. Переход к 15 мл пробирку и центрифугируют пробирки при 400 х г в течение 5 мин. Удалите супернатант при декантации.
- Добавьте 5 мл DMEM с добавлением 10% HS и 1% P / S. Внесите решение вверх и вниз с 10 мл пластиковые пипетки (растирания), по крайней мере в 20 раз для гомогенизации ткани.
- Центрифуга трубки при 200g в течение 4 мин. Собирают супернатант и передачи в 15 мл пробирку.
- Добавьте 5 мл DMEM с добавлением 10% HS и 1% P / S. Внесите снова с пластиковой пипетки 10 мл до фрагментов ткани легко проходит через пипетку.
- Центрифуга трубки при 200g в течение 4 мин и собирают супернатант в 15 мл пробирку.
- Рут клеточный фильтр (40 мкм) на 50 мл трубки и передачи супернатант, содержащий диссоциированных клеток на фильтре. Промыть 1 мл DMEM для максимального восстановления клеток.
- Центрифуга трубки при 1000 мкг в течение 10 мин и отбросить супернатант с пипеткой.
- Ресуспендируют осадок в 300 мкл культуральной среды и подсчет клеток с помощью гемоцитометра.
4. Дифференциация клеток-сателлитов на внеклеточный матрикс геля пятен
- Развести клеточной суспензии, чтобы получить 1,5 · 10 3 клеток в 10 мкл культуральной среды.
- Закрепите крышки камер слайдов с лентой и отметьте места с черным маркером на нижней стороне предметное стекло.
- Использование микропипетки, поместите каплю суспензии клеток 10 мкл на месте внеклеточной матрицы геля. Проверка под микроскопом ли каплю суспензии клеток был правильно расположен на месте. Инкубировать в течение шести часов при температуре 37 ° С.
- Осторожныйлы добавить 400 мкл культуральной среды (DMEM, дополненной 20% FBS, 10% HS, 1% P / S и 1% CEE) и инкубируют в течение трех дней при 37 ° С.
Примечание: В этот момент, свежевыделенные СК подвергаются массивной травмы (ферментативная переварить и жесткой растиранием), и они должны восстанавливаться. Не беспокоить клетки в течение первых трех дней 37. Следующая, питательная среда может быть изменена в зависимости от типа эксперимента.
Гель пятна внеклеточного матрикса может быть заполнена с высокой плотностью клеток (1,5-2,5 · 10 3/20 мкл) для дифференциации анализа. Культуральную среду (DMEM, дополненной 20% FBS, 10% HS, 1% P / S и 1% экстракта куриного эмбриона) могут быть заменены каждый третий день. - Кроме того, если расширение и принятие желательно, выполните следующие шаги:
- Оттепель аликвоту внеклеточного матрикса гель (500 мкл) при 4 ° С в течение по меньшей мере 1,5 ч. Развести 1:10 DMEM и следовать рекомендациям в пункте 1.1.1.
- Предварительно охладить 10 мл пипетки в течение 10 мин при 4 &# 176; С.
- Передача три T75 колбы на холодную поверхность (например, морозильник пакет) в течение 10 мин.
- Используйте предварительно охлажденной пипетки поместить 1 мл внеклеточного матрикса геля в каждой колбе. Убедитесь, что поверхность покрыта полностью. Держите колбы на холодной поверхности, по крайней мере, еще 7 мин (рис 1А).
- Полное удаление оставшегося внеклеточного матрикса гель с 10 мл пипетки, и высушить скважин при 37 ° С в течение 1 часа.
- После подсчета, ресуспендируют свежеизолированных СКС 10 мл культуральной среды (DMEM, дополненной 20% FBS, 10% HS, 1% P / S и 1% экстракта куриного эмбриона) и семени в предварительно покрытых колбах Т75.
- После трех дней, изменить среду (и каждый третий день) до 80% слияния будет достигнута. Для пассирования, мыть колбы T75 три раза PBS. Затем добавьте 1 мл 0,25% раствора трипсина и инкубировать в течение трех минут при 37 ° С. Ресуспендируют в 9 мл культуральной среды (DMEM, дополненной 20% FBS, 10% HS, 1% P / Sи 1% экстракта куриного эмбриона) и центрифугируют при 200g в течение 5 мин. Удалите супернатант. После подсчета, ресуспендируйте 1 х 10 6 клеток в мкл 1000 культуральной среды и заморозить клетки.
Результаты
Используя этот протокол, жевательная мышца (одна сторона) дает 0,8-1 × 10 6 клеток, двубрюшная мышцы (задней) живот дает 1,5-2 × 10 5 клеток, и поднимающей Вели урожайности Палатини мышечные 1-1,5 х 10 5 клеток. Сотовые урожайность зависит от типа мышц, деформации и возраста животного. Для сравнения между тремя группами мышц, свежевыделенные СК высевали при той же плотности клеток (1,5 х 10 3/10 мкл). Непосредственно после выделения, более 90% из свежеизолированных клеток экспрессируют Pax7 (рисунок 6).
День 4, 7 и 10 культур окрашивали антителами против Pax7, MyoD, MyoG и MyHC иммунным. Пять произвольные поля были подсчитаны за культуру, используя цель 20X. В день 4 Pax 7 и Мио D выражается во всех группах мышц (6 и 7 и 8), однако потомство SatCs от жевательных и мышц двубрюшная начать экспреспеть миогенин раньше, чем поднимающей Вели Палатини мышцы (рис 9). В 10-й день, выражение MyoG сильно снижена во всех группах (рисунок 9). Через несколько дней после посева на внеклеточных пятен матрица геля, пролиферирующие клетки начинают сливаться и образовывать несколько ядросодержащие мышечных трубочек, которые выражают тяжелой цепи миозина. Небольшие мышечные трубки отчетливо видны на 7 день (рисунок 10). В 10-й день, подергивание мышечных трубочек можно наблюдать (видео 1).

Рисунок 1:. Внеклеточные пятна матрицы гель в камеру слайд () Для удобства манипулирования, место 8-а камеры слайд в чашку Петри 100 мм. Внесите 10 мкл внеклеточный матрикс геля в каждой камере и поместить его на холодной поверхности (7 мин). (B), палата слайд после избыточного внеклеточного матрикса гэль удаляется.

Рисунок 2:. Рассечение жевательной мышцы () Глава животного в боковой проекции. Ухо (Е), околоушной железы (Р) и лицевого нерва (VII),. (Б) сухожильных апоневроза (Те) поверхностной головки жевательной мышцы (MS) и височной мышцы (T). Отделите сухожилия от его введения с пинцетом. (С) Осторожно рассекают мышцы до ее введения в ветви нижней челюсти. Е: уха, Р: околоушной железы, VII: лицевой нерв, Т: височной мышцы, г-жа: поверхностный глава жевательной мышцы, Te: сухожилия, Мп: глубокий глава жевательной мышцы.
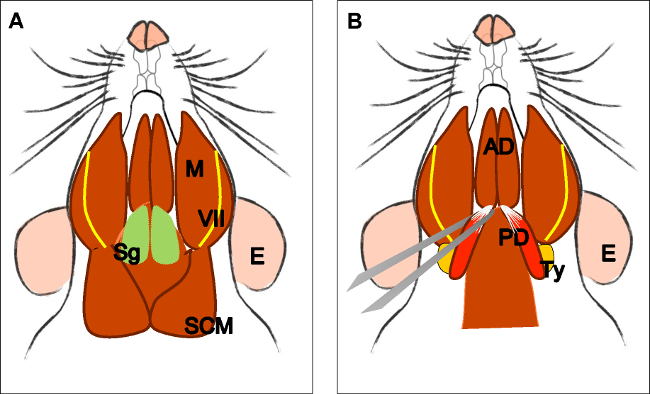
Рисунок 3: Препарирование задней живот двубрюшной мышцы (.) Глава животного в лежачем положении. Локализация подчелюстной железы (SG), жевательные мышцы (М), лицевого нерва (VII) и кивательной мышцы (СКМ). Снимите подчелюстной железы. (Б) Локализация двубрюшная мышц впереди (AD) и задней живот (PD). С помощью прямых щипцов, возьмите переднюю сухожилия задней живот, вырезать его и не рассекать осторожно, пока его происхождения в барабанной буллы (TY). Е: уха, SG: подчелюстные железы, VII: лицевой нерв, М: жевательная мышца, SMC: кивательной мышцы, AD: переднее брюшко двубрюшная мышцы, PD: задний живота двубрюшная мышц, Тай: барабанной буллы.
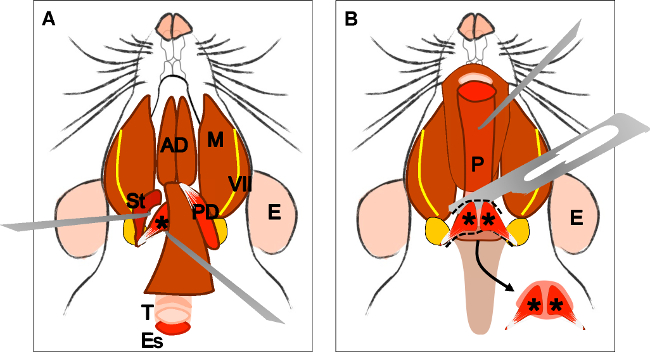
Рисунок 4:. Рассечение поднимающей Вели Палатини мышцы () Общий вид после вскрытия двубрюшной мышцы (задней живота). Шилоподъязычная мышца (St) и сухожилия леватораВели Палатини могут быть локализованы. Обратите внимание на трахею (T) и пищевод (Es) работает позади него. (B) После снятия трахею и пищевод глотки (Р) подвергается. Вставка поднимающей Вели Палатини в мягком небе теперь видна. Стрелка указывает расчлененный мягкого неба с поднимающей Вели Палатини мышц с обеих сторон. Е: уха, Санкт: шилоподъязычная мышца, VII: лицевой нерв, М: жевательная мышца, AD: переднее брюшко двубрюшная мышцы, PD: задний живота двубрюшная мышцы, Т: трахеи, Es: пищевод, Р: Глотка * поднимающей мышцы Вели Палатини ,

Рисунок 5: Внешний вид мышечной ткани (А) и после (б) после ферментативного расщепления проназы. Обратите внимание, что мышечные пучки, кажется, быть ослаблены после ферментативного расщепления.
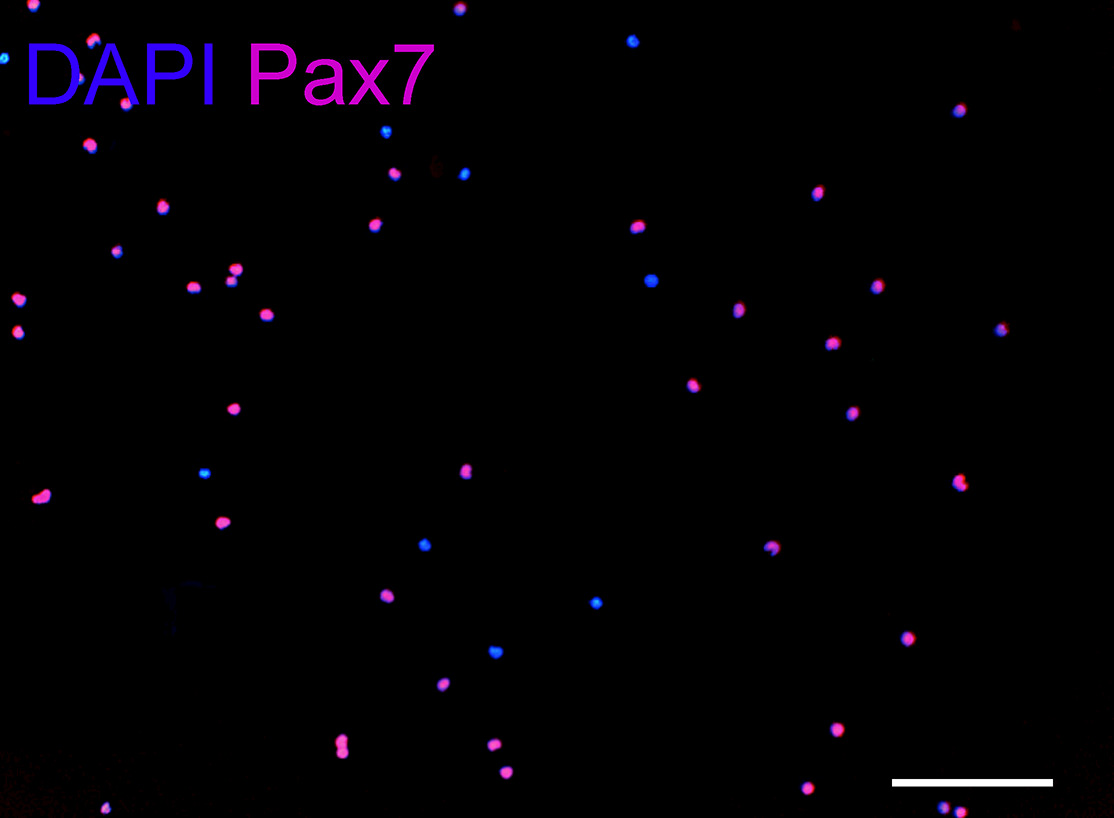
Рисунок 6: Pax 7 иммунное окрашивание Свежевыделенные СКС, применяемые к внеклеточного матрикса геля в конце изоляции (около 6 часов после первоначального ткани пищеварения).. Пять любые поля были подсчитаны с использованием цели 10X в среднем 210 клеток на поле. Приблизительно 90% клеток являются положительными Pax 7. DAPI: синий, Pax7: красный. Масштаб бар, 100 мкм.

Рис. 7: 7 Pax, MyoD иммунное окрашивание 4-й день, 7 и 10 культур окрашивали антителами против Pax7 и MyoD иммунное окрашивание. (- С) и (D - F) Характерные микрофотографии 4 дня и 7 культур от жевательной мышцы. (G и Н ) количество Pax7 + и + MyoD ядер в поле микроскопа подсчитывают и выражают в процентах от общего количества ядер (DAPI). DAPI: синий, Pax7: красный и MyoD: зеленый. Бар Весы, 100 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8:. Распределение Pax7 ± / ± MyoD в культурах клеток с Мононуклеированные в культурах с жевательная, двубрюшной и поднимающей Вели небных мышц (- С) День 4, 7 и 10 культур окрашивали антителами против Pax7 и MyoD иммунным. Общее количество клеток на основе общего количества ядер (DAPI). (D), количественное Данные Pax7 ± / ± MyoD челLs. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 9:. Миогенин иммунное окрашивание 4-й день, 7 и 10 культур окрашивали антителами против миогенин. (- Д) Характерные микрофотографии 4 дня и 7 культур от поднимающей Вели небных мышц. (Е) количество MyoG + ядер в поле микроскопа подсчитывают и выражают в процентах от общего количества ядер (DAPI). Количественная (F) Данные MyoG + клеток. DAPI: синий, миогенин: зеленый. Бар Весы, 100 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.

Рис. 10: тяжелой цепи миозина иммунное окрашивание 4-й день, 7 и 10 культур окрашивали антителами против тяжелой цепи миозина (MyHC). Представительства микрофотографии день 4, 7 и 10 культур от двубрюшной (DIG) мышцы. В 7-й день, небольшие мышечные трубки присутствуют в то время как 10-й день длинные и хорошо организованные мышечные трубки очевидны. Бар Весы, 200 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Видео 1:.. Myotube подергивание Примеры двух представительных полей с дергающихся мышечные трубки приведены за день 10 культур из двубрюшной мышцы Пожалуйста, нажмите здесь, чтобы посмотреть это видео.
Обсуждение
СК из различных branchiomeric мышц головы были изолированы друг от 9-недельных крыс Wistar и культивируют непосредственно на гель пятен внеклеточного матрикса без предварительного расширения и пассирования. После выделения клетки подсчитывали и высевали в то же плотности клеток. Для параллельного выделения трех различных мышц, этот метод занимает около 4 часов. Чтобы избежать загрязнения культуры, важным шагом является быстрая стирка в состоянии алкогольного 70% после рассечения мышц.
Во изоляции SC важно сократить мышечную ткань на мелкие кусочки (приблизительно 2 мм), но избежать слишком много фарша, так как это приведет к небольшим выходом клеток из-за повреждения клеток. Кроме того, продолжительность ферментативного расщепления должны быть тщательно проверены под микроскопом, чтобы избежать дальнейшего повреждения. Целью пищеварения для диссоциации мышечные волокна. Поскольку более 90% клеток экспрессируют изолированных Pax7, дальнейшую очистку не требуется (фиг.6-8).Это позволяет избежать дополнительных стадий очистки в других методах, таких как предварительная покрытия на непокрытых блюд 14,37,38, фракционирование на Перколла 39,40, или fluorescent- или магнитно сортировки клеток 41,43. Для растирания важно, чтобы вызвать сдвиг между фрагментами ткани и отверстие кончика пипетки, поскольку это позволяет механическое высвобождение ГКС. Если растирание с 10 мл пипеткой (внутри наконечника диаметр: 1 мм) трудно, в 5 мл (внутри наконечника диаметром 2 мм) пипетки можно использовать в первую очередь. Кроме того, стеклянные пипетки Пастера можно разрезать на нужный диаметр и быть использованы. Этот метод прост, эффективен и позволяет одновременно изолировать SC из различных образцов мышц.
Культуральные планшеты для СК также могут быть покрыты желатина или коллагена, но наши предыдущие исследования показывают, что внеклеточный матрикс геля гораздо лучше для поддержания миогенный потенциалом, чем коллаген 38. Внеклеточные пятна матрицы геляРазмер мм (10 мкл / Ø 2 мм или 20 мкл / Ø 4 мм) позволяет изучение пролиферации и дифференцировки СК с ограниченным числом клеток. Для анализа дифференциации от 8 до 20 раз меньше клетки требуются по сравнению с 24-луночный планшет (диаметр 15,6 мм) и примерно от 80 до 200 раз меньше по сравнению с 35 мм чашки Петри (диам 35 мм) 14,38.
Так внеклеточный матрикс геля стоит дорого, этот метод также более экономичным. Кроме того, камера скользит может быть заменен пластиковой крышкой скользит для дальнейшего снижения затрат. Для приготовления внеклеточного матрикса геля видит на ночь сушки в камере слайдов имеет важное значение. Как внеклеточные пятна матрицы гель прозрачны, необходимо отметить пятна на нижней стороне с помощью обратно освещения. Камеры горки фиксируются в чашке Петри для легкой манипуляции. Дальнейшее расширение клеточной культуры не является необходимым, который предлагает возможность изучать СКС СмальЛер мышцы или небольшие образцы мышц. Кроме того, например, для ПЦР или мышцы строит, если больше клеток необходимости, свежевыделенных СК сначала может быть расширена в Т75 колбы, как указано выше.
СК выделяют с помощью этого протокола, не подходят для дальнейшей очистки с помощью проточной цитометрии немедленно после изоляции. Переваривание проназой вызывает обширный переваривание поверхности антигены 14. Лошадиную сыворотку, и фетальной бычьей сыворотки, которые используются для культивирования клеток сначала должен быть надлежащим характеризуется перед выделением, так как различные номера партий дифференциально затронуты пролиферацию и дифференцировку миобластов.
В последние годы, есть растущий интерес в мышцах, полученных из жаберных дуг и головы мезодермы (например, мышцы глазного яблока) 24. Это было четко продемонстрировано, что голова и конечности мышцы обладают высокой различными свойствами. Жевательной мышцы от старых животных, кажется, вновьсохранения своего регенеративной способности в сравнении с конечностей мышц 25,26. СК от мышц глазного яблока, обладают надежной пролиферации и дифференцировки способность, сравнимую с СК из мышц головы и показать большую приживление потенциал, чем конечности мышцы SCs 24.
Состав распределение тип волокна и миозина варьирует среди групп мышц, а также между видами. Мышцы, возникающие из первой жаберной дуге у человека содержат как медленные и быстрые волокна (подтипы IIA и IIx), неонатальные миозины и миозины типичные для разработки сердечную мышцу. У грызунов эти мышцы содержат около 95% быстро волокон миозина IIA и IIB) 44-46. Исследования птиц мышц показывают, что СК из различных видов волокон мышц варьироваться в дифференциации мощности. СК из быстрых волокон только дифференцироваться в быстрых мышечных волокон, в то время как СК из медленных волокон могут дифференцироваться в обоих типов волокон 47. Кроме того, процент СК в быстром мышцыволокна ниже, чем в медленных мышечных волокон 48,49. Это указывает на то, что распределение волокна типа должны быть приняты во внимание при исследованиях на мышцы в области черепно. Подобно волчьей мышц неба, ППЖ у грызунов содержит почти исключительно быстро волокнами 50. По этой причине, СК от ППЖ подходят для доклинических исследований в области нёба.
Этот протокол открывает новые возможности для изучения SCs, полученные из branchiomeric мышц головы или других мелких мышц или мышц небольших образцов. Это будет способствовать развитию новых методов лечения для улучшения регенерации мышц челюстно-лицевой области в условиях, таких как волчья пасть, но и в других условий, влияющих на более мелкие мышцы.
Раскрытие информации
The authors have no conflicting interests to disclose.
Благодарности
This study was funded by a Mosaic grant (017.009.009) from The Netherlands Organization for Scientific Research (NWO) and a Start grant (S-13-167C) for young investigators from the AO Foundation. Z.Y.R is supported by the National Institutes of Health (grant # AG021566, AG035377, NS090051).
Материалы
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
Ссылки
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Erratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015. Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены