A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مثلي زرع والأجهزة الطرفية المناعي رصد خلية في نموذج II-45 مسانج الجرذ ورم الظهارة المتوسطة
In This Article
Summary
يتم تقديم جيل من نموذج الفئران مثلي ورم المتوسطة الخبيثة الجنبي بواسطة زرع II-45 خلايا ورم الظهارة المتوسطة في التجويف الجنبي من الفئران المختصة المناعي. وهناك طريقة تدفق cytometric لتحليل سبع مجموعات فرعية الخلايا المناعية في هذه الحيوانات من عينة الدم 25 ميكرولتر يوصف أيضا.
Abstract
تصاعد هائل من الاهتمام في العلاجات القائمة المناعي للسرطان مثل اللقاحات ومثبطات نقطة تفتيش المناعة، وزيادة فهم دور المكروية ورم في الاستجابة للعلاج، وتشير مجتمعة إلى الحاجة إلى نماذج مثلي في مأمن الحكومية المختصة لاختبار ما قبل السريرية من هذه العلاجات الجديدة. توضح هذه الورقة كيفية إنشاء نموذج الفئران المناعة المختصة مثلي ورم المتوسطة الخبيثة الجنبي. ومرتبك مراقبة تطور المرض في نماذج مثلي حسب الموقع الداخلي للأورام. لمراقبة طوليا تطور المرض وتأثيره على تعميم الخلايا المناعية في هذا المجال ونماذج الفئران أخرى من السرطان، أنبوب واحد قياس التدفق الخلوي مقايسة تتطلب سوى 25 ميكرولتر يوصف الدم الكامل. وهذا يوفر تقدير دقيق لسبعة المعلمات المناعي: مجموع الخلايا الليمفاوية، وحيدات والعدلات، فضلا عن مجموعات فرعية T خلايا CD4 و CD8، B-الخلايا والخلايا القاتلة الطبيعية. الغواصات مختلفةخدمات الاختبارات التربوية من هذه المعايير هي مفيدة في الظروف ونماذج مختلفة، مع العدلات إلى نسبة الخلايا اللمفاوية وجود أعظم فائدة لرصد تطور المرض في نموذج ورم الظهارة المتوسطة. تحليل تعميم مستويات الخلايا المناعية باستخدام هذه الطريقة أنبوب واحد يمكن أن تساعد أيضا في رصد استجابة للعلاجات تستند المناعة وفهم الآليات الأساسية التي أدت إلى نجاح أو فشل العلاج.
Introduction
ورم المتوسطة الخبيثة (MM) هو الورم الخبيث العدواني الذي ينشأ من الخلايا تحولت في الغشاء (ميسوثيليوم) أن خطوط الرئة وتجويف البطن والقلب والأعضاء التناسلية الداخلية، و هو الورم الرئيسي الأكثر شيوعا من تجويف الرئة أو غشاء الجنب 1،2 . التعرض لألياف الاسبستوس يمثل 80٪ من جميع MM، وبينما أدخلت حظر استخدام الأسبستوس منذ عقود في معظم البلدان الغربية، وقد ترك استخدام على نطاق واسع في المجتمع ارثا مميتا. وقد قدرت منظمة الصحة العالمية أن 107،000 شخص يموتون في العالم سنويا بسبب أمراض ذات صلة الأسبستوس، مع معدلات وفيات الاستمرار في زيادة. موجة حالات غير مهني جديدة تظهر أيضا، وهناك القليل من الفهم متى وعلى أي مستوى هذا سوف يصل إلى ذروته 3.
ويتم تشخيص معظم الناس مع MM في وقت متأخر عندما يمثل العلاج الكيميائي الجهازي أحد الخيارات الوحيدة القابلة للتطبيق 4. معظم effectiلقد تم تحديد العلاج الكيميائي و"معيار الرعاية" الحالي (بيميتريكسيد مع سيسبلاتين 5) قبل أكثر من 10 عاما. لكن فشل هذا العلاج أمر لا مفر منه وليس هناك أي خيارات سطر الثانية التي أثبتت جدواها، وترك المرضى الذين يعانون من التكهن قاتمة والبقاء على قيد الحياة وسيطة من أشهر 2 12 فقط. ولذلك، هناك حاجة غير الملباة ملحة لعلاجات أكثر فعالية. على الرغم من فحص عدد من العلاجات الجديدة في التجارب السريرية أيا منها لم يفض إلى تغييرات في الممارسة. ويرجع ذلك في جزء منه إلى انخفاض (5٪) نقل النتائج ما قبل السريرية، يؤديها بشكل عام في النماذج طعم أجنبي الماوس، لوضع السريرية 6-8. مثل هذه النماذج لا ألخص بأمانة الجوانب المعقدة للالمكروية الورم التي تحدث في أماكن غير الفسيولوجية، في كثير من الأحيان في غياب نظام المناعة يعمل 9.
نماذج مثلي مسانج خلق بيئة الورم بشكل ملحوظ أكثر واقعية من جتستخدم ommonly نماذج طعم أجنبي تحت الجلد كما تحدث الأورام في الموقع الفسيولوجية الصحيح مع سليمة الجهاز المناعي 10،11. حجم أكبر من الفئران يعزز استخدامه كنموذج المرض القوارض، وخاصة في الدراسات المخدرات حيث توجه الدم التسلسلي المطلوبة لتقييم الاستجابة للعلاج وسمية 12. وعلاوة على ذلك، في النماذج التي مراقبة تطور المرض صعب نظرا للموقع من الأورام (كما هو الحال في التجويف الجنبي)، والقدرة على مراقبة تطور المرض باستخدام العوامل الموجودة في التداول غير جذابة للغاية. يوصف توليد نموذج مثلي مسانج من ورم المتوسطة الجنبي استخدام الفئران في مأمن الحكومية المختصة. بالإضافة إلى ذلك، كما وصفت طريقة سهلة نسبيا وغير الغازية لرصد تطور المرض الجنبي عن طريق قياس تعميم الخلايا المناعية.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم تنفيذ جميع الإجراءات التي تنطوي على الحيوانات وفقا للتوصيات الواردة في قانون الأسترالي من الممارسة لرعاية واستخدام الحيوانات لأغراض علمية. وتمت الموافقة على بروتوكول لهذه الدراسة من قبل لجنة مستشفى رعاية الحيوان والأخلاق رويال نورث شور. وأبقى أنثى فيشر 344 الفئران (F344، 150-200 ز) في مرفق كيرنز، معهد Kolling تحت الظروف القياسية (12 ساعة ضوء / دورات الظلام وحرية الوصول إلى الغذاء والماء).
ملاحظة: يتم عرض مخطط تدفق لجميع الإجراءات التجريبية في الشكل 1.
1. إعداد الخلايا لزرع
- ثقافة ورم الظهارة المتوسطة الفئران II-45 خط الخلية (التي تعرف أيضا باسم IL-45؛ التي يجنيها مقدمة البريتوني الأسبستوس الكروسيدوليت) في RPMI 1640 (RPMI) وسائل الإعلام تستكمل مع المصل 10٪ بقري جنيني (FBS) وتنمو في الظروف القياسية (37 درجة C حاضنة مرطب مع CO 2 5٪). Maintaفي خلال الركض وزراعة الفرعية في حوالي الساعة 1:50 مرتين في الأسبوع في 75 سم 2 قارورة.
- إعداد الكواشف لزراعة الخلايا وقسامات الحارة عند 37 درجة مئوية. وتشمل الكواشف اللازمة المصل وسائل الإعلام الحرة RPMI (SFM)، RPMI مع 10٪ FBS، الفوسفات مخزنة المالحة (PBS) و 0.5٪ التربسين-EDTA.
- خلايا الثقافة لزرع ما يقرب من 70-80٪ التقاء. وهذا يضمن هم في مرحلة النمو الخطي.
- حصاد الخلايا عن طريق تجاهل وسائل الإعلام، وغسل مرة واحدة مع 5 مل من برنامج تلفزيوني العقيمة ثم إضافة 3 مل من 0.5٪ التربسين-EDTA.
- العودة إلى قوارير الحاضنة لمدة حوالي 5 دقائق حتى تصبح جميع الخلايا غير ملتصقة.
- مرة واحدة الخلايا غير ملتصقة، إضافة 3 مل من RPMI مع 10٪ FBS لإبطال نشاط التربسين. جمع والخلايا الطرد المركزي في 300 x ج لمدة 3 دقائق.
- يغسل بيليه خلية في 10 مل من SFM وأجهزة الطرد المركزي مرة أخرى في 300 x ج لمدة 3 دقائق.
- غسل الخلية بيليه مرة أخرى مع 10 مل من SFM وأجهزة الطرد المركزي على النحو الوارد أعلاه.
- resuspend الخلايا في 10 مل من SFM وإجراء تعداد خلايا باستخدام عدادة الكريات أو أجهزة مماثلة.
- تمييع الخلايا بحيث 100 ميكرولتر يحتوي على كمية من الخلايا المراد زرعها.
ملاحظة: وقد تجلى نمو الورم بجرعة منخفضة تصل إلى 100 خلية في 100 ميكرولتر لكن جرعة قياسية هو 500،000 الخلايا في 100 ميكرولتر. - إعداد خلايا كافية في وسائل الإعلام لعدد من الفئران إلى أن زرع (أي 100 ميكرولتر / فأر)، بالإضافة إلى 0.5 مل على الأقل خارج للتعويض عن الخسائر من فتيلة وحجم القتلى من الإبرة.
- إعداد كافية SFM (بدون الخلايا) ليتم زرعها في الفئران التحكم (أي 100 ميكرولتر / فأر)، بالإضافة إلى 0.5 مل على الأقل خارج.
ملاحظة: الخلايا والإدارة المستدامة للغابات هي الآن جاهزة للزرع. وينبغي أن تبقى عند 37 درجة مئوية، وزرعها في غضون 2 ساعة الحصاد للمحافظة على سلامة.
2. في الجسم الحي زرع الخلايا
- وضع الفئران F344 (> 13 أسبوعا من العمر) في غرفة الاستقراء وتخدير باستخدام استنشاق الأيزوفلورين 1.4٪ (أو الطريقة المستخدمة في المنشأة). وبمجرد أن الفئران يبدو أن الخطوة نائما فإنه من غرفة إلى مخروط الأنف (1.4٪ الأيزوفلورين المتدفقة)، وضعه على ظهرها مع الصدر مواجهة (عرض البطني). وهذا يسمح للأجهزة الداخلية ليستقر بعيدا عن تجويف الصدر. تحقق من ردود الفعل وفقا لبروتوكولات مؤسسية لضمان الفئران هو تخدير كامل.
- حلق الصحيحة الناحية الصدرية (الصدر) منطقة لإزالة الفراء.
- تنظيف المنطقة حليق مع 80٪ ت / ت الإيثانول.
- تحديد موقع الحقن: على الجانب الأيسر، العثور على الغدة 2ND تبدأ الجمجمة. موقع الحقن هو 0.5 سم الأقرب إلى ذلك، في فترة ما بين 3 و ضلع 4TH من نهاية الذيلية من القفص الصدري. (الشكل 2A).
- بلطف مزيج الخلايا II-45 ل resuspend. رسم ببطء تعليق الخلية (أو SFM بالنسبة للفئران السيطرة) في 1 مل &# 160؛ حقنة بدون إبرة المرفقة. إذا تم إرفاق إبرة ليصل الرسم الخلايا هناك احتمال للخلايا أن تنمو على طول الخط حقن الإبرة. إرفاق 23G س 1¼ الإبرة. رئيس الإبرة وإزالة أي فقاعات الهواء.
- مرة واحدة وتستعد الحقنة والإبرة، ووضع 20 ملم طولا و 5 مم فاصل على رمح الإبرة. ويستخدم هذا لمنع الإبرة من اختراق عميقا جدا في التجويف الجنبي خلال الحقن. حوالي 5 ملم 12 ملم من إبرة يتعرض كافية لاختراق من خلال الأضلاع دون الإضرار أي أجهزة.
- إدراج ببطء الإبرة بين الضلوع، ووضع مرة أخرى على حقنة لضمان لم يتم ثقب وعاء دموي (يجب أن تظهر أية الدم في حقنة) ثم تضخ 100 خلية ميكرولتر أو SFM. (الشكل 2B).
- إزالة الإبرة ولفة بلطف الفئران من جانب إلى آخر لانتشار الخلايا في تجويف الصدر.
- وضع الفئران في قفص وتحقق للانتعاش. عشروينبغي أن تكون الفئران ه مستيقظا في حدود 1 دقيقة، وبدأت في التحرك.
- كرر لكل الفئران باستخدام إبرة جديدة. وإعادة استخدام نفس الإبرة يؤدي إلى نمو الخلايا على طول الخط حقن الإبرة.
- رصد رفاه الحيوانات يوميا.
- الموت ببطء الحيوانات في النهاية تعريف أخلاقيا كما هو محكوم من قبل لجنة الأخلاق الحيوان المؤسسية. كانت النهاية الأخلاقية للفئران في هذه التجارب فقدان الوزن أكبر من 10٪ أو صعوبة في التنفس.
3. الذيل الوريد جمع الدم
- إذا الدم التي سيتم جمعها فورا بعد زرع الخلايا، والحفاظ على الفئران تخدير. إذا أخذ عينات الدم في نقطة زمنية أخرى، تخدير الفئران باستخدام 1.4٪ استنشاق الأيزوفلورين. تحقق من ردود الفعل وفقا لبروتوكولات مؤسسية لضمان الفئران ومخدرة تماما.
- وضع فأر على جانبها وتحديد الوريد الذيل الأفقي.
- تعقيم الذيل مع 80٪ من الإيثانول وتسمية 0.5 مل EDTA جollection أنبوب.
- لجمع الدم، تبدأ دائما في نهاية الذيلية من الذيل (حوالي ثلث الطريق على طول). وهذا يسمح محاولات أخرى أقرب إلى نهاية الجمجمة من الذيل في حالة المحاولة الأولى غير ناجحة. أبدا إعادة تشكيل caudally لأن ذلك يمكن أن يسبب تجلط الدم.
- وضع مواز 23G س 1¼ الإبرة إلى الوريد الجانبي وأدخلها في الوريد بزاوية حادة حتى يخرقها حوالي 10 مم (الشكل 3A).
- ملاحظة: إذا تم ثقب الوريد بنجاح الدم سيكون مرئيا في نهاية مرفق من الإبرة (الشكل 3B).
- وهناك قطرة دم تتشكل على الذيل في الموقع من ثقب إبرة. جمع هذا الدم باستخدام ماصة ونقل إلى المسمى 0.5 مل (أو أصغر) أنبوب جمع EDTA. لفحص الخلايا المناعية 25 ميكرولتر كافية. تطبيق الشاش مع الضغط على ثقب الموقع حتى يتوقف النزيف.
- نفض الغبار الأنبوب الدم لخلط الدم وEDTA إلى prتخثر الحدث. الحفاظ على الوقت بين جمع الدم والاختلاط مع EDTA قصيرة قدر الإمكان لمنع التخثر.
- عند جمع الدم من عدة متجر الفئران عينات EDTA الدم في رف في RT حتى التحليل. الدم العملية في غضون 2 ساعة من جمعها.
4. إعداد نموذج لالمناعي التنميط الخلية باستخدام أسلوب يستند الخرزة
ملاحظة: يعتمد هذا الأسلوب على استخدام منصة واحدة متاحة تجاريا أنابيب العد المطلقة التي لديها عدد معروف من الخرز لكل عينة. هذه الأنابيب تحتوي على كريات مجفف بالتجميد التي تذوب أثناء إعداد العينات، والإفراج عن الخرز. وfluorescently المسمى الخرز والمعزولة على السكان حبة، التهم المطلقة يمكن حساب.
- ضمان عينة الدم الكامل EDTA مختلطة جيدا بوضعه في خلاط دوارة بطيئة لعدة دقائق. تسمية أنبوب واحد العد المطلق لكل عينة. A بيليه يحتوي على حبات يجب أن تكون مرئية تحت رانه معدن حامل حبة في الجزء السفلي من الأنبوب.
- نقل 25 ميكرولتر من EDTA الدم كله في أنبوب العد المطلق المسمى. سوف بيليه حبة حل على إضافة الدم.
- إلى كل أنبوب إضافة 20 ميكرولتر من مكافحة الفئران كوكتيل T / B / الطبيعية القاتلة (NK) خلية، 10 ميكرولتر من مكافحة الفئران CD8a PE، 10 ميكرولتر من مكافحة الفئران CD4 (المجال 1) FITC و 10 ميكرولتر من مكافحة الفئران CD45 PE / Cy7 (الشكل 4A). يتم تعريف Fluorophores في الجدول 1.
- أجهزة الطرد المركزي لفترة وجيزة أنبوب (300 x ج) لضمان الأجسام المضادة والخلايا في الجزء السفلي من الأنبوب وليس تمسك الجانب من الأنبوب. دوامة لخلط واحتضان لمدة 15 دقيقة في RT.
- ليز خلايا الدم الحمراء إضافة 400 ميكرولتر من 10 ملي تريس، 0.15 M كلوريد الأمونيوم العازلة (7.5 درجة الحموضة) ودوامة لخلط. تحلل اكتمال عندما تظهر العينة شفافة وليس غائم (أرقام 4B و C). الفشل في ليز العينة تماما سيؤدي إلى زيادةد الخلفية ورفعت زورا التهم عند تحليل التدفق الخلوي.
5. تدفق Cytometric تجهيز العينات
ملاحظة: إجراء على لون 4 تدفق عداد الكريات.
- فتح البرنامج في وضع الاستحواذ وقالب جديد مع 8 قطع كما هو مبين في الشكل (5).
- ضبط إعدادات أداة لتلك المدرجة في الجدول 1 وانشاء بوابة R1 (FITC [FL-1] مقابل APC [FL-4])، الشكل 5Ai) لحساب حبات الفلورسنت. بوابات أخرى ليست هامة في هذه المرحلة الاستحواذ ولكن سوف تكون هناك حاجة للتحليل. حبات العد المطلقة المستخدمة في هذا البروتوكول تحتوي على الأصباغ الفلورية، ويمكن الكشف في أي قناة على الرغم من هم الأضعف في القناة الزرقاء.
- باستخدام عينة السيطرة الدم مستعدة، دوامة ثم تحميل على الكريات وتشغيلها في سرعة منخفضة (12 ميكرولتر / دقيقة) على وضع الإعداد حتى أبواب الحصول على البيانات يمكن تعديلها.
- تعيين الاستحواذ لجمع 10000 الأحداث في بوابة حبة R1.
- إعداد مجلد لتسجيل البيانات وتحديد رقم الملف وتسمية ملف عينة في القائمة الاستحواذ.
- تحميل عينة لتحليلها على الكريات وضبط معدل تدفق إلى متوسطة (35 ميكرولتر / دقيقة). تشغيل كل عينة في نفس معدل التدفق. قد تحتاج معدل التدفق إلى أن تختلف إلى الأقل (12 ميكرولتر / دقيقة) أو عالية (60 ميكرولتر / دقيقة)، ولكن المتوسط هو المناسب عموما. وعلى هذا المعدل فإنه يأخذ حوالي 90-120 ثانية للحصول على 10000 الأحداث حبة لكل عينة.
- مرة واحدة يتم تحميل العينة مشاهدة المؤامرات مبعثر لجعل الأحداث على يقين هي التي تظهر في بوابة حبة R1. في البداية يمكن أن يكون هناك نوع من عدم الاستقرار في الضغط عينة مما تسبب الانجراف في مؤامرات التشرذم. انتظر هذا لتحقيق الاستقرار.
- مرة واحدة استقرت، انقر على اكتساب والسماح عينة لتشغيل. بمجرد الانتهاء من الكريات الحصول على 10000 حبة الأحداث في R1 في الكريات سيتوقف اكتساب وحفظ كافة البيانات.
- إزالة عينة وتجاهل تدفق تويكون. والكريات جاهز الآن للعينة القادمة. تشغيل جميع العينات ومن ثم المضي قدما إلى وضع التحليل.
6. المناعي تحليل الخلية
ملاحظة: يتم استخدام استراتيجيات المحاصرة ومنطقية الجبر لتعريف كل السكان الخلية. الجبر البولي هي طريقة التحليل والمنطق القائم الذي يسمح لعمليات متعددة في تعريف واحد. برنامج تحليل الكريات تدفق (على سبيل المثال، BD CELLQuest) يسمح لاستخدام الجبر البولي. تستخدم معادلات لحساب بنشاط من أجل تفاعل سلبي كبير أن تساعد في تحديد الخلية لتعريف كل السكان الخلية بشكل أكثر تحديدا. وتستخدم '' المناطق لتحديد "البوابة". مناطق تحدد مساحة الأبعاد 2 في حين البوابات يمكن أن تتكون من مناطق عديدة متصلة بواسطة مشغلي جبري (+، *، -، المحدد في الجدول 2).
- التبديل البرنامج لوضع التحليل. يجب أن تتولد قالب تحليل لمباراة الشكل 5 مع المؤامرات وبوابات مبين.
- تحليل كل ملف على حدة (أي كل عينة الفردية) على حدة. انشاء بوابات R1 حتى R9 ثم قم بإعداد الخوارزميات لكل نوع من الخلايا كما هو محدد في الجدول 2 (كما هو موضح أيضا في الشكل 5).
- استخدام العداد إحصاءات خلية لحساب سكان الخلية الفردية التي تحددها البوابات والخوارزميات (الجدول 2 والشكل 5). وخوارزميات ضبط أعداد الخلايا تلقائيا في عداد إحصاءات الخلية.
- حساب مجموعات فرعية الخلية باستخدام المعادلة التالية:
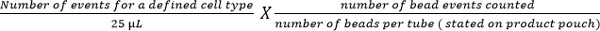
ملاحظة: عدد من الأحداث خلية عدها (على سبيل المثال، CD4 T الأحداث الخلية) يتم تعداد باستخدام المعادلة المذكورة أعلاه لإعطاء عدد الخلايا في ميكرولتر من الدم. وتظهر الأمثلة في الشكل (5).
Access restricted. Please log in or start a trial to view this content.
النتائج
نتج عن الطريقة المستخدمة في هذه الورقة لتوليد نموذج مثلي من ورم المتوسطة الجنبي باستخدام II-45 الخلايا في الحيوانات الخضوع لورم الظهارة المتوسطة في إطار زمني استنساخه والسريع، مع عدم وجود الفئران تموت بسبب طريقة الزرع. قررت المعايرة من عدد الخلايا المزروعة التي 1X 10
Access restricted. Please log in or start a trial to view this content.
Discussion
تفاصيل هذه الورقة طريقة لتوليد نموذج مثلي مسانج الفئران من ورم المتوسطة الجنبي وطريقة بسيطة لرصد تطور المرض من خلال اخذ عينات من الدم الطولية.
تم تطوير نموذج II-45 عن طريق تعريض فيشر 344 الفئران لألياف الاسبستوس 13. على الرغم من ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
References
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved