需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在II-45同基因大鼠模型间皮瘤原位移植和外周免疫细胞监视
摘要
胸膜恶性间皮瘤由II-45间皮瘤细胞进入胸膜免疫活性大鼠腔植入的原位大鼠模型的产生提出。甲流式细胞法分析从25微升血样在这些动物7免疫细胞亚群也被描述。
摘要
在免疫为基础的治疗的癌症如疫苗和免疫检查点抑制剂,和在治疗响应肿瘤微环境中的作用的进一步了解感兴趣的巨大热潮,共同指向需要免疫能干正位模型的临床前试验这些新的治疗方法。本文演示了如何建立胸膜恶性间皮瘤原位免疫能力的动物模型。在原位模型监测疾病进展是由肿瘤的内部位置混淆。纵向监测疾病的进展及其对循环免疫细胞在这方面和癌症等大鼠模型的效果,单管流式细胞术检测只需要25全血中描述微升。这提供了七个免疫指标准确定量:总淋巴细胞,单核细胞和嗜中性粒细胞,以及T细胞亚群CD4和CD8,B细胞和自然杀伤细胞。不同的潜艇这些参数的ETS在不同的情况和模型有用,与中性粒细胞淋巴细胞比率具有用于监测疾病进程中的间皮瘤模型最大的效用。分析循环使用这种单管方法还可以协助监测响应免疫为基础的治疗和了解,导致治疗成功或失败的根本机制免疫细胞的水平。
引言
恶性间皮瘤(MM)是一种侵袭性的恶性肿瘤其来自转化的细胞中的膜(间皮),该系肺和腹腔,心脏和内部繁殖器官和是肺腔或胸膜1,2的最常见的原发性肿瘤。暴露于石棉纤维占80%,所有的MM,虽然对石棉的使用禁令推出几十年前,在大多数西方国家,其社会各界的广泛使用已经留下了一个致命的遗产。据世界卫生组织估计,107,000名员工每年死于与石棉有关的疾病,与死亡率持续增加。一种新的非职业入射波也正在和有何时,在什么水平,这将达到峰值3知之甚少。
大多数人的MM被确诊晚了,当全身化疗代表的唯一可行的选择4之一。最effecti已经化疗(顺铂5培美曲塞在一起)当前的"护理标准"被认定在10年前。但是失败这种治疗是不可避免的,也没有成熟的第二行选项,使患者的一个严峻的预后只有12 个月2,中位生存期。因此,目前迫切未满足的需要更有效的治疗方法。尽管一批临床试验中的新疗法的检查没有导致的变化在实际中。这是部分由于低5%转移的临床前的结果,一般在异种移植小鼠模型中进行,给临床设定6-8。这类模型不忠实概括在非生理位置中发生的肿瘤微环境的复杂的方面,经常在没有免疫系统功能9。
同源原位模型创建比C一显著更现实的肿瘤环境ommonly使用皮下异种移植模型作为出现在正确的生理部位有一个完整的免疫系统10,11的肿瘤。的大鼠的尺寸较大增强其作为一种啮齿动物疾病模型的使用,尤其是在药物研究,其中串行抽血需要来评估治疗反应和毒性12。此外,在模型中,监测疾病进展是困难的,因为在肿瘤(如在胸膜腔)的位置,用在血液循环中发现的因素是非常有吸引力的,监测疾病进展的能力。使用免疫能干大鼠胸膜间皮瘤的同基因原位模型的生成进行说明。此外,一种简单的和相对非侵入性的方法,通过测量循环免疫细胞监测胸膜疾病进展还描述。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有涉及动物的程序进行,根据实践中的动物的护理和使用用于科学目的的澳大利亚准则的建议。该协议为这项研究是经皇家北岸医院的动物护理和伦理委员会。女菲舍尔344大鼠(F344,150-200克)保持在卡恩斯设施,Kolling研究所标准条件(12小时亮/暗周期和自由获得食物和水)下。
注意:一个流程图,用于所有实验程序是在图1。
1.准备细胞植入
- 培养大鼠间皮瘤Ⅱ-45细胞系(也称为IL-45;由腹膜引入青石棉的衍生)的RPMI 1640(RPMI)培养基补充有10%胎牛血清(FBS)和生长在标准条件(37° Ç湿润培养箱5%的CO 2)。 Mainta在通过传代和传代培养在约1:50每周两次在75厘米2烧瓶中。
- 制备试剂的细胞培养和温暖的等分试样在37℃。所需试剂包括无血清RPMI培养基(SFM),RPMI有10%FBS,磷酸盐缓冲盐水(PBS)和0.5%胰蛋白酶-EDTA。
- 培养的细胞植入到约70-80%汇合。这保证它们在线性增长阶段。
- 收获细胞通过丢弃媒体,用5ml无菌PBS洗涤一次,然后加入3毫升0.5%胰蛋白酶-EDTA。
- 返回烧瓶培养箱中约23分钟,直到所有的细胞变成非粘附。
- 一旦细胞是非粘附的,加入3 ml的的RPMI有10%FBS以灭活胰蛋白酶。收集和离心细胞,在300×g离心3分钟。
- 在300×g离心再次在10ml SFM和离心机的洗涤细胞沉淀3分钟。
- 洗涤细胞沉淀再次用10ml的SFM的离心如上。
- 悬浮细胞在10ml的SFM,并执行使用血细胞计数器或类似仪器细胞计数。
- 稀释细胞,使100微升含有细胞被植入的量。
注意:肿瘤生长已被证明在一个剂量低至100个细胞在100μl但一个标准剂量是500,000个细胞在100μl。 - 在媒体准备足够细胞被植入大鼠的数量(即,将100μl/鼠),再加上至少0.5 ml的额外以补偿从引发和针的死体积损失。
- 准备足够的SFM(无细胞)为植入对照大鼠(即,将100μl/鼠),再加上至少0.5 ml的额外。
注:细胞和SFM现在准备植入。他们应保持在37℃,并植入2小时内的收获,保持活力。
2.在体内植入细胞
- 放置F344大鼠(> 13周龄)插入感应腔和麻醉用1.4%异氟烷吸入(或所使用的方法中的设施)。一旦老鼠似乎是睡着了移动它从室到鼻锥(含1.4%异氟醚流),将其放置在其背部与胸部朝上(腹面)。这使内脏解决远离胸腔。请根据机构的协议来保证大鼠reflexes被完全麻醉。
- 剃须正确的区域选择性costalis(胸)区域去除毛发。
- 清洗,用80%V / V乙醇的剃区域。
- 确定注射部位:在右侧,找到第二压盖开始颅。注射部位是0.5厘米近端于此,在从肋笼的尾端的第三和第四肋之间。 (图2A)。
- 轻轻地混合II-45细胞悬浮。慢慢绘制细胞悬浮液(或SFM为对照大鼠)到1毫升#160;注射器没有附加针。如果一个针安装为细胞的图纸上存在对细胞沿着针注入线生长的潜力。附加23G x 1.25针。总理针,并删除任何气泡。
- 一旦注射器和针头都准备,放置20毫米长,直径5毫米间隔件在针轴上。这是用来防止针穿透过深地进入胸膜腔的注射期间。大约5毫米-12毫米暴露针足以通过的肋渗透而不损坏任何器官。
- 慢慢地插入肋骨之间的针,抽回注射器,以确保血管尚未刺破(没血了应该出现在注射器),然后注入100μl的细胞或SFM。 (图2B)。
- 卸下针并轻轻地滚动鼠到另一边蔓延细胞的胸腔。
- 将老鼠进笼子,并检查恢复。钍Ë老鼠应该是在1分钟内清醒并开始走动。
- 重复使用新针头每只大鼠。重复使用相同的针将导致细胞生长沿着针的注入线。
- 每天监视福祉的动物。
- 动物实施安乐死在道义上定义端点作为管辖机构动物伦理委员会。对于大鼠在这些实验伦理终点是重量损失大于10%或呼吸困难。
3.尾静脉采血
- 如果血液要立即采集后的细胞植入,保持麻醉的老鼠。如果采血在其他时间点,麻醉用异氟醚1.4%的老鼠。请根据机构的协议来保证大鼠reflexes完全麻醉。
- 将大鼠倒向一侧,并找到一个侧尾静脉。
- 消毒用80%乙醇的尾巴和标签0.5ml的EDTAÇollection管。
- 为了收集血液,总是从尾巴的尾端(的方式大约有三分之一沿)。这允许进一步尝试更靠近尾部的颅端的情况下的第一次尝试是不成功的。千万不要重新取样尾部,因为这可能会导致血液凝块。
- 定位一个23G x 1.25针平行于侧静脉和它,所以它渗透约10毫米(图3A)滑入静脉以小角度。
- 注意:如果静脉已成功刺破血液将在针(图3B)的连接端可见。
- 一滴血将形成在尾在针穿刺部位。收集用吸管和转移到标记的0.5毫升(或更小)的EDTA收集管这血。对于免疫细胞测定25微升是足够的。应用纱布的压力,穿刺部位,直到出血停止。
- 弗里克管血混合血液和EDTA公关事件凝固。保持采血并与EDTA作短越好,以防止凝血混合之间的时间。
- 当在室温采集血液从多个大鼠店EDTA-血样在机架中直至分析。在2个小时的采集过程中血液。
4.样品制备免疫细胞剖析使用基于微珠的方法
注意:此单一平台方法依赖于使用具有珠粒每个样品已知数市售绝对计数管中。这些管包含冻干丸粒样品制备过程中溶解,释放珠粒。珠荧光标记和通过门控的珠子群,绝对计数可以计算出来。
- 确保EDTA全血样品是通过将其放置在一个缓慢旋转混合器几分钟充分混合。标签1的绝对计数管每个样品。一份载有珠颗粒应为t下方可见在管的底部他金属珠保持器。
- 转移25微升EDTA全血成标记的绝对计数管。珠颗粒会溶解在加血。
- 向每个试管添加20微升抗大鼠T / B /天然杀伤(NK)细胞的鸡尾酒,将10μl抗大鼠CD8A的PE,10微升抗大鼠CD4(域1)的FITC和10μl抗大鼠的CD45 PE / Cy7的(图4A)。荧光团在表1中所定义。
- 离心反应管短暂地(300×g离心),以确保所述的抗体和细胞在管的底部,而不是粘在管的一侧。涡旋混合并孵育15分钟,在RT。
- 以裂解红血细胞中添加的10毫摩尔Tris 400微升,0.15M氯化铵缓冲液(pH 7.5)和涡旋以混合。裂解完成时,样品出现半透明的,不混浊( 图4B和C)。未溶解的样品完全会导致增加研发背景和当流动分析仪假性上升计数。
样品5.流式细胞仪处理
注意:请在四色流式细胞仪。
- 打开采集模式和与8描述一个新的模板的软件,如图5所描绘。
- 调整仪器设置为表1中列出并设置栅极R1(FITC [FL - 1] 与 APC [FL - 4]), 图5AI)计数荧光珠。其他的门都没有在此次收购阶段一样重要,但将需要进行分析。在这个协议中使用的绝对计数的珠含有荧光染料,可在任何通道被检测到,虽然是最弱的蓝色通道。
- 使用准备好的控制血液样品,涡旋,然后加载到流式细胞仪和以低速(12微升/分钟)上设置模式运行,以便数据采集门可以调整。
- 将收购聚集在R1珠门10,000个事件。
- 建立一个文件夹来记录数据,并设置文件号和标签示例文件中采集菜单。
- 加载待分析样品到流式细胞仪,设置流速介质(35微升/分钟)。运行在相同的流速各样品中。流速,可能需要改变,以低(12微升/分钟)或高(60微升/分钟),但介质一般是合适的。以这样的速度,大约需要90至120秒,以获得万珠事件每个样品。
- 一旦样品被加载观看散点图以确保事件出现在R 1胎圈栅极。最初可存在于样品压力引起的漂移在散点图有些不稳定。等待这个稳定。
- 一旦稳定下来,点击获取,并允许样品运行。一旦流式细胞仪已完成收购R1万珠事件流式细胞仪将停止采集并保存所有的数据。
- 取下样品和废弃流涂可以。细胞仪现在准备下一个样品。运行所有的样品,然后进行分析模式。
6.免疫细胞分析
注意:门控策略和布尔代数被用来定义每个细胞群。布尔代数是一个基于逻辑分析方法,其允许在一个单一的定义多个操作。流式细胞仪的分析软件(例如,BD CELLQUEST)允许采用布尔代数。该公式用于积极地占显着的负反应性,其有助于限定细胞更具体标识每个细胞群。 '区域'被用来定义一个"门"。区域限定一个2维空间,而栅极可以通过代数运算符连接众多的区域组成(+,* - , 在表2中定义)。
- 切换软件来分析模式。分析模板应产生匹配图5示出与情节和大门。
- 分析每个单独的文件( 即,每个样品)分开。设置栅极R1至到R9和然后设置算法对于每个细胞类型如表2中所定义(也示于图5)。
- 使用电池的统计数据计数器来计算通过门和算法( 表2和图5)中定义的单个细胞群。该算法将在小区统计计数器自动调节细胞的数量。
- 使用下列公式计算细胞亚群:
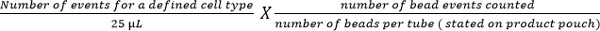
注意:所计数的细胞数的事件(例如,CD4 + T细胞的事件)被利用上述方程,得到每微升血液细胞数计数。例子示于图5。
Access restricted. Please log in or start a trial to view this content.
结果
在本文用于使用II-45细胞胸膜间皮瘤的原位模型的生成的方法,导致动物屈服于间皮瘤可再现的和快速的时间内,没有大鼠垂死由于植入方法。细胞植入的数量的滴定中确定1×10 3个细胞是需要的充分渗透模型(100%的植入)的最小数目。的不同数目的细胞植入到大鼠的改变疾病的时间过程中没有出现影响疾病的严重程度。动物接受1×10 3,1×10 4和5×10 5个细胞40天,30和...
Access restricted. Please log in or start a trial to view this content.
讨论
本文详述了胸膜间皮瘤大鼠的同源原位模型以及用于通过纵向血液取样监测疾病进展的简单方法的产生的方法。
在II-45模型通过将菲舍尔344大鼠石棉纤维13开发的。虽然这种曝光表示主机石棉免疫系统的相互作用的真实动态间皮瘤发病机制,它具有长的滞后时间(以年来产生),并可能是危险的,研究人员由于可能暴露于石棉纤维。 Ⅱ-45细胞的原位移植进入胸膜动物?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
参考文献
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。