Method Article
تطبيقات أحادية التحقيق: وسائل التصوير الطيفي والتحليل خلية واحدة في ظل الظروف المحيطة
In This Article
Summary
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Abstract
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Introduction
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
Protocol
استخدام الحيوان ورعايته ينبغي أن تلتزم دليل المعاهد الوطنية للصحة للرعاية واستخدام الحيوانات المختبرية التالية بروتوكولات مراجعتها والموافقة عليها من قبل لجنة رعاية واستخدام الحيوان المؤسسي (IACUC). وقدمت عينات الأنسجة الماوس عن طريق متعاون الدكتور Chuanbin ماو.
1. ماوس الأنسجة إعداد القسم
- وضع جهاز الماوس كاملة من الفائدة (الدماغ والكلى والكبد، وغيرها) إلى مركز صغير من البلاستيك جيدا (على سبيل المثال، 12-جيدا لوحة الثقافة الخلية)، ويغرق في الأنسجة تضمين مركب يصل إلى حوالي 10 مم الارتفاع. تأكد من وجود أي فقاعة تتشكل في الأنسجة تضمين المجمع والتي يتم وضع الجهاز في الاتجاه المطلوب (أي السهمي، الاكليلية، وما إلى ذلك).
- المكان على الفور الأنسجة في النيتروجين السائل لتجميد فلاش. للتخزين على المدى الطويل، وتخزين العينات المجمدة في الفريزر -80 درجة مئوية.
- خذ جهاز الماوس المجمدة وذوبان الجليد إلى -15 درجة مئوية في من درجات الحرارةإعادة cryomicrotome التي تسيطر عليها.
- الأنسجة آمنة على قاعدة من الصلب مع ما يقرب من 500 ميكرولتر من الأنسجة تضمين المجمع وتضع على وcryomicrotome باجتزاء جبل بحيث يتم تقديم التوجه باجتزاء المطلوب إلى سكين.
- قسم الأنسجة إلى سماكة 12 ميكرون. وضع شرائح الأنسجة مقطوع على الشرائح المجهر البولي وتترك لتجف لمدة 30 دقيقة في درجة حرارة الغرفة. للتخزين على المدى الطويل، وتخزين الشريحة المجمدة في الفريزر -80 درجة مئوية.
2. خلية ثقافة
ملاحظة: تم تنفيذ خلية ثقافة في مجلس الوزراء السلامة البيولوجية (السلامة الأحيائية المستوى الثاني) تحت ظروف معقمة. تم استخدام خط الخلية هيلا كنظام نموذج، وكان مثقف الخلايا في مستنبت الكامل مع البروتوكولات التقليدية التالية:
- الكواشف الدافئة (أي التربسين والفوسفات مخزنة المالحة (PBS)، وزراعة الخلايا المتوسطة) إلى 37 درجة مئوية.
ملاحظة: يحتوي مستنبت الخلية سا غير العضويةLTS، والأحماض الأمينية، والفيتامينات، وغيرها. للحصول على قائمة كاملة من المكونات، الرجوع إلى صياغة من الشركة المصنعة. - الحصول على عينة الخلية (على سبيل المثال، 1 مل تعليق خلية هيلا) وإضافته إلى 9 مل من اكتمال خلية ثقافة المتوسط في 10 سم لوحة ثقافة الخلية القياسية. عدد الخلايا الأولية حوالي 0.5 × 10 6 خلية / مل. إبقاء الخلايا في الثقافة عند 37 درجة مئوية مع 5٪ CO 2 لمدة 2-3 أيام حتى يتم تغطية سطح المتزايد في 70-80٪ على لوحة ثقافة الخلية. سجل عدد الخلايا مرور كل جولة متتالية.
- أداء الركض الخلايا (أي خلية تقسيم) في لوحة الثقافة الخلية.
- نضح المتوسطة النمو، واستخدام 5 مل من برنامج تلفزيوني 1X لشطف الخلايا. إزالة PBS باستخدام طرف طموح العقيمة، واحتضان الخلايا مع 2.5 مل من التربسين (0.25٪) ل~ 5 دقائق عند 37 درجة مئوية لفصل الخلايا من لوحة الثقافة.
ملاحظة: الساعة العلاج التربسين الفعلي يحتاج إلى أن يكون الأمثل وفقا لالم Ù التربسين محدداشترى ط م من الشركة المصنعة. وقت العلاج غير كاف يترك الخلايا التي تعلق على لوحة، في حين أن العلاج المفرطة تؤدي إلى موت الخلايا. - وقف النشاط التربسين بإضافة 7.5 مل الكامل مستنبت الخلية، ثم موحد resuspend الخلايا (إجمالي حجم 10 مل). استخدام تعليق خلية للثقافة (الخطوة 2.2) أو إعداد عينات SCMS (الخطوة 2.4).
- نضح المتوسطة النمو، واستخدام 5 مل من برنامج تلفزيوني 1X لشطف الخلايا. إزالة PBS باستخدام طرف طموح العقيمة، واحتضان الخلايا مع 2.5 مل من التربسين (0.25٪) ل~ 5 دقائق عند 37 درجة مئوية لفصل الخلايا من لوحة الثقافة.
- إعداد عينات من الخلايا لإجراء التجارب SCMS.
- ضع الفردية الشرائح غطاء الصغير في لوحة 12-جيدا، وإضافة مستنبت 1.8 مل الخلية و 0.2 مل من تعليق خلية في البئر.
- المزيج بلطف خلايا مع الإثارة خفيف من لوحة، واحتضان في 5٪ CO 2 بيئة عند 37 درجة مئوية لمدة 24 ساعة ~. لإجراء العلاج من تعاطي المخدرات إلى الخلايا المستزرعة، إضافة محلول مركب المخدرات (على سبيل المثال، في DMSO (سلفوكسيد ثنائي ميثيل)) في 12-جيدا لوحة الثقافة الخلية.
ملاحظة: تركيز الدواء النهائية (على سبيل المثال، 10 نانومتر، 100 نانومتر، 1 ميكرومتر، و 10 ميكرومتر) و روتتنوع الوقت reatment (على سبيل المثال، 4 ساعات) وفقا للغرض المحدد من الدراسات. يتم إرفاق الخلايا إلى شرائح غطاء الصغيرة وعلى استعداد للتجارب CSMS (الخطوة 6).
3. واحد مسبار تلفيق
- وضع مزدوج الجوف الكوارتز أنابيب (القطر الداخلي (ID) 127 ميكرون، القطر الخارجي (OD) 500 ميكرون) في الليزر micropipette مجتذب وسحب الكوارتز إبرة مزدوجة الجوف. استخدام المعلمات التالية كنقاط انطلاق: الحرارة = 400، سن الفيل = 3، فيل = 80، ديل = 150، وبول = 250 (جميع الوحدات هي وحدات الشركة المصنعة). ضمان سحب الإبرة المزدوجة الجوف الكوارتز لديه معلومات سرية مدبب لخصائص التحقيق الأمثل. قطع رأس انسحبت حتى لا يكون هناك ~ 5 مم طويل من unpulled ثنائي حمل الشعرية الكوارتز يسارا عند الطرف الآخر.
ملاحظة: يجب أن يكون الأمثل المعلمات الفعلية للمجتذب الليزر وفقا لشروط محددة من الصك. - قطع جزء ~ 80 ملم من الشعرية السيليكا تنصهر (ID 40 ميكرون، OD. 105 ميكرون) مثل المذيبات تقدم الشعرية، وأدخله في تجويف واحد في نهاية مسطحة من الكوارتز إبرة مزدوجة الجوف.
- قطع جزء مم ~ 40 من الشعرية السيليكا تنصهر (ID 40 ميكرون، OD 105 ميكرون)، واستخدام شفرة حلاقة لحلاقة ~ 5 ملم من طلاء بوليميد من منتصف. استخدام الشعلة البروبان للحرارة بسرعة وسحب شعري تنصهر في باعث نانو Electrospray التأين (ESI) مع تفتق على ما يرام. قطع باعث نانو ESI (~ 7-10 ملم طويلة)، وأدخله في حفرة أخرى في نهاية مسطحة من الكوارتز إبرة مزدوجة الجوف. بدلا من ذلك، استخدم مجتذب الليزر لإنتاج تفتق على ما يرام.
- تطبيق الحد الأدنى من (~ 1-2 ميكرولتر) للأشعة فوق البنفسجية الراتنج علاج على نهاية مسطحة من الكوارتز إبرة مزدوجة الجوف، وترسيخ الراتنج استخدام مصباح الأشعة فوق البنفسجية الصمام ل~ 20 ثانية لتأمين المذيب توفير الشعرية ونانو ESI باعث. وترد الإجراءات لتجميع الأجزاء الفردية في مسبار واحد في الشكل 1A.
- قطع GL المجهر القياسيةشريحة الحمار (1 "س 3") في النصف بالطول. وضع مسبار واحدة على نهاية واحدة من شريحة زجاجية بحيث يتم أشار باعث نانو ESI الخارج. تطبيق الايبوكسي العادي للجسم للتحقيق واحد بحيث يصبح تأمين على شريحة زجاجية (الشكل 1B). ترك بين عشية وضحاها لتصلب. الزوجان ملفقة مسبار واحد مع الإعداد مسبار واحد متكامل (الشكل 1C)، والتي يتم تركيبها على مطياف الكتلة كما هو موضح في الشكل 1D.
4. بناء الإعداد MS المتكاملة واحدة مسبار
- تعديل واجهة شفة مصدر أيون من مطياف الكتلة وافتعال موقف (مع موقف قابل للتعديل والارتفاع) من المجسام الرقمية (الأرقام 1e و 1F).
- حفر واجهة شفة مصدر ايون مع اثنين من الثقوب مما يسمح المرفق من لوحة الضوئية الألومنيوم. جعل جهاز السكك الحديدية الشريحة وقضيب تعديل الارتفاع (مرفقةمرحلة XY لضبط الوضع على ما يرام)، على ان يكون نظام المجسام الرقمية يمكن أن تعلق على الألومنيوم لوحة الضوئية (الشكل 1E).
- إرفاق تعديل المجهر ستيريو رقمي، مجهر رقمي USB، دليل مصغر XYZ مرحلة الترجمة مع حامل المشبك مرنة، وXYZ النظام مرحلة الترجمة الآلية إلى لوحة الضوئية الألومنيوم، والتي شنت على تخصيص مصدر أيون شفة واجهة من مطياف الكتلة (أرقام 1C و1F). استخدام حامل المشبك مرنة لإصلاح شريحة زجاجية مرفقة مع مسبار واحد.
- إرفاق الإعداد مسبار واحد لمطياف الكتلة (الشكل 1F). ضبط حامل المشبك مرنة والمرحلة XYZ مصغرة لوضع باعث للمسبار واحدة أمام مدخل مطياف الكتلة. استخدام مجهر رقمي USB (مع زاوية مشاهدة وتعديل) على جانب واحد مسبار لتقديم صورة التكبير في لف واحدرداء طرف أو باعث نانو ESI، والمجسام الرقمية (مع ارتفاع قابل للتعديل) فوق مسبار واحد لعرض الخلايا وتلميح التحقيق.
ملاحظة: عن طريق المقابلة شفة مصدر أيون، وهذا النظام المتكامل مسبار واحد يمكن أن يقترن إلى أي أنواع أخرى من الطيف كتلة مجهزة مصادر التأين المحيطة.
5. المحيطة MSI
- ذوبان الجليد في القسم العينة في درجة حرارة الغرفة ووضعه على XYZ النظام مرحلة الترجمة الآلية تحت مسبار واحد. ضبط الموقف عينة عن طريق تغيير الإحداثيات في برنامج حاسوبي لمراقبة.
- باستخدام حقنة لضخ المذيب أخذ العينات بمعدل المناسب (على سبيل المثال، 0.2 ميكرولتر / دقيقة)، وتطبيق التأين الجهد (على سبيل المثال، 5 كيلو فولت). اختيار المذيب أخذ العينات مرنة، وتشمل تلك الشائعة MeOH: المياه (9: 1) والأسيتونتريل. قدرت حجم القتلى من باعث نانو ESI أن يكون ~ 3 نيكولا لانغ، والوقت بين التحقيق-المعالم الاتصال والمراقبة إشارة أيون هو عادة أقل من 1 ثانية 15.
ملاحظة: تخصيص أيون واجهة مصدر شفة تسمح الجهد التأين ليتم تسليمها من مطياف الكتلة لاتحاد موصل من خلال مقطع التمساح. ثم ينتقل الجهد التأين من خلال اتحاد موصل للالمذيب داخل الشعيرات الدموية والقنوات مسبار واحد، وتطبيقها على باعث نانو ESI لتأيين التحاليل عينات. ضمان أن يتم تشغيل التيار الكهربائي التأين قبالة عندما ربط مقطع التمساح مع الاتحاد موصل. - ضبط ارتفاع للتحقيق واحد بحيث يستريح فقط فوق سطح العينة، وقادرة على أداء سطح استخراج الأيض. رفع بعناية المرحلة Z، ومن ثم استخدام المجهر الرقمي USB (على الجانب للمسبار واحد) لمراقبة تغير المسافة بين طرف مسبار واحد وسطح الأنسجة. رصد التغيرات في الطيف الكتلي خلال هذا التعديل الارتفاع، والتوقف عن رفعجي في المرحلة Z عندما لوحظ تغيير في إشارة أيون من خلفية المذيبات لنواتج الأيض الأنسجة.
- كرر الخطوة 5.3 ثلاث مرات لضبط ثلاث نقاط مختلفة ضمن برنامج مكافحة مرحلة لسطح الآلية تعديل تسطيح. وضع غيض من مسبار واحد في ثلاث نقاط على سطح العينة على مسافة حوالي 10 ملم بعيدا عن بعضها البعض. أداء ضبط الارتفاع عن طريق الضغط على أعلى وأسفل الرموز، وتأمين النقاط الثلاث في موقف تحت "طريقة الخطة".
- تعيين المعلمات أخرى لrastering عبر قسم المصالح داخل العينة باستخدام هذا البرنامج. للأقسام الماوس الكلى المعروضة هنا، استخدم 10.0 ميكرون / ثانية سرعة rastering و 20 ميكرومتر المسافة بين السطور. النظام مرحلة الآلية لديه 0.1 ميكرون الحد الأدنى زيادة الحركة. يتم الحصول على المسافة بين طرف مسبار واحد ونسيج من الخطوة 5.3.
- إعداد وسيلة لاكتساب الآلي مرض التصلب العصبي المتعدد الأطياف من مطياف الكتلة. فوص قرار كتلة عالية MSI على عينة الماوس الكلى، واستخدام المعايير التالية: قرار جماعي 60000 (م / Δm)، ~ 5 كيلو فولت وضع إيجابي، 1 microscan، 150 ميللي ثانية كحد أقصى وقت الحقن، وAGC جرا. وقال إن جميع أطياف MS المكتسبة تمثل خطوط الفردية للصورة MS نفس العدد من المسح مع تباعد الوقت موحد بين كل فحص، مشيرا إلى أن أحجام بكسل للصور المنتجة والموزعة بانتظام.
- الشروع في الحصول على البيانات MSI. بدء تسلسل اكتساب MS لمطياف الكتلة، ومن ثم الشروع في تسلسل rastering لبرنامج مكافحة XYZ.
- على سبيل المثال، في برنامج الحصول على البيانات MS المستخدمة هنا، انتقل إلى "إعداد تسلسل"، حدد "تسلسل جديد"، وتوليد مجموعة من الملفات لسلسلة جديدة مرقمة من 01 إلى X، حيث X هو عدد الخطوط المستخدمة ل المطلوب صورة MS الواجب اتخاذها، ثم اضغط على "تسلسل تشغيل".
- استخدام جهاز الكتروني محلية الصنع للسماح للبرامج لإنتاج حساب المشتركط إشارة الإغلاق للمطياف الكتلة لجمع البيانات. يظهر مخطط الرسم البياني في الشكل التكميلي (الشكل S1) كمرجع.
- بناء الصور MS من ملفات MS الخام باستخدام MSI البرامج المناسبة التصور. على سبيل المثال، عند استخدام حزمة البرامج التي وضعتها مجموعة Laskin لفي PNNL 17، نفذ الخطوات التالية.
- انقر على "الحواجب ملف." حدد الملف الأول تم الحصول عليها من تجربة MSI. تحديد المكان الذي يبدأ ملف والتشطيبات تحت عنوان "عدد من الخطوط." تحديد نطاق من القيم / ض م لمجموعة صورة MS تحت "أدخل MZ المدى".
- اضغط على زر "ابدأ" لبدء عملية إنشاء صورة. وبمجرد التوصل إلى صورة MS، انقر فوق "حفظ الصورة" تحت عنوان "شريط الأدوات" لتخزين الصور في الكمبيوتر.
6. في الوضع الطبيعي لايف SCMS
- إعداد نظام مسبار واحد كما في إرشادأيونات لMSI. ضبط المذيب (على سبيل المثال، MeOH / H 2 O أو الأسيتونتريل) معدل التدفق (على سبيل المثال، ~ 25 نيكولا لانغ / دقيقة).
- غسل الخلايا المستزرعة، والتي تعلق على الشرائح الغطاء الزجاجي الصغير، مع برنامج تلفزيوني لإزالة وسائل الاعلام الثقافي ومكونات الدواء خارج الخلية. وضع الخلية التي تحتوي شريحة زجاجية على XYZ النظام مرحلة الترجمة الآلية للتجربة.
ملاحظة: بدلا من ذلك، استخدم مستنبت الخلية الطازجة (غير المحتوية على مصل بقري جنيني) لشطف الخلايا المستزرعة. وقد لوحظ أقل قمع أيون. وبالإضافة إلى ذلك، يمكن للخلية البقاء على قيد الحياة لفترة أطول خلال التجربة حيث درجة الحرارة المحيطة (~ 20 درجة مئوية) هو أقل بكثير من درجة حرارة الثقافة (37 درجة مئوية). نوع المخدرات، تركيز المحلول، ووقت العلاج تختلف في مختلف الدراسات. - التركيز المجهر ستيريو رقمي (فوق العينة) على غيض من مسبار واحد لمراقبة تسلل خلية أثناء التحليل. استخدام مجهر رقمي USB (على الصورةبيئة تطوير متكاملة للمسبار واحد) لمراقبة ظروف العمل من باعث نانو ESI على مسبار واحد.
- استخدام برنامج XYZ مرحلة التحكم الآلية والمجهر ستيريو رقمي (فوق الخلايا) لتحديد خلية من الفائدة، وبالضبط موقف طرف مسبار واحد فوق عينه. بدء الحصول على البيانات MS قبل إدراج معلومات سرية التحقيق واحدة في الخلية.
- استخدام المعلمات التالية كمرجع لتحليل MS باستخدام دقة عالية مطياف الكتلة: قرار الشامل 100000 (م / Δm)، ~ 3 كيلو فولت وضع الإيجابية والسلبية، 1 microscan، 150 ميللي ثانية كحد أقصى وقت الحقن، ووضع AGC جرا. يتم اكتساب الآلي مرض التصلب العصبي المتعدد الأطياف من خلال النقر على "ابدأ" في برنامج الحصول على البيانات MS.
- رفع بمحركات Z-المرحلة بالنقر على أيقونة لاختراق غشاء الخلية وتبقي تسجيل إشارة MS المتولدة من الخلايا. ويلاحظ عادة فترة زمنية من 1-2 ثانية بين الإدراج التحقيق والكشف عن إشارة MS. كما تأكيدا آخر للاختراق الخلية، إلى تغيير جذري في الإشارات MS يمكن ملاحظة على اختراق غشاء الخلية. إشارات MS المركبات داخل الخلايا عادة يمكن أن تستمر ل~ 15-20 ثانية قبل أن تنخفض بشكل كبير.
- انخفاض أسفل الخلية التي تحتوي على لوحة لسحب معلومات سرية التحقيق واحد خارج من الخلية. وعادة ما يستغرق <15 ثانية للإشارات أيون من المركبات الخلوية إلى الاقتراب من مستوى الضوضاء. السماح للتدفق المذيبات ل~ 3 دقائق لطرد تماما مسبار واحد. وفي الوقت نفسه، وضع نظام المرحلة XYZ الآلية لتحديد موقع الخلية التالية ليتم تحليلها. تتطلب كل تجربة خلية ~ 3 دقائق إلى أن يتحقق.
النتائج
تم استخدام مسبار واحد بنجاح لتحليل MSI المحيطة من الماوس مقطوع الكلى الأنسجة 15. ويستخدم الجهاز آلية السائل السطح الصغيرة استخراج (الشكل 1A)، التي تنص على استخراج تحليلها كفاءة عالية من مساحة صغيرة، مما أدى إلى وفرة شدة الإشارات أيون في نتائج MSI. على سبيل المثال، قد تحققت شدة إشارة من أكثر من 10 7 لبعض نواتج الأيض وفيرة (الشكل 2A). تم الكشف عن عدد كبير من المركبات على هذا النحو، بما في ذلك عدد من سفينغوميالين (SM) وفسفاتيديل (PC) الأنواع مثل [SM (34: 1) + نا] + (725،5575 م / ض)، [PC (32: 0) + H] + (734،5700 م / ض)، [PC (34: 1) + نا] + (782،5696 م / ض)، و[PC (38: 5 + نا)] + (814،5726 م / ض). وقد تم تحديد هذه المركبات لقرار جماعي عالية ودقة الجماعية عندما يقترن رالزراعة العضوية عالية الدقة مطياف الكتلة. على سبيل المثال، تم تحقيقه في التماهي مع أقل من 4 جزء في المليون م / دقة الجماعية ض (أي الفرق بين القيم المرصودة والنظرية) لكل الأيض (الشكل 2B) في نتائج عرض هنا. وبالإضافة إلى ذلك، جنبا إلى جنب MS تحليل (أي، MS / MS) وأجريت أيضا لتحديد أكثر ثقة من الأنواع ذات الأهمية. 15
ويرجع ذلك إلى قدرة على أداء كفاءة السائل استخراج الصغيرة على مساحة صغيرة، وجهاز مسبار واحد يمكن استخدامه لإجراء تجارب المكانية عالية الدقة MSI في ظل الظروف المحيطة 15. على سبيل المثال، قد تم الحصول عليها صورا تفصيلية MS أقسام الكلى الماوس توضح التوزيع المكاني لنواتج مختارة (الشكل 2C). تم تحديد القرار المكانية للصورة MS أن تكون 8.5 ميكرون، وبعد قياس تستخدم على نطاق واسع من وجود transiti. على نقطة ميزة حادة تحدد في تغيير كثافة 20-80٪ من إشارة MS 18 في حالة فوسفورية [PC (38: 5 + نا)] + على قسم الكلى الماوس، والانتقال ميزة بين النخاع الداخلي والنخاع الخارجي تتم عبر دورة مسح واحدة في قطعة تأريخ، والتي تبين تغير كثافة أكبر من 20-80٪ النطاق. استنادا إلى سرعة عينة تتحرك (10.0 ميكرون / ثانية) وMS معدل الحصول على البيانات (0.85 ثانية / الطيف)، وعينة تتحرك عن بعد في واحد MS مسح دورة (8.5 ميكرون)، أي القرار المكانية MSI، يمكن حساب (الشكل 2D). هذا القرار المكانية هو من بين أعلى المعدلات بعد تحقيقه لتقنيات MSI المحيطة التي أجريت على العينات البيولوجية.
لSCMS كان مسبار واحدة قادرة على تحقيق تحليل خلايا هيلا الحية الفردية 16. حجم غيض من مسبار واحد هو عادة أقل من 10 ميكرون (الشكللدى عودتهم 3A)، والتي هي صغيرة بما يكفي لإدراجها مباشرة في العديد من أنواع الخلايا حقيقية النواة، والتي قطرها ~ 10 ميكرون، لاستخراج وتحليل MS. عملية الإدراج من طرف مسبار واحد في خلية يمكن رصدها بالعين المجردة باستخدام مجهر ستيريو رقمي (الشكل 3B)، ويمكن التأكد من اختراق غشاء الخلية من خلال التغير السريع والكبير من أطياف الشامل من برنامج تلفزيوني (أو خلية ثقافة جديدة متوسطة) إلى مركبات داخل الخلايا (أرقام 3C و 3D). ويمكن إجراء التجارب في كل من وسائط أيون الإيجابية والسلبية للكشف عن أنواع أوسع من الأنواع الجزيئية. على سبيل المثال، تم تحديد 18 نوعا الدهون المختلفة في وضع إيجابي، بما في ذلك sphingomyelins (SM) وphosphatidylcholines (PC)، في حين أن (AMP، ADP، وATP) تم الكشف عن الفوسفات الأدينوساين في وضع الأيونات السالبة (أرقام 3C ود). التأخير الزمني بين الإدراج ط مسبار واحدn لخلية والكشف عن إشارة وعادة ما تكون أقل من ثانيتين، والسماح لالقريب كشف في الوقت الحقيقي من نواتج الأيض الخلوية. تم تطبيق SCMS أيضا في تجارب حيث تم علاج الخلايا مع الأدوية المضادة للسرطان (على سبيل المثال، OSW-1، باكليتاكسيل، ودوكسوروبيسين) 19]. يمكن الكشف عن المخدرات المقابلة داخل خلايا هيلا بعد العلاج 4 ساعات في سلسلة من تركيزات (أي 10 نانومتر، 100 نانومتر، 1 ميكرومتر، و 10 ميكرومتر) في DMSO (سلفوكسيد ثنائي ميثيل)، وذلك باستخدام الخلايا غير المعالجة (إضافة DMSO فقط ) كما الضوابط. وكانت إشارات MS الأدوية غير موجودة ضمن برنامج تلفزيوني خارج الخلية أو التحكم (الشكل 3E)، ولكن تم الكشف داخل الخلايا واحدة باستخدام MS تقنية مسبار واحد (تظهر فقط 100 النتائج العلاج نانومتر في الشكل 3F). لأنه تم تشطف الخلايا مع برنامج تلفزيوني (أو الطازجة مستنبت الخلية) لإزالة مركبات خارج الخلية والتلوث، والكشف عن نواتج الذاتية (على سبيل المثال، نسبة الدهون في الخلايا لد الفوسفات الأدينوساين) والمركبات خارجية (على سبيل المثال، الأدوية المضادة للسرطان) إلى أن مرض التصلب العصبي المتعدد تقنية واحد مسبار يمكن استخدامها لتحليل المركبات داخل الخلايا.
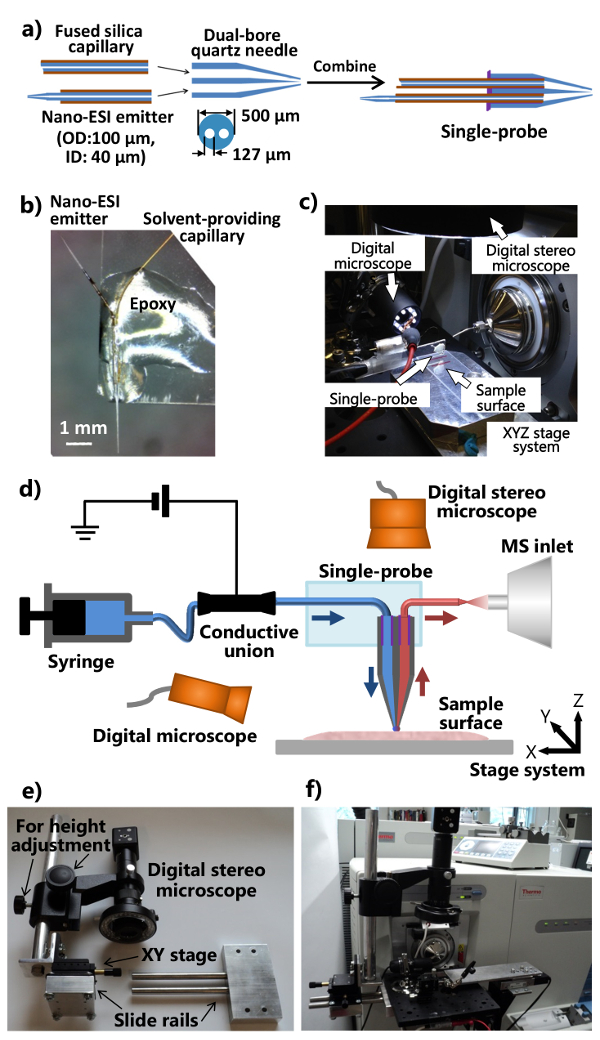
الشكل 1. تصنيع والإعداد للمسبار واحد لMSI وSCMS تحليل المحيطة. أ) الإجراءات تلفيق للمسبار واحد. ب) صورة لمسبار واحدة ملفقة تعلق على شريحة زجاجية. ج) صورة من أحادية الإعداد التحقيق تعلق على مطياف الكتلة. ود) رسم تخطيطي لإعداد مسبار واحد إلى جانب وجود مطياف الكتلة. خلال التجربة، وتقدم المذيب أخذ العينات بشكل مستمر من الحقنة، يتم تطبيق الجهد التأين للاتحاد موصل من مطياف الكتلة، وتستخدم اثنين من المجاهر الرقمية لرصد عينة التنسيب، المرحلة XYZ الآليةيستخدم النظام للسيطرة على عينة الحركة، ويتم استخدام مطياف الكتلة للتحليل. ه) صورة للنظام المجسام الرقمية حسب الطلب. و) صورة تبين المجسام الرقمية التي تعلق على واجهة شفة مصدر أيون من خلال لوحة الضوئية. الرجاء النقر هنا ل عرض نسخة أكبر من هذا الرقم.
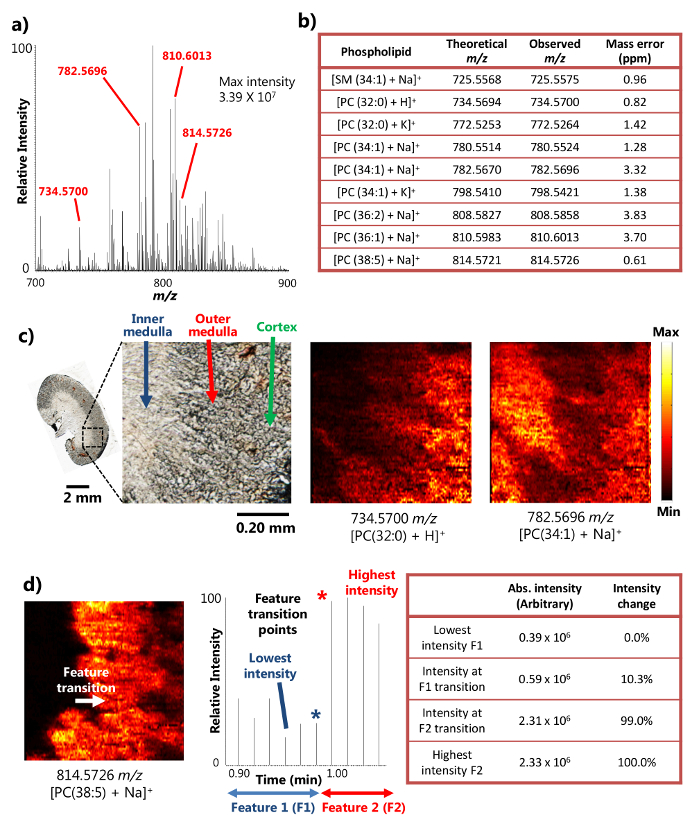
الشكل 2. نتائج من دراسة MSI المحيطة قسم الماوس الكلى مع القرار المكانية والشامل عالية. أ) الطيف الكتلي تمثيلية من مسبار واحد MSI. كثافة القصوى من المركبات الكشف يمكن أن تصل إلى 3.39 × 10 7 (وحدات التعسفي). ب) مجموعة مختارة من نواتج الأيض الكشف قدمت مع دقتها الجماعية. ج)صور MS من [PC (32: 0) + H] + [والكمبيوتر (34: 1) + نا] + مأخوذة من القسم الماوس الكلى عند 8.5 ميكرون القرار المكانية. PC: فسفاتيديل. شريط النطاق: 2 مم. 0.20 مم (الشكل) د) تحديد القرار المكانية للصورة MS ل. [PC (38: 5) + نا] + (مقتبس بإذن من المرجع 15). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3. النتائج من تحليل SCMS المحيطة من المخدرات تعامل خلايا هيلا مع قرار كتلة عالية. أ) تم تكبيره في صورة من طرف مسبار واحد يدل على حجم نموذجية من <10 ميكرون في القطر. ب) أخذت الصورة عند نقطة إدخال مسبار واحد في خلية هيلا. شريط الحجم: 50 ميكرون.ج) إيجابي الطيف نموذجي كتلة وضع أيون مع التعرف على عدد من أجهزة الكمبيوتر (فسفاتيديل) الأنواع. د) قائمة تمثيلية الأيض الكشف عن تحليل SCMS من خلايا هيلا سواء في وسائط أيون الإيجابية والسلبية. EF) قداس الأطياف ل مراقبة والمعالجة (100 نانومتر OSW-1) خلايا (مقتبس بإذن من المرجع 16). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
شخصية S1. مخطط الرسم البياني للجهاز إلكتروني يستخدم لإنتاج اتصال إشارة الإغلاق للمطياف الكتلة لجمع البيانات. الرجاء انقر هنا لعرض أو تحميل هذا الرقم.
Discussion
ومسبار واحد هو جهاز متعدد الوظائف التي يمكن أن تستخدم في كل التجارب MSI وSCMS. تم تصميم الإعداد مسبار واحد (بما في ذلك نظم مرحلة الترجمة، والمجاهر، مصدر أيون شفة واجهة، الخ) كعنصر إضافة على ذلك يمكن تكييفها بمرونة مع مطياف الكتلة الحالية. والتبادل السريع بين الإعداد مسبار واحد ومصدر أيون ESI التقليدية يمكن أن يتحقق في غضون دقيقة واحدة. من حيث المبدأ، وذلك باستخدام واجهة مصدر أيون شفة المناسبة، وإعداد مسبار واحدة يمكن تكييفها مع أي الطيف الإعلام الأخرى. بالإضافة إلى ذلك، المذيب أخذ العينات التي تحتوي على مجموعة متنوعة من المواد الكيميائية التي يمكن استخدامها مع الإعداد مسبار واحد للتجارب MSI وSCMS رد الفعل، مما يعزز إلى حد كبير في الكشف عن نطاقات أوسع من الجزيئات الحيوية. بالإضافة إلى الأنسجة الحيوانية وخطوط الخلايا، ومسبار واحد هو أيضا قادرة على تحليل النظم البيولوجية الأخرى مثل النباتات. لذلك، مع نفس الإعداد التجريبية وتدريب المستخدمين مماثل، ومجموعة متنوعة من الدراسات يمكن القيام بها باستخدام صك واحد وبنفس المستخدمين، مما يتيح للتجارب فعالة ومرنة إلى أن يتحقق مع وقت التدريب الحد الأدنى وتكلفة الأجهزة.
المكون الرئيسي للمسبار واحد MS التقنية هو التحقيق نفسه. نوعية للمسبار واحدة له تأثير كبير على أدائها، والذي يحدد إلى حد كبير على نوعية كل التجارب MSI وSCMS. عندما افتعال-تحقيقات واحدة، تأكد من أن الشعيرات الدموية داخل أنابيب مزدوج الجوف يتم لصقها بشكل آمن للقضاء على فرصة لتسرب المذيبات خلال التجارب. فمن الأهمية بمكان أن استخدام الحد الأدنى من الأشعة فوق البنفسجية الايبوكسي قابل للشفاء، مثل أن الفوهات والشعيرات الدموية ليست مسدودة خلال تلفيق التحقيق.
تم استخدام مسبار واحد لإجراء عالية المكانية والجماعية قرار المحيطة MSI على عينات بيولوجية 15. والميزة الرئيسية لMSI المحيط علىأساليب غير المحيطة، هي أن يتم الاحتفاظ إعداد العينات كحد أدنى دون الحاجة لبيئة أخذ العينات فراغ، والذي يسمح للعينة لتحليلها في حالة الأم بالقرب 8. كانت واحدة من العقبات الرئيسية لمعظم المحيطة أخرى MSI تقنية عدم وجود قرار المكاني 1. مقارنة مع الامتزاز على أساس MSI التقنيات (مثل ديسي وLAESI)، وحجم رأس صغير من مسبار واحد يسمح أكثر قوة وكفاءة السائل السطح الصغيرة استخراج التي يتعين القيام بها على مساحة صغيرة، مما أدى إلى قرار مكانية عالية من 8.5 ميكرون، والتي هي من بين أعلى منها تحقيقه باستخدام تقنيات MSI المحيطة 15. وبالإضافة إلى ذلك، وتعديل مكونات المذيب أخذ العينات يوفر مرونة إضافية لإجراء التجارب. على سبيل المثال، وأخذ العينات المذيبات التي تحتوي على المواد الكيميائية (مثل مركبات dicationic) استخدمت لإجراء تجارب MSI رد الفعل، والسماح لزيادة كبيرة في عدد من المركبات التي تم تحديدها بيص تجربة 20. ميزة أخرى للتحقيق واحد هو تصميم متكامل، والذي يوفر سهولة التشغيل أثناء عملية الحصول على البيانات بأكملها. لأن المسافة بين طرف وسطح الأنسجة حساسة جدا لشدة إشارة أيون والاستقرار، والحصول على قسم الأنسجة شقة وإجراء سطح تسطيح تعديل لتقليل التباين المسافة هو المفتاح للحصول على جودة عالية التجارب MSI. ويترتب على ذلك تقنيات MSI مسبار واحد ليست مناسبة للحصول على صور عالية MS المكانية من الأسطح غير المستوية.
بالإضافة إلى افتعال تحقيق جودة عالية، ضبط بعناية الصك ضروري لتجربة MSI ناجحة. بين جميع الخطوات ضبط، ضبط ارتفاع من طرف مسبار واحد فوق سطح قسم الأنسجة هو الأكثر حرجا. عند ضبط ارتفاع التحقيق، ضخ المذيب أخذ العينات وتشغيل التيار الكهربائي التأين، بحيث لا إشارات أيون خلفية المذيبات يمكن أن يكون observأد. ثم رصد التغير من الطيف الشامل مع الحد بعناية بعد التحقيق سطح برفع بمحركات Z-مرحلة حتى قوية ومستقرة إشارات أيون من قسم الأنسجة ويمكن ملاحظة. وسوف تستخدم هذا الارتفاع التحقيق لجمع البيانات MSI أثناء التجربة. وبالإضافة إلى ذلك، معدل تدفق المذيبات الأمثل هو ضروري لتجارب MSI. ضبط معدل تدفق مع ارتفاع التحقيق الأمثل. ضمان عدم وجود أي انتشار المذيبات على سطح النسيج (أي معدل تدفق مرتفع جدا) أو تشكيل فقاعة داخل باعث نانو ESI (أي معدل التدفق منخفض للغاية).
ومسبار واحد هو جهاز متعدد الوظائف لالتحاليل الطبية. بالإضافة إلى التجارب MSI، أنها قادرة على إجراء قرب الوقت الحقيقي في الموقع SCMS لتوضيح المعلومات الكيميائية مفصلة من الخلايا حقيقية النواة الحية 16، وهي ميزة كبيرة مقارنة مع فراغ آخر التقنيات SCMS أساس (مثل MALDI 10 و سيمز 21 ). صغر حجم تلميح التحقيق يوفر القدرة لإدراجها في خلية حقيقية النواة الحية واستخراج وتأين المركبات داخل الخلايا لتحليلها MS فوري. وبالمثل، فإن المذيبات أخذ العينات التي تحتوي على المواد الكيميائية (مثل مركبات dicationic) يمكن استخدامها في التجارب SCMS، ويمكن الكشف عن مجموعة واسعة من المكونات الخلوية في خلية واحدة حية من أي وقت مضى (البحوث الجارية، لا تظهر البيانات). على الرغم من أن التحليل في الوقت الحقيقي سوف توفر لمحات الكيميائية من الخلايا وحيدة حية، ويرجع ذلك إلى اختراق الخلية من غشاء واستخراج محتويات الخلوية، الخلية قيد التحقيق سيقتلون بعد التجربة، مما يعني أن SCMS تقنية مسبار واحد لا يزال طريقة مدمرة. وبالإضافة إلى ذلك، تلميح التحقيق ونانو ESI باعث في مسبار واحد يمكن انسداد بسهولة للمستخدمين عديمي الخبرة. لتقليل فرصة من انسداد الجهاز، ضمان لتجنب لمس نواة عند إدخال معلومات سرية التحقيق واحد إلى سلل. إذا حدث انسداد، الجهاز يمكن تجديدها عن طريق تسخين تلميح التحقيق انسداد أو نانو ESI باعث باستخدام homebuilt التدفئة لفائف 16. الحد آخر للتحقيق واحد SCMS التقنية هو أن فقط الخلايا لاصقة (أي تعلق الخلايا على الأسطح) يمكن تحليلها باستخدام الإعداد الحالي. ومع ذلك، من خلال دمج نظام معالجة الخلية في الجهاز MS-مسبار واحد، وأنواع أوسع من الخلايا يمكن دراستها في المستقبل.
على غرار تجربة MSI، والحصول على تحقيق جودة عالية ومعدل تدفق المذيبات الأمثل هو أمر حاسم لدراسات SCMS. عندما ضبط معدل تدفق المذيبات، يتم وضع طرف مسبار واحد فوق العينة (أي، لا يوجد اتصال مع خلية أو مستنبت)، والتأكد من أنه لا يوجد يقطر المذيب من تلميح التحقيق أو تشكيل فقاعة داخل النانو ESI باعث.
Disclosures
We have no conflict of interest to declare with the work presented here.
Acknowledgements
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
Materials
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
References
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved