Method Article
단일 프로브의 응용 프로그램 : 주변 조건에서 질량 분석 이미징 및 단일 세포 분석
요약
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
초록
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
서문
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
프로토콜
동물 사용과 복지는 기관 동물 관리 및 사용위원회 (IACUC)에 의해 검토 및 승인 프로토콜 다음과 같은 실험 동물의 관리 및 사용에 대한 NIH 가이드를 준수해야합니다. 마우스 조직 샘플은 협력자 박사 Chuanbin 마오에 의해 제공되었다.
1. 마우스 조직 섹션 준비
- 물론 작은 플라스틱의 중심으로 관심 (뇌, 신장, 간 등)의 전체 마우스 기관 (예를 들면, 12 웰 세포 배양 플레이트)을 놓고 약 10mm 높이로 화합물을 포함 티슈 잠수함. 조직 포함 화합물과 기관이 원하는 방향 (즉, 시상면, 관상 등)에 배치되어 형성에는 거품이없는 것을 확인합니다.
- 즉시 플래시 냉동 액체 질소에 조직을 배치합니다. 장기간 저장을 위해, -80 ° C에 냉동 동결 샘플을 저장한다.
- 냉동 마우스 기관을하고 temperatu에 C ° -15에 해동제어 cryomicrotome을 다시.
- 조직 포함 화합물의 약 500 μL와 함께 강 기재 상에 보안 조직이 원하는 단면 처리 방향이 칼에 제공되도록 장착 절편 cryomicrotome에 배치합니다.
- 제 12 μm의 두께로 조직. 폴리 카보네이트 현미경 슬라이드 상에 단면 조직 조각을 놓고, 실온에서 30 분 동안 건조 떠난다. 장기간 저장을 위해, -80 ° C에 냉동 냉장고 슬라이드를 저장한다.
2. 세포 배양
참고 : 세포 배양은 무균 조건에서 생물 안전 캐비닛 (바이오 안전성 레벨 II)에서 수행 하였다. 된 HeLa 세포주 모델 시스템으로 사용하여, 세포를 다음과 같은 통상의 프로토콜 완전 배지에서 배양 하였다 :
- 따뜻한 시약 (즉, 트립신, 인산염 완충 식염수 (PBS), 및 세포 배양 배지), 37 ℃이다.
주 : 세포 배양 배지는 무기 SA를 포함LTS, 아미노산, 비타민 등을들 수있다. 구성 요소의 전체 목록은 제조업체의 제제를 참조하십시오. - 세포 샘플 (예를 들어, 1 ml의 헬라 세포 현탁액)을 수득하고, 10 cm의 표준 세포 배양 접시에 완전한 세포 배지 9 ㎖ 중에 추가. 초기 세포 수는 약 0.5 × 106 세포 / ml이다. 성장면이 세포 배양 접시에 70~80%에 피복 될 때까지 2-3 일 동안은 5 % CO 2, 37 ℃에서 배양 세포를 유지한다. 각각의 연속 라운드 녹음 세포 통로 번호.
- 세포 배양 접시에 세포 계대 (즉, 세포 분열)을 수행한다.
- 대기음 성장 배지와 세포를 씻어 1X PBS 5 mL를 사용한다. 멸균 흡인 팁을 사용하여 PBS를 제거하고 배양 접시에서 세포를 분리하기 위해 37 ℃에서 ~ 5 분 동안 트립신 (0.25 %) 2.5 ㎖로 세포를 배양한다.
참고 : 실제 트립신 처리 시간이 특정 트립신의 produ에 따라 최적화 될 필요CT는 제조 업체에서 구입. 과도한 처리 세포 사멸에 이르게 부적절한 반면, 처리 시간은, 상기 플레이트에 부착 된 세포를 남긴다. - 7.5 ml의 전체 세포 배양 배지를 첨가함으로써 트립신 활성을 중지하고 균일 한 셀 (총 부피 10 ml)에 재현 탁. SCMS 샘플 (단계 2.4)의 문화 (단계 2.2) 또는 제조를위한 세포 현탁액을 사용합니다.
- 대기음 성장 배지와 세포를 씻어 1X PBS 5 mL를 사용한다. 멸균 흡인 팁을 사용하여 PBS를 제거하고 배양 접시에서 세포를 분리하기 위해 37 ℃에서 ~ 5 분 동안 트립신 (0.25 %) 2.5 ㎖로 세포를 배양한다.
- SCMS 실험에 대한 세포 샘플을 준비합니다.
- 12 웰 플레이트의 개별 마이크로 커버 슬라이드를 위치시키고 1.8 ml의 세포 배양 배지를 추가 웰에 세포 현탁액 0.2 ml를.
- 부드럽게 판의 온화한 교반 세포를 혼합하고, 24 시간 ~ 37 ° C에서 5 % CO 2 환경에서 배양한다. 배양 된 세포를 약물 치료를 수행하기 위해, 12 웰 세포 배양 플레이트에 (DMSO에서 예 (디메틸 술폭 시드)) 약제 화합물 용액을 추가한다.
주 : 최종 약물 농도 (예를 들면, 10 nM 내지 100 nM 내지 1 μM, 10 μM) 및 treatment 시간 (예를 들어, 4 시간)이 연구의 구체적인 목적에 따라 변화된다. 세포는 마이크로 커버 슬라이드에 부착하고 CSMS 실험 (6 단계)에 대한 준비가되어 있습니다.
3. 단일 프로브 제조
- 레이저 마이크로 피펫 풀러에 듀얼 보어 석영 관 (내경 (ID) 127 μm의, 외경 (OD) 500 μm의)를 놓고 듀얼 보어 석영 바늘을 빼냅니다. (모든 단위는 제조 업체의 단위) 열 = 400, 필 = 3, VEL = 80, 델 = 150, 및 PUL = 250 : 시작 지점으로 다음과 같은 매개 변수를 사용합니다. 인출 된 듀얼 보어 석영 바늘을 확인하여 최적의 프로브 속성에 대한 테이퍼 팁이있다. ~ 다른 쪽 끝에서 왼쪽으로 한 unpulled 듀얼 보어 수정 모세관 5 mm 길이가되도록 뽑아 끝을 잘라.
주 : 레이저 풀러의 실제 파라미터는 장비의 특정 조건에 따라 최적화되어야한다. - 용융 실리카 모세관의 ~ 80mm 부분을 잘라 (ID 40 μm의, OD. 용매로 105 μm의)는 모세관을 제공하고 듀얼 보어 석영 바늘의 평평한 끝 부분에 하나의 구멍에 삽입합니다.
- 용융 실리카 모세관 (ID 40 μm의, OD 105 μm의)의 ~ 40mm 부분을 잘라 중간 지점에서 폴리이 미드 코팅 ~ 5mm 면도 면도칼을 사용합니다. 빨리 가열 벌금 테이퍼와 나노 전기 분무 이온화 (ESI) 터에 융합 모세관을 끌어 프로판 불꽃을 사용합니다. 나노 ESI 이미 터 (~ 7-10mm 길이)를 잘라하고, 듀얼 보어 석영 바늘의 평평한 끝에서 다른 구멍에 삽입합니다. 다르게는, 미세 테이퍼를 생성하기 위해 레이저 풀러를 사용한다.
- 듀얼 보어 석영 바늘의 평평한 단부에 (~ 1-2 μL) UV 경화성 수지의 최소량을 적용하고 모세관 나노을 용매 확보 ~ 20 초 발광 다이오드 UV 램프를 이용하여 제공하여 수지를 응고 ESI 터. 단일 프로브에 개별 부품을 조립하는 과정은도 1a에 도시된다.
- 표준 현미경 GL 컷엉덩이 슬라이드 길게 반으로 (1 "× 3"). 나노 ESI 터 외측으로 지적 될 수 있도록 유리 슬라이드의 일단에 단일 프로브를 배치했다. 는 유리 슬라이드 (도 1b)에 고정되도록 하나의 프로브 본체에 정규 에폭시를 적용한다. 강화를 위해 하룻밤 둡니다. 몇도 1D에 도시 된 바와 같이 질량 분광계에 부착되어 일체형의 단일 프로브 설정 (도 1C)와 조립 단일 프로브.
4. 통합 된 단일 프로브 MS 설치 프로그램을 빌드
- 질량 분석 장치의 이온 소스 인터페이스 플랜지 수정 디지털 입체경의 (조정 위치 및 높이)와 스탠드 제조 (도 1E 및 1F).
- 알루미늄 광학 판의 부착을 허용 개의 구멍 이온 소스 인터페이스 플랜지 드릴. 슬라이드 레일 장치와 높이 조절로드를 확인 (붙어디지털 입체경 시스템 알루미늄 광 기판 (도 1E에 부착 될 수 있도록, 미세한 위치 조정을위한 XY 스테이지)).
- 수정 된 디지털 스테레오 현미경하는 USB 디지털 현미경, 플렉시블 클램프 홀더 소형 수동 XYZ 변환 단계 질량 분석의 정의 이온 소스 인터페이스 플랜지에 장착 된 알루미늄 광 보드에 동력 XYZ 변환 스테이지 시스템을 첨부 (도 1C 및 1 층). 단일 프로브에 부착 된 유리 슬라이드를 해결하기 위해 유연한 클램프 홀더를 사용합니다.
- 질량 분석기 (그림 1 층)에 단일 프로브 설정을 연결합니다. 질량 분석 장치의 유입구 앞의 단일 프로브의 에미 터를 배치하는가요 클램프 홀더 소형 XYZ 스테이지를 조절. 단일 페이지의 확대 된 이미지를 제공하기 위해 단일 프로브 측 (조절 시야각)가 USB 디지털 현미경을 사용하여단일 프로브 위의 가운 팁 또는 나노 ESI 이미 터 및 (높이 조절)와 디지털 입체경은 세포와 프로브 팁을 볼 수 있습니다.
주 : 해당 이온 소스 플랜지를 사용하여,이 통합 단일 프로브 시스템은 주변 이온화 소스를 갖춘 질량 분석기의 다른 유형에 결합 할 수있다.
5. 주위 MSI
- 상온에서 샘플 섹션을 해동과 단일 프로브 아래에있는 모터 XYZ 번역 단계 시스템에 배치합니다. 제어 소프트웨어의 좌표를 변경하여 시료 위치를 조정한다.
- 주사기를 사용하여 적당한 레이트 (예를 들면, 0.2 μL / 분)로 샘플링 용매 펌프 및 이온화 전압 (예를 들어, 5 kV의)를 적용한다. 샘플링 용매의 선택은가요 성이고, 일반적인 것는 메탄올을 포함한다 : 물 (9 : 1), 아세토 니트릴. 나노 ESI 터의 불감 부피 3 NL 및 프로브 표면 처 사이의 시간 ~ 것으로 추정가전 접촉 및 이온 신호 관찰은 보통보다 1 초 15이다.
주 : 맞춤 이온 소스 인터페이스 플랜지 이온화 전압 악어 클립을 통해 도전성 조합하여 질량 분석기로 전달 될 수있다. 이온화 전압은 모세관과 단일 프로브 채널 내부의 용매에 도전성 조합을 통해 전송하고, 샘플 분석 물을 이온화 나노 ESI 에미 터에인가된다. 도전 조합과 악어 클립을 연결할 때 이온화 전압의 전원이 꺼져 있는지 확인합니다. - 단지 샘플의 표면 위에서 쉬고 대사면 추출을 수행 할 수 있도록 하나의 프로브의 높이를 조정한다. 조심 Z 스테이지를 해제 한 후, 단일 프로브 팁과 조직 표면 사이의 거리 변화를 모니터링 (단일 프로브의 측면) USB 디지털 현미경을 사용한다. 이 높이 조정시 질량 스펙트럼의 변화를 모니터링하고 리프트를 중지조직 대사에 용매 배경의 이온 신호의 변화가 관찰 될 때 Z 스테이지를 보내고.
- 반복 단계 5.3 세번 자동 표면 평탄화 조정 스테이지 제어 프로그램 내에 세 가지 점을 설정한다. 서로 떨어져 약 10 mm의 거리에서 시료 표면에 세 지점에서, 단일 프로브 팁을 놓는다. 위쪽을 눌러 및 아이콘 아래로 높이 조절을 수행하고, "계획 방법"의 위치로 승점 3 점을 잠급니다.
- 이 프로그램을 사용하여 샘플 내에서 관심있는 부분을 가로 질러 래스터에 대한 다른 매개 변수를 설정합니다. 여기에 제시된 마우스 신장 섹션를 들어, 10.0 μm의 / 초 래스터 화 속도와 라인 사이에 20 μm의 거리를 사용합니다. 전동 스테이지 시스템은 0.1 μm의 최소 증분의 움직임을 갖는다. 단일 프로브 팁 및 조직 사이의 간격은 단계 5.3에서 얻어진다.
- 질량 분석의 MS 스펙트럼의 자동 취득하는 방법을 설정한다. FO마우스 신장 샘플에 대한 연구 높은 질량 분해능 MSI는 다음 매개 변수를 사용하여 질량 분해능 60,000 (m / ΔM을) ~ 5 kV의 긍정적 인 모드, 1 Microscan은 150 밀리 초 최대 주입 시간, AGC합니다. MS는 이미지의 개별 라인을 나타내는 모든 취득한 MS 스펙트럼은 생성 된 이미지의 픽셀 크기가 균일하게 분포되어 있음을 나타내는 각 주사 사이에 일정한 시간 간격을두고 스캔 동일한 수 있었다.
- 의 MSI 데이터 수집을 시작합니다. 질량 분석에 대한 MS 획득 시퀀스를 시작하고 XYZ 제어 프로그램의 래스터 화 시퀀스를 시작합니다.
- 예를 들어, 여기에 사용되는 MS 데이터 수집 프로그램에서, "새 순서"를 선택, "순서 설정"으로 이동 X가 사용되는 라인의 수는 X, 01의 숫자가 새로운 시퀀스 파일 세트를 생성 원하는 MS의 이미지를 촬영 한 다음 "실행 순서"를 누르면된다.
- 소프트웨어가 접점을 생성 할 수 있도록하는 제 전자 장치를 사용하여질량 분석 용 CT 고정 신호는, 데이터를 수집한다. 회로도를 참고로 보충도 (도 S1)에 도시된다.
- 적절한 MSI 시각화 소프트웨어를 사용하여 원시 MS 파일에서 MS의 이미지를 구축합니다. PNNL 17 Laskin의 그룹에 의해 개발 된 소프트웨어 패키지를 사용하는 경우 예를 들어, 다음 단계를 수행한다.
- "눈 썹 파일 '을 클릭합니다. MSI는 실험에서 얻은 첫 번째 파일을 선택합니다. 지정 위치에서 파일이 시작되고 완료 "라인의 수입니다." "입력 MZ 범위"에서 MS의 이미지 범위 m / z 값의 범위를 선택합니다.
- 이미지 생성 프로세스를 시작하려면 "시작"버튼을 누릅니다. MS는 이미지가 이루어지면, 컴퓨터에 이미지를 저장하기 위해 "도구 모음"에서 "이미지 저장"을 클릭합니다.
에서 현장 6. 라이브 SCMS
- 설치 지시한다 따라 단일 프로브 시스템MSI에 대한 이온. 유속 용매 (예, 메탄올 / H 2 O 또는 아세토 니트릴)를 조정 (예를 들어, ~ 25 NL / 분).
- 문화 미디어 외 약제 성분을 제거하기 위해 PBS에 마이크로 커버 유리 슬라이드에 부착 된 배양 세포를 세척 하였다. 실험을위한 동력 XYZ 번역 단계 시스템에 유리 슬라이드를 포함하는 세포를 놓습니다.
대안 적으로, 배양 된 세포를 씻어 (소 태아 혈청을 함유하지 않고) 새로운 세포 배양 배지를 사용하여 참고. 적은 이온 억제가 관찰되었다. 또한, 셀은 주위 온도 (~ 20 ° C)의 배양 온도 (37 ℃)보다 현저히 낮은 실험 기간 동안 긴 시간 동안 생존 할 수있다. 약물의 종류, 용액의 농도 및 처리 시간은 다른 연구에서 변화한다. - 분석하는 동안 세포 침투를 모니터링하는 단일 프로브의 팁 상 (시료 위) 디지털 스테레오 현미경 초점. 의 S에 USB 디지털 현미경 (사용단일 프로브 IDE)은 단일 프로브 나노 ESI 방출기의 작동 상태를 모니터링한다.
- 관심 셀을 찾기 위해 전동 XYZ 스테이지 제어 프로그램 (전술 한 세포) 디지털 스테레오 현미경을 사용하여 정밀 샘플 상기 단일 프로브 팁의 위치. 단일 프로브 팁은 세포 내로 삽입하기 전에 MS 데이터 수집을 시작한다.
- 질량 분해능 100,000 (m / ΔM) ~ 3 kV의 양 및 음의 모드 1 Microscan은 150 밀리 최대 분사 시간에 AGC 모드 : MS 분석을위한 참조 고분해능 질량 분석기를 사용하는 것과 다음 매개 변수를 사용한다. MS 스펙트럼의 자동 취득은 MS 데이터 수집 프로그램에서 "시작"을 클릭하면됩니다.
- 세포막을 통과하여 세포에서 생성 된 MS 신호를 기록 유지하는 아이콘을 클릭하여 전동식 Z 스테이지 리프트. 1-2 초의 시간 지연은 일반적으로 프로브를 삽입하고, MS 신호 검출부 사이에 관찰된다. 다른 확인으로세포 침투의 MS 신호의 급격한 변화는 세포막의 침투에 관찰 될 수있다. 세포 내 화합물의 MS 신호는 일반적으로 이전에 15 ~ 20 초 크게 감소 ~ 지속될 수 있습니다.
- 셀에서 단일 프로브 팁을 끌어 플레이트를 포함하는 셀 아래로 내립니다. 이는 일반적으로 노이즈 레벨에 접근하는 셀룰러 화합물의 이온 신호를 <15 초 걸린다. ~ 3 분 완전히 단일 프로브를 세척하는 용매 흐름을 보자. 한편, 분석 될 다음 셀을 찾을 전동 XYZ 스테이지 시스템의 위치. 각 셀의 실험은 2 ~ 3 분 달성 될해야합니다.
결과
단일 프로브가 성공적으로 단면 한 마우스의 신장 조직 (15)의 주위 MSI 분석에 사용 하였다. 장치는 MSI 결과 풍부한 이온 신호 강도로 이어지는 작은 영역에서 고효율 분석 추출을 제공하는 액체 표면의 미세 추출 (도 1a)의 메카니즘을 이용한다. 예를 들어, 10 개 이상 (7)의 신호 세기가 어떤 풍부한 대사 (도 2a)에 대해 달성되고있다. + (725.5575 m / z), PC (32 : 대사 다수는 스 핑고 미엘린 수 (SM) 및 포스파티딜콜린 (PC)와 같은 종 [+ 나 SM (1 34)]를 포함하여, 이러한 방법으로 검출 하였다 : 0) + H] + (734.5700 m / z), [PC (34 : 1) + 나] + (782.5696 m / z) 및 [PC (38 : 5 + 나)] + (814.5726 m / z). t을 결합 할 때 이들 화합물은 높은 질량 분해능과 질량 정확도로 확인되었다OA 고해상도 질량 분석기. 예를 들면, 식별 (즉, 관찰과 이론 값의 차이)의 각 대사 결과에 대한 (도 2B)은 여기에 제시된 4 개 이하의 PPM m / z 질량 정확도를 달성 하였다. 또한, 탠덤 MS (즉, MS / MS)도 관심의 종의 자신감 식별을 위해 실시 하였다 분석한다. (15)
인해 작은 면적에 효율적으로 액체 미세 추출을 수행하는 능력을, 단일 프로브 장치는 주위 조건 하에서 15 높은 공간 해상도 MSI 실험을 수행 할 수있다. 예를 들어, 마우스 신장 부분의 상세한 MS 이미지 선택된 대사 (도 2C)의 공간 분포를 나타내는 얻어졌다. MS는 이미지의 공간 해상도는 transiti을 갖는 널리 사용되는 메트릭에 따라 8.5 μm의 것으로 측정되었다. 상기 MS 신호의 20 % ~ 80 % 강도의 변화에서 결정된 날카로운 피쳐의 18 지점 인지질의 경우에 [PC (38 : 5 + NA)] + 마우스 신장 부 내측 수질의 기능 전환에 과 외부 수질은 강도 변화에게보다 20 % ~ 80 % 범위를 보여주는 chronogram 한 스캔주기에 걸쳐 발생한다. 샘플 이동 속도 (10.0 μm의 / 초) 및 MS 데이터 획득 레이트 (0.85 초 / 스펙트럼) 샘플 하나의 MS의 거리 사이클 (8.5 μm의), 즉, MSI 공간 해상도를 스캔 이동 계산 될 수있다 (도에 근거 2D). 이 공간 해상도는 아직 생물학적 시료에서 수행 주위 MSI 기술을 달성 가장 높은 사이입니다.
SCMS 들어 단일 프로브 개별 라이브 HeLa 세포 (16)의 분석을 달성 할 수 있었다. 단일 프로브의 선단 사이즈 (전형적으로도 10㎛ 미만이고충분히 작은 URE 3a는) 직접되는 직경은 추출 및 MS 분석을 위해 ~ 10㎛, 진핵 세포의 많은 유형에 삽입한다. 셀에 단일 프로브 팁의 삽입 과정을 시각적 디지털 스테레오 현미경을 이용하여 모니터 할 수있다 (도 3b), 및 세포막을 침투 PBS (또는 새로운 세포 배양에서 질량 스펙트럼의 급격한 상당한 변화를 통해 확인할 수있다 세포 내 화합물 (도 3C 및 3D) 중간). 실험은 분자 종의 광범위한 종류를 검출하는 양성 및 음성 이온 모드 모두에서 수행 될 수있다. 아데노신 포스페이트는 (AMP가 ADP와 ATP)은 음이온 모드 (도 3C 및 d)에서 검출 된 반면, 예를 들어 18 가지 지질 종 sphingomyelins (SM) 및 포스파티딜콜린 (PC)를 포함하여, 포지티브 모드로 확인되었다. 단일 프로브 삽입 I 사이의 시간 지연세포 및 신호 검출 NTO 세포 대사의 거의 실시간 검색을 허용하는 일반적으로 2 초 미만이었다. SCMS는 세포 항암제 (예 OSW-1, 파클리탁셀, 독소루비신) 19]로 처리 된 실험에 적용 하였다. 상응하는 약물 농도 (즉, 10 nM 내지 100 nM 내지 1 μM, 10 μM) DMSO에 (디메틸 술폭 시드), 비 처리 된 세포를 사용하여 (DMSO만을 추가의 시리즈에서 4 시간 처리 후 HeLa 세포 내에서 검출 될 수있다 ) 컨트롤로. 약물의 MS 신호는 세포 PBS 또는 대조군 (도 3E) 내에 존재하지하지만 단일 프로브 MS 기법 (100 nM의 처리 결과,도 3f에 도시되어있다)를 사용하여 단일 세포 내에서 검출 하였다. 세포를 PBS (또는 새로운 세포 배양 배지)로 세정 하였다 때문에 내인성 대사 산물 (예, 세포 지질의 검출이 세포 화합물 및 오염물을 제거아데노신 디 포스페이트) 및 외인성 화합물 (예를 들어, 항암제) 단일 프로브 MS 기술은 세포 내 화합물을 분석 할 수 있음을 나타낸다.
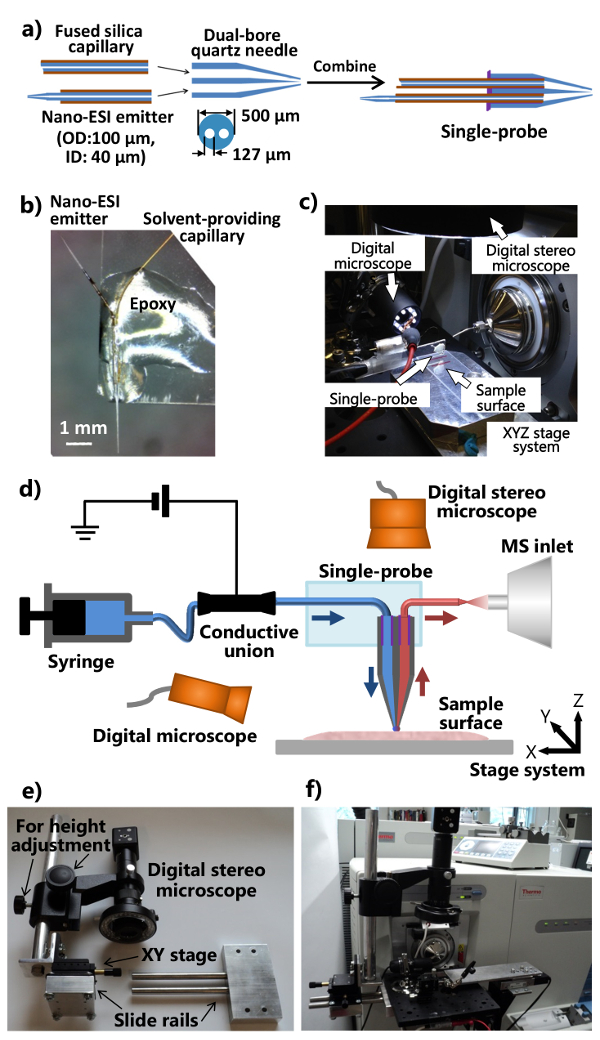
도 1 제조 및 주변 MSI 및 SCMS 분석 단일 프로브의 설치. a) 단일 프로브의 제작 방법. b) 유리 슬라이드. c) 상기 단일의 사진에 부착 제작 단일 프로브의 사진 질량 분광계. D에 부착 된 프로브 설정)을 질량 분석기와 결합 된 단일 프로브 설정의 다이어그램. 실험 동안, 샘플링 용매 연속적 주사기로부터 제공되고, 이온화 전압이 질량 분광계에서 도전성 조합에 적용하고, 두 개의 디지털 현미경의 샘플 위치를 모니터링하는 데 사용되며, 전동 XYZ 스테이지) 사용자 정의 디지털 입체경 시스템. F) 사진 광 보드를 통해 이온 소스 인터페이스 플랜지에 부착 된 디지털 입체경을 보여주는 사진을 시스템은 샘플의 움직임을 제어하는 데 사용되며, 질량 분석기는 분석. 전자에 사용됩니다. 여기를 클릭하십시오 이 그림의 더 큰 버전을 볼 수 있습니다.
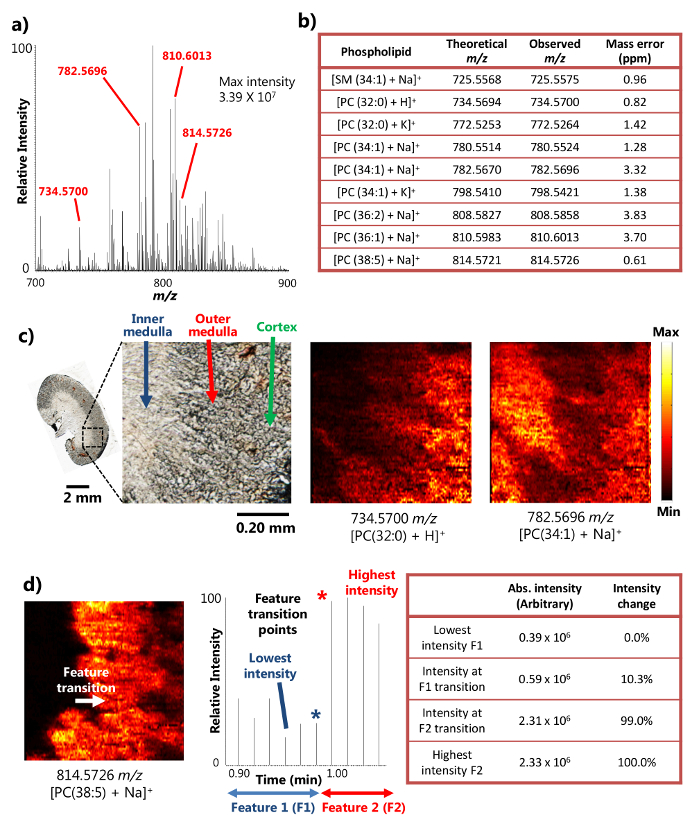
도 높은 공간 분해능 및 질량 마우스 신장 부의 주위 MSI 연구 2. 결과. a) 단일 프로브 MSI의 대표적인 질량 스펙트럼. 3.39 × 10 7 (임의 단위)에 도달 할 수있는 검출 된 대사 산물의 최대 강도. b) 검출 된 대사 물질의 선택) 그들의 질량 정확도. C되게의 MS 이미지 [PC (32 : 0) + H] +와 [PC (34 : 1) + 나 + 8.5 μm의 공간 해상도로 마우스 신장 섹션에서 촬영. PC : 포스파티딜콜린. 스케일 바 : 2mm; 0.20 mm (삽입) 라) 공간에 대한 MS의 이미지의 해상도 결정. [PC (38 : 5) + 나] + (참조 (15)로부터 허가를 적용). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 높은 질량 분해능으로 약물 치료를 HeLa 세포의 주위 SCMS 분석 3. 결과. a) 확대 된 직경이 <10 ㎛의 전형적인 크기를 나타내는 단일 프로브 팁의 사진. b) 사진의 시점에서 촬영 헬라 세포 내로 단일 프로브 삽입. 스케일 바 : 50 μm의.c) PC (포스파티딜콜린) 종. d) HeLa 세포 양 및 음 이온 모드 인치 EF 모두 포함)의 질량 스펙트럼의 SCMS 분석으로부터 검출 된 대사 물질의 대표적인리스트의 수의 식별을 가진 전형적인 양이온 모드의 질량 스펙트럼 제어 및 치료 (100 nM의 OSW-1) 세포 (참조 (16)로부터 허가를 적용). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 S1. 질량 분석 데이터를 수집하기위한 접점 신호를 생성하기 위해 사용 된 전자 장치의 회로도. 보거나이 도면 다운로드 여기를 클릭하세요.
토론
단일 프로브 모두 MSI 및 SCMS 실험에 사용할 수있는 다기능 장치이다. (변환 스테이지 시스템, 현미경, 이온 소스 인터페이스 플랜지 등)를 단일 프로브 설정 유연 기존 질량 분석계에 적용 할 수있는 부가 구성 요소로 설계된다. 단일 프로브 설정 종래 ESI 이온 소스 사이의 신속한 교환이 1 분 이내에 달성 될 수있다. 원칙적으로, 적절한 이온 소스 인터페이스 플랜지를 사용하여 단일 프로브 설정은 다른 질량 분광기에 적용 할 수있다. 또한, 다양한 시약을 포함하는 샘플 용매 크게 생체의 넓은 범위의 검출을 향상 반응성 MSI 및 SCMS 실험 단일 프로브 설정으로 사용될 수있다. 동물 조직 및 세포주뿐만 아니라, 단일 프로브는 또한 식물과 같은 다른 생물학적 시스템을 분석 할 수있다. 따라서 동일한 실험 장치와유사한 사용자 교육은 다양한 연구가 하나의 기기를 사용하여 수행 될 수 있고, 동일한 사용자가 최소 트레이닝 시간 및 장비 비용이 달성 될 효과적인 다목적 실험 수.
단일 프로브 MS 기술의 핵심 요소는 프로브 자체이다. 단일 프로브의 품질은 크게 두 MSI 및 SCMS 실험의 품질을 결정 성능에 상당한 영향을 미친다. 단일 프로브를 제조 할 때, 듀얼 보어 튜브의 내부의 모세 혈관이 안전하게 실험 중 용매 누출의 가능성을 제거하기 위해 접착되어 있는지 확인합니다. 오리피스가 모세관 프로브 제조 동안에 폐색되지 않도록 UV 경화성 에폭시 최소량을 사용하는 것이 중요하다.
단일 프로브를 생물학적 시료 (15) 상에 높은 공간 분해능 및 질량 주위 MSI를 수행하는 데 사용되었다. 주변 MSI의 가장 큰 장점 이상비 주변 방법 시료 제제 샘플 가까운 고유 상태 (8)에서 분석 될 수있는 진공 샘플링 환경에 대한 필요성과 함께 최소로 유지된다는 것이다. 대부분의 다른 주변 MSI 기술의 주요 장애물 중 하나는 공간 해상도 1의 부족이었다. 기초 탈착과 비교 MSI, 단일 프로브의 작은 팁 크기는 더욱 강력하고 효율적인 표면 액체 미세 추출의 높은 공간 해상도로 이어지는 작은 영역에 걸쳐 수행 될 수 있도록 (예 DESI 및 LAESI 등) 기법 주변 MSI 기술 (15)를 사용하여 달성 가장 높은 사람 사이에 8.5 μm의. 또한, 샘플링 용매의 성분을 조정하는 실험을 실시 추가적인 유연성을 제공한다. 예를 들어, 시약 (예 dicationic 화합물)을 함유하는 용매를 샘플링 대사 식별 PE의 개수의 상당한 증가를 허용 MSI 반응성 실험을 수행하는데 사용되어왔다연구 실험 20. 단일 프로브의 다른 장점은 전체 데이터 수집 프로세스 동안 동작의 용이성을 제공하는 통합 설계된다. 팁과 조직 표면 사이의 거리가 이온 신호 강도 및 안정성 평면 조직 절편을 구하고 상기 거리의 분산을 최소화하도록 조정 평탄화 표면 전도에 매우 민감하기 때문에 고품질 MSI 실험하기위한 키이다. 단일 프로브 MSI 기술 요철 표면의 높은 공간 MS 이미지를 획득하기에 적합하지 것을 따른다.
고품질의 프로브를 제조하는 것 외에도, 조심기구를 조정하는 것은 성공적인 MSI 실험을 위해 필수적이다. 모든 동조 단계 중에서, 조직 절편 표면 위의 단일 프로브 팁의 높이를 조정하는 것이 가장 중요한 일이다. 프로브의 높이를 조정할 때는, 샘플링 펌프 및 용매만을 용매 배경 이온 신호 observ 될 수 있도록 이온화 전압 켜에디션. 신중 조직 절편에서 강하고 안정된 이온 신호를 관찰 할 수있을 때까지 전동식 Z 단계 올려서 프로브 표면 거리를 감소시키면서 질량 스펙트럼의 변화를 모니터링; 이 프로브의 높이가 실험 기간 동안 MSI 데이터 수집을 위해 사용될 것이다. 또한, 최적화 된 용매 유량은 MSI 실험을 위해 필수적이다. 최적의 탐침 높이의 유량을 조정한다. 조직 표면에 용제 확산이 없도록 (즉, 유속이 너무 높은 경우) 또는 나노 ESI 터 (즉, 속도가 너무 낮은 흐름) 내부에 기포 형성.
단일 프로브는 bioanalysis을위한 다기능 장치입니다. MSI는 실험을 또한, SCMS 다른 진공에 비해 큰 장점이다 라이브 진핵 세포 (16)으로부터 상세한 화학적 정보를 밝히기 원위치 거의 실시간으로 수행 할 수있는 이러한 MALDI 10 SIMS 등 기초 SCMS 기술 ( (21) ). 프로브 팁의 작은 크기는 능력 라이브 진핵 세포에 삽입하고 추출 즉각적인 MS 분석을위한 세포를 이온화하는 화합물을 제공한다. 유사하게, 시약 (예 dicationic 화합물)를 포함하는 샘플링 용매는 SCMS 실험에 사용될 수 있으며, 세포 성분의 넓은 범위가 전보다 라이브 단일 셀에서 검출 될 수있다 (진행중인 연구의 데이터는 도시되지 않음). 실시간 분석에 의한 세포막 및 세포 내용물의 추출의 세포 침투 라이브 단일 세포 화학적 정보를 제공하지만, 조사중인 셀은 단일 프로브 SCMS 기술은 여전히 암시 실험 후에 사망한다 파괴적인 방법. 또한, 단일 프로브 탐침 나노 ESI 에미 쉽게 경험이없는 사용자 막히게 할 수있다. 장치의 막힘의 가능성을 줄이기 위해, CEL에 단일 프로브 팁을 삽입 할 때 핵에 손이 닿지 않도록 보장엘. 막힘이 발생하면, 장치가 막힌 프로브 팁 및 자작 또는 가열 코일 (16)을 사용하여 방출기 나노 ESI를 가열함으로써 재생 될 수있다. 단일 프로브 SCMS 기술의 다른 제한 사항은 접착 세포 (즉, 세포 표면에 부착 된) 현재 설정을 사용하여 분석 할 수 있다는 것이다. 그러나, 단일 프로브 MS 장치로 세포 조작 시스템을 도입함으로써, 전지의 광범위한 종류 향후 연구 될 수있다.
고품질 프로브 최적화 용매 유량을 얻는다 MSI 실험 마찬가지로 SCMS 연구에 중요하다. 용매 유량을 조정하는 경우, 단일 프로브 팁은 (즉, 세포 또는 배양 배지와 접촉없이) 샘플 위에 배치하고, 나노 ESI 내부 프로브 팁 또는 기포 형성로부터 용매 떨어지는이 없도록한다 이미 터.
공개
We have no conflict of interest to declare with the work presented here.
감사의 말
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
자료
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
참고문헌
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유