Method Article
مراقبة المكانية الفصل في استعمار سطح الميكروبية السكان
In This Article
Summary
دور نفسك (الفصل المكاني) في سيناريوهات التطور يمكن فحصها باستخدام أنظمة الميكروبية بسيطة في المختبر التي تتيح التحكم تعديل التوزيع المكاني. عن طريق تعديل كثافة الخلية مؤسس، ومختلف مستويات متنوعة يمكن تصور استخدام سلالات بكتيرية fluorescently المسمى في الأغشية الحيوية مستعمرة العصوية الرقيقة.
Abstract
Microbes provide an intriguing system to study social interaction among individuals within a population. The short generation times and relatively simple genetic modification procedures of microbes facilitate the development of the sociomicrobiology field. To assess the fitness of certain microbial species, selected strains or their genetically modified derivatives within one population, can be fluorescently labelled and tracked using microscopy adapted with appropriate fluorescence filters. Expanding colonies of diverse microbial species on agar media can be used to monitor the spatial distribution of cells producing distinctive fluorescent proteins.
Here, we present a detailed protocol for the use of green- and red-fluorescent protein producing bacterial strains to follow spatial arrangement during surface colonization, including flagellum-driven community movement (swarming), exopolysaccharide- and hydrophobin-dependent growth mediated spreading (sliding), and complex colony biofilm formation. Non-domesticated isolates of the Gram-positive bacterium, Bacillus subtilis can be utilized to scrutinize certain surface spreading traits and their effect on two-dimensional distribution on the agar-solidified medium. By altering the number of cells used to initiate colony biofilms, the assortment levels can be varied on a continuous scale. Time-lapse fluorescent microscopy can be used to witness the interaction between different phenotypes and genotypes at a certain assortment level and to determine the relative success of either.
Introduction
في العقود الأخيرة، وقد تم الاعتراف الميكروبات كما المجتمعات الاجتماعية المرتبطة مختلف النظم الإيكولوجية على الأرض 1،2. وعلى النقيض من الثقافات العوالق المستخدمة في الممارسة المخبرية العامة والجراثيم في البيئة تظهر مجموعة متنوعة من هياكل المجتمع المكانية اعتمادا على الإعداد البيئي. ويمكن استخدام أنظمة الميكروبية بسيطة لفهم ذلك من البنى المكانية على تطور التفاعلات الاجتماعية 3،4. أبرزت المنشورات في السنوات الماضية 2-3 استخدام كلا النظامين نموذج حقيقية النواة وبدائية النواة تأثير البنى المكانية على استقرار التعاون داخل السكان الميكروبية 5-8. بالإضافة إلى ذلك، تلزم التفاعل بين الميكروبات، مثل التمثيل الغذائي عبر الرضاعة، قد تغير أيضا التوزيع المكاني للشركاء التفاعل 9-11. يتم فحص تأثير الهيكل المكاني في هذه الدراسات معظمها باستخدام سطح المرفقة خلايا اطئة تسكن ذلكالأغشية الحيوية -called أو في المستعمرات تنمو على سطح سيلة أجار. الانجراف الوراثي الناتجة عن تشكيلة مكانية عالية ويمكن ملاحظة في المستعمرات الجرثومية حيث نضوب المغذيات في حافة النتائج التوسع انقسام الخلايا بوساطة في سلسلة من الاختناقات الوراثية التي تسبب ارتفاع احتمال تثبيت المحلي لبعض linages نسيلي 12. الانجراف الوراثي يمكن بالتالي استخدامها لدراسة دور الفصل المكاني في المستعمرات الجرثومية.
في البيئة، والأغشية الحيوية هي مجتمعات متعددة الأنواع وتحيط بها الذات المنتجة مصفوفة البوليمرية (13). هيكل بيوفيلم، وظيفة والاستقرار تعتمد على شبكة معقدة من التفاعلات الاجتماعية حيث إشارات الصرف البكتيريا، مكونات المصفوفة والموارد، أو التنافس على الفضاء والمواد الغذائية باستخدام السموم والمضادات الحيوية. العصوية الرقيقة هو التربة مسكن والبكتيريا استعمار الجذر الذي يطور درجة عالية من التنظيم المجتمعات بيوفيلم 14. قياسا لالاجتماعيةالحشرات، B. الخلايا الرقيقة توظيف قسم من استراتيجية العمل وتطوير جزء من السكان المنتجين خارج الخلية المصفوفة وأكلة لحوم البشر، وخلايا متحركة، بكتيريا كامنة وأنواع أخرى من الخلايا 15،16. عملية التمايز هو دينامية، ويمكن تعديلها من قبل الظروف البيئية 17،18.
استراتيجيات الاستعمار السطح بواسطة البكتيريا يمكن التلاعب بها بسهولة تحت ظروف المختبر عن طريق تعديل تركيز أجار في وسائل الإعلام نمو. عند مستويات منخفضة أجار (0.2-0.3٪)، والبكتيريا إيواء سياط نشطة قادرة على السباحة، في حين شبه صلبة أجار (0،7-1٪ أجار) يسهل تنتشر السوط المدفوعة باعتبارات المجتمعات المحلية، ودعا يحتشدون 19-21. في حالة عدم وجود السوط، وبعض سلالات بكتيرية قادرة على نقل أكثر المتوسطة شبه صلبة عن طريق انزلاق، أي النمو والتوسع السكاني يعتمد سهلت مصفوفة exopolysaccharide وغيرها من المركبات hydrophobin يفرز 22-24. وأخيرا، والبكتيريا التي هي capabl(ه) من شكل تطوير بيوفيلم مستعمرات معقدة معماريا على وسط أجار الصلب (1.2-2٪) 14،17،25. في حين يتم فحص هذه الصفات في المختبر عن طريق تعديل على وجه التحديد الظروف، في الموائل الطبيعية هذه الاستراتيجيات الانتشار السطح قد عبور تدريجيا من واحدة إلى أخرى تبعا للظروف البيئية 26. بينما واحدة حركية على الخلايا أمر بالغ الأهمية خلال الشروع في تطوير بيوفيلم في واجهة الهواء السائل في البكتيريا إيجابية الجرام على حد سواء و-سلبية 27، الأغشية الحيوية مستعمرة معقدة من B. لا تتأثر الرقيقة بالحذف من سوطي الحركة 28. ومع ذلك، التنظيم المكاني خلال تطوير B. الرقيقة الأغشية الحيوية مستعمرة تعتمد على كثافة من اللقاح البكتيري يستخدم لبدء بيوفيلم 8.
هنا، ونحن نستخدم B. الرقيقة لإظهار أن الفصل المكاني أثناء الاستعمار سطح يعتمد على آلية motili مستوى السكانتاي (أي يحتشدون أو الانزلاق)، والتنمية مستعمرة بيوفيلم يعتمد على كثافة الخلية مؤسس. نقدم أداة المجهر الفلورسنت التي يمكن تطبيقها لمراقبة باستمرار نمو الجراثيم بيوفيلم والاستعمار السطحية ومتنوعة على المستوى الكلي. وعلاوة على ذلك، يتم تقديم وسيلة القياس الكمي لتحديد وفرة سلالة النسبية في عدد السكان.
Protocol
1. إعداد الثقافة وسائل الإعلام، صلبة نصف آجار وبيوفيلم لوحات، قبل الثقافات
- إعداد المتوسط لالعج وانزلاق
- حل 2 غرام من لينوكس مرق (LB) و 0.7 غرام من آجار آجار في المياه تبادل الأيونات 100 مل والأوتوكلاف لمدة 20 دقيقة في 120 درجة مئوية. استخدام كميات صغيرة (50-200 مل) لتحسين استنساخ بين التجارب.
- مباشرة بعد التعقيم، وأغلق الغطاء للزجاجة متوسطة للحد من تبخر ومكان في 55 درجة مئوية الحاضنة لا يقل عن 2 ساعة.
- بعد أن خفف من درجة حرارة متوسطة إلى 55 درجة مئوية، صب 20 مل أجار LB المتوسطة إلى 90 مم البوليسترين طبق بيتري تحت مختبر غطاء العقيمة. للتجارب مرور الزمن، صب 5 مل أجار LB المتوسطة في 35 مم البوليسترين طبق بيتري.
- إغلاق طبق بتري على الفور بعد سكب، كومة لا يزيد عن 4 لوحات على رأس كل منهما الآخر، والسماح للالمتوسطة أجار يصلب لا يقل عن 1 ساعة.
- 2xSG المتوسطة فالتعويض عن مستعمرة الأغشية الحيوية
- حل 1.6 غرام من المغذيات مرق، 0.2 غرام من بوكل، 0.05 غرام من MgSO 4 7H 2 O، و 1.5 غرام من آجار آجار في المياه تبادل الأيونات 100 مل والأوتوكلاف لمدة 20 دقيقة في 120 درجة مئوية. استخدام كميات صغيرة (50-200 مل) لتحسين استنساخ بين التجارب.
- مباشرة بعد التعقيم، وأغلق الغطاء للزجاجة المتوسطة لتقليل التبخر ووضع الزجاجة في 55 درجة مئوية الحاضنة لا يقل عن 2 ساعة.
- بعد درجة حرارة متوسطة لديها إلى 55 درجة مئوية، تعديل نفسها بنفسها، إضافة 0.1 مل فلتر تعقيم 1M الكالسيوم (NO 3) 2 الحل، تعقيمها 0.1 مل تصفية 100 ملي MnCl 2 الحل، 0.1 مل فلتر تعقيم 1 ملم FeSO 4 الحل، و 0.5 مل معقم محلول الجلوكوز 20٪.
- في مختبر غطاء العقيمة، صب 20 مل المتوسطة أجار 2X سان جرمان في 90 مم البوليسترين طبق بيتري. للتجارب مرور الزمن، صب 5 مل أجار LB المتوسطة في 35 مم البوليسترين طبق بيتري.
- كلوسالبريد طبق بتري على الفور بعد سكب، كومة من لوحة فوق بعضها البعض، ولكن ليس أكثر من 4 لوحات، والسماح للالمتوسطة أجار ليصلب لا يقل عن 1 ساعة.
- التحضير للثقافات مبدئ
ملاحظة: B. الرقيقة 168، NCIB 3610 سلالات المشتقات المستخدمة في الأساليب المذكورة أدناه جوهري تنتج البروتينات الدفيئة أو أحمر ومضان ووصفت قبل 8،27. يتم تخزين سلالات بشكل روتيني في الفريزر -80 درجة مئوية.- تطعيم الثقافات بداية من مخزونات الكربون -80 درجة في 3 مل LB المتوسطة واحتضان بين عشية وضحاها (16-18 ساعة) عند 37 درجة مئوية مع الأفقية تهز (225 دورة في الدقيقة). لا احتضان الثقافة أطول من 18 ساعة كما يعزل البرية من B. الرقيقة هي في معظمها عرضة لتجميع وتشكيل بيوفيلم في أنبوب الاختبار.
2. المشارك تلقيح Fluorescently صفتها البكتيرية سلالات السطحي نشر
- تجفيف لوحات أجار شبه الصلبة لليحتشدون وانزلاق B. الرقيقة.
- لوحات أجار الجافة يحتشدون والانزلاق لمدة 20 دقيقة قبل التلقيح. لوحات الجافة كشف في غطاء تدفق الصفحي (انظر الشكل 1).
ملاحظة: يحتشدون الجرثومي وانزلاق تعتمد على جفاف المتوسطة أجار شبه صلبة. تجفيف كاف يسمح تراكم المياه على المدى المتوسط أجار مما أدى إلى السباحة بوساطة السوط. مطولة النتائج وقت التجفيف في عدم وجود يحتشدون.
- لوحات أجار الجافة يحتشدون والانزلاق لمدة 20 دقيقة قبل التلقيح. لوحات الجافة كشف في غطاء تدفق الصفحي (انظر الشكل 1).
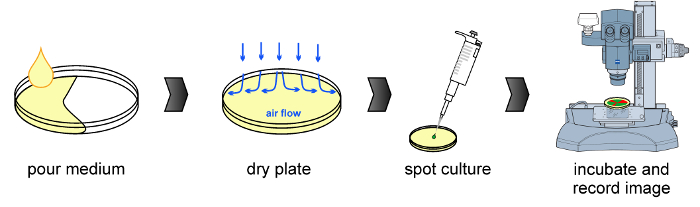
الشكل 1:.. سير العمل التجريبي وصفت الإجراء المشترك في الشكل، بما في ذلك إعداد المتوسطة زراعة، تجفيف الكشف عن لوحة، والتلقيح ومضان المجهر (من اليسار إلى اليمين) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- شارك في التلقيحمن الثقافات البكتيرية عن العج وانزلاق
- تحديد الكثافة البصرية من بداية الثقافات بين عشية وضحاها في 600 نانومتر، وخلط كثافة تطبيع إنتاج البروتين سلالات الدفيئة وأحمر فلوري من B. الرقيقة NCIB 3610 أو مشتق Δ حاج في أنبوب 1.5 مل التفاعل. على سبيل المثال، مزيج 100 ميكرولتر من سلالة 1 مع (100 * [OD 600 من ثقافة بين عشية وضحاها من سلالة 1] / [OD 600 من ثقافة بين عشية وضحاها من سلالة 2]) ميكرولتر من سلالة 2. أقل ما يقال دوامة (3 ثانية بسرعة قصوى) ل توزيع متجانس.
ملاحظة: B. يتم تلقيح الرقيقة NCIB 3610 سلالات لمراقبة يحتشدون، في حين تستخدم المشتقات Δ حاج من أجل انزلاق. - بقعة 2 ميكرولتر من ثقافة مختلطة في منتصف لوحة المجفف مسبقا (انظر الشكل 1) ومزيد من الجفاف لوحة لمدة 10 دقيقة بعد التلقيح.
- احتضان لوحات عند 37 درجة مئوية تستقيم للسماح للرطوبة الزائدة لتتكثف على الغطاء وليس على سطح أجار. <ر /> ملاحظة: فترة حضانة ل B. الرقيقة يحتشدون عادة بين 8-16 ساعة. عموما، على حافة سرب تصل جانب طبق بيتري 90 مم في 8 ساعات. انزلاق هو عملية بطيئة ويتطلب ما لا يقل عن 16-42 ساعة من الحضانة. بعد 36 ساعة، وأمام انزلاق تصل جانب 90 مم طبق بيتري.
- للتجارب مرور الزمن، وضع 35 مم أطباق بتري في غرفة مرحلة الحضانة مسخن وضعت في 37 درجة مئوية. تأكد من أن غطاء طبق بيتري لا تزال إزالة طوال مدة التجربة. تعيين غطاء الحاضنة مرحلة إلى 40 درجة مئوية للتحايل على تشكيل الرطوبة على الجزء العلوي من الحاضنة.
- تحديد الكثافة البصرية من بداية الثقافات بين عشية وضحاها في 600 نانومتر، وخلط كثافة تطبيع إنتاج البروتين سلالات الدفيئة وأحمر فلوري من B. الرقيقة NCIB 3610 أو مشتق Δ حاج في أنبوب 1.5 مل التفاعل. على سبيل المثال، مزيج 100 ميكرولتر من سلالة 1 مع (100 * [OD 600 من ثقافة بين عشية وضحاها من سلالة 1] / [OD 600 من ثقافة بين عشية وضحاها من سلالة 2]) ميكرولتر من سلالة 2. أقل ما يقال دوامة (3 ثانية بسرعة قصوى) ل توزيع متجانس.
3. المشارك تلقيح Fluorescently صفتها البكتيرية سلالات مختلفة مع كثافات الخلية الأولية
- تجفيف لوحات أجار لمستعمرة تشكيل بيوفيلم من B. الرقيقة.
- تجف لوحات للتنمية مستعمرة بيوفيلم دون غطاء في تدفق الصفحيغطاء محرك السيارة لمدة 15 دقيقة قبل التلقيح.
ملاحظة: نتائج التجفيف غير كافية في زيادة الرطوبة والسباحة أو يحتشدون قد يكون ممكنا 29. تجفيف النتائج طويلة جدا في المستعمرات بيوفيلم الصغيرة.
- تجف لوحات للتنمية مستعمرة بيوفيلم دون غطاء في تدفق الصفحيغطاء محرك السيارة لمدة 15 دقيقة قبل التلقيح.
- إعداد 10 أضعاف الثقافات كاتب المخففة للمستعمرة الأغشية الحيوية
- مزيج 100 ميكرولتر من البروتين الأخضر- وأحمر فلوري إنتاج الثقافات بداية ليلة وضحاها من B. الرقيقة 168 في أنبوب رد فعل 1،5 مل وأقل ما يقال دوامة لتوزيع متجانس. إعداد سلسلة التخفيف 10 أضعاف في LB المتوسطة.
- بقعة 2 ميكرولتر من غير المخففة أو 10 1، 10 2، 10 3، 10 4 المخفف الثقافات المختلطة على لوحة تحتوي على المتوسط الذي يحفز بيوفيلم.
ملاحظة: يمكن البدء 6-9 المستعمرات بيوفيلم على واحد 90 ملم طبق بيتري مع الأخذ بعين الاعتبار أن المستعمرات يتم فصل على مسافة متساوية من بعضها البعض. - احتضان لوحات عند 30 درجة مئوية تستقيم للسماح للرطوبة الزائدة لتتكثف على الغطاء وليس على سطح أجار.
ملاحظة: فترة حضانة ل B. الرقيقة بيوفيلم ما بين 1-3 أيام. عموما، بيوفيلم مستعمرة B. الرقيقة يصل متوسط حجم وبنية معقدة في 2 يوما. - للتجارب مرور الزمن، وضع اللقاح واحد في منتصف 35 مم طبق بيتري ووضع طبق في غرفة مرحلة الحضانة مسخن وضعت في 30 درجة مئوية. تأكد من أن الجزء العلوي من طبق بيتري لا تزال إزالة طوال مدة التجربة. تعيين غطاء الحاضنة مرحلة إلى 35 درجة مئوية للتحايل على تشكيل الرطوبة على الجزء العلوي من الحاضنة.
4. نيون الكشف المجهري للصفتها سلالات
- وصف معدات التصوير.
- للكشف عن الاستعمار السطحية وإشارة مضان، واستخدام التكبير المجهر بمحرك مضان ستيريو (انظر قائمة مفصلة في المواد الجدول) مجهزة الهدف 0.5X PlanApo، وهما الصماممصادر الباردة ضوء (واحد للكشف عن مضان واحد للضوء المرئي)، ومجموعات تصفية GFP (الإثارة في 470/40 نانومتر، والانبعاثات في 525/50 نانومتر) وMRFP (الإثارة في 572/25 نانومتر، والانبعاثات في 629 / 62 نانومتر)، وكاميرا أحادية اللون عالية الدقة.
- أداء الحصول على الصور ومعالجتها مع البرمجيات المناسبة المتاحة للمجهر ستيريو التكبير بما في ذلك متعددة وحدات مرور الزمن. لالفاصل الزمني التجربة، استخدام حاضنة مرحلة التسخين القياسية لنصرة المجهر ستيريو التكبير مع محول.
- تصوير يحتشدون وانزلاق التوسع
- استخدام أدنى التكبير للقبض على أكبر مساحة ممكنة من لوحة 90 ملم. تعيين أصل التلقيح (وسط طبق بيتري 90 ملم) إلى الزاوية الحقل مرئية لرصد شعاعي التوسع البكتيرية ومضان.
- ضبط وقت التعرض الأمثل اعتمادا على قوة إشارة مضان.
ملاحظة: للحصول على expre جوهريالجينات مضان ssed في B. الرقيقة، الأخضر- والأحمر ومضان مع أوقات التعرض 1.5 و 3 ثانية يمكن استخدامها، على التوالي. بالإضافة إلى ذلك، 10 مللي ثانية وقت التعرض المناسب للضوء المرئي.
- استخدام التكبير التي تسمح للكشف عن مستعمرة بيوفيلم كاملة وضبط مستعمرة في منتصف مجال الرؤية.
ملاحظة: بالنسبة لليحتشدون والتوسعات انزلاق، ومرات التعرض المثلى للكشف عن الإشارات مضان في المستعمرات بيوفيلم يعتمد على مستوى التعبير عن الجينات ترميز البروتين الفلورسنت. للحصول على نتائج تمثيلية أدناه، تم الكشف عن الأخضر- والأحمر ومضان باستخدام 1 و 3 فترات التعرض ثانية، على التوالي. - للتصوير مرور الزمن، الحصول على الصور في فترات معينة باستخدام مرات التعرض المستمر.
- حفظ الصور المسجلة مضان مجهر تشريحي في تنسيق ملف معترف بها من قبل برنامج ImageJ لتحليل البيانات الكمي.
5. داتوتحليل
- لتحليل المنطقة من قبل كل سلالة الفلورسنت وصفت بشكل مختلف المحتلة، فتح الملف من الاهتمام في برنامج ImageJ موسع مع البرنامج المساعد BioVoxxel.
- عندما تظهر نافذة تسمى "بيو تنسيقات خيارات استيراد" حيث لا يوجد سوى الخيارات "مفتوحة طوال سلسلة" و "Autoscale" يتم اختيار فتح الملف بالنقر على "موافق".
ملاحظة: يتم عرض الملفات كما كومة من ثلاث صور، واحد لكل قناة يستخدم لتسجيل الصورة في المجهر (الأخضر- والأحمر ومضان ومشرق الميدان صور). - فصل كومة إلى صور قناة الفردية عن طريق اختيار "صورة" - "الأكوام" - "كومة من الصور" في لوحة التحكم يماغيج.
ملاحظة: الصور تظهر ويتم ترقيم كما 1/3 (قناة خضراء)، 2/3 (القناة الحمراء) و03/03 (مشرق الميدان). هنا، يتم استبعاد لصورة مشرق الميدان من التحليل.
- عندما تظهر نافذة تسمى "بيو تنسيقات خيارات استيراد" حيث لا يوجد سوى الخيارات "مفتوحة طوال سلسلة" و "Autoscale" يتم اختيار فتح الملف بالنقر على "موافق".
- لتحليل الصور، وتحويل كل إلى صورة 8 بت عن طريق تحديد"صورة" - "نوع" - "8 بت".
- لتحديد المنطقة المحتلة في بكسل 2، إعادة تعيين حجم الصور باستخدام "تحليل" - "تعيين مقياس". عندما يظهر نافذة مع خيارات مختلفة الحجم، إعادة تعيين الحجم عن طريق اختيار "انقر لإزالة مقياس". التحقق من الخيار "جلوبل" لإزالة النطاق لجميع الصور مفتوحة.
- لإزالة الخلفية، رسم المنطقة البيضاوي (المنطقة من اهتمام، ROI) خارج منطقة الفلورسنت باستخدام أداة "البيضاوي" في لوحة التحكم يماغيج.
- للتأكد من أن حجم البيضاوي الخلفية هو نفسه بالنسبة لجميع الصور تحليلها، إضافة إلى مدير العائد على الاستثمار عن طريق [ر] حرف من لوحة المفاتيح. نافذة مدير العائد على الاستثمار يأتي حيث العائد على الاستثمار البيضاوي الخلفية يمكن انقاذه عبر "عن" - خيارات "حفظ".
- إذا كان العائد على الاستثمار البيضاوي الخلفية مرئيا على الصورة، وقياس شدة المجال عن طريق اختيار "تحليل" - "قياس".
ملاحظة: النتائجتظهر نافذة فيها وغيرها يتم عرض كثافة مضان يعني في العمود بعنوان "المتوسط". - طرح قيمة متوسط كثافة مضان الخلفية من الصورة عن طريق إلغاء تحديد خلفية العائد على الاستثمار البيضاوي، والنقر فوق "عملية" - "الرياضيات" - "طرح" وإدراج القيمة المقاسة.
- تطبيق عتبة للصورة عن طريق "صورة" - "ضبط" - خيار "عتبة". حدد طريقة أوتسو والأبيض والأسود (B & W). التحقق من الخيار "الخلفية المظلمة" وتوظيف عتبة بالنقر على "تطبيق".
ملاحظة: يتغير صورة إلى صورة ثنائية حيث أظهرت المنطقة فوق عتبة باللون الأبيض وأن أدناه يظهر عتبة باللون الأسود. - حدد كل شيء فوق عتبة عن طريق "تحليل" - خيار "تحليل الجزيئات". في الإطار مع الإعدادات، والحفاظ على الخيارات الافتراضية والحفاظ على "عرض النتائج" و "Summarize "خيارات التحقق. انقر على زر" موافق "لعرض ملخص في إطار النتائج وعرض المنطقة المحتلة في العمود بعنوان" المساحة الكلية ".
النتائج
نظم مختبر مجموعات البكتيريا توفر نهجا جذابة لاستكشاف الأسئلة البيئية أو التطورية. هنا، ثلاثة أنماط الاستعمار سطح B. واستخدمت الرقيقة لفحص مظهر تشكيلة السكان، أي الفصل بين متطابقة وراثيا، ولكن مختلفة fluorescently سلالات المسمى. يحتشدون، وهو السوط تعتمد حركة سطح الجماعي من B. الرقيقة، والنتائج في يقطنها خليط سكاني كبير. في هذه المستعمرات يحتشدون، والبكتيريا الدفيئة وأحمر فلوري المناطق المستعمرة كانت متداخلة (انظر الشكل 2A). يمكن أن يتبع الاستعمار سطح السريع في الوقت المناسب (فيديو الشكل 1). خلال يحتشدون من الرقيقة باء، وهو طبقة رقيقة من الخلايا يوسع من مركز التلقيح بعد بضع ساعات من الحضانة (انظر الشكل 2B).
4752 / 54752fig2.jpg "/>
الشكل 2: العج توسيع B. . الرقيقة تحتوي مستعمرة يحتشدون سلالات الدفيئة والحمراء الفلورسنت التي كانت مختلطة 1: 1 قبل التلقيح. تم الكشف عن (A) بعد 15 ساعة، والأخضر- والأحمر ومضان (GFP وطلب تقديم العروض، على التوالي) مع مرشحات مضان المناسبة. (ب) صور من طبقة رقيقة من يحتشدون B. وتظهر الرقيقة في نقاط زمنية مختارة المستخرجة من فيديو الشكل 1. شريط مقياس = 5 ملم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
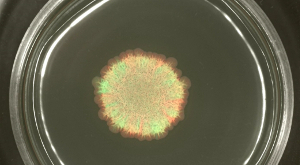
ومع ذلك، عندما B. سلالات الرقيقة، التي تفتقر سياط وظيفية ولكنها قادرة على الانتشار مع مساعدة من إنتاج exopolysaccharide، hydrophobin وsurfactin، شوهد على وسط أجار شبه صلبة، تم فصل السلالات وصفت بشكل مختلف في مواطنه معينالقطاعات INED (انظر الشكل 3A). تطوير مستعمرة انزلاق يمكن تسجيلها في الوقت المناسب (انظر الشكل 3B أو فيديو الشكل 2).

الشكل (3): انزلاق مستعمرة B. . الرقيقة تحتوي مستعمرة سلالات الدفيئة والحمراء الفلورسنت التي كانت مختلطة 1: 1 قبل التلقيح. تم الكشف عن (A) بعد 24 ساعة، والأخضر- والأحمر ومضان (GFP وطلب تقديم العروض، على التوالي) مع مرشحات مضان المناسبة. (ب) صور من B. وتظهر الرقيقة انزلاق القرص عند نقاط زمنية محددة المستخرجة من فيديو الشكل 2. شريط مقياس = 5 ملم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
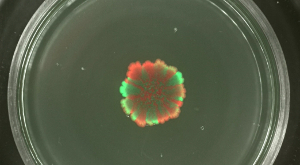
في حين أن مستويات متنوعة من يحتشدون وسليلا يمكن تعديل دينغ المستعمرات التوسع والفصل المكاني من سلالات الفلورسنت وصفت بشكل مختلف في بيوفيلم مستعمرة يمكن أن تتأثر كثافة خلية البداية. عندما بيوفيلم مستعمرة B. بدأ الرقيقة مع كثافة الخلايا عالية من السكان مختلطة، وأظهرت السلالات الدفيئة والحمراء الفلورسنت الصغيرة أو أي تشكيلة المكانية (انظر الشكل 4). على العكس من ذلك، عندما كانت كثافة الخلية لبدء biolfilm منخفضة، ويمكن أن يتم الكشف عن القطاعات الأخضر- والأحمر ومضان واضحة بواسطة المجهر مضان. وكان مستوى تشكيلة يعتمد بشكل واضح على مستوى التخفيف من بيوفيلم الشروع السكان. فيديو الشكل 3 و 4 تقديم توسيع مستعمرة لأدنى وأعلى تخفيف من الضغوط تلقيح.

الشكل 4: مستوى متنوعة في الأغشية الحيوية مستعمرة B. الرقيقة في. المختلفة الكثافة خلية أولية ترد الأغشية الحيوية مستعمرة من سلالات الأخضر- والأحمر ومضان بعد 2 أيام التي تم تلقيح مع مختلف الكثافات الخلية الأولية (من فوق لتحت: غير المخفف إلى 10 5 مرات المخفف بدء الثقافات، على التوالي). شريط مقياس = 5 ملم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
نسبة السلالات الدفيئة والأحمر الفلورسنت يمكن زيادة كميا باستخدام برنامج ImageJ التي تسمح للتوصيف الكمي من التركيبة السكانية والقدرة التنافسية من السلالات المستخدمة في التجارب.
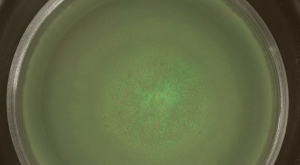
فيديو الشكل 1: الفاصل الزمني ايماجوفاق من يحتشدون B. بدأت الرقيقة مع 1: 1 خليط من سلالات الدفيئة والحمراء الفلورسنت (انقر بالزر الأيمن للتحميل.) ويظهر شريط الفيديو دورة زمنية من 10 ساعة. شريط مقياس = 7 ملم.

فيديو الشكل 2: الزمان الصور انقضاء انزلاق B. بدأت الرقيقة مع 1: 1 خليط من سلالات الدفيئة والحمراء الفلورسنت (انقر بالزر الأيمن للتحميل.) ويظهر في الشريط مدار الساعة من 24 ساعة. شريط مقياس = 5 ملم.
الشكل الفيديو 3: الزمان الصور انقضاء B. الأغشية الحيوية مستعمرة الرقيقة بدأت مع 1: 1 مزيج من الأخضر- وسلالات أحمر فلوري بكثافة عالية الخلية (انقر بزر الماوس الأيمن للتحميل.) ويظهر شريط الفيديو دورة زمنية من 48 ساعة. شريط مقياس = 5 ملم.
فيديو الشكل 4: الزمان الصور انقضاء B. الأغشية الحيوية مستعمرة الرقيقة بدأت مع 1: 1 خليط من سلالات الدفيئة وأحمر فلوري في كثافة الخلايا منخفضة. (انقر بزر الماوس الأيمن للتحميل.) ويظهر شريط الفيديو دورة زمنية من 48 ساعة. شريط مقياس = 5 ملم.
Discussion
توافر الأدوات الفلورية للبكتيريا يسهل ليس فقط دراسة التعبير الجيني غير متجانس 30،31 والبروتين توطين 32، ولكن أيضا لتحليل التوزيع المكاني للسلالات داخل الكتلة السكانية 8. علامات الفلورسنت مع مختلف بما فيه الكفاية الإثارة وانبعاث موجات تسمح لتوطين بوضوح سلالتين التي لا يمكن تمييزها إلا من بعضها البعض عندما مختلطة. بروتوكول صفها ويمكن استخدام لمراقبة ديناميات السكان في ثقافات متباينة، على سبيل المثال تجارب المنافسة أو التآزر بين السلالات أو الأنواع. لا يقتصر القدرة على تحديد فرة نسبية وصفت من fluorescently سلالات في يقطنها خليط سكاني على السطح يحتشدون المرفقة، انزلاق، أو المستعمرات بيوفيلم، ولكن يمكن أن تستخدم أيضا لأنظمة بيوفيلم متعددة الخلايا الأخرى، بما في ذلك المغمورة، وتدفق خلية أو الهواء المتوسط واجهة الأغشية الحيوية 27،33-35.
_content "> في حين أن التقنية التي جرى طرحها هي أداة قوية للكشف عن التوزيع المكاني للسلالات والتجارب مسابقة التصميم، كما أنه يسمح التالية التجانس التعبير الجيني في مستعمرات في التوسع. تنطبق الشروط زراعة وصفها هنا ل B. الرقيقة والمعلمات الدقيق للتوسع في أجار قد تتطلب وسائل الإعلام الأمثل للأنواع أو سلالات 20 أخرى. وضع العينات في غرفة الحضانة في حين يسمح التصوير المجرب لمتابعة ديناميات السكان في الوقت المناسب، على الرغم من أن وينبغي إيلاء الاهتمام لمستوى الرطوبة داخل الغرفة أثناء الحضانة.تتطلب تقنيات وصفها هنا أيضا التعديل الوراثي للسلالات بكتيرية فحص بحيث سلالات تعبر عن علامات الفلورسنت التي يمكن تمييزها عن بعضها البعض. وعلاوة على ذلك، بالاضافة الى وجود الإثارة متميزة والأطياف الانبعاثات، فمن المستحسن أن اثنين من علامات الفلورسنت اختار لها ضليع في الرياضيات مماثلةغلة أم (أي نسبة من الفوتونات تمتص التي تنبعث) ويتم التعبير في مستوى مماثل. وبالإضافة إلى ذلك، والتغيرات الكثافة النسبية في وقت يمكن قياسها وتطبيع إلى وقت نقطة في وقت مبكر من تجربة. الزيادة أو الانخفاض النسبي يمكن بعد ذلك مقارنة بين fluorophores مختلفة مع كفاءات الكم مختلفة. وبالنسبة للنظام التجريبي المقدمة، تم اختبار مختلف البروتينات الأخضر- وأحمر فلوري سابقا 36،37 لاختيار لأزواج الفلورسنت المثلى التي يمكن الكشف عنها في B. الرقيقة. ينبغي تحديد وقت التعرض الأمثل لكل بروتين فلوري وعينة. قد تكون هناك حاجة الكثافة خلية معينة أو طبقات متعددة من الخلايا للكشف عن إشارة بكفاءة بين السكان. قد يكون بعض البروتينات الفلورية كثافة منخفضة في الخلايا البكتيرية بسبب التعبير غير فعالة و / أو الترجمة من البروتين، وبالتالي انخفاض العائد الكم. هذه علامات الفلورسنت غير فعالة يمكن صاستخرج حساسية النظام وتمديد الوقت اللازم للكشف عن سلالات بكتيرية وربما أدى إلى السمية الخلوية التي كتبها ضوء الإثارة. شدة الفلورسنت يمكن وفقا لذلك تعديل عن طريق تغيير المروج تستخدم للتعبير عن مراسل ترميز الجين الفلورسنت. مستوى التعبير التي هي مرتفعة جدا يمكن أن يؤدي إلى الإفراط في الإنتاج غير الضروري من البروتين الفلوري مما يؤدي إلى تكاليف اللياقة البدنية الضارة للبكتيريا. عند إجراء التجارب المنافسة، ينبغي للمرء النظر في تكلفة معين إنتاج بروتين فلوري في الخلايا. تجارب السيطرة، حيث يتم تبديل علامات الفلورسنت بين سلالات تنافس أو حيث تنافس اثنين من سلالات إسوي تختلف فقط في علامات من الفلورسنت ضد بعضها البعض، هناك حاجة دائما لتحديد أي انحياز علامة واحدة. وعمر من البروتينات الفلورية داخل الخلايا قد تؤثر أيضا على كثافة يقاس. بالإضافة إلى ذلك، تألق ذاتي من بعض مسكوكة البكتيريةالصورة قد تتطلب استخدام علامات الفلورسنت مختلفة أخرى من وصفها هنا.
لتحديد بالضبط التوزيعات وفرة المكانية من السلالات البكتيرية واضحة، وإشارة الخلفية التي تنشأ من أول بروتين فلوري أثناء استخدام فلتر مضان للعلامة فلوري الثانية والعكس بالعكس ينبغي اختبار فردي على عينات الأحادية (التي تحتوي على البكتيريا المنتجة فقط علامة واحدة ). وهذا يسمح للالطرح تداخل شدة إشارة الفلورسنت. الأهم من ذلك، كما يسجل مجهر تشريحي إشارة مضان من فوق مستعمرة التوسع، وبروتوكول المعروضة مريحة لتحديد الترتيب المكاني في بعدين. العمارة من السكان البكتيرية توسيع يمكن أن يؤدي إلى تفاوت مستويات مضان (قد تحتوي على هياكل أي مثل تجعد أكثر من الخلايا التي تظهر أعلى كثافة مضان المحلية). ولذلك، فإن تحليل ووصف الصور دetermines التوزيع المكاني، ولكن ليس وفرة من السلالات داخل موقع معين. ووصفت البروتوكولات السابقة إعداد نموذج ليحتشدون 20 أو التصوير مضان من ديناميات السكان في المستعمرات البكتيرية 38، ولكن لدينا بروتوكول يجمع بين هذه التقنيات. تقنيات المجهر الأخرى التي تسمح للمراقبة من ثلاثة قرار الابعاد من التركيبة السكانية (مثل ليزر متحد البؤر المجهر 39،40 أو منظم إضاءة المجهر 41) يمكن تطبيقها للحصول على عينات مع زيادة التعقيدات الهيكلية. هذه التقنيات إضافية تدعم أيضا الكشف عن خلية واحدة على أساس من سلالات 31 غير متوفرة باستخدام المجسمة.
Disclosures
الكتاب تعلن أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
وقد تم تمويل هذا العمل من قبل منحة KO4741 / 3-1 من جمعية الألمانية للبحوث (DFG). وعلاوة على ذلك، تم دعم مختبر Á.TK من قبل ماري سكلودوفسكا كوري التكامل الوظيفي منحة (PheHetBacBiofilm) وتمنح KO4741 / 2-1 من DFG. TH، AD، RG-M.، وكانت مدعومة من قبل EM المدرسة الدولية ماكس بلانك للأبحاث، الكسندر فون همبولت الأساس، المجلس الوطني لCiencia بحوث والتكنولوجيا الألمانية للتبادل الأكاديمي (CONACYT-DAAD)، والزمالات JSMC، على التوالي.
Materials
| Name | Company | Catalog Number | Comments |
| Lennox Broth (LB) | Carl Roth GmbH | X964 | |
| Agar-agar, Kobe I | Carl Roth GmbH | 5210 | |
| Petri dish (90 mm diameter) | any | NA | Use Petri dishes without ventillation cams |
| Petri dish (35 mm diameter) | any | NA | Use Petri dishes without ventillation cams |
| Difco Nutrient Broth | BD Europe | 234000 | |
| KCl | any | NA | |
| MgSO,4 7H2O | any | NA | |
| Ca(NO3)2 4H2O | any | NA | |
| MnCl24H2O | any | NA | |
| FeSO4 | any | NA | |
| D-Glucose | any | NA | |
| Fluorescence AxioZoom V16 time-lapse microscope | Carl Zeiss Microscopy GmbH | see bellow detailed description | |
| AxioZoom V16 Microscope body | Carl Zeiss Microscopy GmbH | 435080 9030 000 | |
| Phototube Z 100:0 for Axio Zoom V16 | Carl Zeiss Microscopy GmbH | 435180 9020 000 | without eyepieces |
| Fluar Illuminator Z mot Fluorescence intermediate tube for Axio Zoom.V16 | Carl Zeiss Microscopy GmbH | 435180 9060 000 | |
| Controller EMS 3 | Carl Zeiss Microscopy GmbH | 435610 9010 000 | |
| System Control Panel SYCOP 3 | Carl Zeiss Microscopy GmbH | 435611 9010 000 | |
| Reflector module Z | Carl Zeiss Microscopy GmbH | 435180 9160 000 | For Fluar Illuminator Z mot on Axio Zoom.V16 and SYCOP 3 |
| Filter set 38 HE eGFP shift free (E) | Carl Zeiss Microscopy GmbH | 489038 9901 000 | EX BP 470/40, BS FT 495, EM BP 525/50 |
| Filter set 63 HE mRFP shift free (E) | Carl Zeiss Microscopy GmbH | 489063 0000 000 | EX BP 572/25, BS FT 590, EM BP 629/62 |
| Mount S | Carl Zeiss Microscopy GmbH | 435402 0000 000 | |
| Objektive PlanApo Z 0,5x/0,125 FWD 114 mm | Carl Zeiss Microscopy GmbH | 435280 9050 000 | 164 mm parfocal length; M62x0.75 thread at front |
| Coarse/fine drive with profile column | Carl Zeiss Microscopy GmbH | 435400 0000 000 | 490 mm, 10 kg load capacity, compatible with stand bases 300/450 |
| Stand base 450 | Carl Zeiss Microscopy GmbH | 435430 9902 000 | |
| Cold-light source Zeiss CL 9000 LED CAN | Carl Zeiss Microscopy GmbH | 435700 9000 000 | |
| CAN-bus cable | Carl Zeiss Microscopy GmbH | 457411 9011 000 | 2.5 m length |
| Slit-ring illuminator | Carl Zeiss Microscopy GmbH | 417075 9010 000 | d = 66 mm |
| Flexible light guide 1500 | Carl Zeiss Microscopy GmbH | 417063 9901 000 | 8/1,000 mm |
| Illumination Adapter for light guide | Carl Zeiss Microscopy GmbH | 000000 1370 927 | |
| Lightguide HXP with liquid fill | Carl Zeiss Microscopy GmbH | 000000 0482 760 | ø3 mm x 2,000 mm |
| Camera Adapter 60N-C | Carl Zeiss Microscopy GmbH | 426113 0000 000 | 2/3" 0.63X |
| High Resolution Microscopy Camera AxioCam MRm Rev. 3 FireWire | Carl Zeiss Microscopy GmbH | 426509 9901 000 | |
| AxioCam FireWire Trigger Cable Set | Carl Zeiss Microscopy GmbH | 426506 0002 000 | for direct shutter synchronization |
| ZEN pro 2012 | Carl Zeiss Microscopy GmbH | 410135 1002 120 | Blue edition, requires min. Windows 7 64-bit |
| ZEN Module Time Lapse | Carl Zeiss Microscopy GmbH | 410136 1031 110 | |
| Standard Heating Stage Top Incubator | Tokai Hit | INUL-MS1-F1 | |
| Zeiss Stereo Microscope Base Adapter | Tokai Hit | MS-V12 | |
| Softwares | |||
| ImageJ | National Institute of Health, Bethesda, MD, USA | v 1.49m | |
| BioVoxxel plugin | BioVoxxel | http://www.biovoxxel.de/development/ |
References
- Nadell, C. D., Xavier, J. B., Foster, K. R. The sociobiology of biofilms. FEMS Microbiol Rev. 33 (1), 206-224 (2009).
- West, S. A., Griffin, A. S., Gardner, A., Diggle, S. P. Social evolution theory for microorganisms. Nat Rev Microbiol. 4 (8), 597-607 (2006).
- Kovács, &. #. 1. 9. 3. ;. T. Impact of spatial distribution on the development of mutualism in microbes. Front Microbiol. 5, 649 (2014).
- Martin, M., Hölscher, T., Dragoš, A., Cooper, V. S., Kovács, &. #. 1. 9. 3. ;. T. Laboratory evolution of microbial interactions in bacterial biofilms. J Bacteriol. , (2016).
- Drescher, K., Nadell, C. D., Stone, H. A., Wingreen, N. S., Bassler, B. L. Solutions to the public goods dilemma in bacterial biofilms. Curr Biol. 24 (1), 50-55 (2014).
- Momeni, B., Waite, A. J., Shou, W. Spatial self-organization favors heterotypic cooperation over cheating. Elife. 2, e00960 (2013).
- van Dyken, J. D., Müller, M. J., Mack, K. M., Desai, M. M. Spatial population expansion promotes the evolution of cooperation in an experimental Prisoner's Dilemma. Curr Biol. 23 (10), 919-923 (2013).
- van Gestel, J., Weissing, F. J., Kuipers, O. P., Kovács, &. #. 1. 9. 3. ;. T. Density of founder cells affects spatial pattern formation and cooperation in Bacillus subtilis biofilms. ISME J. 8 (10), 2069-2079 (2014).
- Momeni, B., Brileya, K. A., Fields, M. W., Shou, W. Strong inter-population cooperation leads to partner intermixing in microbial communities. Elife. 2, e00230 (2013).
- Müller, M. J., Neugeboren, B. I., Nelson, D. R., Murray, A. W. Genetic drift opposes mutualism during spatial population expansion. Proc Natl Acad Sci U S A. 111 (3), 1037-1042 (2014).
- Pande, S., et al. Privatization of cooperative benefits stabilizes mutualistic cross-feeding interactions in spatially structured environments. ISME J. 10, 1413-1423 (2016).
- Hallatschek, O., Hersen, P., Ramanathan, S., Nelson, D. R. Genetic drift at expanding frontiers promotes gene segregation. Proc Natl Acad Sci U S A. 104 (50), 19926-19930 (2007).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11 (3), 157-168 (2013).
- Lopez, D., Kolter, R. Extracellular signals that define distinct and coexisting cell fates in Bacillus subtilis. FEMS Microbiol Rev. 34 (2), 134-149 (2010).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol Rev. 33 (1), 152-163 (2009).
- Mhatre, E., Monterrosa, R. G., Kovács, &. #. 1. 9. 3. ;. T. From environmental signals to regulators: Modulation of biofilm development in Gram-positive bacteria. J Basic Microbiol. , (2014).
- Zhang, W., et al. Nutrient depletion in Bacillus subtilis biofilms triggers matrix production. New J Physics. 16, 015028 (2014).
- Kearns, D. B. A field guide to bacterial swarming motility. Nat Rev Microbiol. 8 (9), 634-644 (2010).
- Morales-Soto, N., et al. Preparation, imaging, and quantification of bacterial surface motility assays. J Vis Exp. (98), (2015).
- Angelini, T. E., Roper, M., Kolter, R., Weitz, D. A., Brenner, M. P. Bacillus subtilis spreads by surfing on waves of surfactant. Proc Natl Acad Sci U S A. 106 (43), 18109-18113 (2009).
- Grau, R. R., et al. A Duo of Potassium-Responsive Histidine Kinases Govern the Multicellular Destiny of Bacillus subtilis. MBio. 6 (4), e00581 (2015).
- Park, S. Y., Pontes, M. H., Groisman, E. A. Flagella-independent surface motility in Salmonella enterica serovar Typhimurium. Proc Natl Acad Sci U S A. 112 (6), 1850-1855 (2015).
- van Gestel, J., Vlamakis, H., Kolter, R. From cell differentiation to cell collectives: Bacillus subtilis uses division of labor to migrate. PLoS Biol. 13 (4), e1002141 (2015).
- Abee, T., Kovács, &. #. 1. 9. 3. ;. T., Kuipers, O. P., van der Veen, S. Biofilm formation and dispersal in Gram-positive bacteria. Curr Opin Biotechnol. 22 (2), 172-179 (2011).
- Kovács, &. #. 1. 9. 3. ;. T. Bacterial differentiation via gradual activation of global regulators. Curr Genet. 62 (1), 125-128 (2016).
- Hölscher, T., et al. Motility, chemotaxis and aerotaxis contribute to competitiveness during bacterial pellicle biofilm development. J Mol Biol. 427 (23), 3695-3708 (2015).
- Seminara, A., et al. Osmotic spreading of Bacillus subtilis biofilms driven by an extracellular matrix. Proc Natl Acad Sci U S A. 109 (4), 1116-1121 (2012).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis do not exhibit swarming motility. J Bacteriol. 191 (22), 7129-7133 (2009).
- de Jong, I. G., Beilharz, K., Kuipers, O. P., Veening, J. W. Live Cell Imaging of Bacillus subtilis and Streptococcus pneumoniae using Automated Time-lapse Microscopy. J Vis Exp. (53), e3145 (2011).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. (60), (2012).
- Turnbull, L., et al. Super-resolution imaging of the cytokinetic Z ring in live bacteria using fast 3D-structured illumination microscopy (f3D-SIM). J Vis Exp. (91), e51469 (2014).
- Barken, K. B., et al. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10 (9), 2331-2343 (2008).
- Oliveira, N. M., et al. Biofilm formation as a response to ecological competition. PLoS Biol. 13 (7), e1002191 (2015).
- Wang, X., et al. Probing phenotypic growth in expanding Bacillus subtilis biofilms. Appl Microbiol Biotechnol. 100, 4607-4615 (2016).
- Detert Oude Weme, R. G., et al. Single cell FRET analysis for the identification of optimal FRET-pairs in Bacillus subtilis using a prototype MEM-FLIM system. PLoS One. 10 (4), e0123239 (2015).
- Overkamp, W., et al. Benchmarking various green fluorescent protein variants in Bacillus subtilis, Streptococcus pneumoniae, and Lactococcus lactis for live cell imaging. Appl Environ Microbiol. 79 (20), 6481-6490 (2013).
- Stannek, L., Egelkamp, R., Gunka, K., Commichau, F. M. Monitoring intraspecies competition in a bacterial cell population by cocultivation of fluorescently labelled strains. J Vis Exp. (83), e51196 (2014).
- Bridier, A., Briandet, R. Contribution of confocal laser scanning microscopy in deciphering biofilm tridimensional structure and reactivity. Methods Mol Biol. 1147, 255-266 (2014).
- Khajotia, S. S., Smart, K. H., Pilula, M., Thompson, D. M. Concurrent quantification of cellular and extracellular components of biofilms. J Vis Exp. (82), e50639 (2013).
- Neu, T. R., Lawrence, J. R. Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends Microbiol. 23 (4), 233-242 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved