A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تدعمه سقالة زرع الجزر في سادة الدهون البربخ من الفئران السكري
In This Article
Summary
هذا البروتوكول يوضح الفئران العزلة جزيرة والبذر على سقالة ديسيلولاريزد. تم زرع الجزر التي تدعم سقالة في لوحة الدهون البربخ من ستريبتوزوتوسين (ستز) التي يسببها الفئران السكري. نجت الجزر في موقع الزرع وعكست حالة فرط سكر الدم.
Abstract
وقد ثبت سريريا زرع جزيرة لتكون فعالة في علاج مرض السكري من النوع 1. ومع ذلك، فإن استراتيجية زرع داخل الكبد الحالية قد تتسبب في ردود فعل الدم كلها حادة ويؤدي إلى سوء إنغرافتمنت جزيرة. هنا، ونحن الإبلاغ عن بروتوكول قوي لزرع الجزر في موقع زرع خارج الكبد - لوحة الدهون البربخ (إف) - في نموذج الفأر السكري. تم وصف بروتوكول لعزل وتنقية الجزر في الغلة العالية من الفئران C57BL / 6J، وكذلك طريقة زرع يؤديها البذر الجزر على سقالة ديسيلولاريزد (دسس) وزرعها في موقع إف في الفئران C57BL / 6J سينجينيك المقدمة السكري بواسطة ستريبتوزوتوسين. الكسب غير المشروع دسس يحتوي على 500 الجزر عكس حالة فرط سكر الدم في غضون 10 يوما، في حين أن الجزر الحرة دون دسس المطلوبة 30 يوما على الأقل. تم الحفاظ على نقص سكر الدم لمدة تصل إلى 3 أشهر حتى تم الكشف عن الكسب غير المشروع. في الختام، دسس تعزيز إنغرافتمنت من الجزر في tموقع خارج الكبد من إف، والتي يمكن بسهولة استرجاعها ويمكن أن توفر منصة استنساخه ومفيدة للتحقيق في المواد سقالة، فضلا عن غيرها من المعلمات زرع المطلوبة ل إنغرافتمنت جزيرة ناجحة.
Introduction
داء السكري من النوع 1 (T1D) هو اضطراب الغدد الصماء المناعي الذاتي الذي يتم طرد خلايا الجزيرة من الجهاز المناعي، مما يجعل المرضى يعتمدون على حقن الأنسولين الخارجي لحياتهم كلها. ويمثل بروتوكول ادمونتون معلما بارزا في الدراسات السريرية لزرع الجزر. تم غرس الجزر من خلال الوريد البابي وزرعها في موقع داخل الكبد 1 . ومع ذلك، اثنين من العقبات الرئيسية - مصادر غير كافية من الجزر المانحة والجزيرة إنغرافتمنت الفقراء - منع نجاح واسع من زرع جزيرة 2 . عادة، الجزر تحتاج إلى جمعها من ثلاثة المانحين الجاد لعكس حالة فرط سكر الدم من مريض واحد. وهذا يرجع إلى انخفاض العائد من إجراءات العزلة جزيرة وفقدان جزيرة بعد زرع. على وجه الخصوص، على الرغم من أن ما بعد الزرع الجزر استحم في الدم الغنية بالأكسجين، والاتصال المباشر مع الدم في كثير من الأحيان أثارت لحظة اللثة بوساطة الدم(إبير)، والتي يمكن أن تسبب فقدان حاد في الجزر. على المدى الطويل، ويعتقد أن الخسارة التدريجية للجزر في المرضى تمثل انخفاض معدلات داء السكري في المجموعات السريرية، والتي يمكن أن تصل إلى 90٪ في السنة الأولى وانخفضت إلى 30٪ و 10٪ بنسبة 2 و 5 سنوات بعد الزرع، على التوالي 3 .
كان زرع جزيرة في مواقع خارج الكبد استراتيجية جذابة للحد من اتصال مباشر من الجزر مع الدم في حين حصر عمليات زرع إلى مواقع أكثر تحديدا مقارنة مع التسريب داخل الكبد. وقد أجريت دراسات في كبسولة الكلى والعين والعضلات، وسادات الدهون، والمساحات تحت الجلد على مدى السنوات الماضية، والتي تبين أن الجزر في هذه المواقع هي قادرة على البقاء على قيد الحياة وظيفة لاستعادة نورموجليسيميا 4 . وبالإضافة إلى ذلك، الجزر في هذه المواقع يمكن استرجاعها، مما يجعل من الممكن خزعة أو حتى لمزيد من إجراءات الاستبدال. خارج الكبد sوبالتالي فإنه يدل على إمكانات كبيرة للزرع السريري 5 .
وقد تم التحقيق بشكل مكثف السقالات القائمة على المواد البيولوجية لزرع الخلايا وهندسة الأنسجة. وعادة ما تحتوي السقالات ثلاثية الأبعاد (3D) على هياكل مسامية ويمكن أن تستخدم كقوالب خلوية لتوليد الهيكل المكاني / تنظيم الخلايا أو كخزانات لتوفير الإطلاق الخاضع للرقابة للإشارات النشطة بيولوجيا. كما تم ملفقة السقالات من المواد البوليمرية، مثل بولي (جليكوليد L- لاكتيد) 6 ، بولي (ديميثيلزيلوكسان) 7 ، والبولي بالحرارة (يوريتان) 8 ، لزرع الجزر في إف. بالمقارنة مع زرع الجزر مباشرة، تم العثور على استخدام السقالات للحد من فقدان جزيرة عن طريق منع تسرب الجزر في تجويف داخل الصفاق 9 ، 10 ، وتوفير الحماية الميكانيكية ومودوواللاتينغ رد فعل التهابات المحلي. وبالتالي يمكن تطوير السقالات لتعزيز جزيرة إنغرافتمنت في مواقع زرع 7 .
في هذه الدراسة، ونحن نعتزم إظهار نموذج زرع جزيرة في إف، التي أجريت في نماذج الفئران باستخدام دسس. وقد جذبت السقالات المستمدة من المصفوفات خارج الخلية اهتماما كبيرا في السنوات الأخيرة بسبب التوافق مع متفوقة والهياكل التي يسهل اختراقها أكثر طبيعية مقارنة مع المنتجات الاصطناعية. هنا، نحن تصف بروتوكول عزل قوي للحصول على الجزر البنكرياس في عوائد عالية من الفئران C57BL / 6J. ثم تم فرز دسس معالجتها من التامور البقري مع الجزر، وتم زرع الطعوم إلى إف في نماذج السكري متجانسة. تم تحقيق نقص السكر في الدم في الفئران في غضون 10 أيام، وتم الحفاظ عليه لمدة تصل إلى 100 يوما، حتى إزالة الطعوم.
Protocol
تمت الموافقة على جميع التجارب من قبل جامعة بكين المؤسسية رعاية الحيوان واللجنة الاستخدام (إاكوك، إاكوك رقم سو-لوي-1).
1. عزل العزلة
- إعداد الكواشف والمعدات.
- إعادة مسحوق كولاجيناز P (2 U / ملغ) في هبس لجعل محلول 5 ملغ / مل وتصفية من خلال مرشح 0.22 ميكرون لإزالة البكتيريا. إعداد 0.6 مل-قسامة حلول كولاجيناز P في أنابيب مخروطية 15 مل وتخزينها في -20 درجة مئوية.
ملاحظة: أثناء الاستخدام، يتم تخفيف كل قسامة مع هبس لإعطاء 6-مل حلول العمل مع تركيزات النهائية من 0.5 ملغ / مل، أو 1 U / مل (ما يكفي لعلاج 3 الفئران). يتم الاحتفاظ حل العمل على الجليد للاستخدام الفوري في غضون ساعة واحدة. لا ينبغي استعادة حل العمل أو إعادة تجميده للاستخدام الإضافي. - إعداد حل تحييد بإضافة فبس (2.5٪) و P / S (1٪) في نظام حمل ومراقبة الأمتعة؛ والحفاظ على الحل على الجليد. إعداد 60 مل من محلول تحييد إلى تريار 6 الفئران.
- بالنسبة لمتوسط استزراع الجزر، أضف D-غلوكوس (7 ملم) و فبس (10٪) و P / S (1٪) إلى وسط رمي 1640.
- الأوتوكلاف أدوات الجراحة في 115 درجة مئوية لمدة 30 دقيقة و 15 رطل لكل بوصة مربعة من الضغط.
- إعادة مسحوق كولاجيناز P (2 U / ملغ) في هبس لجعل محلول 5 ملغ / مل وتصفية من خلال مرشح 0.22 ميكرون لإزالة البكتيريا. إعداد 0.6 مل-قسامة حلول كولاجيناز P في أنابيب مخروطية 15 مل وتخزينها في -20 درجة مئوية.
- التضخم في البنكرياس.
- إعداد 12 مل من حل كولاجيناز العمل، على النحو المحدد في الخطوة 1.1.1، لمدة 6 الفئران (12 أسابيع من العمر). ملء حقنة 10 مل مع 9 مل من حل العمل وربط الحقنة إلى إبرة الوريد 27 G. تخزين حقنة على الجليد واستخدام الحل في غضون ساعة واحدة.
- الموت ببطء الماوس عن طريق خلع عنق الرحم. ضع الماوس في موقف ضعيف على منشفة ورقية، مع الذيل مشيرا نحو المشغل. رش الجسم كله مع الايثانول 70٪، مما يجعلها رطبة تماما.
- جعل شق V، بدءا من منطقة الأعضاء التناسلية وتمتد إلى الحجاب الحاجز، وذلك باستخدام مقص تشريح وملقط. أضعاف الجلد على الصدر للكشف تماما تجويف البطن.
- نقلالأمعاء إلى الجانب الأيمن من الماوس وفضح البنكرياس والقناة الصفراوية المشتركة. الاستيلاء على الاثني عشر بعناية مع ملقط وسحبه حتى القناة الصفراوية مشدود ( الشكل 1A -1 و A-2 ).
- العثور على الوريد البابي والقناة الصفراوية المؤدية إلى الكبد. المشبك الوريد البابي والقناة الصفراوية مع المشبك مرقئ المجهري.
ملاحظة: لقط يمنع النزيف المفرط ودخول كولاجيناز في الكبد. - في حين لا يزال عقد الأمعاء مع ملقط، والعثور على موقع أمبولا الذي يربط القناة الصفراوية والاثني عشر. إدراج إبرة 27G في الوريد في القناة الصفراوية المشتركة من خلال أمبولا ( الشكل 1B -1 و B-2 ).
- الاستغناء عن 200 ميكرولتر من حل العمل كولاجيناز للتحقق مما إذا كان القنية هو على طول الطريق من خلال القناة الصفراوية. إذا بدأ الحل كولاجيناز لملء القناة ( الشكل 1C- 1 و C2 )، الإبرة في تجويف القناة؛ المشبك الجزء لاصق تحتوي على إبرة باستخدام المشبك مرقئ الشريان والاستغناء عن بقية 2 مل من الحل بمعدل بطيء وثابت في غضون 1 دقيقة ( الشكل 2A -1 ، A-2 ، و B-1 ).
ملاحظة: إذا الأنسجة المحيطة القناة يبدأ في تضخيم ( الشكل 2B -2 )، وقد قفزت الإبرة من خلال جدار القناة الصفراوية، مما يجعل من الضروري إعادة وضع الإبرة ومحاولة قنية القناة الصفراوية مرة أخرى. وبالمثل، إذا بدأ الاثني عشر لتضخيم ( الشكل 2C -1 و C-2 )، المشبك مرقئ الشريان يحتاج إلى تعديل والقناة الصفراوية إعادة مقنى. كما حل كولاجيناز يملأ البنكرياس، والأنسجة بالقرب من الاثني عشر تضخم أولا، تليها ريجيوn، على مقربة من، ال التعريف، بانكريتيك، ذيل. نضح الذيل البنكرياس (الفص الطحال) مهم لتحقيق أقصى قدر من العائد جزيرة. - بعد التضخم الكامل للبنكرياس ( الشكل 2C -1 )، ودفع الأمعاء إلى الجانب الأيسر من الماوس وإزالة البنكرياس عن طريق البدء في القولون النازل. استخدام ملقط لرفع الأمعاء وفصله عن البنكرياس مع زوج آخر من ملقط. الاستمرار في إزالة البنكرياس حتى يتم إرفاقها من الجزء العلوي من المعدة. وأخيرا، رفع البنكرياس من البطن وقطعه خالية من الطحال المتبقية.
ملاحظة: يجب أن يتم تنفيذ الفصل كله بسرعة، كما يستمر الهضم أثناء عملية الإزالة. - وضع البنكرياس في أنبوب مخروطي 15 مل فارغة وتركه على الجليد. كرر الإجراء أعلاه للفئران المتبقية. وينبغي معالجة جميع البنكرياس مرة أخرى في غضون ساعة واحدة عن طريق اتباع الخطوة 1.3 فورا لمنع الإفراط في الهضم بواسطة كولاجيناز P. < / لى>
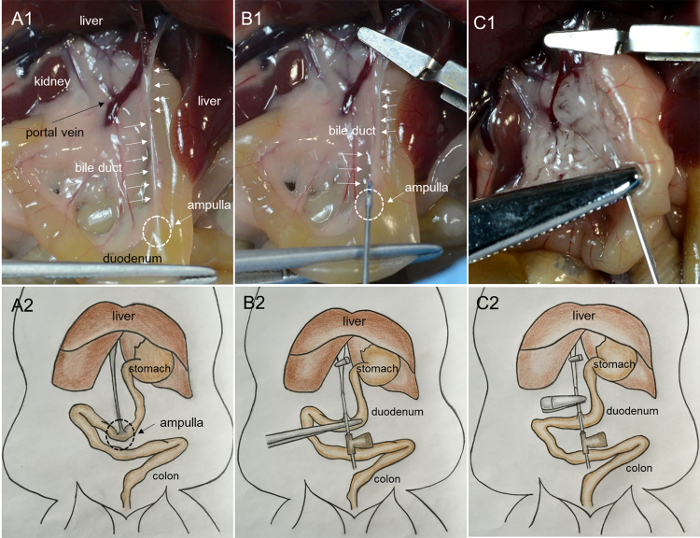
الشكل 1: صور تظهر قنية القناة الصفراوية ونضح البنكرياس مع حلول كولاجيناز. ( A1 ) سحب الاثني عشر حتى القناة الصفراوية مشدود. (أمبولة: المثلث، منطقة حليبي على سطح الاثني عشر؛ القناة الصفراوية: هيكل حليبي تشبه الحبل على السطح). ( B1 ) إدراج الإبرة في القناة الصفراوية من أمبولة. ( C1 ) تضخيم البنكرياس مع حقن الانزيم. ( A2، B2، C2 ) صور الكرتون للإجراءات المعروضة في A1، B1، و C1، على التوالي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
س: المحافظة على together.within الصفحات = "1"> 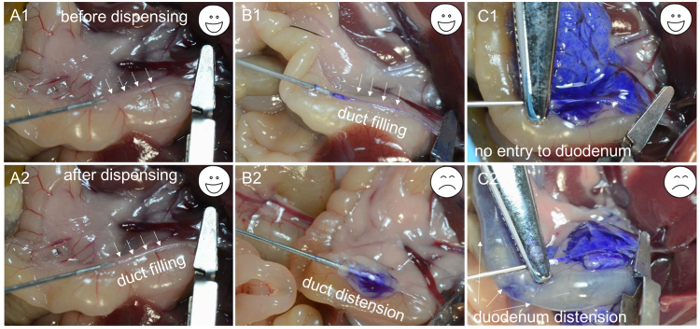
الشكل 2: استكشاف الأخطاء وإصلاحها للقنية. ( A1 ) طرف إبرة إدراجها في التجويف من القناة الصفراوية. ( A2 ) القناة مليئة حلول الانزيم. ( B1 ) إبرة إدراجها في تجويف القناة الصفراوية، والقناة مليئة صبغة زرقاء. ( B2 ) بسبب القنية غير مناسب، والإبرة تحت القناة الصفراوية، وفقط كبسولة تضخم لوحظ بعد الاستغناء عن صبغة زرقاء. ( C1 ) ويدل على قنية ناجحة من انتفاخ البنكرياس. ( C2 ) بسبب لقط غير لائقة، صبغة زرقاء يدخل الاثني عشر ويسبب انتفاخ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- <قوي> الهضم وتنقية الجزر.
- احتضان الأنابيب المخروطية التي تحتوي على البنكرياس بيرفوسد عند 37 درجة مئوية لمدة 17 دقيقة.
ملاحظة: قد تختلف فترة حضانة مع عمر وأنواع الحيوان. - إنهاء الهضم عن طريق إضافة 7 مل من محلول تحييد ووضع الأنابيب على الجليد.
- فصل الأنسجة عن طريق هز الأنابيب بقوة (على سبيل المثال، 20 مرة في 10 ثانية) حتى يتم الحصول على جزيئات الأنسجة الدقيقة.
ملاحظة: سوف يكون العائد جزيرة منخفضة إذا فشل البنكرياس في فصل تماما. - تصفية عينات الأنسجة هضمها من خلال 0.5 ملم شبكة سلكية لإزالة أي قطع الأنسجة غير هضمها. جمع تعليق جزيرة في أنبوب مخروطي 50 مل جديد.
- الطرد المركزي أنابيب لمدة 3 دقائق في 230 x ج و 4 درجات مئوية وتصب قبالة طاف بعناية، دون إزعاج الكريات الأنسجة.
- ريسوسبيند الكريات من 3 الفئران في 4 مل من التدرج الكثافة بوليسوكروس بواسطة فورتيكسينغ بلطف أو صإيبتينغ تعليق صعودا وهبوطا عدة مرات. ببطء ماصة 4 مل من هبس أسفل الجانب من الأنبوب إلى الجزء العلوي من حلول بوليسوكروس.
ملاحظة: يجب أن يكون الحلين طبقات فصل جيدا مع واجهة حادة.
ملاحظة: يجب أن يتم تنفيذ هبس مع الرعاية، دون إزعاج التدرج الكثافة بوليسوكروس في الجزء السفلي. - أجهزة الطرد المركزي تعليق لمدة 20 دقيقة في 900 x ج و 4 درجة مئوية عن طريق اختيار معدل تسارع بطيء جدا. إنهاء الطرد المركزي مع عدم وجود الفرامل.
ملاحظة: هذه هي خطوة لتنقية الجزر من الخلايا إكسوكرين، مع معظم الجزر تهاجر إلى واجهة بين طبقات من بوليسوكروس و هبس ومعظم الخلايا إكسوكرين يستقر في الجزء السفلي. - إزالة كامل من الحلول طاف 8 مل باستخدام ماصة كبيرة 15 مل. تمرير الحلول من خلال مقلوب 70 ميكرون مصفاة.
ملاحظة: سيتم تنقيته الجزر أيضا والاحتفاظ بها من قبل مصفاة، في حين أن الخلايا إكسوكرينسوف تمر من خلال مرشح.
الحذر: التدرج كثافة بوليسكورس هو سامة الخلية. فإن الترشيح مساعدة الجزر تخلص من بوليسوكروس. - ماصة 2 مل من محلول تحييد الباردة إلى طبق بتري 35 ملم. عكس مصفاة الخلية الجانب الأيمن لأعلى، تراجع سطح الاحتفاظ الجزر في الحل، ويهز بلطف للافراج عن الجزر.
- اختيار اليد الجزر تحت المجهر باستخدام ماصة 20 ميكرولتر مع طرف أبيض.
ملاحظة: الجزر هي مصفر، المجاميع الخلية المدمجة ( الشكل 3A )، في حين أن الأنسجة أو الخلايا الغدد الصماء الملوثة لديها بنية سوداء و فضفاضة تحت المجهر تشريح. - وضع حوالي 200 الجزر في طبق 35 ملم مع 2 مل من وسط الثقافة واحتضان عند 37 درجة مئوية في حاضنة الموردة مع 5٪ كو 2 لمدة 12 ساعة.
ملاحظة: عادة 150-300 الجزر يمكن حصادها من واحد 12 أسبوعا C57BL / 6J الماوس. الجزر هي عرضة لتشكيل المجاميع خلال الثقافة،والجزر الكبيرة (> 300 ميكرون) عرضة لنخر مركزي ( الشكل 1B ، أقحم). هز تعليق جيدا لتوزيع بالتساوي الجزر في الطبق والحد من التكتل.
- احتضان الأنابيب المخروطية التي تحتوي على البنكرياس بيرفوسد عند 37 درجة مئوية لمدة 17 دقيقة.
2. جزيرة الثقافة على سقالة
ملاحظة: دسس لديه مسامية من حوالي 79٪، وسمك حوالي 0.6 ملم، وحجم المسام تتراوح بين 12 و 300 ميكرون.
- قطع السقالات في أقراص 7 ملم، نقع لهم في الايثانول 70٪، وغسلها مع هبس. وضع السقالات في 24-جيدا إدراج الأنسجة الأنسجة.
ملاحظة: عندما يتم استرداد الجزر الطازجة بعد الثقافة بين عشية وضحاها، والجزر تبدو مشرقة وضيقة، مع حدود ناعمة ( الشكل 3B ). - دوامة الطبق وجمع الجزر من وسط الطبق باستخدام ماصة 20 ميكرولتر مع طرف أبيض. نقل الجزر إلى السقالات (250 جزيرة / سقالة) باستخدام ماصة وإضافة 2 مل من وسط الثقافة إلىالبئر. ثقافة الجزر لمدة 12 ساعة قبل زرع.
3. زرع الجزر في موقع إف
- تحريض مرض السكري في الفئران المتلقية.
- مكان الفئران C57BL / 6J (أكثر من 10 أسابيع من العمر) في قفص جديد مع إمدادات المياه ولكن لا طعام. سريع الفئران لمدة 10 ساعة قبل تحريض مرض السكري.
- إعداد حلول عازلة مع قيم الرقم الهيدروجيني من 4.2-4.5 عن طريق خلط 0.1 M حامض الستريك مع 0.1 M سترات الصوديوم. حل ستز (10 ملغ / مل) في المخزن المؤقت الطازجة وتعقيم الحل عن طريق تمرير ذلك من خلال مرشح 0.22 ميكرون.
ملاحظة: ستز هو حساسة للضوء ويفقد النشاط في غضون 10 دقيقة. دائما إعداد الحل ستز جديدة الحق قبل الحقن. - حقن كل الماوس داخل الصفاق مع ستز بجرعة 140-150 ملغ / كغ لكل الماوس C57BL / 6J.
ملاحظة: تختلف الجرعة اعتمادا على عمر وأنواع الحيوان. فمن المستحسن لأداء على نطاق صغير جرعة الأمثل تيست لأنواع معينة قبل بدء التجربة الرسمية. - جمع الدم الوريد الذيل ورصد الجلوكوز في الدم مع متر الجلوكوز في أيام 2 و 3 و 4 حقن بعد ستز.
ملاحظة: عندما تكون الحيوانات هي ارتفاع سكر الدم (غير الصيام السكر في الدم> 16.7 ملم) على يومين متتاليين، فهي على استعداد لزرع جزيرة.
- زرع الجزر إلى موقع إف.
- تخدير الفئران مع بنتوباربيتال تسليمها داخل البريتون (50 ملغ / كلغ). ضع الماوس في موقف ضعيف على منشفة ورقية، مع الذيل مشيرا نحو المشغل. حلق البطن على نطاق واسع لإزالة الفراء من جميع أنحاء موقع شق. الشريط أسفل أطرافه الأربعة ومسحة الجلد تماما مع الكحول بالتناوب ومناديل يودوفور انتقلت بطريقة دائرية لتعقيم موقع شق. ثنى الماوس مع ثنى العقيمة، والسماح فقط الوصول إلى منطقة شق. جعل شق 7 ملم من خلال جدار البريتوني فيخط الوسط، على مقربة من منطقة الأعضاء التناسلية.
ملاحظة: يجب أن تكون جميع الأدوات المستخدمة أثناء الجراحة، بما في ذلك القفازات، معقمة. - انتزاع بلطف وإزالة إف من تجويف البطن باستخدام ملقط. نشر إف على الشاش المعقم مبلل. وضع الجزر التي تحتوي على سقالة على إف وأضعاف إف لتفاف زرع. تأمين الاتصال المباشر بين الجزر و إف عن طريق خياطة إف مع خيوط 6-0 امتصاص. الرطب سطح إف مع محلول ملحي معقم باستخدام مسحة القطن غارقة لمنع إف من الجفاف.
- وضع بلطف إف مرة أخرى في تجويف البطن. إغلاق شق عن طريق خياطة الجدار البريتوني وتحامل طبقة الجلد مع مقاطع الجرح.
- حقن البوبرينورفين (0.1 ملغ / كلغ) تحت الجلد كمسكن.
- حقن 1 مل من محلول ملحي تحت الجلد لمنع الجفاف.
- ضع الماوس في قفص على وسادة التدفئة حتى يتعافى الماوس من التخدير.
- تحقق من الجلوكوز غير الصيام ليفيلس بعد يومين من جمع الدم من الوريد الذيل. إذا استرجاع الكسب غير المشروع، كرر إجراءات زرع أعلاه، سحب بلطف إف، استخدام خياطة 3-0 ليغات نهاية لوحة الدهون المتاخمة للبربخ، انسداد الأوعية الدموية، إكسلانت الكسب غير المشروع إف، والحفاظ عليه للعلم الأنسجة .
ملاحظة: شرح الجزر يجب أن تجعل المتلقي الفئران ارتفاع السكر في الدم مرة أخرى في غضون 3 أيام، مما يؤكد وظيفة الكسب غير المشروع.
- تخدير الفئران مع بنتوباربيتال تسليمها داخل البريتون (50 ملغ / كلغ). ضع الماوس في موقف ضعيف على منشفة ورقية، مع الذيل مشيرا نحو المشغل. حلق البطن على نطاق واسع لإزالة الفراء من جميع أنحاء موقع شق. الشريط أسفل أطرافه الأربعة ومسحة الجلد تماما مع الكحول بالتناوب ومناديل يودوفور انتقلت بطريقة دائرية لتعقيم موقع شق. ثنى الماوس مع ثنى العقيمة، والسماح فقط الوصول إلى منطقة شق. جعل شق 7 ملم من خلال جدار البريتوني فيخط الوسط، على مقربة من منطقة الأعضاء التناسلية.
النتائج
لدينا طريقة لقط، يؤديها باستخدام المشبك مرقئ المجهري، هو واضح وتوفير الوقت مقارنة مع تقنية ربط خياطة. استغرق الأمر حوالي 4 ساعات لعزل وتنقية حوالي 1200 جزيرة من 6 الفئران. وكان الجزر المعزولة حديثا عادة محيط الخام تحت المجهر الضوئي ( الشكل 3A...
Discussion
البنكرياس نضح والهضم الوقت هما البارامترات الرئيسية التي تؤثر على العائد جزيرة والجودة. ذكرت موسكالوسكي أولا استخدام خليط كولاجيناز الخام لهضم المفروم غينيا بنكرياس خنزير 11 . لاسي وآخرون. وذكرت حقن الانزيمات في نظام القناة لإرضاء البنكرياس، مما أ?...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
المؤلفين أود أن أشكر وي تشانغ من غوانهاو التكنولوجيا الحيوية لتوفير السقالات ديسلولاريزد. نشكر شياو هونغ بنغ للمناقشات مفيدة. وقد دعم هذا البحث ماليا من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (مشروع رقم 31322021).
Materials
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
References
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707 (2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved