Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Diyabetik Farenin Epididimal Yağ Tabağında Iskelelerin İskele Destekli Nakli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, murine iz izolasyonunu ve bir desellularize iskele üzerine tohumlamayı gösterir. İskele destekli adacıklar streptozotosin (STZ) ile indüklenen diyabetik farelerin epididimal yağ yastığı içine nakledildi. Isletler nakil alanından kurtuldu ve hiperglisemik durumu tersine çevirdi.
Özet
Adacık transplantasyonunun klinik olarak tip 1 diyabet tedavisinde etkili olduğu kanıtlanmıştır. Bununla birlikte, mevcut intrahepatik transplantasyon stratejisi akut tam kan reaksiyonlarına neden olabilir ve kötü adacık engraftmanına neden olabilir. Burada, ekstrahepatik transplantasyon alanındaki adacıkların transplantasyonu için sağlam bir protokol bildirdik, diyabetik bir fare modelinde epididimal yağ bandı (EFP). Adacıkların C57BL / 6J farelerden yüksek verimle izole edilmesi ve saflaştırılması için bir protokolün yanı sıra, bir desellüler hale getirilmiş iskelete (DCS) adacıkların ekilmesi ve diyabetik hale getirilen eş merkezli C57BL / 6J farelerindeki EFP alanına implante edilmesiyle gerçekleştirilen bir transplantasyon yöntemi anlatılmıştır Streptozotosin. DCS olmayan serbest adacıklar en az 30 gün süre ederken, 500 adacık içeren DCS grefti, hiperglisemik durumu 10 gün içinde tersine çevirdi. Normoglisemi, greft eksplantlana kadar 3 aya kadar sürdürüldü. Sonuç olarak, DCS adacıkların engraftsını tO ekstrahepatik EFP sitesinde bulunabilir ve bu iskelet materyallerini araştırmak için tekrarlanabilir ve yararlı bir platform sunabilir ve başarılı bir adacık yerleşimi için gereken diğer transplantasyon parametrelerini sağlayabilir.
Giriş
Tip 1 diabetes mellitus (T1D) adacık hücrelerinin bağışıklık sistemi tarafından ablasyona uğramış olduğu hastaları, tüm yaşamları boyunca eksojen insülin enjeksiyonuna bağımlı kılan bir otoimmün endokrin bozukluktur. Edmonton protokolü adacık transplantasyonunun klinik çalışmalarında bir kilometre taşı temsil eder; Adacıklar portal ven yoluyla infüze edildi ve intrahepatik bölgeye nakledildi 1 . Bununla birlikte, donör adacıklarının yetersiz kaynakları ve zayıf adacık engrafmanı olmak üzere iki ana engel, adacık transplantasyonunun geniş başarısını engellemektedir 2 . Genellikle, bir hastanın hiperglisemik durumunu tersine çevirmek için üç kadavradan donörden adacıklar toplanmalıdır; Bunun nedeni, düşük adacık yalıtım prosedürleri ve transplantasyondan sonraki adacık kaybıdır. Özellikle, transplantasyon sonrası adacıklar oksijen açısından zengin kanla ıslatılmış olsalar da, kanla doğrudan temas çoğu zaman kan yoluyla dolaştırılan inflamamayı uyandırırAdacıkların akut şekilde kaybedilmesine neden olabilecek toory reaction (IBMIR). Uzun vadede, hastalardaki adacıkların kademeli olarak kaybedilmesi, birinci yılda% 90'a ulaşabilen ve 2 ve 5 oranında% 30'a ve% 10'a düşebilecek klinik gruplarda diyabetin tersine dönme oranlarının düşmesine neden oldu- ğu düşünülmektedir Transplantasyon sonrası yıllar sırasıyla 3 .
Ekstrahepatik bölgelerdeki adacık transplantasyonu, adacıkların kanla doğrudan temasını azaltmak, intrahepatik infüzyona kıyasla transplantları daha tanımlanabilir yerlere kısıtlamak için çekici bir strateji olmuştur. Geçtiğimiz yıllar boyunca böbrek kapsülü, göz, kas, yağ yastıkları ve subkutanöz alanlarda çalışmalar yapıldı ve bu bölgelerdeki adacıkların normoglisemi 4'ü geri kazanmak için ayakta kalabildiklerini ve işlev gösterebildiklerini gösterdi. Buna ek olarak, bu bölgelerdeki adacıklar geri alınabilir, böylece biyopsi veya daha başka değiştirme prosedürleri mümkündür. Ekstrahepatik sBu nedenle, klinik transplantasyon için büyük bir potansiyel ortaya koymaktadır 5 .
Biyolojik materyal tabanlı iskeleler hücre nakli ve doku mühendisliği için yoğun şekilde araştırıldı. Üç boyutlu (3D) iskele genellikle gözenekli yapılar içerir ve hücrelerin mekansal yapısını / organizasyonunu oluşturmak için hücresel şablonlar olarak veya biyoaktif ipuçlarının kontrollü salımını sağlamak için rezervuar olarak işlev görebilir. İskele ayrıca EFP'deki adacıkları nakletmek için poli (glikolid-L-laktit) 6 , poli (dimetilsiloksan) 7 ve termoplastik poli (üretan) 8 gibi polimerik malzemelerden imal edilmiştir. Adacıkların doğrudan transplantasyonu ile karşılaştırıldığında, iskeletlerin adacıkların intraperitoneal boşluğa 9 , 10 sızıntısını önleyerek adacık kaybını azalttığı ve mekanik korumanın sağlandığı ve modülLokal inflamatuar reaksiyonu önleme. İskele böylece, transplantasyon bölgelerinde 7 adacık engraftmanını geliştirmek için geliştirilebilir.
Bu çalışmada, bir DCS kullanarak farelerin modellerinde gerçekleştirilen, EFP'deki adacık nakli paradigmasını göstermek istiyoruz. Ekstraselüler matristen türetilen iskeleler, sentetik ürünlerle karşılaştırıldığında üstün biyouyumluluk ve daha doğal gözenekli yapılar nedeniyle son yıllarda büyük ilgi gördü. Burada, C57BL / 6J farelerden yüksek verimle pankreatik adacıklar elde etmek için sağlam bir izolasyon protokolü açıklanmaktadır. Sığır perikardından işlenen DCS'lere daha sonra adacıklar ekildi ve greftler, eşzamanlı diyabetik modellerde EFP'ye nakledildi. Farelerde normoglisemi, 10 gün içinde elde edildi ve greftlerin çıkarılıncaya kadar 100 güne kadar tutuldu.
Protokol
Tüm deneyler Pekin Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC, IACUC no. COE-LuoY-1) tarafından onaylandı.
1. Islet İzolasyonu
- Reaktiflerin ve ekipmanın hazırlanması.
- HBSS'de 5 mg / mL'lik bir solüsyon yapmak için kollajenaz P tozunu (2 U / mg) yeniden yapılandırın ve bakterileri çıkarmak için 0.22 μm'lik bir filtreyle filtreleyin. 15 mL konik tüplerde 0.6 mL'lik kolajenaz P çözeltileri hazırlayın ve -20 ° C'de saklayın.
NOT: Kullanım esnasında, her alikot, 0.5 mg / mL veya 1 U / mL nihai konsantrasyonları olan 6 mL çalışma solüsyonları vermek üzere HBSS ile seyreltilir (3 farenin tedavisi için yeterlidir). Çalışma solüsyonu 1 saat içinde hemen kullanım için buzda tutulur. Ek bir kullanım için çalışma solüsyonu geri getirilmemeli veya tekrar dondurulmamalıdır. - HBSS içine FBS (% 2.5) ve P / S (% 1) ekleyerek nötralizasyon çözeltisi hazırlayın; Çözümü buzda tutun. Trea'ya 60 mL nötrleştirme solüsyonu hazırlayınT 6 fareleri.
- Ada kültür ortamı için RPMI 1640 ortamına D-glukoz (7 mM), FBS (% 10) ve P / S (% 1) ilave edin.
- Ameliyat aletlerini 115 ° C'de 30 dakika ve 15 psi basınç altında otoklavlayın.
- HBSS'de 5 mg / mL'lik bir solüsyon yapmak için kollajenaz P tozunu (2 U / mg) yeniden yapılandırın ve bakterileri çıkarmak için 0.22 μm'lik bir filtreyle filtreleyin. 15 mL konik tüplerde 0.6 mL'lik kolajenaz P çözeltileri hazırlayın ve -20 ° C'de saklayın.
- Pankreasın şişmesi.
- 6 fareler için (12 haftalık) adım 1.1.1'de belirtildiği gibi 12 mL kolajenaz çalışma solüsyonu hazırlayın. 10 mL şırıngayı 9 mL çalışma solüsyonuyla doldurun ve şırıngayı 27 G intravenöz iğneye bağlayın. Şırıngayı buz üzerinde saklayın ve çözeltiyi 1 saat içinde kullanın.
- Fareyi rahim ağzı çıkığıyla euthanize edin. Fareyi, kuyruk operatöre doğru bakacak şekilde kağıt havlu üzerine yatar konuma getirin. Tüm vücudu% 70 etanol ile püskürterek tamamen ıslak hale getirir.
- Disital makas ve forseps kullanarak genital bölgede başlayan ve diyafragma uzanan bir V-insizyon yapın. Karın boşluğunu tamamen açığa çıkarmak için cildi göğsünüzden geçirin.
- HareketBağırsağın sağ tarafına gelin ve pankreas ve ortak safra kanalı ortaya çıkar. Duodenumu forsepsle dikkatli tutun ve safra kanalı gerginleşene kadar çekin ( Şekil 1A -1 ve A-2 ).
- Karaciğere yönelen portal damarı ve safra kanalını bulun. Portal damarı ve safra kanalını mikroskopik bir hemostatik kelepçe ile sıkıştırın.
NOT: Sıkıştırma, aşırı kanamanın ve kolajenazın karaciğere girmesini önler. - Bağırsağı hala forsepsle tutarken safra kanalını ve duodenumu birleştiren ampulanın yerini bulun. 27G damar içi iğne, ampulla ( Şekil 1B- 1 ve B-2 ) yoluyla ortak safra kanalına yerleştirilir.
- Kanülasyonun safra kanalından geçip geçmediğini kontrol etmek için yaklaşık 200 mcL kollajenaz solüsyonu dağıtın. Kollajenaz çözeltisi kanalın içine dolmaya başlarsa ( Şekil 1C- 1 ve C2 ), iğne kanalın lümenindedir; Iğneyi içeren kanal segmentini bir arter hemostatik kelepçe kullanarak sıkıştırın ve 2 mL'lik solüsyonun geri kalanını 1 dakika içinde yavaş ve sabit bir hızda boşaltın ( Şekil 2A -1 , A-2 ve B-1 ).
NOT: Kanalı çevreleyen doku şişirmeye başlarsa ( Şekil 2B -2 ), iğne safra kanalının duvarı boyunca itilir ve iğneyi yeniden konumlandırması ve safra kanalı tekrar kanülasyon yapmayı dener. Benzer şekilde, duodenum şişirmeye başlarsa ( Şekil 2C- 1 ve C-2 ), arter hemostatik kelepçesi ayarlanmalı ve safra kanalı yeniden kanüle edilmelidir. Kollajenaz çözelti pankreasın tamamını doldurduktan sonra, duodenum yakınındaki doku şişirilir, ardından bölgeN pankreas kuyruğunun yakınında. Pankreas kuyruğunun (dalak lobu) perfüzyonu, adacık verimi maksimize etmek için önemlidir. - Pankreastın enflasyondan sonra ( Şekil 2C -1 ) bağırsak faresinin sol tarafına itin ve aşağı doğru iki nokta üstüste başlayarak pankreası çıkartın. Bağırsak kaldırmak için forseps kullanın ve başka bir çift forseps ile pankreas ayırın. Midenin üstünden bağlanıncaya kadar pankreası çıkarmaya devam edin. Son olarak, pankreasları karından çıkarın ve kalan dalaktan ayırın.
NOT: Çıkarma işlemi sırasında sindirim devam ettiği için tüm ayrılma işlemi hızla gerçekleştirilmelidir. - Pankreas boş bir 15 mL konik tüp içine yerleştirin ve buz üzerinde bırakın. Kalan fareler için yukarıdaki prosedürü tekrarlayın. Tüm pankreas, kollajenaz P ile aşırı sindirimi önlemek için, adım 1.3'ü takiben 1 saat içinde daha fazla işlenmelidir.
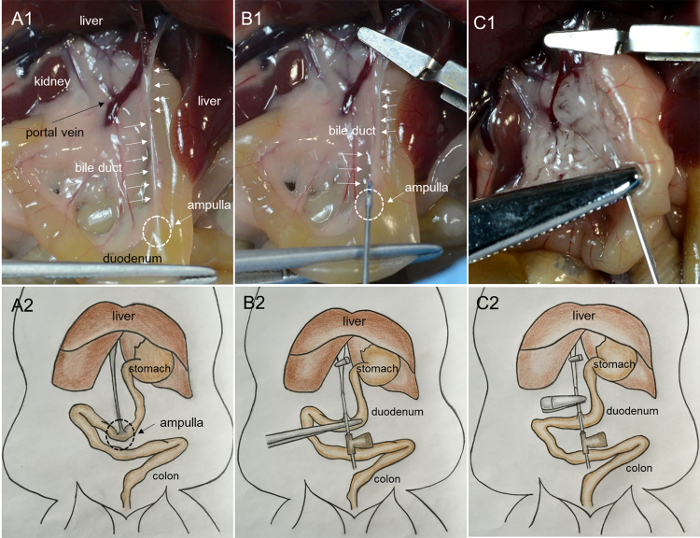
Şekil 1: Safra oluğunun kanülasyonunu ve pankreasın kollajenaz çözeltileri ile perfüzyonunu gösteren fotoğraflar. ( A1 ) Safra kanalı gerginleşene dek duodenum çekilir. (Ampulla: duodenum yüzeyindeki üçgen, sütlü alan; safra kanalı: yüzeydeki kordon benzeri sütlü yapı). ( B1 ) İğneyi ampulla safra kanalına sokmak. ( C1 ) Pankreasın enzim enjekte edilerek şişirilmesi. ( A2, B2 ve C2 ) Sırasıyla A1, B1 ve C1'de gösterilen prosedürlerin karikatür görüntüleri. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
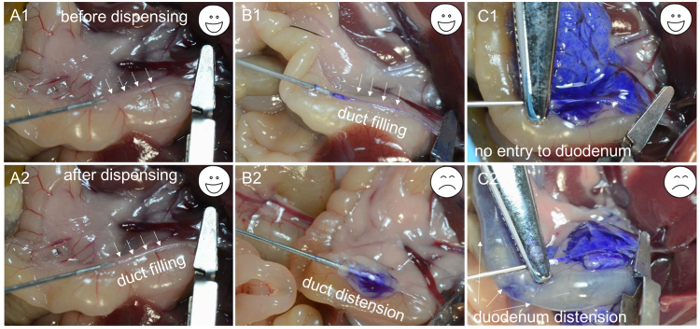
Şekil 2: Kanülasyon için sorun giderme. ( A1 ) İğne ucu safra kanalının lümenine sokulmuştur. ( A2 ) Kanal, enzim çözeltileri ile doldurulmuştur. ( B1 ) İğne safra kanalının lümenine sokuldu ve kanal mavi bir boya ile dolduruldu. ( B2 ) Uygun olmayan kanülasyon nedeni ile iğne safra kanalının altında ve mavi boyayı verdikten sonra sadece şişirilmiş bir kapsül görülür. ( C1 ) Başarılı bir kanülasyon pankreas distansiyonu ile kanıtlanmaktadır. ( C2 ) Uygun olmayan sıkıştırma nedeniyle mavi boya duodenuma girer ve şişmeye neden olur. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
- Adaların sindirimi ve saflaştırılması.
- Perfüze pankreas içeren konik tüpleri 37 ° C'de 17 dakika inkübe edin.
NOT: Kuluçka süresi, hayvanın yaşına ve türüne göre değişebilir. - 7 mL nötrleştirme solüsyonu ilave ederek ve tüpleri buz üzerine koyarak sindirimi sona erdirin.
- İnce doku parçacıkları elde edilinceye kadar tüpleri şiddetle ( örn . 10 saniye içinde 20 kez) sallayarak dokuyu çözün.
NOT: Pankreasın tamamen ayrışması başarısız olursa adacık verimi düşük olacaktır. - Sindirilmemiş doku parçalarını çıkarmak için 0.5 mm tel örgü vasıtasıyla sindirilmiş doku örneklerini filtreleyin. Adacık süspansiyonlarını yeni bir 50 mL konik tüpe toplayın.
- Tüpleri 230 xg ve 4 ° C'de 3 dakika boyunca santrifüjleyin ve doku peletlerini bozmadan süpernatantı dikkatlice boşaltın.
- Nazikçe veya p vortekslenerek 4 ml'lik polisükroz yoğunluk gradyanındaki 3 fareden peletleri tekrar süspanse edinSüspansiyon birkaç kez yukarı ve aşağı ipekleme. Tüpün kenarından polisükroz solüsyonlarının tepesine 4 mL HBSS'ye yavaş yavaş pipetle alın.
NOT: İki çözüm keskin arayüzü olan iyi ayrılmış katmanlar olmalıdır.
NOT: HBSS'nin ilavesi, tabandaki polisükroz yoğunluğu değişimini bozmadan özenle yapılmalıdır. - Süspansiyonu, çok yavaş bir hızlanma oranı seçerek 900 x g'de ve 4 ° C'de 20 dakika santrifüjleyin. Santrifüjü fren olmadan sonlandırın.
NOT: Adacıkların çoğunun polisükroz ve HBSS tabakaları arasındaki ara yüze göç ettiği ve altta yerleşen ekzokrin hücrelerin tamamı ile birlikte adacıkların ekzokrin hücrelerden saflaştırılması için bir adımdır. - Büyük çapta 15 mL'lik bir pipet kullanarak 8 mL'lik süpernatan solüsyonlarının tamamını çıkarın. Çözeltileri, ters çevrilmiş 70 μm'lik bir süzgeçten geçirin.
NOT: Adacıklar süzgeç tarafından daha da arıtılıp tutulurken ekzokrin hücrelerFiltreyi geçecektir.
Dikkat: Polisukor yoğunluk derecesi hücre toksiktir; Filtrasyon adacıkların polisükrozdan kurtulmasına yardımcı olur. - 35 mL'lik bir Petri kabına 2 mL soğuk nötrleştirme solüsyonu pipetleyin. Hücre süzgeçini sağ tarafı yukarı çevirin, adacıkları çözeltide tutan yüzeyi daldırın ve adacıkları serbestçe sallayın.
- Elle beyaz bir uçlu bir 20-μL pipet kullanarak bir mikroskop altında adacıkları seçin.
NOT: Adacıklar sarımtırak, kompakt hücre agregalarıdır ( Şekil 3A ), buna karşın kirletici ekzokrin doku veya hücreler mikroskop altında siyahımsı ve gevşek bir yapıya sahiptir. - 2 ml kültür ortamı ile 35 ml'lik bir çanakta yaklaşık 200 adacık yerleştirin ve 37 ° C'de% 12 CO 2 ile sağlanan inkübatöre 12 saat boyunca inkübe edin.
NOT: Genellikle 150-300 adacık, 12 haftalık bir C57BL / 6J fareden hasat edilebilir. Adalar kültür sırasında agrega oluşturmaya eğilimli,Ve büyük adacıklar (> 300 μm) merkezi nekroza duyarlıdır ( Şekil 1B , inset). Adacıkların çanakta eşit şekilde dağıtılması ve yığılmayı azaltmak için süspansiyonu iyice çalkalayın.
- Perfüze pankreas içeren konik tüpleri 37 ° C'de 17 dakika inkübe edin.
2. Iskele Kültür İskele Üzerinde
NOT: DCS, yaklaşık% 79 gözeneklilik, yaklaşık 0.6 mm kalınlık ve 12-300 um aralığında gözenek boyutuna sahiptir.
- İskeleleri 7 mm'lik disklere kesin,% 70 etanol içinde bekletin ve HBSS ile yıkayın. İskeleleri 24-kuyucuklu doku kültür eklerine yerleştirin.
NOT: Gecelik kültürden sonra taze adacıklar toplandığında, adacıklar düzgün kenarlı parlak ve sıkı görünür ( Şekil 3B ). - Çanağı döndürünüz ve beyaz bir uçlu 20 mcL'lik bir pipet kullanarak çanak merkezinden adacıklar topla. Adacıkları bir pipet kullanarak iskelelere (250 adacık / iskele) aktarın ve 2 mL kültür ortamı ekleyin.Kuyu. Adaları, nakilden 12 saat önce kültürleyin.
3. Adalar EFP Yerinde Transplantasyon
- Alıcı farelerde diyabet indüksiyonu.
- C57BL / 6J farelerini (10 haftalıktan fazla) bir su kaynağına sahip fakat yiyecekleri olmayan yeni bir kafese yerleştirin. Diyabet indüksiyonu başlamadan önce fareleri hızlıca 10 saat hızlandırın.
- 0.1 M sitrik asit ile 0.1 M sodyum sitrat karıştırılarak pH değerleri 4.2-4.5 olan tampon çözeltileri hazırlayın. Yeni hazırlanmış tamponda STZ'yi (10 mg / mL) eritin ve çözeltiyi 0.22 um'lik bir filtreden geçerek sterilize edin.
NOT: STZ ışığa duyarlıdır ve 10 dakika içinde aktivite kaybeder; Enjeksiyondan hemen önce taze STZ solüsyonunu daima hazırlayın. - Her fare C57BL / 6J fare başına 140-150 mg / kg dozunda STZ ile intraperitonal olarak enjekte edin.
NOT: Doz, hayvanın yaşına ve türüne bağlı olarak değişir. Küçük ölçekli bir doz optimizasyonu gerçekleştirilmelidir.Resmi deney başlamadan önce verilen türler için st. - Kuyruk damarı kanını toplayın ve STZ enjeksiyonundan 2, 3 ve 4. günlerde bir glikoz sayıcısı ile kan glikozunu izleyin.
NOT: Hayvanlar ard arda iki gün boyunca hiperglisemik (açlık-kan şekeri> 16.7 mM) olduğunda, adacık nakli için hazırdırlar.
- Adacıkların EFP bölgesine nakli.
- Fareler intraperitoneal olarak verilen pentobarbital ile anestezi altına alın (50 mg / kg). Fareyi, kuyruk operatöre doğru bakacak şekilde kağıt havlu üzerine yatar konuma getirin. Kesi bölgesinden kürkü çıkarmak için karın tıraş edin. Dört eklemi bantlayın ve cildinizi tamamen alkol ve iyodofor mendil ile tamamen sürünüz, kesi bölgesini sterilize etmek için dairesel bir tarzda hareket ettirin. Fareyi steril bir örtüyle örtün, ancak insizyon alanına erişime izin verin. Peritoneal duvar boyunca 7 mm'lik bir kesi yapın.Orta hat, genital bölgeye yakın.
NOT: Ameliyat sırasında eldivenler de dahil olmak üzere kullanılan tüm araçlar steril olmalıdır. - Forseps kullanarak karın boşluğundan hafifçe tutun ve EFP çıkarın. Islak steril gazlı bezin üzerine EFP yayıldı. Adaları içeren iskeleti EFP'ye yerleştirin ve EFP'yi transplantayı saracak şekilde katlayın. Adacıklar ve EFP arasındaki doğrudan temasın emilebilir 6-0 sütürler ile EFP dikilmesi ile sabitleyin. EFP'nin kurumasını önlemek için batırılmış pamuk çubuk kullanarak steril salinle EFP yüzeyini ıslatın.
- EFP'yi karın boşluğuna hafifçe yerleştirin. Peritoneal duvarı dikerek ve deri tabakasını yara klipsleriyle sıkarak insizyonu kapatın.
- Buprenorfin (0.1 mg / kg) subkutanöz analjezik olarak enjekte edin.
- Dehidrasyonu önlemek için 1 mL serum fizyolojik alt deri enjekte edin.
- Fare, anesteziden kurtuluncaya dek ısıtma pedindeki bir kafese yerleştirin.
- Açlık-karşı glikoz le kontrol edinVels iki gün sonra kuyruk damarından kan toplarken. Greft alınıyorsa, yukarıdaki transplantasyon prosedürlerini tekrar edin, hafifçe EFP'yi çekin, epididime bitişik yağ pedinin sonuna bağlamak, kan damarlarını tıkamak, EFP greftini eksprese etmek ve histoloji için korumak için 3-0 sütür kullanın .
NOT: Adacıkların eksprese edilmesi alıcı fareleri 3 gün içinde tekrar hiperglisemik hale getirmelidir, böylece greftin fonksiyonu teyit edilir.
- Fareler intraperitoneal olarak verilen pentobarbital ile anestezi altına alın (50 mg / kg). Fareyi, kuyruk operatöre doğru bakacak şekilde kağıt havlu üzerine yatar konuma getirin. Kesi bölgesinden kürkü çıkarmak için karın tıraş edin. Dört eklemi bantlayın ve cildinizi tamamen alkol ve iyodofor mendil ile tamamen sürünüz, kesi bölgesini sterilize etmek için dairesel bir tarzda hareket ettirin. Fareyi steril bir örtüyle örtün, ancak insizyon alanına erişime izin verin. Peritoneal duvar boyunca 7 mm'lik bir kesi yapın.Orta hat, genital bölgeye yakın.
Sonuçlar
Mikroskopik bir hemostatik kelepçe kullanılarak gerçekleştirilen sıkıştırma yöntemimiz, dikiş bağlantı tekniğiyle karşılaştırıldığında basit ve zaman kazandırır. 6 fareden yaklaşık 1.200 adacık izole etmek ve saflaştırmak kabaca 4 saat sürdü. Yeni izole edilen adacıklar tipik olarak optik bir mikroskop altında kaba bir çevreye sahiptir ( Şekil 3A ). Adacıklar izolasyon sürecinden kurtulduktan sonra parlak ve sıkı görün...
Tartışmalar
Pankreas perfüzyonu ve sindirim zamanı, adacık verimi ve kalitesini etkileyen iki önemli parametredir. Moskalewski ilk olarak kıyılmış kobay pankreasını 11 sindirmek için ham kollajenaz karışımı kullanımını bildirdi. Lacy ve ark. , Adacık verimi 12'yi büyük ölçüde arttıran pankreaları perfüze için kanal sistemine enzim enjeksiyonu yaptığını bildirdi. Enzim duktal perfüzyon daha homojen bir sindirim ve pankreas
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, decellularized iskeleler sağlamaktan Guanhao Biotech'ten Wei Zhang'a teşekkür etmek istiyorlar. Yardımcı tartışmalar için Xiao-hong Peng'e teşekkür ediyoruz. Bu araştırma, Çin Ulusal Doğa Bilimleri Vakfı tarafından maddi olarak desteklendi (Proje No: 31322021).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Referanslar
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707 (2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır