Method Article
قياس البروتين ملزمة ل F- أكتين بواسطة الترسيب المشترك
In This Article
Summary
يصف هذا البروتوكول طريقة لاختبار قدرة البروتين للمشاركة في الرواسب مع أكتين الخيطية (F- أكتين)، وإذا لوحظ ملزم، لقياس تقارب التفاعل.
Abstract
وينظم تنظيم أكتين الخيطية (F- أكتين) داخل الخلايا من قبل عدد كبير من البروتينات ملزمة أكتين التي تتحكم في تنوي الأكتين، والنمو، عبر ربط و / أو التفكيك. يصف هذا البروتوكول تقنية - الترسيب المشارك أكتين، أو التكوير، فحص - لتحديد ما إذا كان بروتين أو مجال البروتين يربط F- أكتين وقياس تقارب التفاعل ( أي ثابت التفكك التوازن). في هذه التقنية، يتم تحضين بروتين من الفائدة لأول مرة مع F- أكتين في الحل. ثم، يتم استخدام الطرد المركزي التفاضلي لترسيب خيوط أكتين، ويتم تحليل المواد بيليتد بواسطة سدز-بادج. إذا كان البروتين من الفائدة يربط F- أكتين، وسوف يشارك في الرواسب مع خيوط أكتين. ويمكن قياس المنتجات من رد فعل ملزمة ( أي F- أكتين والبروتين من الفائدة) لتحديد مدى تقارب التفاعل. المقايسة أكتين التكوير هو تقنية واضحة لتحديدإذا كان بروتين من الفائدة يربط F- أكتين ولتقييم كيفية التغييرات في هذا البروتين، مثل يجند ملزمة، تؤثر على تفاعلها مع F- أكتين.
Introduction
أكتين هو بروتين الهيكل الخلوي الضروري الذي يلعب دورا حاسما في العمليات الخلوية متعددة، بما في ذلك الحركة، والانكماش، والتصاق، والتشكل 1 . أكتين موجود في شكلين: أكتين كروي أحادي (G- أكتين) وأكتين بلمرة خيطية (F- أكتين). داخل الخلايا، يتم التحكم في التنظيم F- أكتين من قبل مجموعة كبيرة من البروتينات التي تنظم تنوي، والنمو، عبر ربط وتفكيك شعيرات أكتين 2 ، 3 ، 4 . ومع ذلك، كيف العديد من البروتينات ملزمة أكتين تعمل في الحفل لتنظيم تنظيم شبكة أكتين لا يزال غير واضح إلى حد كبير.
قياس التفاعلات البروتين البروتين هو نهج مهم لفهم كيفية بروتينات تمارس آثارها على السلوك الخلوي على مستوى الكيمياء الحيوية. العديد من المقايسات المختلفة يمكن استخدامها للكشف عن التفاعلات بين البروتينات المنقى.وتشمل النهج المشتركة للبروتينات القابلة للذوبان سحب المنسدلة، الاستقطاب مضان، كالوريمتري المعايرة متساوي الحرارة، والرنين بلاسمون السطح. الأهم من ذلك، كل هذه المقايسات تتطلب البروتينات لتكون قابلة للذوبان، وبالتالي من الصعب على التكيف للاستخدام مع البوليمرية، والخيطية البروتين مثل F- أكتين. هنا، نحن تصف تقنية - أكتين المشارك الترسيب، أو التكوير، فحص - لتحديد ما إذا كان بروتين أو مجال البروتين يربط F- أكتين وقياس تقارب التفاعل.
مقايسة التكوير أكتين هي تقنية بسيطة نسبيا التي لا تتطلب معدات متخصصة، وبصرف النظر عن نابذة فائقة السرعة. ويمكن إجراء جميع الكواشف، على افتراض معرفة الكيمياء الحيوية الأساسية، أو شراؤها. مرة واحدة ملزمة ل F- أكتين يتم تأسيسها، ويمكن استخدام مقايسة لقياس تقارب واضح ( أي ثابت التفكك التوازن) 5 . أيضا، مرة واحدة يتم تأسيس تقارب، فحص التكويرهو أداة مفيدة لقياس كيفية التغيرات في البروتين من الفائدة ( أي التعديلات بعد متعدية، الطفرات، أو يجند ملزمة) تؤثر على تفاعلها مع F- أكتين 6 . تقنية لديها قيود (انظر المناقشة ) أن الباحث يجب أن يكون على بينة من قبل محاولة الفحص.
Protocol
1. إعداد المواد
- تنقية البروتين من الفائدة (انظر القسم 2).
- إعداد أو شراء G- أكتين.
ملاحظة: G- أكتين يمكن أن تكون معزولة عن مصادر متعددة 1 ؛ بدلا من ذلك، يمكن شراؤها. إعادة تشكيل G- أكتين (في 5 ملي تريس درجة الحموضة 8.0، 0.2 ملي كاكل 2 ، 0.2 ملي أتب (أدينوسين ثلاثي الفوسفات)، و 0.5 ملي ديثيوثريتول (دت)) يجب أن تكون مجمدة فلاش، وتخزينها في -80 درجة مئوية و> 10 ملغ / مل في صغيرة (10-20 ميكرولتر) أليكوتس، وذوبان قبل الاستخدام. لا ينبغي إعادة تجميد أليكوتس G- أكتين. - إعداد أو شراء البروتين السيطرة، مثل بسا (انظر الخطوة 4.4).
- إعداد 10X البلمرة العازلة (200 ملي إيميدازول درجة الحموضة 7.0، 1 M بوكل، 20 ملي مغكل 2 ، 5 ملم أتب، و 10 ملي إغتا (الإيثيلين غليكول مكرر (β- أمينو إيثيل الأثير) -N، N، N '، N'- حمض تيتراسيتيك)). جعل الأسهم 10X وضبط درجة الحموضة بعد إضافة أتب، إذا لزم الأمر. قسامة (25 ميكرولتر هو حجم مفيد) وتخزينها في -80 و #176، C.
- إعداد 10X رد فعل رد فعل (200 ملي إيميدازول درجة الحموضة 7.0، 1.5 M كلوريد الصوديوم، 20 ملي مغكل 2 ، 5 ملم أتب، و 10 ملي إغتا). جعل الأسهم 10X وضبط درجة الحموضة بعد إضافة أتب، إذا لزم الأمر. قسامة (50-100 ميكرولتر هو حجم مفيد) وتخزينها في -80 درجة مئوية.
ملاحظة: تكوين المخزن المؤقت رد فعل مرنة وقد تحتاج إلى تعديل للحد من الترسيب الخلفية، والحد من غير محددة ملزمة، و / أو تحسين ملزمة (الخطوات 1.5.1-1.5.3).- ضبط الرقم الهيدروجيني من المخزن المؤقت التفاعل بين 6 و 8 لتحسين استقرار البروتين. في درجة الحموضة أقل أو أعلى، استبدال عازلة مناسبة ل إيميدازول.
ملاحظة: استخدام الرقم الهيدروجيني 7.0 كنقطة انطلاق، إلا إذا كان البروتين يتطلب درجة الحموضة أقل أو أعلى للاستقرار. لا تستخدم المخزن المؤقت مع الرقم الهيدروجيني دون 6.0 أو أعلى من 8.0، وهذا قد يعطل أكتين. المخازن المؤقتة الموصى بها (التركيز النهائي ودرجة الحموضة الأمثل المدرجة) ما يلي: 20 ملي موبس (3- ( N -morpholino) حمض بروبانيسولفونيك)، ودرجة الحموضة= 6.5؛ 20 ملي إميدازول، ف = 7.0؛ 10 ملي هيبيس (4- (2-هيدروكسي إيثيل) بيبيرازين-1-إيثانسولفونيك حمض، ودرجة الحموضة = 7.5. و 20 ملي تريس، ودرجة الحموضة = 8.0. - تختلف تركيز الملح من المخزن المؤقت رد فعل، اعتمادا على احتياجات الفحص.
ملاحظة: أكتين هو بروتين الحمضية، وتقريبا جميع البروتينات المرتبطة أكتين تعتمد إلى حد ما على التفاعلات كهرباء لربط مع الأكتين. لذلك، زيادة تركيز الملح يقلل من الأكتين ملزمة في معظم الحالات. يستخدم المخزن المؤقت رد فعل مستوى الفسيولوجية من الملح (150 ملي كلوريد الصوديوم، تركيز العمل)، وهذا هو نقطة البداية الموصى بها. إذا لزم الأمر، يمكن خفض تركيز الملح (على سبيل المثال، إلى 100 ملم) لتعزيز ملزمة أو زيادة للحد من ملزمة. - لا تغيير تركيزات مغكل 2 ، أتب، أو إغتا في المخزن المؤقت رد فعل ما لم يكن هناك سبب محدد للقيام بذلك.
- ضبط الرقم الهيدروجيني من المخزن المؤقت التفاعل بين 6 و 8 لتحسين استقرار البروتين. في درجة الحموضة أقل أو أعلى، استبدال عازلة مناسبة ل إيميدازول.
2. إعداد البروتين اختبار للفحص
- Preparإي البروتين عالية النقاء باستخدام اللوني السائل للحصول على أفضل النتائج 7 .
ملاحظة: إذا كان استخدام البروتين المؤتلف، يجب إزالة علامات البروتين الكبيرة، مثل الجلوتاثيون- S- ترانسفيراز (غست) عن طريق الانقسام البروتياز من البروتين المستهدف، لأنها يمكن أن تتداخل مع ملزمة. غست أيضا يسبب هوموديمريسيزاتيون من البروتينات الانصهار، والتي يمكن أن تزيد بشكل مصطنع تقارب الأكتين ملزمة. - تحديد تركيز البروتين عن طريق قياس الامتصاصية في 280 نانومتر. تقسيم بواسطة معامل الانقراض. يمكن حساب معامل الانقراض من تسلسل البروتين باستخدام تحليل التسلسل أو أدوات الإنترنت. بدلا من ذلك، تحديد تركيز البروتين باستخدام طرق برادفورد أو بكا (حمض بيسينونينيك).
ملاحظة: للتجارب الأولية، 50-100 ميكرولتر من البروتين في 20-40 ميكرومتر عادة ما تكون كافية. وهذا سوف يسمح تحليل ملزمة في نطاق ميكرومولار منخفضة، نقطة انطلاق مفيدة لمعظم البروتينات ملزمة أكتين. كوان أكبروفي كثير من الأحيان هناك حاجة إلى تركيز أعلى من البروتين لتوليد منحنى ملزمة لحساب تقارب (انظر القسم 5). - قبل الاستخدام مباشرة، تدور الثابت البروتين (50،000-100،000 x ج لمدة 10 دقيقة في 4 درجات مئوية) لإزالة المجاميع من البروتين غير قابلة للذوبان. إذا الذوبان هو مصدر قلق، إعادة قياس تركيز البروتين (الخطوة 2.2) بعد الطرد المركزي.
3. إعداد F- أكتين
- إزالة قسامة من G- أكتين من الفريزر -80 درجة مئوية والذوبان بسرعة.
- إضافة 10X البلمرة العازلة إلى G- أكتين إلى تركيز النهائي من 1X. تأكد من أن تركيز G- أكتين في العازلة البلمرة 1X هو على الأقل 10-20 ميكرومتر، أعلى بكثير من التركيز الحرج. احتضان لمدة 1 ساعة في درجة حرارة الغرفة (رت) للسماح للأكتين إلى بلمرة.
- بعد البلمرة، وتخزين F- أكتين في حل في 4 درجات مئوية، حيث أنها سوف تكون مستقرة لبضعة أسابيع. قبل استخدام F- أكتين مرة أخرى بعد التخزين، عكس بلطفأو نفض الغبار أنبوب عدة مرات لضمان أن يتم حل جميع أكتين وتوزيعها بشكل موحد في الحل.
ملاحظة: (اختياري) إضافة فالويدين لتحقيق نسبة 1: 1 المولي من G- أكتين: فالويدين. احتضان لمدة 30 دقيقة في رت للسماح فالويدين لربط F- أكتين. فالويدين يستقر F- أكتين وينجز شيئين: (1) أنه يقلل من كمية الأكتين الذي لا الرواسب أثناء الطرد المركزي و (إي) أنه يسمح F- الأكتين إلى المخفف تحت التركيز الحرج (~ 0.5 ميكرومتر)، والذي غالبا ما ضروري إذا اختلفت كمية F- أكتين لتوليد منحنى ملزمة (انظر القسم 5 على قياس تقارب).
4. بيليتينغ الفحص - البروتوكول الأساسي
ملاحظة: يتم استخدام البروتوكول الأساسي الموصوفة في القسم 4 لتحديد ما إذا كان بروتين من الفائدة المشارك الرواسب مع F- أكتين. مرة واحدة يتم تأسيس ملزمة ل F- أكتين، ويمكن قياس تقارب هذا التفاعل بعد البروتوكول الموصوفة في القسم 5.
- إعداد المخزن المؤقت رد فعل يوم الاستخدام عن طريق تمييع الأسهم 10X إلى 1X وإضافة دت إلى تركيز النهائي من 1 ملم.
ملاحظة: (اختياري) إضافة بوليدوكانول إلى تركيز العمل النهائي من 0.02٪ في المخزن المؤقت رد فعل. بوليدوكانول هو السطحي الذي يقلل من خلفية غير محددة ملزمة ويساعد على منع البروتينات مسعور من الالتصاق أنبوب نابذة فائقة السرعة. - تمييع البروتين من الفائدة إلى تركيزات المطلوب في المخزن المؤقت رد فعل 1X في أنابيب نابذة فائقة السرعة. الحفاظ على وحدات التخزين عينة منخفضة (40-60 ميكرولتر) لتجنب استخدام كميات كبيرة من البروتين باستخدام أنابيب نابذة فائقة السرعة مع وحدات التخزين الحد الأدنى الصغيرة (على سبيل المثال ، 7 × 20 ملم أنابيب التي تعقد 0.2 مل لكل منهما).
ملاحظة: منذ العديد من البروتينات المرتبطة أكتين لها تقارب ل F- أكتين في نطاق ميكرومولار، ويوصى اختبار البروتين من الفائدة في 2 و 10 ميكرومتر. إذا لم يلاحظ ملزمة في 10 ميكرومتر، فمن غير المرجح أن ملاحظتها ستلاحظ في تركيزات أعلى. إذا كانوأضاف البروتين يشكل أكثر من 10-20٪ من حجم رد الفعل النهائي، قد يكون من الضروري أن دياليز البروتين في المخزن المؤقت رد فعل قبل تنفيذ التجربة. - إضافة F- أكتين إلى التركيز النهائي المطلوب.
ملاحظة: 2 ميكرومتر هو تركيز مفيد للتجارب الأولية لأنه هو أعلى بكثير من التركيز الحرج، وبالتالي الحفاظ على أكتين في الدولة الخيطية وسوف تنتج بيليه مرئية عند تحليلها من قبل سدز-بادج (الخطوة 4.10). - إعداد الضوابط التالية في أنابيب نابذة فائقة السرعة لجعل الفحص بالمعلومات.
- إعداد عينة (ق) تحتوي على البروتين من الفائدة دون F- أكتين. تأكد من أن تركيز البروتين في هذه العينات يطابق التركيز في عينات "زائد F- أكتين".
ملاحظة: هذه العينات سوف تحدد كمية البروتين التي يتم تجميعها أو عالقة على جانبي أنبوب نابذة فائقة السرعة في غياب F- أكتين. - إعداد عينات السيطرة السلبيةفي نفس أو تركيز مماثل (ق) المستخدمة للبروتين من الفائدة. استخدام البروتين السيطرة التي لا ترتبط F- أكتين، مع وبدون F- أكتين.
ملاحظة: هذا هو عنصر تحكم مهم لأن البروتينات يمكن أن تصبح "المحاصرين" في شعيرات أكتين وبيليه مع F- أكتين، على الرغم من أنها لا تربط F- أكتين. كمية المحاصرة يمكن أن تختلف تبعا لمصدر F- أكتين، والظروف العازلة، وما إلى ذلك وهكذا، ينبغي أن تدرج هذه السيطرة في جميع التجارب. من الناحية المثالية، يجب أن يكون البروتين السيطرة على الوزن الجزيئي مماثلة للبروتين من الفائدة (على سبيل المثال ، ل αE- كاتينين (~ 100 كيلو دالتون)، بسا (66 كيلو دالتون) هو السيطرة المناسبة). معايير الترشيح هلام المتاحة تجاريا جعل بروتينات مراقبة ممتازة، لأنها تغطي مجموعة من الأحجام وتميل إلى عدم احتواء المجاميع. - اختياريا، وإعداد عينات السيطرة الإيجابية التي تحتوي على البروتين الذي يربط F- أكتين، مع وبدون F- أكتين. تأكد من أن تركيز (ق) مماثلة لتلك التي من ثه البروتين من الفائدة.
ملاحظة: هذه السيطرة مفيدة في أنه يدل على أن الظروف التجريبية (على سبيل المثال، أعدت F- أكتين، رد فعل رد فعل، والطرد المركزي) تسمح F- أكتين ملزمة. منذ فحص التكوير يمكن أن تفشل في الكشف عن التفاعلات F- أكتين ضعيفة (انظر المناقشة)، فمن المستحسن أن البروتين F- أكتين ملزمة المعروفة لديها علاقة معتدلة إلى ضعيفة ل F- أكتين ( أي في نطاق ميكرومولار منخفضة ). بروتينات ملزمة F- أكتين ملزمة متاحة تجاريا.
- إعداد عينة (ق) تحتوي على البروتين من الفائدة دون F- أكتين. تأكد من أن تركيز البروتين في هذه العينات يطابق التركيز في عينات "زائد F- أكتين".
- احتضان جميع العينات لمدة 30 دقيقة في رت.
ملاحظة: أوقات حضانة أطول على ما يرام، على افتراض أن البروتين من الفائدة هو مستقر، على الرغم من احتمال لا لزوم لها. إذا كان البروتين من الفائدة ليست مستقرة في رت، ثم عينات يمكن أن تحضن في 4 درجات مئوية. في هذه الحالة، قد تكون أوقات حضانة أطول ضرورية. - تحميل العينات في الدوار الطرد المركزي. وضع الأنابيب داخل الدوار للمساعدة في إعادة تعليق بيليه بعد الطرد المركزي.لهذا، وضع علامة على جميع أنابيب الطرد المركزي (على سبيل المثال، مع عدد العينة) ووضع جميع الأنابيب في الدوار في نفس الموقف (على سبيل المثال، عدد تواجه بها).
- أجهزة الطرد المركزي في 100،000 x ج لمدة 20 دقيقة في 4 درجات مئوية في نابذة فائقة السرعة.
- بعد الطرد المركزي، وإزالة 3/4 من طاف (على سبيل المثال ، 45 ميكرولتر إذا كان حجم البداية 60 ميكرولتر) من كل أنبوب وتخلط مع 1/3 مجلدات من العازلة عينة 4X (15 ميكرولتر في هذه الحالة) في أنبوب ميكروسنتريفوج منفصلة.
- إزالة طاف المتبقية مع تلميح تحميل هلام، مع الحرص على عدم إزعاج بيليه (والتي قد تكون مرئية على شكل بقعة زجاجية).
ملاحظة: من المهم لإزالة طاف من الأنابيب في أقرب وقت ممكن بعد الانتهاء من تشغيل الطرد المركزي للحد من البروتين التفكك بعد الانفصال. أيضا، لا يغسل بيليه مع رد فعل العازلة لنفس السبب.
- إزالة طاف المتبقية مع تلميح تحميل هلام، مع الحرص على عدم إزعاج بيليه (والتي قد تكون مرئية على شكل بقعة زجاجية).
- إضافة 4/3 مجلدات من العازلة عينة 1X لكل بيليهر (على سبيل المثال ، 80 ميكرولتر إذا كان حجم البداية 60 ميكرولتر).
ملاحظة: وهذا يجعل التخفيف نفسه كما طاف (الخطوة 4.8، 1/3 مجلدات من العازلة عينة 4X تم إضافة)، مما يسمح للمقارنة المباشرة بين بيليه وعينات طافية وتحديد نسبة البروتين الذي تم بيليه.- إضافة عينة عازلة لجميع الأنابيب واحتضان لمدة لا تقل عن 5 دقائق في رت. السماح بيليه للجلوس في المخزن المؤقت العينة لتحسين عينة الانتعاش.
- تريتوريت العينة 8-10 مرات مع غيض ماصة P200 لمعلق بيليه من خلال غسل باستمرار منطقة بيليه من الأنبوب. كشط بلطف غيض ماصة على بيليه خلال تريتوراتيون للمساعدة في إعادة تعليق.
ملاحظة: الحرص على تجنب إدخال الهواء في العينة خلال تريتوراتيون، لأن هذا سوف يسبب العازلة عينة إلى فقاعة وسوف تقلل من استرداد العينة. - نقل عينات معلق إلى أنابيب ميكروفوج بعد تريتوراتيون.
- تحليل طاف وبيليه عينات بواسطة سدز-بادج و كوماسي تلطيخ 8 عن طريق تحميل 10-15 ميكرولتر من العينة في حارة. وهذا يكفي لتصور البروتينات.
ملاحظة: سيتم إثراء البروتينات التي تشارك في الرواسب مع F- أكتين في "زائد F- أكتين" عينات بيليه على عينات "لا F- أكتين" بيليه ( الشكل 1A ). معيار تلطيخ كوماسي الأزرق كافية للكشف إذا تركيزات البروتين هي في نطاق 0.1-10 ميكرومتر. الغروية كوماسي 9 أو النشاف الغربية يمكن استخدامها لزيادة حساسية إذا تم استخدام تركيزات أقل البروتين لقياس التفاعلات أعلى تقارب. - صورة هلام ملطخة كوماسي باستخدام الماسح الضوئي أو نظام التصوير (الخطوة 5.12).
5. بيليتينغ الفحص - الكمي
ملاحظة: إذا لوحظ ارتباط محدد ل F- أكتين، فإنه يمكن أن يكون مفيدا لقياس تقارب tانه التفاعل. ويتم إنجاز ذلك عن طريق إجراء بعض التغييرات والإضافات إلى البروتوكول المبين في القسم 4. للحصول على دليل ممتاز لتصميم وفحص مقايسات ملزمة، انظر بولارد 10 . يتم توفير مخطط تدفق ( الشكل 2 ) للمساعدة في التحليل والتقدير الكمي.
- تحديد نطاق تركيز لاختبار.
ملاحظة: وسوف تعتمد مجموعة تركيز على البروتين، وينبغي أن تمتد من تركيز تحت K K واضح (على سبيل المثال، 1 ميكرومتر) إلى تركيزات عالية بما فيه الكفاية لتشبع ملزمة. ومن الأهمية بمكان أن تصل إلى التشبع ملزمة في عينات متعددة في نهاية عالية من نطاق تركيز لتوليد منحنى ملزم دقيق ( الشكل 1C ). كما ذكر أعلاه، العديد من البروتينات ملزمة أكتين لها تقارب ل F- أكتين في نطاق ميكرومولار منخفضة (1-5 ميكرومتر). بالنسبة للبروتين مع K د من 0.5-1 ميكرومتر، فإن نطاق تركيز البداية المفيدة يكون 0.1-10 ميكرومتر. - تدور الثابت (الخطوة 2.3) البروتين من الفائدة لإزالة المجاميع. تمييع متسلسل البروتين لجعل سلسلة تركيز تحتوي على 7-8 عينات في 2X التركيز النهائي لفحصها. على سبيل المثال، إذا كان النطاق لاختبار هو 0.1-8 ميكرومتر، وإعداد التخفيفات التالية في المخزن المؤقت رد فعل 1X: 16، 8، 4، 2، 1، 0.5، و 0.2 ميكرومتر.
ملاحظة: كما ذكر في الخطوة 4.2، إذا كان البروتين وأضاف يشكل أكثر من 10٪ -20٪ من التخفيف الأول (عينة 16 ميكرومتر في المثال أعلاه)، قد يكون من الضروري إما تركيز البروتين أبعد من ذلك أو دياليز البروتين في المخزن المؤقت رد فعل 1X. تأكد من إعداد ما يكفي من كل التخفيف ل "زائد F- أكتين" و "لا F- أكتين" العينات. - إعداد العينات (كما هو الحال في القسم 4)، عن طريق تمييع البروتين من الفائدة إلى تركيزات المطلوب في المخزن المؤقت رد فعل 1X في أنابيب نابذة فائقة السرعة. الحفاظ على وحدات التخزين عينة منخفضة (40-60 ميكرولتر) لتجنب استخدام كميات كبيرة من البروتين باستخدام أولتراسنت(على سبيل المثال ، 7 × 20 ملم أنابيب التي تعقد 0.2 مل لكل منهما).
- إضافة F- الأكتين إلى التركيز النهائي المطلوب للعينات المناسبة وإظهار حجم باستخدام 1X رد فعل العازلة. على سبيل المثال، ل 50 ميكرولتر ردود الفعل باستخدام 2 ميكرومتر F- أكتين، وضمان أن كل عينة لديها 25 ميكرولتر من البروتين 2X، 10 ميكرولتر من 10 ميكرومتر F- أكتين، و 15 ميكرولتر من العازلة رد فعل 1X. تضمين عينات التحكم (الخطوات 4.4.2 و 4.4.3).
ملاحظة: بالنسبة للضوابط السلبية والإيجابية، استخدم تركيز واحد ضمن نطاق لفحصها (الخطوة 5.1)، من الناحية المثالية بالقرب من منتصف إلى نهاية عالية من نطاق (على سبيل المثال، 4 ميكرومتر إذا كان نطاق تركيز 0.1-10 ميكرومتر).
- إضافة F- الأكتين إلى التركيز النهائي المطلوب للعينات المناسبة وإظهار حجم باستخدام 1X رد فعل العازلة. على سبيل المثال، ل 50 ميكرولتر ردود الفعل باستخدام 2 ميكرومتر F- أكتين، وضمان أن كل عينة لديها 25 ميكرولتر من البروتين 2X، 10 ميكرولتر من 10 ميكرومتر F- أكتين، و 15 ميكرولتر من العازلة رد فعل 1X. تضمين عينات التحكم (الخطوات 4.4.2 و 4.4.3).
- احتضان جميع العينات لمدة 30 دقيقة في رت.
- بعد 30 دقيقة، وإزالة 1/5 من كل عينة (على سبيل المثال، 10 ميكرولتر من رد فعل 50 ميكرولتر) وتخلط مع 20 ميكرولتر من الماء و 10 ميكرولتر من العازلة عينة 4X.
ملاحظة: هذه هي "المجموع" sأمبلز، وسوف تستخدم لتوليد منحنى القياسية. - تحميل العينات في الدوار نابذة فائقة السرعة. أجهزة الطرد المركزي لمدة 20 دقيقة في 100،000 x ج و 4 درجات مئوية.
- اختياريا، بعد الطرد المركزي، وإزالة 3/4 من طاف (على سبيل المثال، 30 ميكرولتر إذا كان حجم الطرد المركزي 40 ميكرولتر) من كل أنبوب وتخلط مع العازلة عينة 4x (10 ميكرولتر في هذه الحالة) في أنبوب ميكروفوج منفصلة. إزالة طاف المتبقية مع تلميح تحميل هلام، مع الحرص على عدم إزعاج بيليه.
ملاحظة: عند قياس تقارب ملزمة، فإنه ليس من الضروري لتشغيل طاف. ومع ذلك، يمكن أن يكون من المفيد لإنقاذ طاف، وخصوصا عند اختبار بروتين جديد. - إزالة طاف إذا لم يكن تحليل (الخطوة 5.7).
- ريسوسبيند الكرية في 1 حجم 1X عينة العازلة (على سبيل المثال، 40 ميكرولتر إذا كان حجم الطرد المركزي 40 ميكرولتر).
- إضافة عينة عازلة لجميع الأنابيب واحتضان لمدة لا تقل عن 5 دقائق في رت.
- آريكرر العينة 8-10 مرات مع طرف ماصة P200، باستمرار غسل منطقة بيليه من الأنبوب. كشط بلطف غيض ماصة على بيليه خلال تريتوراتيون للمساعدة في إعادة تعليق.
- نقل البروتين معلق إلى أنبوب ميكروسنتريفوج.
ملاحظة: هذه هي عينات "بيليه". - تحليل مجموع وعينات بيليه بواسطة سدز-بادج 8 . تشغيل جميع العينات على هلام واحد إذا كان ذلك ممكنا. إن لم يكن، تشغيل عينات بيليه على هلام واحد والعينات الإجمالية على الثانية.
ملاحظة: نظرا لعدد من العينات، ويوصى نظام هلام كبير للتحليل. إذا كان تشغيل عينات على اثنين أو أكثر من المواد الهلامية، فمن المهم أن تكون ملطخة جميع المواد الهلامية متطابقة ( أي نفس حل كوماسي ووقت متطابقة في وصمة عار / دستين). - صورة المواد الهلامية الملطخة كوماسي باستخدام نظام التصوير الذي يقيس كثافة الفرقة البروتين على نطاق واسع ( أي، اثنين إلى ثلاثة سجل) ومجموعة خطي. تأكد من أن الصور أإعادة جمعها مع عدم وجود بكسل المشبعة.
ملاحظة: أنظمة التصوير القائم على الليزر توفر أفضل حساسية ونسبة الإشارة إلى الضوضاء. - باستخدام إيماجيج أو برنامج تحليل مماثل، وقياس كثافة البروتين الفرقة وحساب كمية البروتين ملزمة.
ملاحظة: لجميع القياسات عينة، استخدم أداة اختيار في إيماجيج لرسم منطقة من الفائدة (روي) حول كل فرقة وقياس (تحليل> قياس) المنطقة ومتوسط القيمة الرمادية. حساب الخلفية لكل هلام عن طريق قياس القيمة الرمادية متوسط من منطقة دون عينة. طرح القيمة الرمادية متوسط الخلفية من كل عائد استثمار يعني القيمة الرمادية ثم ضرب من قبل المنطقة للحصول على قيمة الكثافة المتكاملة لكل نطاق.- قياس البروتين من كثافة شدة الفائدة من مجموع العينات ( الشكل 2A ).
- توليد منحنى القياسية عن طريق التآمر كثافة الفرقة ( أي قياسات الكثافة المتكاملة) مقابل كتلة البروتين ( الشكل2B).
- قياس كمية البروتين من الفائدة التي شاركت في الرسوبيات مع F- أكتين (المشارك الرسوبي البروتين، الشكل 2C ).
- قياس كمية البروتين من الفائدة التي رسوبيت في غياب F- أكتين (الترسيب الخلفية، الشكل 2D ).
- طرح الترسيب الخلفية من البروتين المشترك الرسوبي ( أي طرح القيم من الخطوة 5.13.4 من الخطوة 5.13.3) لتحديد كمية البروتين الذي يرتبط F- أكتين.
- قياس كمية F- أكتين في كل بيليه ( الشكل 2E ). تحديد متوسط كمية F- أكتين لكل عينة ومن ثم تقسيم كل عينة من قبل المتوسط لتحديد نسبة F- أكتين في كل عينة نسبة إلى المتوسط ( أي الأرقام أدناه نطاقات).
- لكل عينة، وتقسيم كمية البروتين ملزمة (المحسوبة في الخطوة 5.13.5) من قبل F- أكتين أكتين بيليه نسبة (الخطوة 5.13.6) لضبط الاختلافات في بيليه.
Nأوت: هذه القيمة هي البروتين ملزمة تطبيع. - استخدام منحنى القياسية (الخطوة 5.13.2) لحساب كمية (كتلة) من البروتين ملزمة تطبيع (الخطوة 5.13.7) في كل عينة.
ملاحظة: البروتين إزالة في البداية (العينة "توتال")، فضلا عن كمية محملة (والتي، ما لم يتم تحميل بيليه بأكمله، سيكون بعض جزء من بيليه)، يجب أن تحسب عند حساب المبلغ الإجمالي للبروتين التي بيليتد. - تحديد تركيز البروتين ملزمة في كل عينة من الكتلة الكلية للبروتين في بيليه (المحسوبة في الخطوة 5.13.8) وحجم العينة. طرح هذه القيمة من تركيز البداية لتحديد كمية البروتين الحرة. تقسيم تركيز البروتين ملزمة من تركيز أكتين (μM / ميكرومتر من أكتين) والمؤامرة مقابل تركيز البروتين الحر لتوليد منحنى ملزم ( الشكل 1C ).
ملاحظة: منذ F- أكتين ليست واحدة، وأنواع موحدة هو ديفتيعبادة لاستقراء تركيز مولار من F- أكتين من تركيز G- الأكتين. استخدام تركيز G- الأكتين بدءا لتحديد كمية البروتين ملزمة (ميكرومتر / ميكرومتر من أكتين) وتقدير تركيز واضح من مواقع الربط في رد الفعل. تركيز مواقع الربط عادة ما يكون أقل من تركيز مونومرات الأكتين في التفاعل لأن ليس كل من الأكتين يتبلمر ولأن جزيء بروتين واحد أكتين ملزم يمكن أن يجعل الاتصال مع مونومرات متعددة على خيوط أكتين.
- باستخدام برنامج إحصائي، تحديد تقارب (K د ) و B ماكس من منحنى الربط باستخدام الانحدار خطي المربعات الصغرى.
ملاحظة: يتم تثبيط المؤامرات سكاتشارد لتحليل البيانات ملزمة، ويرجع ذلك جزئيا لأنها يمكن أن تحجب ما إذا كان مشبعة ملزمة ولأنها يمكن أن تشوه الخطأ التجريبي 10 .
النتائج
فحصنا αE- كاتينين هوموديمر ملزمة ل F- أكتين في الفحص المشترك الترسيب. منذ التجارب السابقة أظهرت أن تقارب هوموديمير αE- كاتينين ل F- أكتين حوالي 1 ميكرومتر و B ماكس بالقرب 1 11 ، أجرينا الفحص مع تركيز منخفض من F- أكتين (0.2 ميكرومتر بدلا من 2 ميكرومتر، انظر المناقشة). منذ 0.2 ميكرومتر أقل من التركيز الحرج، وأضاف فالويدين لتحقيق الاستقرار في F- أكتين بلمرة من أرنب العضلات والهيكل العظمي G- أكتين (الخطوة 3.3). تم تحضين زيادة تركيزات هوموديمر αE- كاتينين (0.125-12.0 ميكرومتر) في وجود أو غياب 0.2 ميكرومتر F- أكتين. تم طرد العينات، وتم تحليل الكريات الناتجة ( الشكل 1A ). كما هو متوقع، هوموديمر αE- كاتينين المشارك الرسوبي مع F- أكتين فوق الخلفية ( الشكل 1A ، مقارنة عينات بيليه F- أكتين إلى لا F- أسالقصدير بيليه عينات). تم تشغيل بسا كسيطرة سلبية ( الشكل 1B ). تم قياس كمية البروتين وتآمر على البروتين الحر لحساب تقارب التفاعل ( الشكل 1C ). البيانات تآمر أفضل تناسب معادلة هيل. وكان K د المحسوب 2.9 ميكرومتر، وكان B ماكس 0.2، وكان معامل هيل (ح) 4.8. وهكذا، αE- كاتينين هوموديمر يربط F- أكتين بشكل تعاوني مع تقارب ميكرومولار منخفضة، بما يتفق مع العمل السابق (K د من 2.9 ميكرومتر مقابل ~ 1.0 ميكرومتر) 11 .
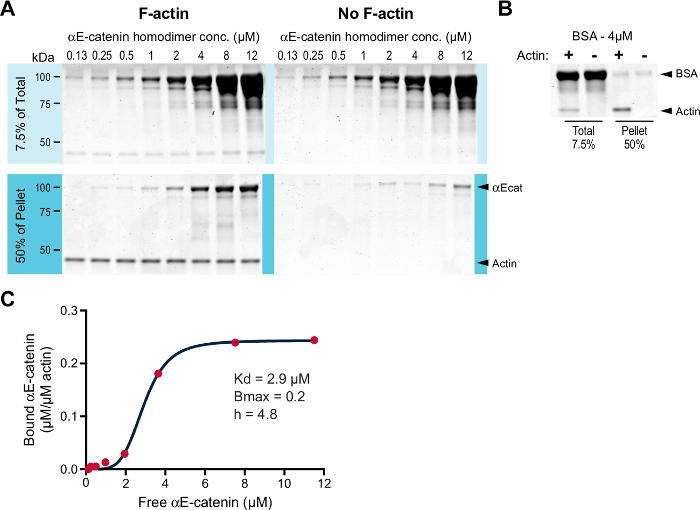
الشكل 1: عالية السرعة F- أكتين المشارك الترسيب الفحص. ( أ ) زيادة التركيز (0.125-12.0 ميكرومتر) من هوموديمر αE- كاتينين مع (لوحات اليسار) أو بدون (لوحات اليمنى) 0.2 ميكرومتر F- أكتين استقرت مع فالويدين. تم احتضانهم لمدة 30 دقيقة في رت والطرد المركزي. تم فصل مجموع (7.5٪ من المواد بدءا) والمواد بيليتد (50٪ من المواد بيليه) من قبل سدز-بادج وملطخة صبغ كوماسي. ( B ) تم تشغيل 4 ميكرومتر بسا كسيطرة سلبية. تم فصل مجموع وبيليه العينات، مع (+) أو بدون (-) F- أكتين، سدز-بادج وملطخة صبغ كوماسي. ( C ) ملزمة αE- كاتينين (μM / ميكرومتر أكتين) من A تم تآمر ضد αE- كاتينين الحرة (μM)، والبيانات تناسب معادلة هيل (الخط الأحمر). يتم سرد K د ، B ماكس ، ومعامل هيل (ح). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: أكتين التكوير الكمي - الرسم البياني. ويوضح هذا التخطيطي الخطوات الرئيسية في القسم 5، مع أمثلة من عينات توتال وبيليه ( A ، سي) والمنحنى القياسي ( B ) المستخدمة في القياس الكمي. 5.13 الخطوات: 1 ) قياس كمية البروتين من الفائدة في مجموع العينات (A). 2 ) توليد منحنى القياسية عن طريق التآمر كثافة الفرقة مقابل كتلة البروتين (B). 3 ) قياس كمية البروتين من الفائدة التي شاركت في الرسوبيات مع F- أكتين ( C ). 4 ) قياس كمية البروتين من الفائدة التي بيليتد في غياب F- أكتين ( D ). 5 ) طرح D من C لتحديد كمية البروتين ملزمة F- أكتين. 6 ) قياس كمية F- أكتين في كل بيليه (E)، وحساب متوسط كمية F- أكتين لكل عينة، وتقسيم كل عينة حسب المتوسط (الأرقام أدناه تظهر النسبة). 7 )لكل عينة، وتقسيم كمية البروتين ملزمة (المحسوبة في الخطوة 5) من قبل F- أكتين بيليه نسبة (المحسوبة في الخطوة 6) لضبط الاختلافات في بيليه. 8 ) استخدام منحنى القياسية ( B ) لحساب كمية (كتلة) من البروتين ملزمة تطبيع في كل عينة (الخطوة 7). 9 ) تحديد تركيز البروتين الحرة والبروتين ملزمة لخلق منحنى ملزمة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
و أكتين المشارك الترسيب الفحص هو تقنية واضحة التي يمكن أن تحدد بسرعة ما إذا كان البروتين يربط F- أكتين. مع بعض التعديلات، ويمكن أيضا أن تستخدم تقنية لقياس تقارب التفاعل. بالإضافة إلى النقاط التي أثيرت في البروتوكول أعلاه، ينبغي النظر في القضايا التالية عند تصميم وإجراء وتفسير الفحص.
بروتين الفائدة
بروتين الطازجة أو المجمدة يمكن استخدامها في الفحص. إذا تم استخدام البروتين المجمد، فمن المستحسن أن تتم مقارنة النتائج مع الطازجة (أبدا المجمدة) البروتين لضمان أن التجميد لا يؤثر F- أكتين ملزمة.
مصدر أكتين G
العديد من التجارب التكوير استخدام G- أكتين معزولة عن العضلات بسبب وفرة النسبية. هناك ثلاثة أنماط أساسية أكتين في الثدييات - ألفا، بيتا وجاما - التي هي مشابهة بشكل ملحوظ (> 90٪ تسلسل إيدنتيتي واي). ومع ذلك، هناك اختلافات وظيفية بين إيزوتيبس 12 ، 13 . إذا كان ذلك ممكنا، يجب أن يكون إيزوتيب G- أكتين المستخدمة في فحص ملزمة تطابق النمط الظاهري في الجسم الحي . على سبيل المثال، إذا اختبار البروتين أعرب في العضلات والهيكل العظمي، ألفا أكتين هو الخيار الافضل. إذا فحص البروتين أعرب في الخلايا الليفية، ينصح بيتا أكتين.
استخدام فالويدين
منذ فالويدين يربط F- أكتين، فإنه يمكن أن تتدخل أو حتى منع ربط بعض البروتينات ملزم F- أكتين (على سبيل المثال، كتل فالويدين كوفيلين من ربط خيوط أكتين) 14 . وهكذا، فالويدين ينبغي أن تستخدم بحذر والنتائج مقارنة مع عينات غير فالويدين المعالجة عندما يكون ذلك ممكنا.
خلفية عالية
ليس من غير المألوف للبروتينات إلى الرواسب في غياب F- أكتين ( الشكل 1A ، لا F- أكتين بيليه عينةق). ومع ذلك، يمكن لمستويات عالية من الترسيب الخلفية أن تخفي ترسيب الأكتين المشترك الحقيقي وتجعل من الصعب، إن لم يكن من المستحيل، تحديد ما إذا كان البروتين يربط F- أكتين أو لقياس تقارب التفاعل. إضافة بوليديكانول إلى المخزن المؤقت رد فعل (الخطوة 4.1) يمكن أن تقلل بشكل كبير من الخلفية، وهو حل سهل. إذا كان هذا لا يقلل من الخلفية، وضبط المخزن المؤقت رد فعل، تركيز الملح، و / أو درجة حرارة الحضانة قد يساعد.
منحنى ملزم
لتوليد منحنى ملزمة، فمن الضروري أن تختلف تركيز إما البروتين من الفائدة أو F- أكتين على مدى سلسلة من ردود الفعل. في الممارسة العملية، فإنه من الأسهل والأفضل للحفاظ على F- أكتين في تركيز ثابت وتختلف تركيز البروتين من الفائدة. الحفاظ على F- أكتين في تركيز ثابت (على سبيل المثال، 2 ميكرومتر) في مقايسة تكوير حدود محاصرة غير محددة في تركيزات أعلى من F- أكتين ويمنعإزالة البلمرة في تركيزات أقل من (0.5 ميكرومتر) من F- أكتين. يمكن منع إزالة البلمرة باستخدام فالويدين، على الرغم من أن هذا يدخل عامل تعقيد محتمل في النظام (انظر الخطوة 3.3 وما فوق). كما أن الحفاظ على F-أكتين عند تركيز ثابت يسمح لمقارنة (وتطبيع) بيليه F- أكتين عبر العينات وتحديد التجارب الفاشلة ( أي حيث يكون بيليه F- أكتين متغير بدرجة كبيرة، مما يمنع التحليل عبر التركيزات). وأخيرا، والحفاظ على F- أكتين في تركيز ثابت يسمح واحد لتحديد ما إذا كان ملزم خيوط أكتين تعاونية ( الشكل 1C ).
مشبعة ملزمة
كما هو الحال في جميع التجارب ملزمة، فمن الأهمية بمكان أن الربط إلى F- الأكتين مشبعة وأن تركيز البروتين زائد الهضاب F- أكتين ( الشكل 1C ). دون هضبة، فإنه ليس من الممكن لحساب ثابت التفكك ثابت ثابت. وهكذا، فإنهمن المهم أن تخطط بعناية لسلسلة التخفيف ليتم اختبارها ودائما تشمل تركيزات أعلى من البروتين ( أي، على الأقل 5- إلى 10 أضعاف أعلى من المتوقع K د ).
تحليل ملزم
من أجل الثوابت التفكك قياس أن تكون حاسمة، وينبغي إجراء الفحص باستخدام تركيز F- الأكتين الذي يسمح لتركيز مواقع ملزمة على F- أكتين للبروتين من الفائدة لتكون أقل بكثير من تقارب. للتحقق من ما إذا تم استيفاء هذا المعيار، تقدير تركيز مواقع الربط من B ماكس . على سبيل المثال، إذا كان [F- أكتين] 2 ميكرومتر و B ماكس = 0.5، ثم [مواقع ملزمة] ≈ 1 ميكرومتر. وينبغي أن يكون K d على الأقل من 5 إلى 10 أضعاف أكبر من [المواقع الملزمة]. إذا كان المقياس K d من نفس الحجم من حيث [المواقع الملزمة]، فمن الممكن أن يمثل منحنى ملاحظ لوحظ معايرة من عالية تقارب ملزمة سيتيس بدلا من إيسوثرم ملزمة حقيقية. إذا لوحظ هذا، كرر الفحص باستخدام انخفاض 10 أضعاف تركيز F- الأكتين لقياس تقارب دقيق. للتفاعلات عالية تقارب، فالويدين الاستقرار (الخطوة 3.3) قد يكون ضروريا لتحقيق تركيز F- أكتين منخفضة بما فيه الكفاية لقياس تقارب بدقة.
وأخيرا، هناك قيود أساسية مع الفحص المشترك الترسيب أن الباحثين يجب أن يكون على بينة من عند إجراء وتقييم الفحص. الأهم من ذلك، فإن مقايسة الترسيب المشترك لا تنتج ثابت التوازن الحقيقي. يتم فصل المنتجات من ملزمة ( أي البروتين زائد F- أكتين) من المواد المتفاعلة أثناء الطرد المركزي، وعندها يمكن للمنتجات ثم فصل لخلق توازن جديد. ونتیجة لذلك، یمکن أن یخطئ مقیاس الترسیب المشترك أو یخفق في الکشف عن التفاعلات المنخفضة الألفة. منذ العديد من البروتينات المرتبطة أكتين لديها تقارب منخفض ( أي، ميكرومولار) ل F- أكتين، نتيجة سلبية ( أي، لا يمكن الكشف عنها ملزمة) في الفحص لا يعني بالضرورة أن البروتين لا ربط F- أكتين. كبديل، تيرف القائم على الفحص المجهري، وفحوصات واحدة خيوط ملزمة هي أكثر حساسية وأكثر دقة لتحديد ثابت التفكك (للاستعراضات على هذه التقنية، انظر المراجع 15،16 ). وعلى الرغم من هذه القيود، فإن فحص التكوير هو ضمن وسائل معظم الباحثين، وهو أداة فعالة لتحديد ما إذا كان البروتين يربط F- أكتين وقياس تقارب التفاعل.
Disclosures
ويعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة منحة HL127711 ل أفك.
Materials
| Name | Company | Catalog Number | Comments |
| Sorvall MTX 150 Micro-Ultracentrifuge | ThermoFisher Scientific | 46960 | |
| S100-AT3 rotor | ThermoFisher Scientific | 45585 | |
| Ultracentrifuge tubes - 0.2 mL | ThermoFisher Scientific | 45233 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Bovine Serum Albumin | Sigma | A8531 | |
| Polidicanol (Thesit) | Sigma | 88315 | |
| Phalloidin | ThermoFisher Scientific | P3457 | |
| Dithiothreitol (DTT) | ThermoFisher Scientific | R0862 | |
| Adenosine triphosphate (ATP) | Sigma | A2383 | |
| Imidazole | Fisher Scientific | O3196 | |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | M33 | |
| Potassium Chloride (KCl) | Fisher Scientific | P217 | |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma | 3779 | |
| Odyssey CLx Imaging System | LI-COR | ||
| Coomassie Brilliant Blue R-250 Dye | ThermoFisher Scientific | 20278 | |
| Colloidal Blue Staining Kit | ThermoFisher Scientific | LC6025 |
References
- Pollard, T. D. Actin and Actin-Binding Proteins. Cold Spring Harb Perspect Biol. 8 (8), (2016).
- Hansen, M. D., Kwiatkowski, A. V. Control of actin dynamics by allosteric regulation of actin binding proteins. Int Rev Cell Mol Biol. 303, 1-25 (2013).
- Lappalainen, P. Actin-binding proteins: the long road to understanding the dynamic landscape of cellular actin networks. Mol Biol Cell. 27 (16), 2519-2522 (2016).
- Mullins, R. D., Hansen, S. D. In vitro studies of actin filament and network dynamics. Curr Opin Cell Biol. 25 (1), 6-13 (2013).
- Miller, P. W., et al. Danio rerio alphaE-catenin is a monomeric F-actin binding protein with distinct properties from Mus musculus alphaE-catenin. J Biol Chem. 288 (31), 22324-22332 (2013).
- Wickline, E. D., et al. alphaT-Catenin Is a Constitutive Actin-binding alpha-Catenin That Directly Couples the Cadherin.Catenin Complex to Actin Filaments. J Biol Chem. 291 (30), 15687-15699 (2016).
- Simpson, R. J., Adams, P. D., Golemis, E. Basic methods in protein purification and analysis : a laboratory manual. , Cold Spring Harbor Laboratory Press. (2009).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Pollard, T. D. A guide to simple and informative binding assays. Mol Biol Cell. 21 (23), 4061-4067 (2010).
- Hansen, S. D., et al. alphaE-catenin actin-binding domain alters actin filament conformation and regulates binding of nucleation and disassembly factors. Mol Biol Cell. 24 (23), 3710-3720 (2013).
- Perrin, B. J., Ervasti, J. M. The actin gene family: function follows isoform. Cytoskeleton (Hoboken). 67 (10), 630-634 (2010).
- Tondeleir, D., Vandamme, D., Vandekerckhove, J., Ampe, C., Lambrechts, A. Actin isoform expression patterns during mammalian development and in pathology: insights from mouse models. Cell Motil Cytoskeleton. 66 (10), 798-815 (2009).
- Prochniewicz, E., Janson, N., Thomas, D. D., Dela Cruz, E. M. Cofilin increases the torsional flexibility and dynamics of actin filaments. J Mol Biol. 353 (5), 990-1000 (2005).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophys J. 88 (2), 1387-1402 (2005).
- Hansen, S. D., Zuchero, J. B., Mullins, R. D. Cytoplasmic actin: purification and single molecule assembly assays. Methods Mol Biol. 1046, 145-170 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved