Method Article
Ko-çöktürme yoluyla F-aktine Bağlı Proteinin Ölçülmesi
Bu Makalede
Özet
Bu protokol, bir proteinin filamentli aktinle (F-aktin) birlikte sedimentasyon yeteneğini test etmek için bir yöntem ve bağlanma gözlemlendiğinde etkileşimin afinitesini ölçmek için bir yöntem açıklamaktadır.
Özet
Hücrelerin içinde filamentli aktin (F-aktin) organizasyonu, aktin nükleasyonu, büyümesi, çapraz bağlanma ve / veya demontajı kontrol eden çok sayıdaki aktin bağlayıcı proteinler tarafından düzenlenir. Bu protokol, bir protein veya protein alanının F-aktin'e bağlanıp bağlanmadığını belirlemek ve etkileşimin afinitesini ( yani, ayrışma dengesi sabiti) ölçmek için bir tekniği - aktin çöktürme veya topaklama testi - tanımlamaktadır. Bu teknikte, ilgilenilen bir protein önce çözeltide F-aktin ile inkübe edilir. Ardından, aktin filamanlarını tortulaştırmak için diferansiyel santrifüj kullanılmış ve topaklaştınlmış malzeme SDS-PAGE ile analiz edilmiştir. Eğer ilgilenilen protein F-aktini bağlarsa, aktin filamentleri ile birlikte çökecektir. Bağlanma tepkimesinin ( yani F-aktin ve ilgili protein) ürünleri etkileşimin afinitesini belirlemek için nicelleştirilebilir. Aktin peletleme tahlili, belirlenmesi için basit bir tekniktirEğer ilgilenilen bir protein F-aktini bağlar ve ligand bağlanması gibi o proteindeki değişiklikler F-aktin ile olan etkileşimini nasıl etkilediğini değerlendirir.
Giriş
Aktin, motilite, kasılma, yapışma ve morfoloji gibi çok hücresel süreçlerde kritik bir rol oynayan temel bir sitoskeletal proteintir 1 . Aktin, iki biçimdedir: monomerik globüler aktin (G-aktin) ve polimerize filamentli aktin (F-aktin). Hücreler içinde F-aktin organizasyonu, aktin filamanlarının 2 , 3 , 4 nükleasyonunu, büyümesini, çapraz bağlanmasını ve sökülmesini düzenleyen geniş bir protein koleksiyonu tarafından kontrol edilir. Bununla birlikte, aktin ağı düzenlenmesini düzenleyen çoklu aktin-bağlayıcı proteinlerin nasıl işlediği hala net değildir.
Protein-protein etkileşimlerinin ölçümü, proteinlerin hücresel davranış üzerine etkilerini biyokimyasal düzeyde nasıl uyguladığını anlamada önemli bir yaklaşımdır. Saflaştırılmış proteinler arasındaki etkileşimleri saptamak için birçok farklı tahlil kullanılabilir.Çözünür proteinler için yaygın yaklaşımlar pull-down'lar, fluoresan polarizasyonu, izotermal titrasyon kalorimetresi ve yüzey plazmon rezonansıdır. Önemlisi, bu tahlillerin hepsi, proteinlerin çözünür olmasını gerektirir ve bu nedenle, F-aktin gibi bir polimerik, ipliksi protein ile kullanım için uyarlanmak zordur. Burada, bir protein veya protein alanının F-aktine bağlanıp bağlanmadığını belirlemek ve etkileşimin afinitesini ölçmek için bir teknik - aktin birlikte sedimentasyon veya topaklanma, tahlil tanımlıyoruz.
Aktin peletleme tahlili, bir ultra-santrifüjün yanı sıra özel ekipman gerektirmeyen nispeten basit bir tekniktir. Tüm reaktifler, temel biyokimya bilgilerini varsayarak veya satın alınarak yapılabilir. F-aktin'e bağlandıktan sonra, deney, görünür afiniteyi ( yani, ayrışma dengesi sabiti) ölçmek için kullanılabilir 5 . Ayrıca, bir kez bir afinite kurulduğunda, peletleme deneyi, Ilgi proteinindeki değişikliklerin ( yani , translasyon sonrası modifikasyonlar, mutasyonlar veya ligand bağlanması) F-aktin 6 ile olan etkileşimini nasıl etkilediğini ölçmek için yararlı bir araçtır. Tekniğin araştırmacının deneyi denemeden önce farkında olması gereken kısıtlamaları vardır (bkz. Tartışma ).
Protokol
1. Malzemeleri hazırlayın
- İlgili proteini arındırın (bkz. Bölüm 2).
- G-actin hazırlayın veya satın alın.
NOT: G-actin birden fazla kaynaktan izole edilebilir 1 ; Alternatif olarak, satın alınabilir. Yeniden yapılandırılmış G-aktin (5 mM Tris pH 8.0, 0.2 mM CaCl2, 0.2 mM ATP (adenosin trifosfat) ve 0.5 mM ditiyotreitol (DTT) içinde) -80 ° C'de hızlı dondurulmalı ve> 10 mg / mL Küçük (10-20 uL) alikuotlar halinde ve kullanımdan hemen önce çözülmüştür. G-aktin alikotları yeniden soğutulmamalıdır. - BSA gibi bir kontrol proteini hazırlayın veya satın alın (bkz. Adım 4.4).
- 10x polimerizasyon tamponu (200 mM imidazol pH 7.0, 1 M KCI, 20 mM MgCl2, 5 mM ATP ve 10 mM EGTA (etilen glikol-bis (p-aminoetil eter) -N, N, N ', N'- Tetraasetik asit)). Gerekirse ATP eklenmesinden sonra 10x stok yapın ve pH değerini ayarlayın. Kısım (25 μL yararlı bir hacim) ve -80 de saklayın #176 ° C.
- 10x reaksiyon tamponu (200 mM imidazol pH 7.0, 1.5 M NaCl, 20 mM MgCl2, 5 mM ATP ve 10 mM EGTA) hazırlayın. Gerekirse ATP eklenmesinden sonra 10x stok yapın ve pH değerini ayarlayın. Kısım (50-100 μL faydalı bir hacimdir) ve -80 ° C'de saklayın.
NOT: Tepkime tamponunun bileşimi esnektir ve zemin sedimantasyonunu azaltmak, spesifik olmayan bağlanmayı sınırlandırmak ve / veya bağlanmayı iyileştirmek için ayarlanması gerekebilir (basamaklar 1.5.1-1.5.3).- Protein stabilitesini optimize etmek için reaksiyon tamponunun pH değerini 6 ile 8 arasında ayarlayın. Daha düşük veya daha yüksek bir pH'da, imidazol için uygun bir tampon maddesi koyun.
NOT: Bir protein stabilite için daha düşük veya daha yüksek bir pH gerektirmediği sürece pH 7,0'ı başlangıç noktası olarak kullanın. Faktinin bozulmasına neden olabileceğinden pH'ın 6.0'ın altında veya 8.0'ın üstünde bir tampon kullanmayın. Tavsiye edilen tamponlar (nihai konsantrasyon ve listelenen en uygun pH) aşağıdakileri içerir: 20 mM MOPS (3- ( N- morfolino) propansülfonik asit), pH= 6.5; 20 mM imidazol, pH = 7.0; 10 mM HEPES (4- (2-Hidroksietil) piperazin-1-etansülfonik asit), pH = 7.5; Ve 20 mM Tris, pH = 8.0. - Testin ihtiyaçlarına bağlı olarak reaksiyon tamponunun tuz konsantrasyonunu değiştirin.
NOT: Aktin asidik bir proteindir ve neredeyse tüm aktin-bağlayıcı proteinler, aktin ile ilişkilendirmek için elektrostatik etkileşimler üzerinde bir dereceye kadar güvenirler. Bu nedenle, çoğu durumda tuz konsantrasyonunun arttırılması aktin bağlanmasını azaltır. Reaksiyon tamponu, fizyolojik bir tuz düzeyini (150 mM NaCl, çalışma konsantrasyonu) kullanır ve bu önerilen başlangıç noktasıdır. Gerekirse, bağlanmayı artırmak için tuz konsantrasyonu düşürülebilir ( örn., 100 mM'ye kadar) veya bağlanmayı sınırlandırmak için arttırılabilir. - Bunun için özel bir sebep yoksa, reaksiyon tamponu içindeki MgCl2, ATP veya EGTA konsantrasyonlarını değiştirmeyin.
- Protein stabilitesini optimize etmek için reaksiyon tamponunun pH değerini 6 ile 8 arasında ayarlayın. Daha düşük veya daha yüksek bir pH'da, imidazol için uygun bir tampon maddesi koyun.
2. Deney için Test Proteinini Hazırlayın
- preparEn iyi sonuçlar için sıvı kromatografisini kullanarak yüksek saflıkta protein 7 .
NOT: Eğer rekombinant protein kullanılıyorsa, glutatyon-S-transferaz (GST) gibi büyük protein etiketleri, bağlanmaya müdahele edebildiği için hedef proteinden proteaz klivajı ile uzaklaştırılmalıdır. GST ayrıca füzyon proteinlerinin homodimerizasyona neden olur, bu da yapay olarak aktin bağlanmasının afinitesini artırabilir. - 280 nm'de absorbansı ölçerek protein konsantrasyonunu belirleyin. Sönüm katsayısı ile bölün; Sönüm katsayısı, sekans analizi veya çevrimiçi araçlar kullanarak protein sekansından hesaplanabilir. Alternatif olarak, Bradford veya BCA (bicinchoninic acid) yöntemlerini kullanarak protein konsantrasyonunu belirleyin.
NOT: İlk deneyler için genellikle 20-40 μM'de 50-100 μL protein yeterlidir. Bu, aktin bağlayıcı proteinlerin çoğu için yararlı bir başlangıç noktası olan düşük mikromolar aralıktaki bağlanmanın analiz edilmesini sağlayacaktır. Daha büyük bir quanYakınlığın hesaplanması için bir bağlanma eğrisi üretmek için daha yüksek bir protein konsantrasyonuna ihtiyaç duyulmaktadır (bkz. Bölüm 5). - Çözülmeyen proteinin agregalarını çıkartmak için protein kullanılmadan hemen önce proteini sıkıca döndürün (50,000-100,000 xg, 10 dakika süreyle 4 ° C'de). Çözünürlük bir endişe kaynağı ise, santrifüjden sonra protein konsantrasyonunu yeniden ölçün (adım 2.2).
3. F-aktini hazırlayın
- -80 ° C derin dondurucudan bir alikot G-aktini çıkarın ve çabucak çözdürün.
- 10x polimerizasyon tamponu G-aktin'e son konsantrasyonu 1x'e ekleyin. 1x polimerizasyon tamponundaki G-aktin konsantrasyonunun, kritik konsantrasyonun çok üzerinde en az 10-20 μM olmasını sağlayın. Aktinin polimerleşmesine izin vermek için oda sıcaklığında (RT) 1 saat inkübe edin.
- Polimerizasyondan sonra, F-aktini solüsyonda 4 ° C'de saklayın; burada birkaç hafta stabil kalacaktır. Depolamadan sonra F-aktini tekrar kullanmadan önce, hafifçe ters çevirinVeya tüm aktinin eritildiğinden ve çözelti içinde düzgün şekilde dağıldığından emin olmak için tüpü birkaç kez hafifçe vurun.
NOT: (İsteğe bağlı) 1: 1 molar oranda G-aktin: phalloidin elde etmek için phalloidin ekleyin. Phalloidin'in F-actin'e bağlanmasına izin vermek için oda sıcaklığında 30 dakika inkübe edin. Phalloidin, F-aktini stabilize eder ve iki şeyi yerine getirir: (i) santrifüj sırasında tortulanmayan aktin miktarını azaltır ve (ii) F-aktinin, kritik konsantrasyonun (~ 0.5 uM) altında seyreltilmesine izin verir, Bir bağlanma eğrisi üretmek için F-aktin miktarını değiştirirse gereklidir (afiniteyi ölçmek için bölüm 5'e bakınız).
4. Pelletleme Deneyi - Temel Protokol
NOT: Bölüm 4'te açıklanan temel protokol, ilgi konusu bir proteinin F-aktin ile birlikte sedimant olup olmadığını belirlemek için kullanılır. F-aktine bağlanma yapıldıktan sonra, bu etkileşimin afinitesi, bölüm 5'de açıklanan protokolü izleyerek ölçülebilir.
- Tepkime tamponu kullanım gününü, 10x stoğu 1x'e seyrelterek hazırlayın ve 1 mM'lik bir nihai konsantrasyona kadar DTT ekleyin.
NOT: (İsteğe bağlı) Polidokanol, reaksiyon tamponu içinde% 0.02'lik bir nihai çalışma konsantrasyonuna ilave edilir. Polidokanol, spesifik olmayan arka plan bağlanmayı azaltan ve hidrofobik proteinlerin ultra-santrifüj tüpüne yapışmasını önlemeye yardımcı olan bir yüzey aktif maddedir. - İlgili proteini, ultra santrifüj tüplerinde 1x reaksiyon tamponunda istenen konsantrasyonlara seyreltin. Minimum asgari hacimlerdeki ultra santrifüj tüpleri ( örneğin , her biri 0,2 mL tutan 7 x 20 mm tüpler) kullanarak büyük protein miktarlarını kullanmaktan kaçınmak için numune hacmini düşük tutun (40-60 μL).
NOT: Birçok aktin bağlayıcı proteinin mikromolar aralıkta F-aktin'e yakınlığı olduğundan, 2 ve 10 uM'lik bir ilgi çekici bir proteinin test edilmesi önerilir. 10 uM'de bağlanma gözlemlenmiyorsa, bağlantının daha yüksek konsantrasyonlarda gözlenmesi olası değildir. EğerEklenen protein, nihai reaksiyon hacminin% 10-20'sini oluşturduğundan, deney yapılmadan önce proteini reaksiyon tamponu içine diyalize etmeniz gerekebilir. - İstenen son konsantrasyona F-aktin ekleyin.
NOT: 2 μM, başlangıç deneyleri için yararlı bir konsantrasyondur çünkü kritik konsantrasyonun çok üstündedir, böylece filament halindeki aktini muhafaza eder. SDS-PAGE ile analiz edildiğinde görünür pelet üretecektir (adım 4.10). - Deneyi bilgilendirici yapmak için aşağıdaki kontrolleri ultra santrifüj tüplerinde hazırlayın.
- F-aktin olmadan ilgilenilen proteini içeren örnek (ler) hazırlayın. Bu örneklerdeki protein konsantrasyonunun "artı F-aktin" örneklerindeki konsantrasyonla eşleştiğinden emin olun.
NOT: Bu numuneler, F-aktin yokluğunda ultra santrifüj tüpünün kenarlarına bir araya getirilen veya sıkışmış protein miktarını belirleyecektir. - Negatif kontrol örnekleri hazırlayınIlgi protein için kullanılan aynı veya benzer konsantrasyonlarda. F-aktin ile veya F-aktin olmadan F-aktin'e bağlanmayan bir kontrol proteini kullanın.
NOT: Bu önemli bir kontroltür, çünkü proteinler aktin filamentlerinde "sıkıştırabilir" ve F-aktini bağlamasa da F-aktin ile topaklar haline gelebilir. Yakalama miktarı, F-aktin kaynağına, tampon koşullarına vb . Bağlı olarak değişebilir. Dolayısıyla bu kontrol, tüm deneylerde dahil edilmelidir. İdeal olarak, kontrol proteininin ilgilenilen proteine benzer bir molekül ağırlığı olmalıdır ( örn. , ΑE-katenin (~ 100 kDa) için, BSA (66 kDa) uygun bir kontroltür). Ticari olarak temin edilebilen jel filtrasyon standartları mükemmel kontrol proteinlerini üretir; çünkü bunlar bir dizi ebadı kapsar ve agrega içermeme eğilimindedir. - İsteğe bağlı olarak, F-aktin ile veya F-aktin olmadan F-aktin'e bağlanan bir protein içeren pozitif kontrol örnekleri hazırlayın. Konsantrasyonun, bu konsantrasyonunE protein.
NOT: Bu kontrol, deneysel koşulların ( örn. Hazırlanmış F-aktin, reaksiyon tamponu ve santrifüj) F-aktin bağlanmasına izin verdiğini göstermesi açısından yardımcıdır. Peletleme deneyi, zayıf F-aktin etkileşimlerini saptamayı başaramadığı için (bkz. Tartışma), bilinen F-aktin bağlayıcı proteinin F-aktin için orta ila zayıf bir yakınlığa ( yani, düşük mikromolar aralıkta) sahip olması önerilir ). Saflaştırılmış F-aktin bağlama proteinleri ticari olarak mevcuttur.
- F-aktin olmadan ilgilenilen proteini içeren örnek (ler) hazırlayın. Bu örneklerdeki protein konsantrasyonunun "artı F-aktin" örneklerindeki konsantrasyonla eşleştiğinden emin olun.
- Tüm numuneleri oda sıcaklığında 30 dakika inkübe edin.
NOT: Olasılıkla gereksiz olmasına rağmen, ilgilenilen proteinin sabit olduğu varsayılarak daha uzun inkübasyon süreleri uygundur. Eğer ilgilenilen protein RT'de stabil değilse, numuneler 4 ° C'de inkübe edilebilir. Bu durumda, inkübasyon süreleri daha uzun olabilir. - Örnekleri santrifüj rotoruna yükleyin. Santrifüjden sonra pelet yeniden süspansiyona yardımcı olmak için tüpleri rotorun içine yerleştirin.Bunun için tüm santrifüj tüplerini işaretleyin ( örn. Numune numarası ile) ve tüm tüpleri rotor içine aynı konuma getirin ( örneğin, numara dışarı bakacak şekilde).
- Ultracentrifuge'de 4 ° C'de 20 dakika 100,000 xg'de santrifüjleyin.
- Santrifüjden sonra, her tüpten yüzer maddenin 3 / 4'ünü ( örneğin , başlangıç hacmi 60 mcL olan 45 mcL) çıkarın ve ayrı bir mikrosantrifüj tüpünün 1/3 hacimdeki 4x örnek tamponu (bu durumda 15 mcL) ile karıştırın.
- Geriye kalan süpernatanı, pelleti (camsı bir nokta olarak görülebilir) rahatsız etmemeye özen gösteren bir jel yükleme ucu ile çıkarın.
NOT: Ayrıştırma sonrasında protein ayrışmasını sınırlamak için, santrifüjün tamamlanmasından sonra, süpernatıttan tüplerden mümkün olduğunca çabuk çıkarmak önemlidir. Ayrıca, aynı nedenden dolayı tepkime tamponuyla topağı yıkamayın.
- Geriye kalan süpernatanı, pelleti (camsı bir nokta olarak görülebilir) rahatsız etmemeye özen gösteren bir jel yükleme ucu ile çıkarın.
- Her pelleğe 4/3 hacim 1x örnek tamponu ekleyinT (başlangıç hacmi 60 μL ise 80 μL).
NOT: Bu, seyreltmeyi süpernatant ile aynı yapar (pelet ve süpernatan numuneleri arasında doğrudan kıyaslama yapılmasına ve peletlenen proteinin yüzdesinin belirlenmesine izin verilerek adım 4,8, 1/4 hacim 4x örnek tampon eklenmiştir).- Tüm tüplere örnek tamponu ekleyin ve oda sıcaklığında en az 5 dakika inkübe edin. Örnek geri kazanımını iyileştirmek için topağın örnek tamponuna oturmasına izin verin.
- Tüpün pelet alanını sürekli olarak yıkayarak topağı yeniden askıya almak için numuneyi bir p200 pipet ucu ile 8-10 kez toz haline getirin. Yeniden süspansiyon ile yardımcı olmak için toz haline getirme sırasında pelet üzerindeki pipet ucunu yavaşça kazın.
NOT: öğütme sırasında numuneye hava girmesini önlemek için dikkat edin, çünkü numune tamponunun kabarcık oluşturmasına ve numunenin geri kazanımını azaltmasına neden olur. - Öğütülmeden sonra yeniden süspanse edilen numuneleri mikro huniye tüplerine aktarın.
- Şerit başına 10-15 μL örnek yükleyerek SDS-PAGE ve Coomassie boyama 8 ile süpernatan ve topak numunelerini analiz edin; Bu proteinleri görselleştirmek için yeterlidir.
NOT: F-aktin ile birlikte çökelen proteinler, "F-aktin" yoksun topak örnekleri üzerinde "artı F-aktin" pelet örneklerinde zenginleştirilir ( Şekil 1A ). Standart Coomassie mavisi boyama protein konsantrasyonları 0.1-10 μM aralığında ise saptama için yeterlidir. Düşük afiniteli etkileşimleri ölçmek için düşük protein konsantrasyonları kullanılırsa, Colloidal Coomassie 9 veya Western blotlama hassasiyeti artırmak için kullanılabilir. - Image Bir tarayıcı veya görüntüleme sistemi kullanarak Coomassie boyalı jelleri (adım 5.12).
5. Peletleme Deneyi - Niceleme
Not: F-aktine spesifik bağlanma gözlemleniyorsa, t nin afinitesini ölçmekO etkileşim. Bu, 4. bölümde özetlenen protokole birkaç değişiklik ve ekleme yaparak gerçekleştirilir. Bağlama analizlerini tasarlamak ve yorumlamak için mükemmel bir kılavuz için bkz. Pollard 10 . Analiz ve miktar tayini için yardım için bir akış şeması ( Şekil 2 ) sağlanmıştır.
- Test edilecek konsantrasyon aralığını belirleyin.
NOT: Konsantrasyon aralığı, proteine bağlıdır ve görünür Kd'nin ( örn., 1 uM) altındaki bir konsantrasyondan bağlanmayı doyurmaya yetecek kadar konsantrasyona kadar yayılmalıdır. Doğru bir bağlanma eğrisi oluşturmak için ( Şekil 1C ), bağlanmanın konsantrasyon aralığının üst ucundaki çok sayıda numunede bağlanmanın doygunluğa ulaşması kritiktir. Yukarıda belirtildiği gibi, birçok aktin-bağlayıcı protein düşük mikromolar aralıkta (1-5 uM) F-aktin için bir afiniteye sahiptir. 0.5-1 uM bir Kd'ye sahip bir protein için, yararlı bir başlangıç konsantrasyon aralığı, 0.1-10 uM. - Agregaları çıkarmak için katı spin (adım 2.3) ilgilenilen protein. Test edilecek nihai konsantrasyondaki 2x'de 7-8 örnek içeren bir konsantrasyon serisi yapmak için proteini ciddi olarak seyreltin. Örneğin, test edilecek aralık 0.1-8 μM ise, aşağıdaki seyreltileri 1x reaksiyon tamponu içerisinde hazırlayın: 16, 8, 4, 2, 1, 0.5 ve 0.2 uM.
NOT: Adım 4.2'de belirtildiği gibi, eklenen protein ilk seyreltmenin (yukarıdaki örnekte 16 uM numune)% 10 -% 20'sini oluşturursa, ya proteini konsantre hale getirmek ya da 1x reaksiyon tamponuna ilave edin. "Artı F-aktin" ve "hayır F-aktin" örnekleri için her seyreltmeden yeterince hazırladığınızdan emin olun. - İlgili proteini ultra santrifüj tüplerinde 1x reaksiyon tamponu içerisinde istenen konsantrasyonlara seyrelterek örnekler hazırlayın (bölüm 4'te olduğu gibi). Ultracent kullanarak büyük miktarlarda protein kullanmaktan kaçınmak için numune hacimlerini düşük (40-60 μL) tutunKüçük asgari hacimlerdeki rifuge tüpleri ( örneğin , her biri 0.2 mL tutan 7 x 20 mm tüpler).
- Uygun numunelere istenen nihai konsantrasyona F-aktin ekleyin ve 1x reaksiyon tampon kullanarak hacmi getirin. Örneğin, 2 uM F-aktin kullanarak 50 μL reaksiyonlar için, her bir numunenin 2x protein 25 mcL, 10 uL 10 uM F-aktin ve 15 uL 1x reaksiyon tamponu içerdiğinden emin olun. Kontrol numunelerini ekleyin (adım 4.4.2 ve 4.4.3).
NOT: Negatif ve pozitif kontroller için, test edilecek aralıkta (adım 5.1), ideal olarak aralığın orta ila üstünün yakınında ( örn . Konsantrasyon aralığı 0.1-10 μM ise 4 uM) bir konsantrasyon kullanın.
- Uygun numunelere istenen nihai konsantrasyona F-aktin ekleyin ve 1x reaksiyon tampon kullanarak hacmi getirin. Örneğin, 2 uM F-aktin kullanarak 50 μL reaksiyonlar için, her bir numunenin 2x protein 25 mcL, 10 uL 10 uM F-aktin ve 15 uL 1x reaksiyon tamponu içerdiğinden emin olun. Kontrol numunelerini ekleyin (adım 4.4.2 ve 4.4.3).
- Tüm numuneleri oda sıcaklığında 30 dakika inkübe edin.
- 30 dakika sonra, her numunenin 1 / 5'ini ( örneğin, 50 μL reaksiyonun 10 uL'si) çıkarın ve 20 mcL su ve 10 mcL 4x numune tamponu ile karıştırın.
NOT: Bunlar "Toplam" larVe standart eğri oluşturmak için kullanılacaktır. - Numuneleri ultra-santrifüj rotoruna yükleyin. 100.000 xg ve 4 ° C'de 20 dakika boyunca santrifüjleyin.
- İsteğe bağlı olarak, santrifüjden sonra, her tüpten yüzer maddenin 3 / 4'ünü ( ör., Santrifüj hacmi 40 mcL olan 30 mcL) kaldırın ve ayrı mikrofüj tüpünde 4x numune tamponu (bu durumda 10 mcL) ile karıştırın. Geriye kalan süpernatanı, pelleti rahatsız etmemeye özenerek bir jel yükleme ucu ile çıkarın.
NOT: Bağlanma afinitesi ölçülürken, süpernatanın çalıştırılması gerekli değildir. Yine de, özellikle yeni bir proteini test ederken süpernatanı kurtarmak yararlı olabilir. - Analiz edilmezse süpernatanı çıkarın (adım 5.7).
- Pelet 1 hacim 1x örnek tampon ( örneğin, santrifüj hacmi 40 mcL ise 40 mcL) tekrar süspansiyon haline getirin.
- Tüm tüplere örnek tamponu ekleyin ve oda sıcaklığında en az 5 dakika inkübe edin.
- TrNumuneyi, bir p 200 pipet ucu ile 8-10 kez yineleyin, tüpün pelet alanını sürekli olarak yıkayın. Yeniden süspansiyon ile yardımcı olmak için toz haline getirme sırasında pelet üzerindeki pipet ucunu yavaşça kazın.
- Yeniden askıdaki proteini bir mikrosantrifüj tüpüne aktarın.
NOT: Bunlar "Pelet" örnekleridir. - Total ve Pellet örneklerini SDS-PAGE 8 ile analiz edin. Mümkünse tüm numuneleri tek bir jel üzerinde çalıştırın; Yoksa, bir jeldeki pellet örneklerini ve saniyedeki toplam örnekleri çalıştırın.
NOT: Numunelerin sayısına bakıldığında, analiz için büyük bir jel sistemi önerilir. İki veya daha fazla jel üzerinde numuneler çalıştırılıyorsa, tüm jellerin aynı şekilde boyanması önemlidir ( yani, aynı Coomassie çözeltisi ve aynı zamanda leke / destain içinde). - Görüntü geniş bantlı yoğunluğu ( yani iki veya üç günlük) ve doğrusal aralıkta ölçen bir görüntüleme sistemi kullanarak Coomassie boyalı jelleri. Resimlerinizin bir veyaDoymuş piksel olmadan toplandı.
NOT: Lazer tabanlı görüntüleme sistemleri en iyi hassasiyet ve sinyal-gürültü oranlarını sunar. - ImageJ veya benzeri bir analiz programı kullanarak, protein bant yoğunluklarını ölçün ve bağlı protein miktarını hesaplayın.
NOT: Tüm örnek ölçümler için, her bandın etrafında bir ilgi alanı (ROI) çizmek ve alanı (grafiğin ortalama değerini ölçün) ölçmek için ImageJ'deki seçim aracını kullanın. Örnek olmayan bir alanın ortalama gri değerini ölçerek her bir jel için arka planı hesaplayın. Her ROI ortalama gri değerden arka plan ortalama gri değerini çıkarın ve daha sonra her bir bant için entegre yoğunluk değerini elde etmek için alanla çarpın.- Toplam örneklerden ilgi band yoğunluklarının proteinini ölçün ( Şekil 2A ).
- Band yoğunluğunu ( yani entegre yoğunluk ölçümleri) protein kütlesi karşısında çizerek standart bir eğri oluşturun ( Şekil2B).
- F-aktin ile birlikte çökeltilen ilgi protein miktarını ölçün (birlikte çöktürülmüş protein, Şekil 2C ).
- F-aktin yokluğunda tortulaştırılan ilgi protein miktarını ölçün (arka plan sedimantasyonu, Şekil 2D ).
- F-aktine bağlanan proteinin miktarını belirlemek için birlikte sedimantasyonlu proteinin arka plan çökmesini çıkartın ( yani, 5.13.4 adımından 5.13.4 adımından çıkarın).
- Her pelet içindeki F-aktin miktarını ölçün ( Şekil 2E ). Her numune için F-aktinin ortalama miktarını belirleyin ve her örneği ortalamaya bölünerek, her bir numunedeki F-aktin oranını ortalamayla ( yani, bantların altındaki sayıları) ölçün.
- Her numune için, pelet içindeki farklılıkları ayarlamak için bağlı protein yüzdesini (adım 5.13.5'te hesaplanan) F-aktin aktin pelet oranı ile bölün (adım 5.13.6).
N-OTE: Bu değer, normalleştirilmiş bağlı proteintir. - Her bir numunede normalleştirilmiş bağlı proteinin miktarını (kütle) hesaplamak için standart eğrisi (adım 5.13.2) kullanın (adım 5.13.7).
NOT: Başlangıçta çıkarılan protein ("Toplam" numune) yanı sıra yüklenen miktar (tüm pelet yüklenmedikçe, pelletin bir kısmı olacaktır) toplam protein miktarını hesaplarken hesaba katılmalıdır Peletlenen bu. - Pellet içindeki toplam protein kütlesi (adım 5.13.8'de hesaplanan) ve numunenin hacminden her bir numunedeki bağlı proteinin konsantrasyonunu belirleyin. Serbest protein miktarını belirlemek için başlangıç konsantrasyonundan bu değeri çıkarın. Bağlanan protein konsantrasyonunu aktin (μM / μM aktin) konsantrasyonuna bölün ve bir bağlanma eğrisi oluşturmak için serbest protein konsantrasyonuna karşı çizim yapın ( Şekil 1C ).
NOT: F-aktin tek bir üniform olmayan tür olmadığından,Kült, F-aktinin molar konsantrasyonunu G-aktin konsantrasyonundan çıkarır. Bağlanan protein miktarını (μM / μM aktin) belirlemek için başlangıç G-aktin konsantrasyonunu kullanın ve reaksiyondaki bağlanma bölgelerinin belirgin konsantrasyonunu hesaplayın. Bağlanma sahalarının konsantrasyonu genellikle reaksiyonda aktin monomerlerinin konsantrasyonundan daha düşüktür çünkü tüm aktin polimerize değildir ve tek bir aktin bağlayıcı protein molekülü aktin filament üzerinde çoklu monomerler ile temasa geçebilir.
- İstatistiksel bir program kullanarak doğrusal olmayan en küçük kareler regresyonunu kullanarak bağlanma eğrisinden afiniteyi (Kd) ve Bmax değerini belirleyin.
NOT: Scatchard arazileri, bağlanma verilerini analiz etmek için caziptir çünkü kısmen bağlanma doymuş olup olmadığını belirsizlik gösterebilir ve deney hatasını 10 bozabilir.
Sonuçlar
Ko-sedimantasyon deneyinde F-aktine karşı αE-katenin homodimer bağlanmasını inceledi. Geçmiş deneyler, F-aktin için αE-katenin homodimerinin afinitesi 1 uM civarında ve Bmax 1 11'e yakın olduğu gösterdiğinden, düşük bir F-aktin konsantrasyonuyla (2 uM'den ziyade 0.2 uM; tartışma). 0.2 uM kritik konsantrasyonun altında olduğu için, tavşan iskelet kasından G-aktin'den polimerize edilmiş F-aktini stabilize etmek için phalloidin ilave edildi (basamak 3.3). Artan konsantrasyonlarda αE-catenin homodimeri (0.125-12.0 uM) 0.2 uM F-aktin varlığında veya yokluğunda inkübe edildi. Numuneler santrifüje tabi tutuldu ve elde edilen pelletler analiz edildi ( Şekil 1A ). Beklendiği gibi, αE-katenin homodimeri, arka planın üstünde F-aktin ile birlikte çökeltildi ( Şekil 1A , F-aktin pelet numunelerinin no-F-ac'ye kıyaslaKalay pellet örnekleri). BSA, negatif bir kontrol olarak çalıştırıldı ( Şekil 1B ). Bağlanan protein nicelendirildi ve etkileşimin afinitesini hesaplamak için serbest protein üzerine çizildi ( Şekil 1C ). Planlanan veriler en iyi Hill denklemine uymaktadır. Hesaplanan K d 2.9 uM, Bmax 0.2 ve Hill katsayısı (h) 4.8 idi. Dolayısıyla, αE-catenin homodimeri F-aktini, önceki çalışmada (~ 1.0 uM'ye karşı 2,9 μM'nin bir Kd'si) tutarlı, düşük bir mikromolar afinite ile birlikte bağlar 11 .
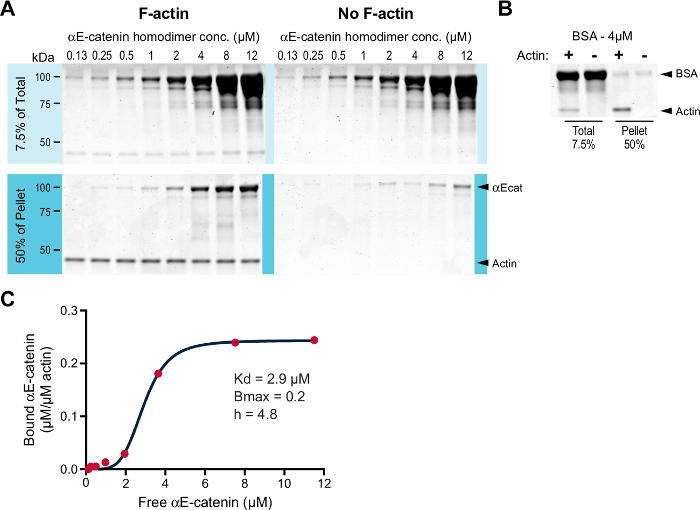
Şekil 1: Yüksek hızlı F-aktin birlikte sedimentasyon testi. ( A ) Artan konsantrasyonlar (0.125-12.0 uM) αE-katenin homodimeri, sol panellerle veya sağ paneller olmadan (sağ paneller), phalloidi ile stabilize edilmiş 0.2 uM F-aktin ile kuluçkaya yatırıldın. Oda sıcaklığında 30 dakika inkübe edildi ve santrifüj edildi. Toplam (başlangıç maddesinin% 7.5'i) ve pelet haline getirilmiş malzeme (pellet haline getirilmiş malzemenin% 50'si) SDS-PAGE ile ayrılmış ve Coomassie boyasıyla lekelenmiştir. ( B ) 4 uM BSA negatif bir kontrol olarak çalıştırıldı. (+) Veya (-) F-aktin içeren toplam ve pellet örnekleri, SDS-PAGE ile ayrılmış ve Coomassie boyası ile boyanmıştır. ( C ) A'dan bağlanan αE-katenin (μM / μM aktin) serbest αE-katenin (μM) karşısında çizildi ve veriler bir Hill denklemine (kırmızı çizgi) sığdı. K d , B max ve Hill katsayısı (h) listelenmiştir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 2: Aktin peletleme kantifikasyonu - akış şeması. Bu şema, Toplam ve Pelet örnekleri ( A , CE ) ve kantifikasyon için kullanılan standart eğri ( B ) örnekleriyle, bölüm 5'deki önemli adımları özetlemektedir. 5.13 adımlar: 1 ) Toplam örneklerde (A) ilgi protein miktarını ölçün. 2 ) Bant yoğunluğuna karşı protein kütlesi (B) çizerek standart bir eğri oluşturun. 3 ) F-aktin ( C ) ile çöktürülen ilgi protein miktarını ölçün. 4 ) F-aktin ( D ) yokluğunda peletlenen ilgi protein miktarını ölçün. 5 ) F proteinine bağlı protein miktarını belirlemek için C'den D çıkarın. 6 ) Her bir topakta (E) F-aktinin miktarını ölçün, numune başına F-aktinin ortalama miktarını hesaplayın ve her bir örneği ortalama olarak bölün (aşağıdaki sayılar oranı gösterelim). 7 )Her numune için, pelet içindeki farklılıkları ayarlamak için bağlanmış proteinin miktarını (5. adımda hesaplanan) F-aktin pelet oranı ile bölün (6. adımda hesaplanmıştır). 8 ) Her bir numunede normalize edilmiş bağlanmış proteinin miktarını (kütle) hesaplamak için standart eğriyi ( B ) kullanın (basamak 7). 9 ) Bağlayıcı bir eğri yaratmak için serbest protein ve bağlanmış protein konsantrasyonunu belirleyin. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Tartışmalar
Aktin birlikte sedimantasyon tahlili, bir proteinin F-aktine bağlanıp bağlanmadığını çabucak belirleyebilen basit bir tekniktir. Bazı değişikliklerle teknik, etkileşimin afinitesini ölçmek için de kullanılabilir. Yukarıdaki protokolde ortaya konulan hususlara ek olarak, tahlil tasarlanırken, iletilirken ve yorumlanırken aşağıdaki hususlar dikkate alınmalıdır.
İlgi Proteinleri
Yeni hazırlanmış veya dondurulmuş protein testte kullanılabilir. Dondurulmuş protein kullanılıyorsa, dondurmanın F-aktin bağlanmasını etkilemediğinden emin olmak için sonuçların taze (asla donmamış) protein ile karşılaştırılması önemle tavsiye edilir.
G-aktin Kaynağı
Birçok peletleme deneyinde göreceli bolluk nedeniyle kasdan izole edilen G-aktin kullanılır. Memelilerde - alfa, beta ve gamma - üç ana aktin izotipi vardır ki bunlar dikkat çekici derecede birbirine benzemektedir (>% 90 sekans tanımlamaty). Bununla birlikte, izotipler 12 , 13 arasında işlevsel farklılıklar vardır. Mümkünse, bağlanma tahlilinde kullanılan G-aktin izotipi in vivo izotipe uymalıdır. Örneğin iskelet kasında ifade edilen bir proteini test ederseniz alfa-aktin en iyi seçimdir; Fibroblastlarda eksprese edilen bir proteini incelemek için beta-aktin önerilir.
Phalloidin Kullanımı
Falloidin F-aktini bağladığından, bazı F-aktin bağlayıcı proteinlerin bağlanmasını ( örneğin, faloidin , cofilin bağlamadan aktin filamentlerine blokar) müdahale edebilir veya hatta engelleyebilir. Bu nedenle, phalloidin dikkatle kullanılmalı ve mümkün olduğunca phalloidin ile muamele edilmiş numunelerle karşılaştırılmalıdır.
Yüksek Arka Plan
Proteinlerin F-aktin yokluğunda tortulaşması nadir değildir ( Şekil 1A , hiçbir F-aktin pelet örneğis). Bununla birlikte, arka plan sedimentasyonunun yüksek seviyeleri, gerçek aktin çökelmesini maskeleyebilir ve imkansız olmasa da, bir proteinin F-aktini bağlayıp bağlamadığını veya etkileşimin afinitesini ölçmesini zorlaştırabilir. Polidicanol tepkime tamponuna ekleme (adım 4.1), arka planı önemli ölçüde azaltabilir ve kolay bir çözümdür. Bu, arka planı azaltmazsa, reaksiyon tamponu, tuz konsantrasyonu ve / veya inkübasyon sıcaklığı ayarlanması yardımcı olabilir.
Bağlanma Eğrisi
Bir bağlanma eğrisi üretmek için, bir dizi reaksiyon üzerinde ilgi protein veya F-aktinin konsantrasyonunu değiştirmek gereklidir. Pratikte F-aktini sabit bir konsantrasyonda tutmak ve ilgi protein konsantrasyonunu değiştirmek daha kolay ve tercih edilir. Peletleme deneyinde F-aktinin sabit konsantrasyonda ( örn., 2 uM) tutulması, daha yüksek konsantrasyonlarda F-aktin ile spesifik olmayan yakalama sayısını sınırlar veDüşük (<0.5 uM) F-aktin konsantrasyonlarında depolimerizasyon. Depolimerizasyon, phalloidin kullanılarak önlenebilir, ancak bu, sisteme potansiyel bir komplike edici faktör getirir (bkz. Adım 3.3 ve üstü). F-aktini sabit bir konsantrasyonda muhafaza etmek, numuneler boyunca F-aktin peletini karşılaştırabilir (ve normalleştirir) ve başarısız deneyleri tanımlamayı sağlar ( yani, F-aktin peletinin çok değişken olduğu, konsantrasyonlarda analizi önlediği durumda). Son olarak, F-aktini sabit bir konsantrasyonda tutmak, birinin aktin filamanına bağlanmanın birlikte çalışıp çalışmadığını belirlemesine izin verir ( Şekil 1C ).
Doymuş Bağlama
Bütün bağlanma deneylerinde olduğu gibi, F-aktine bağlanmanın doymuş olması ve protein artı F-aktin platolarının konsantrasyonunun kritik olması önemlidir ( Şekil 1C ). Bir plato olmadan doğru bir ayrışma denge sabitinin hesaplanması mümkün değildir. Böylece,Test edilecek seyreltme serisini dikkatlice planlamak ve her zaman daha yüksek konsantrasyonlarda protein ( yani, beklenen Kd'den en az 5-10 kat daha yüksek) içerdiği önemlidir.
Bağ Analizi
Ölçülen ayrışma sabitlerinin kesin olması için, analiz, ilgi proteinine yönelik olarak F-aktin üzerindeki bağlanma alanlarının konsantrasyonunun afiniteye göre daha düşük olmasına izin veren bir F-aktin konsantrasyonu kullanılarak gerçekleştirilmelidir. Bu kriterin karşılanıp karşılanmadığını kontrol etmek için bağlama alanlarının B max konsantrasyonunu hesaplayın. Örneğin, eğer [F-aktin] 2 mcM ve B max = 0.5 ise, o zaman [bağlanma bölgeleri] ≈ 1 uM'dir. K d , [bağlanma yerlerinden] en az 5-10 kat daha büyük olmalıdır. Ölçülen Kd, [bağlanma alanları] ile aynı derecede ise, gözlemlenen bağlanma eğrisinin yüksek afiniteli bağlama titrini temsil etmesi mümkündürGerçek bir bağlayıcı izoterm yerine tes. Bu gözlemlenirse, doğru bir afinite ölçmek için tahlil 10 kat daha düşük bir F-aktin konsantrasyonu kullanılarak tekrarlayın. Yüksek afiniteli etkileşimler için afiniteyi doğru bir şekilde ölçmek için düşük bir F-aktin konsantrasyonu elde etmek için phalloidin stabilizasyonu (adım 3.3) gerekli olabilir.
Son olarak, araştırmacıların testi yaparken ve değerlendirirken farkında olmaları gereken birlikte sedimantasyon tahlilinde temel sınırlamalar vardır. En önemlisi, birlikte sedimentasyon tahlili gerçek bir denge sabiti oluşturmaz. Bağlanma ürünleri ( yani, protein artı F-aktin), santrifüj işlemi sırasında reaktanlardan ayrılır ve daha sonra ürünler, yeni bir denge yaratmak için ayrışabilir. Sonuç olarak birlikte çöktürme deneyi, düşük afiniteli etkileşimleri yanlış hesaplayabilir veya algılayamaz. Birçok aktin bağlayıcı proteinin F-aktin için düşük bir ( yani, mikromolar) afiniteye sahip olması nedeniyle, negatif bir sonuçtur ( yani herhangi bir tespit edilebilir bağlanma) bir proteinin F-aktini bağlamadığı anlamına gelmez. Alternatif olarak, TIRF mikroskopi tabanlı, tek filamentli bağlanma deneyleri, bir ayrışma sabitinin belirlenmesinde daha hassas ve daha doğrudur (bu tekniğe yönelik incelemeler için bkz. Referanslar 15,16 ). Bu kısıtlamalara rağmen, peletleme tahlili çoğu araştırmacı tarafından yapılmaktadır ve bir proteinin F-aktine bağlanıp bağlanmadığını belirlemek ve etkileşimin afinitesini ölçmek için etkili bir araçtır.
Açıklamalar
Yazarlar, rekabet eden mali çıkarlarının olmadığını beyan ettiler.
Teşekkürler
Bu çalışma Ulusal Sağlık Grant Enstitüleri tarafından AVK'ya HL127711 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sorvall MTX 150 Micro-Ultracentrifuge | ThermoFisher Scientific | 46960 | |
| S100-AT3 rotor | ThermoFisher Scientific | 45585 | |
| Ultracentrifuge tubes - 0.2 mL | ThermoFisher Scientific | 45233 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Bovine Serum Albumin | Sigma | A8531 | |
| Polidicanol (Thesit) | Sigma | 88315 | |
| Phalloidin | ThermoFisher Scientific | P3457 | |
| Dithiothreitol (DTT) | ThermoFisher Scientific | R0862 | |
| Adenosine triphosphate (ATP) | Sigma | A2383 | |
| Imidazole | Fisher Scientific | O3196 | |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | M33 | |
| Potassium Chloride (KCl) | Fisher Scientific | P217 | |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma | 3779 | |
| Odyssey CLx Imaging System | LI-COR | ||
| Coomassie Brilliant Blue R-250 Dye | ThermoFisher Scientific | 20278 | |
| Colloidal Blue Staining Kit | ThermoFisher Scientific | LC6025 |
Referanslar
- Pollard, T. D. Actin and Actin-Binding Proteins. Cold Spring Harb Perspect Biol. 8 (8), (2016).
- Hansen, M. D., Kwiatkowski, A. V. Control of actin dynamics by allosteric regulation of actin binding proteins. Int Rev Cell Mol Biol. 303, 1-25 (2013).
- Lappalainen, P. Actin-binding proteins: the long road to understanding the dynamic landscape of cellular actin networks. Mol Biol Cell. 27 (16), 2519-2522 (2016).
- Mullins, R. D., Hansen, S. D. In vitro studies of actin filament and network dynamics. Curr Opin Cell Biol. 25 (1), 6-13 (2013).
- Miller, P. W., et al. Danio rerio alphaE-catenin is a monomeric F-actin binding protein with distinct properties from Mus musculus alphaE-catenin. J Biol Chem. 288 (31), 22324-22332 (2013).
- Wickline, E. D., et al. alphaT-Catenin Is a Constitutive Actin-binding alpha-Catenin That Directly Couples the Cadherin.Catenin Complex to Actin Filaments. J Biol Chem. 291 (30), 15687-15699 (2016).
- Simpson, R. J., Adams, P. D., Golemis, E. . Basic methods in protein purification and analysis : a laboratory manual. , (2009).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Pollard, T. D. A guide to simple and informative binding assays. Mol Biol Cell. 21 (23), 4061-4067 (2010).
- Hansen, S. D., et al. alphaE-catenin actin-binding domain alters actin filament conformation and regulates binding of nucleation and disassembly factors. Mol Biol Cell. 24 (23), 3710-3720 (2013).
- Perrin, B. J., Ervasti, J. M. The actin gene family: function follows isoform. Cytoskeleton (Hoboken). 67 (10), 630-634 (2010).
- Tondeleir, D., Vandamme, D., Vandekerckhove, J., Ampe, C., Lambrechts, A. Actin isoform expression patterns during mammalian development and in pathology: insights from mouse models. Cell Motil Cytoskeleton. 66 (10), 798-815 (2009).
- Prochniewicz, E., Janson, N., Thomas, D. D., Dela Cruz, E. M. Cofilin increases the torsional flexibility and dynamics of actin filaments. J Mol Biol. 353 (5), 990-1000 (2005).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophys J. 88 (2), 1387-1402 (2005).
- Hansen, S. D., Zuchero, J. B., Mullins, R. D. Cytoplasmic actin: purification and single molecule assembly assays. Methods Mol Biol. 1046, 145-170 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır