A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة بسيطة ومنخفضة التكلفة لقياس أمبوليشن في نماذج الماوس من ضمور العضلات
In This Article
Summary
ويصف هذا البروتوكول نظام مرن، ومنخفضة التكلفة لقياس أمبوليشن الفأرة في مقايسة نشاط حقل مفتوح. نظهر أن مقايسة أمبولاتيون 6 دقائق استناداً إلى هذا النظام يكشف عن انخفاض في الحركة الطوعية في الفئران mdx ، ويميز بدقة التحسين في إنقاذ الخاصة بالعضلات لهذه الحيوانات.
Abstract
قياس النتائج الفنية في علاج ضمور العضلات جانبا أساسيا من التجارب الإكلينيكية. تقييم أمبوليشن الطوعية في نماذج الماوس هو مقايسة نشاط غير الغازية واستنساخه يماثل مباشرة تدابير أمبوليشن المريض مثل الاختبار 6 دقائق سيرا على الأقدام، والمتعلقة بتنقل عشرات. العديد من الأساليب الشائعة لاختبار سرعة أمبوليشن الماوس والمسافة تستند إلى اختبار حقل مفتوح، حيث يتم قياس حرية الحركة الحيوان داخل ساحة على مر الزمن. واحد الجانب السلبي الرئيسي لهذا النهج هو أن البرمجيات التجارية والمعدات اللازمة لتتبع الحركة ذات الدقة العالية مكلفة وقد يتطلب نقل الفئران إلى مرافق متخصصة للاختبار. وهنا يصف لنا نظام منخفضة التكلفة، والقائم على الفيديو لقياس أمبوليشن الماوس التي تستخدم البرمجيات الحرة والمفتوحة المصدر. باستخدام هذا البروتوكول، علينا أن نظهر أن أمبوليشن الطوعية في طراز الماوس ديستروفين خالية null mdx لضمور العضلات دوشين (DMD) انخفض بالنسبة إلى نشاط الماوس البرية من نوع. في mdx الفئران معربا عن التحوير أوتروفين، لا تراعي هذه العجوزات النشاط والمسافة الإجمالية سافر لا يمكن تمييزها من الفئران البرية من نوع. هذه الطريقة فعالة لقياس التغيرات في أمبولاتيون الطوعية المرتبطة بأمراض تندب، ويوفر منصة متعددة الاستخدامات التي يمكن تكييفها مع سهولة إلى إعدادات البحث المتنوعة.
Introduction
قياسات موثوقة واستنساخه لوظيفة العضلات ضرورية لتقييم مدى فعالية العلاجات المحتملة لإعلان الدوحة الوزاري. DMD اضطراب وراثي الناتجة عن الطفرات في الجينات ديستروفين، مما يؤدي إلى ضعف العضلات التدريجي، فقد أمبوليشن، والفشل في نهاية المطاف القلبية. نموذج الحيوان الأكثر استخداماً من إعلان الدوحة الوزاري هو الماوس ديستروفين خالية null mdx . بطارية اختبارات الوظيفية ظهرت فحوصات روتينية لتقييم تطور المرض في الماوس mdx كذلك كما في نماذج حيوانية مماثلة أخرى ضمور وميوباثيس. استخداماً في فيفو فحوصات تشمل قياس قوة قبضة فوريليمب، أسلاك معلقة الوقت، روتارود كحد أقصى، والوقت لاستنفاد أثناء نشاط قيد التشغيل، والسيارات المطحنة تتبع. كان هناك جهد كبير في الميدان من أجل توحيد هذه الاختبارات، بهدف الحد من تقلب بين الدراسات الإكلينيكية وزيادة إمكانات متعدية للمداواة اختبارها في الفئران1،2.
فئة هامة من التجارب الإكلينيكية هو قياس حركة طوعية، ومعلمة التي كثيرا ما يتم تغيير في نماذج موريني من ضمور العضلات. هذا عادة ما يتم اختباره من خلال فحوصات استناداً إلى رصد النشاط حقل مفتوح، وقد تقييم أفقي (المشي) أو الحركات الرأسية (تربية) خلال دقائق أو ساعات2،،من34. عدد من الدراسات أظهرت الحركة الطوعية تغيير في الفئران mdx ، لا سيما بعد التمرين، وأظهرت هذه القياسات لتكون حساسة لتطور المرض وعلاج المخدرات. القيد الرئيسي واحد في أداء هذه الاختبارات هو الحاجة إلى المعدات المتخصصة، وعالية التكلفة. ويرد هنا، وسيلة منخفضة التكلفة التي تتعقب أمبوليشن الماوس باستخدام الموارد المتاحة بسهولة.
مسافة 6 دقائق سيرا على الأقدام من متري تستخدم عادة كأداة لتقييم السريري في الأفراد مع دوشين ضمور العضلات5،6. وقد استخدمت التعديلات من هذا الإجراء لتقييم النتائج في نماذج حيوانية دوشين، بما في ذلك الفئران mdx 7 والذهبي المسترد الكلاب ضمور العضلات (جرمد)8. في هذه الدراسة، نقوم بتسجيل الحركة الطوعية فتح الحقل في 6 دقائق فور تحديا ممارسة خفيفة. وحسبت المسافة أمبوليشن ثم استخدام البرمجيات الحرة المفتوحة المصدر لقياس الحركة الأفقية على مر الزمن.
والميزة الرئيسية لهذا الأسلوب أن الحيوانات يمكن اختبارها في مجموعة متنوعة من الإعدادات دون الحاجة إلى معدات متخصصة أو البرمجيات التجارية ذات التكلفة العالية للتحليل. أحد الجوانب الهامة لهذا التحليل أنه يمكن أن يتم في أجواء مختبرية أساسية دون الحاجة إلى الانتقال أو نقل الفئران من فيفاريوم إلى منشأة أساسية متخصصة. البروتوكول فيديو-تتبع الموصوف هنا هو مناسبة تماما لتقييم أمبولاتيون على مدى فترات زمنية قصيرة نسبيا ويمكن الكشف عن نشاط الاختلافات بين الفئران البرية من نوع و mdx ،، فضلا عن تكشف عن تحسن الوظيفية في عملية إنقاذ نموذج من إعلان الدوحة الوزاري.
Protocol
الأساليب الموصوفة هنا بموافقة لجنة الاستخدام في جامعة كاليفورنيا، لوس أنجلوس ورعاية الحيوان المؤسسية. البرية من نوع (C57BL/6J) والفئران mdx (خلفية C57Bl/10ScSn) تم شراؤها من مصدر تجاري. mdx: أوتروفين--تيراغرام الفئران كانت هدية من جيمس ارفاستي، بإذن من كاي ديفيز، وأبقى على خلفية mdx . وأجريت فحوصات أمبوليشن على الفئران الذكور في سن 6 أشهر. وأبقى على الفئران في "فيفاريوم علوم الحياة تيرازاكي" اتباع المبادئ التوجيهية التي وضعت "رعاية الحيوان المؤسسية"، ومنحت "اللجنة الاستخدام" في جامعة كاليفورنيا، لوس أنجلوس (الموافقة #2000-029-43) والموافقة على هذه الدراسات جامعة كاليفورنيا الحيوان ضمان الرعاية الاجتماعية (الموافقة #A3196-01).
1-إعداد الدائرة
- تنفيذ جمع البيانات في غرفة هادئة، للتحكم في درجة حرارة في وقت يتفق من يوم9. إجراء اختبارات أعمى للنمط الوراثي والعلاج للماوس يتم اختباره.
- التكيف مع أي نظام الدائرة في حقل مفتوح لهذا التحليل.
ملاحظة: في هذه الدراسة، ونحن نستخدم دائرة تسجيل غير مكلفة ويمكن نقلها بسهولة شيدت من سلة مهملات كبيرة. على الساحة الميدانية المفتوحة علبة تعيين في قفص أو منصة مرتفعة مشابهة. - ضع الكاميرا على شبكة أسلاك أعلاه قاعة لتسجيل عبر الساحة كاملة.
- تنظيف قاعة التسجيل بمطهر قبل كل محاكمة.
2-ممارسة قبل البروتوكول وجمع البيانات
- بشكل اختياري، مباشرة قبل تسجيل النشاط، تحدي كل الماوس مع بروتوكول تنشيط العضلات.
ملاحظة: هذا اختياري ولكن يوصي في التجارب التي أجريت على الفئران mdx .- تسمح الماوس إلى قبضة شريط السحب لقياس القوة الرقمية وسحب بلطف مرة أخرى حتى يتم الإفراج عن شريط السحب. كرر هذا الإجراء خمس مرات في المحاكمة.
- سجل ذروة التوتر (ن) لكل محاكمة.
ملاحظة: بالإضافة إلى خدمة عملية تحديا للانزيم أمبولاتيون، يمكن استخدام هذه القوة التي تمارسها الحيوان أثناء هذا الفحص قوة قبضة كنتائج وظيفية إضافية تدبير2،10. - إجراء خمس تجارب إجمالي لكل الماوس مع 1 دقيقة من الراحة بين كل محاكمة.
- فور المقايسة قوة قبضة أو بروتوكول ممارسة أخرى، ضع الماوس في قاعة النشاط.
- بدء تسجيل الفيديو لحركة الماوس على الساحة الدائرة. تسمح الماوس لاستكشاف بحرية لمدة 6 دقائق.
- إيقاف التسجيل في 6 دقيقة والعودة الماوس إلى قفصة المنزل.
3-تحليل فيديو
- بشكل اختياري، إعداد الفيديو للتحليل بتقليل معدل الإطار. بغية خفض معدل الإطارات لتتبع التحليل، باستخدام بروتوكول التالية في برنامج (مثلاً، موفي أو برنامج مماثل) تحرير فيديو لتهلك معدل إطار الفيديو بمعامل 2.
ملاحظة: اعتماداً على طول ومعدل الإطارات للفيديو، قد يكون من المفيد لخفض معدل إطار الفيديو قبل التحليل. في هذه الدراسة، تم تسجيل الفيديو في الإطارات 30/s (6 دقيقة تسجيل، مجموع ما يقارب 10,800 إطارات).- تحميل الفيديو في البرنامج.
- ضمن القائمة 'السرعة'، حدد 'السرعة: سريع' وتعيين السرعة إلى 2 x.
- تصدير الفيديو تدمير في تنسيق الملف.mp4 لتتبع التحليل.
- فتح الفيديو للتحليل في البرنامج. تعيين المعايرة لتسجيل باستخدام أداة الخط الفيديو. رسم خط على طول جانب واحد من الدائرة. الحق فوق على الخط وتحديد "قياس معايرة..." أدخل الحجم الفعلي من جانب الدائرة بالسنتيمتر.
- لبدء التتبع شبه الآلي لموضع الماوس، انقر فوق المؤشر 'نقل'.
بدءاً من الإطار الأولى في شريط الفيديو، انقر على الحق في هذه النقطة يجب تعقبها؛ يتم وضع علامة نقطة التعقب مع دائرة زرقاء.
ملاحظة: في هذه الدراسة، تم تعقب موقف كل حيوان عن طريق تتبع قاعدة الذيل. - تقدم الإطار بالنقر فوق مفتاح السهم إلى اليمين على لوحة المفاتيح؛ ينبغي أن تتحرك نقطة التعقب تلقائياً استناداً إلى على وضع قاعدة الذيل.
- إذا لم يتم محاذاتها موضع تتبع مع نقطة الاهتمام في إطار معين، يدوياً محاذاة دائرة زرقاء إلى قاعدة الذيل.
ملاحظة: اعتماداً على جودة الفيديو وسرعة الماوس، قد تتطلب التتبع مستويات متغيرة من إدخال المستخدم للحفاظ على الاتساق مع نقطة الاهتمام. ينبغي أن تقدم مسار الماوس من خلال مسار الفيديو.
- إذا لم يتم محاذاتها موضع تتبع مع نقطة الاهتمام في إطار معين، يدوياً محاذاة دائرة زرقاء إلى قاعدة الذيل.
- عند الانتهاء من تتبع الفيديو كامل، حفظ تراكب الفيديو والتعقب. تصدير بيانات الموضعية للتتبع عن طريق تحديد "تصدير إلى جدول بيانات".
4. تحليل البيانات
- فتح البيانات الموضعية في برنامج جدول بيانات. تقارير برنامج تحليل حركة X, Y تنسيق وضع الماوس في كل إطار.
- لحساب المسافة التي سافر من قبل الإطار، استخدم المعادلة التالية (حيث يكون الموقف في إطار واحد س1، ص1 ، والإطار الثاني هو س2، ص2):
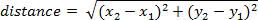
ملاحظة: يمكن حساب المسافة التراكمية مع مرور الوقت عن طريق إضافة المسافة سافر بين كل إطار.
النتائج
أظهرت اختلافات المقايسة حقل مفتوح يكون وسيلة فعالة لاختبار تطور المرض في نماذج ضمور العضلات. هنا، علينا أن نظهر فيديو تنوعاً تتبع أسلوب لتحليل حركة الماوس ثنائي الأبعاد باستخدام معدات تسجيل متاحة بسهولة وبرمجيات المصدر المفتوح (الشكل 1A–ب
Discussion
مقايسة حقل مفتوح يوفر طريقة فعالة وغير الغازية لاختبار وظيفة الحركة في نماذج الماوس من أمراض العضلات، والاختلافات في هذا التحليل بمثابة تدبير قيمة نقطة نهاية للدراسات ما قبل السريرية. حد كبير واحد مع هذا النوع من التحليل هو إمكانية عالية التكلفة ومحدودية الحصول على نشاط نظم الرصد. في هذه ...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل المنح المقدمة من المعاهد الوطنية للصحة [R01 AR048179 و R01 HL126204 R.C.W، T32 AR059033 و F32 AR069469to E.M.G] وضمور العضلات رابطة الولايات المتحدة الأمريكية [274143 و 416364 إلى R.C.W.].
Materials
| Name | Company | Catalog Number | Comments |
| Video camera | Apple Inc. | ME553LL/A | For recording ambulation video, iPhone 5S Plus (or equivalent) |
| Kinovea software (version 0.8.15) | Kinovea Association | Open source video analysis software. Free download, PC compatible (Version 0.8.15, www.kinovea.org) | |
| iMovie (version 10.0.6) | Apple Inc. | Any similar software can be used to reduce video frame rate (optional) | |
| Roughneck 32 Gallon Black Round Trash Bin (Open field chamber) | Rubbermaid | # 1778013 | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. |
| Avant White Plastic Tray 15"W x 10"D x 1.45"H (Open field chamber) | US Acrylic, LLC | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. | |
| C57BL/6J | Jackson Laboratory | #000664 | Male 6 month mice |
| C57BL/10ScSn-Dmd/J (mdx) | Jackson Laboratory | #001801 | Male 6 month mice |
| mdx: utrophin-Tg (fiona) | Gift from from James Ervasti, with permission from Kay Davies | Male 6 month mice |
References
- Nagaraju, K., Carlson, G., De Luca, A. Behavioral and locomotor measurements using open field animal activity monitoring system. TREAT-NMD SOP Number M2.1.002. 2. 2, (2010).
- Tatem, K. S., et al. Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases. J Vis Exp. (91), e51785 (2014).
- Kobayashi, Y. M., et al. Sarcolemma-localized nNOS is required to maintain activity after mild exercise. Nature. 456 (7221), 511-515 (2008).
- Belanto, J. J., et al. Microtubule binding distinguishes dystrophin from utrophin. Proc Natl Acad Sci U S A. 111 (15), 5723-5728 (2014).
- McDonald, C. M., et al. The 6-minute walk test in Duchenne/Becker muscular dystrophy: longitudinal observations. Muscle Nerve. 42 (6), 966-974 (2010).
- Mazzone, E., et al. Star Ambulatory Assessment, 6-minute walk test and timed items in ambulant boys with Duchenne muscular dystrophy. Neuromuscul Disord. 20 (11), 712-716 (2010).
- Kobayashi, Y. M., Rader, E. P., Crawford, R. W., Campbell, K. P. Endpoint measures in the mdx mouse relevant for muscular dystrophy pre-clinical studies. Neuromuscul Disord. 22 (1), 34-42 (2012).
- Acosta, A. R., et al. Use of the six-minute walk test to characterize golden retriever muscular dystrophy. Neuromuscul Disord. 26 (12), 865-872 (2016).
- Sousa, N., Almeida, O. F., Wotjak, C. T. A hitchhiker's guide to behavioral analysis in laboratory rodents. Genes Brain Behav. 5, 5-24 (2006).
- Gibbs, E. M., et al. High levels of sarcospan are well tolerated and act as a sarcolemmal stabilizer to address skeletal muscle and pulmonary dysfunction in DMD. Hum Mol Genet. 25 (24), 5395-5406 (2016).
- Gillis, J. M. Multivariate evaluation of the functional recovery obtained by the overexpression of utrophin in skeletal muscles of the mdx mouse. Neuromuscul Disord. 12, S90-S94 (2002).
- Tinsley, J., et al. Expression of full-length utrophin prevents muscular dystrophy in mdx mice. Nat Med. 4 (12), 1441-1444 (1998).
- Song, Y., et al. Suite of clinically relevant functional assays to address therapeutic efficacy and disease mechanism in the dystrophic mdx mouse. J Appl Physiol. 122 (3), 593-602 (2017).
- Bolivar, V. J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol Learn Mem. 92 (2), 206-214 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved