É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio simples e de baixo custo para medir a deambulação em modelos de Mouse de Distrofia Muscular
Neste Artigo
Resumo
Este protocolo descreve um sistema flexível e de baixo custo para medir a deambulação do mouse em um ensaio de atividade de campo aberto. Mostramos que um ensaio de 6 minutos de deambulação com base neste sistema detecta uma diminuição no movimento voluntário em camundongos mdx e distingue com precisão a melhoria em um músculo específico resgate destes animais.
Resumo
Medir resultados funcionais no tratamento da distrofia muscular é um aspecto essencial dos testes pré-clínicos. A avaliação de deambulação voluntária em modelos do rato é um ensaio de atividade não-invasiva e reprodutíveis que é diretamente análogo para medidas de deambulação paciente, tais como o teste de caminhada de 6 minutos e relacionados com golo de mobilidade. Muitos métodos comuns para testar o rato deambulação de velocidade e distância baseiam-se no teste de campo aberto, onde a liberdade de circulação dos animais dentro de uma arena é medido ao longo do tempo. Uma grande desvantagem dessa abordagem é que o software comercial e equipamento para rastreamento de movimento de alta resolução é caro e pode exigir a transferência de ratos para instalações especializadas para testes. Aqui, descrevemos um sistema de baixo custo, baseado em vídeo para medir a deambulação do mouse que utiliza software livre e de código aberto. Usando este protocolo, demonstramos a deambulação voluntária no modelo do rato de distrofina-nulo mdx para distrofia muscular de Duchenne (DMD) é diminuída em relação à atividade do mouse do tipo selvagem. Em mdx camundongos expressando o transgene de Utrofina, estes défices de atividade não são observados e a distância total percorrida é indistinguível do selvagem-tipo ratos. Esse método é eficaz para medir alterações na deambulação voluntária associado com patologia distrófica e fornece uma plataforma versátil que pode ser facilmente adaptada para pesquisa de diversas configurações.
Introdução
Medições confiáveis e reprodutíveis de função muscular são fundamentais para avaliar a eficácia das terapias potenciais para DMD. DMD é uma doença genética causada por mutações no gene da distrofina, levando à fraqueza muscular progressiva, perda da deambulação e eventual insuficiência cardiorrespiratória. O modelo animal mais amplamente utilizado de DMD é o mouse distrofina-nulo mdx . Uma bateria de testes funcionais têm emergido como ensaios de rotina para avaliar a progressão da doença no mdx mouse, bem como em modelos animais similares de outras distrofias e miopatias. Ensaios comumente usados na vivo incluem medições de força de preensão do membro anterior, fio pendurado, máximo rotarod, tempo até a exaustão durante a atividade de execução e motor de esteira de rastreamento. Tem havido um esforço considerável no campo para padronizar esses testes, com o objetivo de reduzir a variabilidade entre os estudos pré-clínicos e aumentar o potencial de translação da terapêutica testada em ratos1,2.
Uma importante categoria de testes pré-clínicos é a medição do movimento voluntário, um parâmetro que é alterado com frequência em modelos murino de distrofia muscular. Isto é geralmente testado pelos ensaios com base no monitoramento da atividade de campo aberto e pode avaliar horizontal (curta) ou movimentos verticais (criação), um longo de minutos ou horas,2,3,4. Vários estudos têm demonstrado o movimento voluntário para ser alterada em camundongos mdx , particularmente após o exercício, e estas medições foram mostradas para ser sensível à progressão de doença e tratamento de drogas. Uma limitação importante na realização destes ensaios é a necessidade de equipamento especializado, de alto custo. Aqui, apresenta-se um método de baixo custo que rastreia a deambulação de rato usando recursos prontamente disponíveis.
A distância de caminhada de 6 minutos é uma métrica comumente usada como uma ferramenta de avaliação clínica em indivíduos com distrofia muscular de Duchenne5,6. Modificações desta medida têm sido utilizadas para avaliar os resultados em modelos animais de Duchenne, incluindo de camundongos mdx 7 e retriever dourado de cães de distrofia muscular (GRMD)8. Neste estudo, nós gravamos o movimento voluntário de campo aberto em 6 minutos imediatamente após um exercício suave desafio. Distância de deambulação foi então calculada usando o software livre de código aberto para medir o movimento horizontal ao longo do tempo.
A principal vantagem deste método é que os animais podem ser testados em uma variedade de configurações sem a necessidade de equipamento especializado ou alto custo software comercial para análise. Um aspecto importante desta análise é que pode ser realizada em uma configuração de laboratório básico sem a necessidade de mover ou transferir os ratos fora do viveiro para uma instalação de núcleo especializado. O protocolo de controle de vídeo descrito aqui é bem adequado para a avaliação da deambulação por períodos relativamente curtos e pode detectar diferenças de atividade entre ratos do selvagem-tipo e mdx , bem como revelar melhora funcional em um resgate modelo de DMD.
Protocolo
Os métodos descritos aqui foram aprovados pelo Comitê de uso, a Universidade da Califórnia, Los Angeles e institucional Cuidado Animal. Selvagem-tipo (C57BL/6J) e camundongos mdx (fundo C57Bl/10ScSn) foram adquiridos a partir de uma fonte comercial. MDX: Utrofina-Tg ratos foram um presente de James Ervasti, com permissão de Kay Davies e foram mantidos no fundo de mdx . Deambulação ensaios foram realizados em camundongos machos com 6 meses de idade. Os ratos foram mantidos em viveiro de Ciências da vida a Terasaki seguindo diretrizes estabelecidas pelo cuidado Animal institucional e Comitê de uso para a Universidade da Califórnia, Los Angeles (aprovação #2000-029-43) e aprovação para estes estudos foi concedida pelo Garantia de bem-estar Animal UCLA (aprovação #A3196-01).
1. preparação da câmara
- Execute coleta de dados em uma sala de temperatura controlada a silenciosa, um momento consistente do dia9. Realize os testes cegados para o genótipo e o tratamento do mouse sendo testado.
- Se adapte a qualquer sistema de câmara de campo aberto para esta análise.
Nota: Neste estudo, utilizamos uma câmara de gravação barato e facilmente transportável, construída a partir de uma grande lixeira. A arena de campo aberto é uma bandeja conjunto em uma gaiola ou plataforma elevada similar. - Coloque a câmera em uma malha de arame acima da câmara para gravar em plena arena.
- Limpe a câmara de gravação com desinfetante antes de cada ensaio.
2. pré-exercício protocolo e coleta de dados
- Opcionalmente, imediatamente antes da gravação da atividade, desafie cada rato com um protocolo de ativação muscular.
Nota: Isto é opcional, mas recomendado em experimentos envolvendo ratos do mdx .- Permitir que o mouse agarrar a barra de tração de um medidor digital de força e puxe delicadamente até que a barra de tração é liberada. Repita este procedimento cinco vezes por julgamento.
- Registro de pico de tensão (N) para cada julgamento.
Nota: Além de servir como um desafio de exercício para o ensaio de deambulação, a força exercida pelo animal durante este ensaio de resistência de aderência pode ser usada como uma medida de resultado funcional adicional2,10. - Realize cinco ensaios totais para cada mouse com 1 minuto de descanso entre cada tentativa.
- Imediatamente após o ensaio de resistência de aderência ou outro protocolo de exercício, posicione o mouse na câmara de atividade.
- Inicie a gravação de vídeo do movimento do mouse na arena de câmara. Permitir que o mouse para explorar livremente por 6 min.
- Parar a gravação em 6 min e retornar o mouse para sua gaiola em casa.
3. a análise
- Opcionalmente, prepare o vídeo para análise, reduzindo a taxa de quadros. A fim de reduzir a taxa de quadros para análise de controle, use o seguinte protocolo em um vídeo que edita o software (por exemplo, o iMovie ou programa similar) para dizimar a taxa de frame de vídeo por um fator de 2.
Nota: Dependendo do comprimento e taxa de quadros do vídeo, pode ser útil reduzir a taxa de frame de vídeo antes da análise. Neste estudo, o vídeo foi gravado a 30 quadros/s (6 min de gravação, aproximadamente 10.800 frames totais).- Carrega o vídeo para o software.
- Sob o menu 'Velocidade', selecione ' velocidade: rápido ' e definir a velocidade de 2x.
- Exporte o vídeo dizimado no formato de arquivo. MP4 para análise de controle.
- Abra o vídeo para análise no programa de software. Defina a calibragem para a gravação usando a ferramenta de linha de vídeo. Desenhe uma linha ao longo de um dos lados da câmara. Clique com o botão direito na linha e selecione "Calibrar medida..." Digite o tamanho real do lado de câmara em centímetros.
- Para começar a controlar semi-automático da posição do mouse, clique sobre o cursor 'mover'.
Começando com o frame inicial no vídeo, botão direito do mouse sobre o ponto a ser rastreado; o ponto de controle é marcado com um círculo azul.
Nota: No presente estudo, a posição de cada animal foi rastreada ao traçar a base da cauda. - Avançar o quadro clicando na seta direita do teclado; o ponto de rastreamento deve mover automaticamente com base na posição da base da cauda.
- Se o rastreamento de posição não está alinhado com o ponto de interesse em um determinado quadro, alinhe manualmente o círculo azul na base da cauda.
Nota: Dependendo da qualidade do vídeo e a velocidade do mouse, o rastreamento pode exigir níveis variáveis de entrada do usuário para manter o alinhamento com o ponto de interesse. O caminho do mouse deve avançar através do curso do vídeo.
- Se o rastreamento de posição não está alinhado com o ponto de interesse em um determinado quadro, alinhe manualmente o círculo azul na base da cauda.
- Quando a localização do vídeo completo está completa, salve o overlay de vídeo e rastreamento. Exporte os dados posicionais do que o rastreamento, selecionando "Exportar para planilha".
4. análise de dados
- Abra os dados posicionais em um programa de software de planilha eletrônica. O software de análise de movimento relata que o X, Y coordenar a posição do mouse em cada quadro.
- Para calcular a distância percorrida pelo quadro, use a seguinte equação (onde é a posição no quadro de uma x1, y1 e quadro 2 é x2, y2):
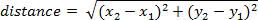
Nota: A distância acumulada ao longo do tempo pode ser calculada adicionando a distância percorrida entre cada quadro.
Resultados
Variações de ensaio de campo aberto tem demonstradas ser um método eficaz para testar a progressão da doença em modelos de distrofia muscular. Aqui, demonstramos um versátil vídeo monitoramento método para a análise do movimento do mouse bidimensional usando equipamento de gravação prontamente disponíveis e software de fonte aberta (figura 1A–B). Consistente com os resultados relatados de ensaios semelhantes, mo...
Discussão
O ensaio de campo aberto fornece uma maneira eficaz e não-invasiva para testar a função motora em modelos do rato da doença muscular, e variações deste teste podem servir como uma medida de ponto de extremidade valiosa para estudos pré-clínicos. Uma limitação importante com este tipo de ensaio é a acessibilidade limitada e de alto custo dos sistemas de monitoramento de atividade. Neste estudo, vamos demonstrar um sistema de baixo custo para análise de atividade de campo aberto que pode gerar resultados semelh...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado por concessões do National Institutes of Health [R01 AR048179 e R01 HL126204 R.C.W, AR059033 T32 e F32 AR069469to E.M.G] e a associação de Distrofia Muscular EUA [274143 e 416364 de R.C.W.].
Materiais
| Name | Company | Catalog Number | Comments |
| Video camera | Apple Inc. | ME553LL/A | For recording ambulation video, iPhone 5S Plus (or equivalent) |
| Kinovea software (version 0.8.15) | Kinovea Association | Open source video analysis software. Free download, PC compatible (Version 0.8.15, www.kinovea.org) | |
| iMovie (version 10.0.6) | Apple Inc. | Any similar software can be used to reduce video frame rate (optional) | |
| Roughneck 32 Gallon Black Round Trash Bin (Open field chamber) | Rubbermaid | # 1778013 | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. |
| Avant White Plastic Tray 15"W x 10"D x 1.45"H (Open field chamber) | US Acrylic, LLC | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. | |
| C57BL/6J | Jackson Laboratory | #000664 | Male 6 month mice |
| C57BL/10ScSn-Dmd/J (mdx) | Jackson Laboratory | #001801 | Male 6 month mice |
| mdx: utrophin-Tg (fiona) | Gift from from James Ervasti, with permission from Kay Davies | Male 6 month mice |
Referências
- Nagaraju, K., Carlson, G., De Luca, A. Behavioral and locomotor measurements using open field animal activity monitoring system. TREAT-NMD SOP Number M2.1.002. 2. 2, (2010).
- Tatem, K. S., et al. Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases. J Vis Exp. (91), e51785 (2014).
- Kobayashi, Y. M., et al. Sarcolemma-localized nNOS is required to maintain activity after mild exercise. Nature. 456 (7221), 511-515 (2008).
- Belanto, J. J., et al. Microtubule binding distinguishes dystrophin from utrophin. Proc Natl Acad Sci U S A. 111 (15), 5723-5728 (2014).
- McDonald, C. M., et al. The 6-minute walk test in Duchenne/Becker muscular dystrophy: longitudinal observations. Muscle Nerve. 42 (6), 966-974 (2010).
- Mazzone, E., et al. Star Ambulatory Assessment, 6-minute walk test and timed items in ambulant boys with Duchenne muscular dystrophy. Neuromuscul Disord. 20 (11), 712-716 (2010).
- Kobayashi, Y. M., Rader, E. P., Crawford, R. W., Campbell, K. P. Endpoint measures in the mdx mouse relevant for muscular dystrophy pre-clinical studies. Neuromuscul Disord. 22 (1), 34-42 (2012).
- Acosta, A. R., et al. Use of the six-minute walk test to characterize golden retriever muscular dystrophy. Neuromuscul Disord. 26 (12), 865-872 (2016).
- Sousa, N., Almeida, O. F., Wotjak, C. T. A hitchhiker's guide to behavioral analysis in laboratory rodents. Genes Brain Behav. 5, 5-24 (2006).
- Gibbs, E. M., et al. High levels of sarcospan are well tolerated and act as a sarcolemmal stabilizer to address skeletal muscle and pulmonary dysfunction in DMD. Hum Mol Genet. 25 (24), 5395-5406 (2016).
- Gillis, J. M. Multivariate evaluation of the functional recovery obtained by the overexpression of utrophin in skeletal muscles of the mdx mouse. Neuromuscul Disord. 12, S90-S94 (2002).
- Tinsley, J., et al. Expression of full-length utrophin prevents muscular dystrophy in mdx mice. Nat Med. 4 (12), 1441-1444 (1998).
- Song, Y., et al. Suite of clinically relevant functional assays to address therapeutic efficacy and disease mechanism in the dystrophic mdx mouse. J Appl Physiol. 122 (3), 593-602 (2017).
- Bolivar, V. J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol Learn Mem. 92 (2), 206-214 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados