Method Article
تصوير راتيوميتريك الكالسيوم من الخلايا العصبية الفردية في التصرف ايليجانس كاينورهابديتيس
In This Article
Summary
يصف هذا البروتوكول استخدام جينياً المرمزة Ca2 + الصحفيين لتسجيل التغييرات في النشاط العصبي في التصرف ايليجانس كاينورهابديتيس الديدان.
Abstract
أصبح من الواضح بشكل متزايد أن نشاط الدوائر العصبية في سلوك الحيوانات يختلف إلى حد كبير من أن ينظر في الحيوانات تخديره أو المعطل تداولها. ثورة الصحفيين الفلورسنت حساسة للغاية، وترميز وراثيا من Ca2 + تسجيل خلية ومتشابك النشاط باستخدام النهج البصرية غير الغازية في سلوك الحيوانات. عندما يتم دمجها مع الوراثية وتقنيات أوبتوجينيتيك، الآليات الجزيئية التي تعدل نشاط الخلية والدائرة خلال سلوك مختلفة يمكن التعرف على الدول.
هنا يصف لنا طرق راتيوميتريك Ca2 + تصوير الخلايا العصبية وحيدة في التصرف بحرية الديدان ايليجانس كاينورهابديتيس . نظهر تقنية بسيطة تركيب بلطف كتلة الديدان تراكبات المتزايد على أجار وسائط نمو ديدان أسطوانية (NGM) قياسية مع ساترة زجاجية، السماح للحيوانات التي سيتم تسجيلها في الاستبانة خلال بحرية الحركة والسلوك. مع هذا الأسلوب، نستخدم الحساسة Ca2 + مراسل GCaMP5 لتسجيل التغييرات في داخل الخلية Ca2 + في "الخلايا العصبية المحددة خنثي" هرمون السيروتونين (هسنس) وهم يقودون سلوك وضع البيض. بالمشاركة الإعراب عن مشري، Ca2 +-بروتين فلوري غير حساسة، نستطيع تتبع موقف HSN داخل ~ 1 ميكرومتر والصحيح للتقلبات في الأسفار التي تسببها التغيرات في التركيز أو حركة. تصوير برايتفيلد المتزامنة، والأشعة تحت الحمراء يسمح بتسجيل السلوك وتتبع الحيوانات باستخدام مرحلة إليه. من خلال دمج هذه التقنيات المجهرية والبيانات والجداول، يمكن تسجيل نشاط Ca2 + C. ايليجانس في حلبة وضع البيض كلما تقدمت بين الدول السلوك غير نشطة وفعالة أكثر من عشرات الدقائق.
Introduction
هدف الرئيسي لعلم الأعصاب لفهم كيفية اتصال الخلايا العصبية في الدوائر لسلوك الحيوانات بالسيارة. دمج الدوائر العصبية مجموعة من الإشارات الحسية المتنوعة بغية تغيير نشاط الدائرة، مما يقود التغيرات السلوكية اللازمة للحيوانات للاستجابة لبيئتهم. ديدان أسطوانية، C. ايليجانس، لديها نظام عصبي بسيط مع الخلايا العصبية 302 اتصالات متشابك التي كانت المعين تماما1. بالإضافة إلى ذلك، هي حفظت الجينات ترميز للبروتينات المشاركة في كبيرة جداً بين C. ايليجانس والثدييات2. وعلى الرغم من بساطة تشريحية في الجهاز العصبي، فإنه يعرض مرجع معقدة من السلوكيات المصانة توفير منصة خصبة لفهم كيفية تنظيم الخلايا العصبية السلوك3.
C. ايليجانس قابلة للتطبيق لمجموعة واسعة من النهج مثل التلاعب بالجينات، والليزر خلية التذرية، التقنيات الكهربية، كذلك في فيفو البصرية التصوير4،5. وأسفرت الدراسات الأخيرة خرائط مفصلة للناقل العصبي الرئيسية مما يشير إلى نظم في ايليجانس جيم- بما في ذلك اتروبين والشبكات العصبية جابايرجيك. هذه الدراسات، جنبا إلى جنب مع الدراسات الجارية لتعيين التعبير عن مستقبلات مقترنة بالبروتين ز جميع الخلايا العصبية مكان هذا النموذج في موقع فريد يمكنها من الاستفادة من هيكلية مفصلة للغاية وخرائط اتصال الخلايا العصبية الوظيفية نفهم تماما كيف أن هذه الإشارات العصبية المختلفة عن طريق المستقبلات المختلفة والجداول الزمنية إلى محرك أقراص مختلف جوانب سلوك الحيوانات.
من أجل دراسة أنماط النشاط الخلايا العصبية الحيوية في أي نظام، شرط أساسي لتطوير منهجيات قوية لتسجيل النشاط في الخلايا العصبية الفردية أو دوائر كاملة خلال السلوكيات. أهمية خاصة الانقياد هذه النهج البصرية لتصور النشاط بريسينابتيك الذي يدفع الانصهار حويصلة متشابك. ثورة الصحفيين الفلورسنت سريعة وحساسة للغاية من داخل الخلية Ca2 +، جنبا إلى جنب مع زيادة توافر نظريتهم الحساسة، تسجيل خلية والنشاط متشابك في الحيوانات الحية مستيقظا أثناء السلوك. لأن نتيجة رئيسية للنشاط الكهربائي متشابك لتنظيم قنوات Ca2 + ، والتغييرات في كاليفورنيا داخل الخلية2 + يعتقد أن صدق التقرير التغييرات ذات الصلة سلوكيا في نشاط الخلية.
في هذه الدراسة، نقدم نهجاً لأداء راتيوميتريك Ca2 + تصوير في HSN الخلايا العصبية الحركية التي تشجع على سلوك وضع البيض في6، C. ايليجانس7هرمون السيروتونين. ويستند هذا النهج الجهود السابقة لتصور Ca2 + النشاط في C. ايليجانس وحلبة وضع البيض خلال السلوك5،،من89،10،11 . الأسلوب يسمح في الوقت نفسه الربط بين التغيرات الملاحظة في نشاط الخلية/الدائرة مع وضع البيض الأحداث، فضلا عن التغييرات في حالة الحركية الحيوانية. على الرغم من أننا استخدام هذا النهج لدراسة النشاط في الديدان الكبار، يبين أعمال غير منشورة من مختبرنا هذا النهج يمكن أن تمتد إلى الحيوانات الأحداث في المرحلة (L4) اليرقات الرابعة كذلك. ومن المرجح أن نشاط الخلايا العصبية C. ايليجانس الأخرى التي تعمل في دوائر متميزة والسلوكيات ينبغي أن يكون موجوداً على نحو مماثل مع هذا الأسلوب. المتقدمة الأخرى مؤخرا سريعة Ca2 + المؤشرات غير متداخلة أطياف الانبعاث12،13،14،،من1516، أوبتوجينيتيك أدوات17 ، ووراثيا ترميز المؤشرات الضوئية للغشاء الجهد18، ينبغي أن تسمح لنا بالقيام باختراق 'جميع الضوئية' التحقيقات كيف التغيرات في نشاط الدوائر العصبية تدفع الدول السلوك متميزة.
Protocol
1-سلالات، ثقافة وسائل الإعلام، وتصاعد من الحيوانات
- تنمو الديدان C. ايليجانس عند 20 درجة مئوية على ألواح أجار القياسية المتوسطة النمو ديدان أسطوانية (NGM) 60 ملم المصنف مع OP50 كولاي البكتيرية الغذاء19.
- إعداد والبلازميدات اثنين لكل خلية على حدة مروج للفائدة: واحد، يقود التعبير GCaMP5 إلى سجل داخل الخلية Ca2 +، والثاني، يقود التعبير عن مشري للسماح كوانتيتيشن راتيوميتريك GCaMP5 fluorescence التغييرات و تبسيط إيجاد الكائن والقياس.
ملاحظة: تصحيح GCaMP5:mCherry راتيوميتريك تصوير للتقلبات في الأسفار GCaMP5 التي تنتج عن التغيرات في حركة الحيوان والتركيز، والتغيرات الفعلية لا في كاليفورنيا داخل الخلية2 +. - حقن والبلازميدات الإعراب عن GCaMP5 ومشري جنبا إلى جنب مع بلازميد علامة مرئية الإنقاذ pL15EK في الغدد التناسلية للحيوانات المسخ lite-1(ce314)، lin-15(n765ts) س LX1832 واسترداد غير فيروس lin-15(+) الحيوانات معربا عن GCaMP5 و مشري من21،20،التحوير عالية-نسخة22. استخدام خلفية متحولة لايت 1 لتقليل الضوء الأزرق تجنب السلوك23،24.
- دمج المتسلسلات للكروموزومات لخفض mosaicism وتبسيط توليد سلالات متحولة مجمع25.
ملاحظة: أن سلالة LX2004 الموصوفة هنا يحمل التحوير عالية-نسخة متكاملة تعبر عن GCaMP5 ومشري في هسنس من المروج البرمجة اللغوية العصبية-3 (انظر الجدول للمواد)26،27، 28 , 29-تم العثور على المروج 3 البرمجة اللغوية العصبية للتعبير محرك قوي في هسنس L4 الراحل والحيوانات الكبار دون أن تسبب تشوهات كبيرة في التنمية HSN أو سلوك وضع البيض مقارنة بغيرها المروجين اختبار (e.g.,tph-1، 6-أجل، و قيادة الأمم المتحدة--86). تتوفر هذه السلالة وغيرها التي تعبر عن GCaMP5 ومتشيري في الخلايا العصبية الحركية الحبل البطني (VC) وعضلات فرجي، وخلايا الغدد الصم العصبية uv1 من مركز علم الوراثة كاينورهابديتيس وقد ورد وصف تفاصيل البناء 27. - تطبيق OP50 انتقاء الغذاء البكتيرية من صفيحة أجار NGM المصنف إلى الجزء السفلي من دودة البلاتين، واستخدامه لنقل ~ 20 الحيوانات L4 LX2004 المتأخرة التي تعبر عن GCaMP5 ومشري في هسنس من المروج 3 البرمجة اللغوية العصبية . تأكد من أن يظهر الفرج النامي في ستيريوميكروسكوبي كبقعة مظلمة واضحة تحيط به هلال أبيض. تبني الحيوانات في 20 درجة مئوية ح 24-40.
- الحضانة، وبعد تطبيق OP50 لاختيار ونقل ~ 3 الديدان لصفيحة NGM المصنف، مع ترك كمية صغيرة من الغذاء وراء للديدان لإطعام عليها أثناء التصوير. ضمان الحصول على الغذاء الكافي، كما سيشجع القليل جداً من الغذاء البكتيرية الديدان يهيم بعيداً عن مركز اللوحة بينما سيزيد من الأسفار خلفية الكثير من الطعام وتسبب نقص.
- استخدام ملعقة مدورة مسطحة لقطع ~ 20 ملم × 20 ملم القطعة من لوحة تحمل الديدان ونقل القطعة الوجه للأسفل في وسط نظيفة 24 مم × 60 مم #1.5 ساترة (الشكل 1). بدء تشغيل التطبيق من جانب واحد للحفاظ على فقاعات من المحاصرين تحت ساترة والتدخل مع التصوير. تطبيق من ساترة 22 مم × 22 مم #1 إلى الجزء العلوي من القطعة تقليل الخلاف والتبخر.
2-الأجهزة وإعداد الأجهزة
- ضع مراحل، الديدان المحورة وراثيا على خشبة المسرح مجهر مقلوب مع ≥ 0.7 العددية الفتحة الخطة--أبوتشرومات 20 x موضوعية، ويجهز XY مرحلة السيطرة عليها مع جويستيك، صورة الخائن والأسفار المرشحات ل GCaMP5 المتزامن و مشري الإثارة والانبعاثات، وكاميرات برايتفيلد الأسفار والأشعة تحت الحمراء التصوير، ونظام إضاءة "الصمام ثنائي" التي ينبعث منها ضوء (LED) تريجيرابل (الشكل 2أ).
ملاحظة: يرسل الفاصل شعاع من 80/20 80% إشارة الصورة للكاميرا الأسفار و 20% للكاميرا برايتفيلد. يمكن أيضا أن تستخدم مجهر تستقيم، ولكن ينبغي أن توضع القطعة NGM بين شريحة زجاجية وساترة كبيرة في هذه الحالة.- استخدم العدسات مجهر لتحديد دودة للتصوير. عندما يتم تحديد حيوان، الشريحة مرشح الأشعة تحت الحمراء في مكان أعلاه المكثف.
- الترانزستور الترانزستور منطق (TTL) المشغلات
- إرفاق الكابلات المحورية من كل من ثلاثة خطوط الإخراج الزناد TTL على الكاميرا الأسفار. قم بتوصيل الناتج الأول BNC الإدخال #3 نظام إضاءة LED.
- وصل الناتج الثاني إلى محول 'موز' BNC مع الأخضر وإدخال أسلاك براون من 8-دبوس موصل جبيو تشغيل إلى جبيو #3 (الرقم 4) والأرض (الرقم 5) كاميرا الأشعة تحت الحمراء، على التوالي.
- وصل الناتج الثالث إلى محول 'موز' BNC مع أسلاك الطائر يستخدم لإدخال رقمية #8 والأرض في الجهاز الرقمي اقتناء (الشكل 2ب).
- جهاز اكتساب الرقمية (دق)
- توصيل لوحة متحكم دق (انظر الجدول للمواد) بجهاز الكمبيوتر عن طريق كابل الناقل التسلسلي العام. تحديث البرامج الثابتة مع معيار فيرماتا البروتوكول (انظر الجدول للمواد)، وتكوين منفذ USB للاتصال في سرعة البث بالباود 57600.
- المصابيح
- قم بتشغيل برنامج تحكم LED (انظر الجدول للمواد). تبديل "وضع المشغل" من 'مستمر إلى' مبوب 'وحدد مشغل القناة 3' للمصابيح نانومتر 470 و 590.
- قم بتشغيل وإدخال الطاقة LED لكل الصمام (مثلاً مجموعة 470 شمال البحر الأبيض المتوسط الصمام إلى 20% والصمام نانومتر 590 إلى 40 في المائة).
- تشغيل البرنامج النصي 'س-المرحلة النهائي' في بونساي (انظر الجدول للمواد) الاتصالات التسلسلية-المرحلة30. انقر فوق العقدة 'كسفوريتير' رمادية وحدد مجلد الذي تريد حفظ تسجيل X و Y المرحلة المعلومات (الشكل 3). اضغط السهم الأخضر في شريط الأدوات لتهيئة دق.
ملاحظة: سيبدأ البرنامج النصي تسجيل موقف المرحلة X و Y عند الكاميرا fluorescence يرسل إشارة TTL. هذا البرنامج النصي بإخراج أربعة أعمدة من البيانات: إطار عدد × موقف (ميكرومتر)، وموقف Y (ميكرومتر)، والفاصل الزمني بين الإطارات (s). - في برنامج تسجيل كاميرا الأشعة تحت الحمراء (انظر الجدول للمواد) تحت '"وسائط الفيديو المخصصة"،' حدد "الوضع 1" (2 × 2 binning؛ 1,024 x 1,024 بكسل)، و "الخام تنسيق بكسل 8". تحت 'الزناد/القوية'، تعيين خط الزناد الإدخال (جبيو) "3"، الأقطاب إلى "مرتفع"، 'الوضع' إلى "14". تبديل 'تمكين' لوقف شراء الإطار حتى يتم تلقي إشارة الزناد TTL.
- ترك هذه النافذة مفتوحة، انقر فوق الزر الأحمر "السجل" على شريط الأدوات عرض الكاميرا الرئيسية. حدد المجلد لتسلسل الصورة ليتم حفظها. حدد طريقة التسجيل 'خفف'، وحفظ 'الصور' بتنسيق JPEG. انقر فوق "بدء التسجيل" لتهيئة اقتناء.
- التقسيم fluorescence الكاميرا والصورة
ملاحظة: GCaMP5 ومشري fluorescence قنوات يجب جمع في وقت واحد لضمان تسجيل الصورة الصحيحة كوانتيتيشن راتيوميتريك. يسمح تقسيم صورة ثنائي القناة اقتناء الأسفار GCaMP5 ومشري على استشعار واحد.- في علامة التبويب 'التقاط' برنامج اقتناء الصورة (انظر الجدول للمواد)، التعرض لتعيين الوقت إلى 10 مللي ثانية، binning 4 x، وعمق الصورة إلى 16-بت. حدد صبري كاميرا مركزة من 512 بكسل بكسل 256 عالية. انقر فوق '"إظهار خيارات مشغل الإخراج"' وتعيين كافة المشغلات إلى 'إيجابية'.
ملاحظة: دق يمكن أحياناً يغيب المشغلات TTL إذا كانوا 10 مللي ثانية أو أقل. - ضمان أن يتم تعيين 'المشغل 1' و '2 المشغل' إلى 'تعرض' بينما يتم تعيين 'المشغل 3' إلى 'برمجة' مع 'فترة' السيدة 25 تحت علامة التبويب 'تسلسل'، حدد '"الفاصل الزمني"' مع 'Delay1 الحقل' 50 مللي ثانية لجمع الصور في 20 هرتز. اختر 'حفظ"المخزن المؤقت".'
- في علامة التبويب 'التقاط' برنامج اقتناء الصورة (انظر الجدول للمواد)، التعرض لتعيين الوقت إلى 10 مللي ثانية، binning 4 x، وعمق الصورة إلى 16-بت. حدد صبري كاميرا مركزة من 512 بكسل بكسل 256 عالية. انقر فوق '"إظهار خيارات مشغل الإخراج"' وتعيين كافة المشغلات إلى 'إيجابية'.
- PMT كسب والليزر كثافة أثناء تصوير القناة ثلاثة [كنفوكل]
- تعيين كسب PMT حتى الأسفار الخلفية مستوى فقط أعلى من الحد الأدنى (مستوى أسود). زيادة قوة الليزر (الأخضر) نانومتر 561 حتى يحتفل بكسل مشبعة 12-بت أو 16-بت واحد في المحطة بريسينابتيك في قناة مشري.
- ضبط 488 نانومتر الليزر (الأزرق) الكثافة بحيث GCaMP5 fluorescence مرئياً فقط في المحطة presynaptic فوق الخلفية. يمنع هذا الإعداد منخفضة تشبع بكسل GCaMP5 عندما يزيد الأسفار في الاستجابة لقوى Ca2 + العابرين. فتح الثقب [كنفوكل] وصولاً إلى تحقيق أقصى قدر من التقاط الضوء.
3-راتيوميتريك Ca2 + تصوير وتسجيل السلوك
- ضمن علامة التبويب 'تسلسل' في برنامج اقتناء الأسفار، انقر فوق "ابدأ" لبدء التسجيل. مسار الدودة مع الجويستيك، الحفاظ على الخلايا والاشتباكات العصبية للفائدة في التركيز وفي مركز مجال الرؤية (FOV). انقر فوق الزر 'إحصائيات' في نافذة الرسم البياني لإظهار إحصائيات بكسل لكل قناة.
- ضبط السلطة الصمام لضمان الأسفار مشري واحد بكسل كحد أقصى في المحطة presynaptic من ≥ التهم 8,000 (~ فوتوليكترونس 4,000)، وإعطاء ~ 12 بت النطاق الديناميكي أعلاه الخلفية (~ فوتوليكترونس 100). إشارات GCaMP5 في المحطة presynaptic أثناء استراحة Ca (منخفض)2 + ينبغي أن يكون حول ~ 2,500 تعول--فقط تظهر فوق الخلفية.
- السجل حتى يتم التوصل إلى وضع البيض دولة نشطة؛ عادة ما يحدث هذا كل 20-30 دقيقة في البرية من نوع دودة7. حفظ مجموعة فرعية 10-مين (إطارات 12,001)، إطارات 6,000 قبل وبعد الحدث الأول وضع البيض (الإطار 6,001). من المؤكد أن تبقى نفس مجموعة فرعية من الصور برايتفيلد من دودة تيميبوينتس س وص المرحلة الموقف والسلوك، أو سيتم فقدان التزامن الدقيق للبيانات والجداول.
- استخدام إيماجيج والبرنامج المساعد بيوفورماتس (انظر الجدول للمواد) لتحويل تسلسل الصور إلى تنسيق الصورة الخلوي القياسية (.ics) بحيث يمكن استيرادها إلى البرنامج "كوانتيتاتيون راتيوميتريك".
4-صورة تجزئة وتحليل كمي
- استيراد تسلسل الصور إلى البرنامج "كوانتيتيشن راتيوميتريك" (انظر الجدول للمواد). انقر فوق '"على النقيض من السيارات"' في القائمة 'أدوات'، وضبط التباين لكل قناة لإنشاء الأسود المناسبة (~ 1,800) والأبيض مستويات (10,000). حدد '"تغيير الألوان"...' في القائمة أدوات للتأكد من أن مشري وتعيينات الألوان قناة GCaMP5 الصحيح (الشكل 4أ-ج).
- انقر على الحق في "السلسلة الزمنية" في علامة التبويب 'تسلسل' وتعيينها إلى إطارات 20/s و 1.25 ميكرومتر/بكسل.
- حدد 'نسبة' من القائمة 'أدوات' وحدد "GCaMP5" من أجل 'قناة A' و "متشيري" "القناة ب" '. انقر فوق "حساب" بجوار 'عتبة' طرح الخلفية من كل تسلسل الصور. حدد "تطبيق قوس قزح طرفية المستعملين المحليين على القناة نسبة".
ملاحظة: لتسجيل مع أساس يعني نسبة 0.3 (انخفاض Ca2 +) ونسبة الحد أقصى من 2-3 (ارتفاع Ca2 +)، جدول بحث مناسبة سيكون من 0 (أزرق) إلى 1 (أحمر). - إنشاء قناة "نسبة التضمين كثافة" استخدام القناة مشري (الشكل 4د). القناة "نسبة كثافة التضمين" صورة الملايين من الألوان حيث يتم تعيين اللون نسبة إلى سطوع القناة مشري.
- ضمن علامة التبويب 'القياسات'، إنشاء وضع بروتوكول البحث عن كائن بواسطة سحب أداة '"العثور على كثافة استخدام الكائنات"' إلى 'بروتوكول' الجزء. انقر فوق 'الترس' تعيين الإطار مشري قيم الكثافة والبحث عن الكائنات.
- حدد قيم كثافة ≥ 2 الانحرافات المعيارية (SD) أعلاه الخلفية (مثلاً، الحد الأدنى من ~ 2,500، الحد الأعلى من 65535). تأكد من أن يتم الكشف عن المحطة presynaptic وأن 'تلقائياً تحديث الملاحظات' المحدد من قائمة القياسات.
ملاحظة: البرنامج أيضا تعريف الكائنات بالانحراف المعياري بهم من الخلفية باستخدام بروتوكول ذات صلة '"كثافة التنمية المستدامة"'. ومع ذلك، إذا دخل كائن لا سيما مشرق فوف، هائلة يمكن تغيير كثافة يعني خلال هذه تيميبوينتس، التي تؤثر على سقف كثافة استخدامها للعثور HSN. لن يحدث هذا التغير إذا كان يتم استخدام قيم الكثافة الخام للعثور على كائنات.
- حدد قيم كثافة ≥ 2 الانحرافات المعيارية (SD) أعلاه الخلفية (مثلاً، الحد الأدنى من ~ 2,500، الحد الأعلى من 65535). تأكد من أن يتم الكشف عن المحطة presynaptic وأن 'تلقائياً تحديث الملاحظات' المحدد من قائمة القياسات.
- إضافة عوامل تصفية إضافية تستهدف فقط قناة مشري (حجم وكثافة ماكس و غيرها) إذا لزم الأمر لاستبعاد الكائنات غير مرغوب فيها مثل الرأس، والذيل، والقناة الهضمية الأسفار. حدد 'جعل' "قياس عنصر" من قائمة القياسات واختر '"تيميبوينتس جميع"'.
ملاحظة: سيتم تنفيذ هذا البروتوكول، وكتابة كافة القياسات إلى ملف قيمة مفصولة بفاصلة (.csv) الذي ينبغي أن يكون تم تصديرها باستخدام الأمر 'تصدير' في القائمة ملف. - فتح ملف exported.csv وانسخ ورقة جديدة تيميبوينت ومنطقة (ميكرومتر2) ويعني (نسبة القناة)، Centroid X (ميكرومتر) وبيانات Centroid Y (ميكرومتر). تصدير الملف a.csv بدون رؤوس الأعمدة. البرنامج "كوانتيتيشن راتيوميتريك" قد تصنف في خلية لمصلحة واحد أو أكثر من الكائنات في تيميبوينت.
- لإعادة تجميع هذه الكائنات، استخدام برنامج نصي مخصص 'AnalzyeGCaMP_2017.m'.
ملاحظة: البرنامج النصي أيضا يحدد Ca2 + (نسبة) قمم في البيانات، ويحفظ الملف a.csv تيميبوينتس وستريك ذروة، وذروة الأعراض. فإنه أيضا بإنشاء ملفات بوستسكريبت لآثار نسبة الخام والمشروح. مع هذه المعلومات، وينبغي تحديد Ca2 + عابر السعة والفاصل الزمني بين عابر.
- لإعادة تجميع هذه الكائنات، استخدام برنامج نصي مخصص 'AnalzyeGCaMP_2017.m'.
- إضافة إخراج س وقيم ص centroid من كل كائن الأسفار لقيم X و Y مسجل من قبل البرنامج النصي XY-المرحلة من المنمنمات. استخدام صافي موقف س وص لتوليد عملية تتبع الحركة دودة وحساب الخلية التشرد والسرعة التي تصاحب سلوك مختلف الدول31.
- استيراد الصور برايتفيلد مسجل في إيماجيج مكدس ظاهري. تعليم الأحداث وضع البيض والسلوكيات الأخرى. مقارنة توقيت هذه الأحداث إلى Ca2 + قمم من تتبع نسبة.
النتائج
تركيب بسيط الأسلوب الموصوفة هنا (الشكل 1) يسبب تغيرات طفيفة للبيئة الثقافة L4 والكبار C. ايليجانس بينما يسمح عالية الدقة تسجيل في سلوك الحيوانات من خلال ساترة زجاجية (الشكل 4). المزامنة من مصادر الضوء LED ووحدات تحكم مرحلة التعرض الكاميرا يسمح بالحصول على البيانات من تيارات متعددة في إطارات 20/s ليصل إلى حاء 1 متوسط التكبير (20 x) مع أهداف الفتحة العددية عالية (0.7-0.8) يوفر جيدة القرار المكانية المنطقة متشابك في حلبة سلوك وضع البيض، حتى مع 4 × 4 binning بكسل (1.25 بيكسل ميكرومتر). اكتساب متزامنة من GCaMP5 ومشري fluorescence إشارات (الشكل 4أ، ب) يستخدم لإنشاء قناة نسبة بكسل بكسل التي تعوض عن التغييرات في حركة الحيوانات والتركيز (الشكل 4د). المحطة HSN presynaptic كبيرا كما يمكن تصور العديد من الهيئات الخلايا العصبية في C. ايليجانس، والتغييرات في كاليفورنيا HSN presynaptic2 + وضوح. فوف كبير الكاميرا برايتفيلد الأشعة تحت الحمراء يسمح الدودة يدوياً يجب تعقبها أثناء تسجيل (الشكل 4ﻫ). لكل الحيوانات، يمكن أن يرتبط تغييرات في كاليفورنيا داخل الخلية2 + مع سلوكيات واضحة في تصوير برايتفيلد بما في ذلك الإفراج عن البيض، والتغيرات في الحركة (الشكل 4ه).
ويؤكد كوانتيتيشن HSN Ca2 + وسرعة أن الديدان تغيير هذه الحركة كما أنها تمر بمرحلة انتقالية إلى سلوك وضع البيض. وهناك اختلافات كبيرة في سرعة دودة قبل وأثناء وبعد الحالة النشطة وضع البيض (الشكل 5ألف). لا يحدث هذا بسبب الضوضاء الملازمة للتصوير أو تتبع النظام. التكبير في حدث واحد وضع البيض، نلاحظ قوي التغيير في الأسفار GCaMP5 (ΔF/و) قبل الحدث وضع البيض بينما مشري fluorescence نسبيا دون تغيير (الشكل 5ب). قياس التغيرات في نسبة GCaMP5:mCherry (ΔR/R) تظهر بوضوح كاليفورنيا HSN2 + عابر ~ 4 s قبل الإفراج عن البيض (الشكل 5ب). تزامنت مع تقلص العضلات فرجي، تباطؤ واضح للحركة دودة يحدث أن تنتهي مع البيض الإفراج. وقد أظهرت النتائج السابقة أن اتروبين VC الخلايا العصبية الحركية، التي هي معصب قبل هسنس، وتظهر ذروة النشاط أثناء تقلصات عضلة فرجي قوية والبيض الإصدار 8،،من1027. ونحن قد أظهرت أيضا أن التنشيط أوبتوجينيتيك من الخلايا العصبية الرأسمالي يدفع تباطؤ الفوري للحركة، مما يشير إلى أنه قد يتم تنشيط الخلايا العصبية VC بتقلص العضلات فرجي، وبالتالي تباطؤ الحركة حتى تلقي التغذية المرتدة للإفراج عن البيض27 .
التصوير ووصف نظام تتبع يسمح التصور المكاني المنظمة لسلوك وضع البيض (الشكل 5ج). كما سبق سيظهر، أدخل الديدان يدير المطرد للحركة إلى الأمام فقط قبل الدولة النشط32. الديدان يقضون معظم وقتهم في جمع العلف على البكتيريا في وسط القطعة أجار. قبل دخولها إلى الحالة النشطة، الديدان التحرك بعيداً عن المواد الغذائية، التي تزامنت مع ظهور نادر HSN Ca2 + العابرين. النشاط HSN ثم التحولات في إطلاق الاندفاع، مع عدة HSN Ca2 + العابرين المتقاربة التي تغذي الأحداث وضع البيض. الديدان ثم غالباً ما يستدير واستئناف الحركة إلى الأمام، وتضع بيضها في الطريق إلى الوراء نحو مركزها انطلاق القرب من البكتيريا OP50. ونحن نفترض أن التغييرات المحلية س2 و/أو تركيز CO2 قد يكون التأثير على حيث تقرر الديدان لوضع البيض33،34.
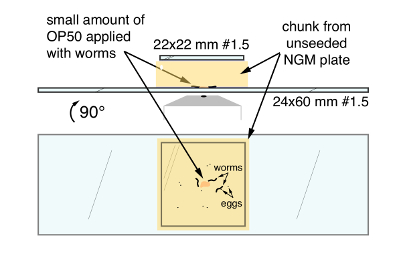
الشكل 1. C. ايليجانس تركيب تقنية لتصوير عالي الدقة لنشاط الدائرة وسلوك وضع البيض. في الأعلى، جبل النهائي من الجانب. أسفل، جبل النهائي كما تم عرضه من خلال الجزء السفلي من ساترة كبيرة. تشير الأسهم إلى الغذاء البكتيرية OP50 والديدان C. ايليجانس والبيض، تقع بين القطعة أجار NGM وساترة الكبيرة 24 × 60 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
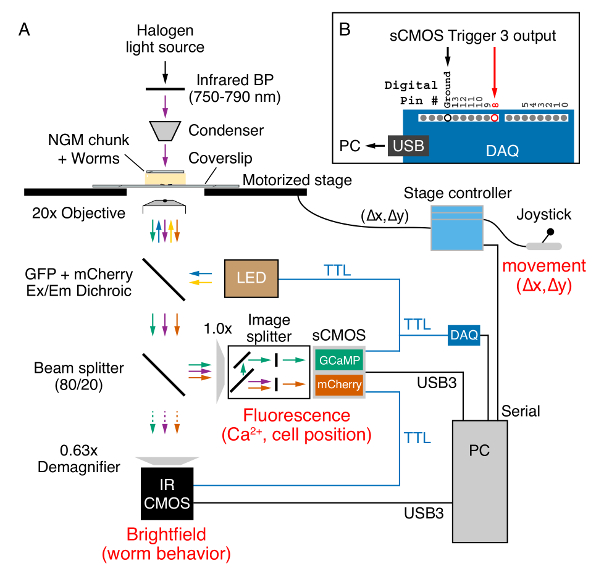
الشكل 2 . ويديفيلد راتيوميتريك Ca2 + تصوير وسلوك تسجيل على مجهر مقلوب ابيفلوريسسينسي. (أ) دودة موقف وسلوك يتم التقاطها في برايتفيلد عن طريق 20 × (0.8 غ) هدف الخطة--أبوتشرومات باستخدام الأشعة تحت الحمراء (750-790 nm) الضوء (الأرجواني السهام) المنبعثة من مصباح هالوجين عن طريق القطعة NGM. عصا والمرحلة يجهز وحدة تحكم يستخدم للحفاظ على الدودة في مجال الرؤية أثناء التسجيل. موقف المرحلة (Δx، Δy) يتم إرسالها إلى جهاز كمبيوتر بمنفذ تسلسلي. البروتينات GCaMP5 ومشري المعرب عنها في الدودة متحمسون استخدام 470 نانومتر (الأسهم الزرقاء) و 590 نانومتر (الأسهم الصفراء) "الصمامات الثنائية" التي ينبعث منها الضوء (LED). تنبعث GCaMP5 (الأسهم الخضراء) والأسفار مشري (الأسهم البرتقالية) جنبا إلى جنب مع ضوء الأشعة تحت الحمراء يمر من خلال مرآة مزدوج اللون فرقة متعددة (انظر الجدول للمواد). يرسل الفاصل شعاع من 80/20 20% الضوء من خلال ديماجنيفير 0.63 x لالتقاط على كاميرا CMOS حساسة للأشعة تحت حمراء (أرجواني سهم). يتم إرسال 80 في المائة المتبقية من الضوء عبر هذا الميناء الجانب المجهر إلى صورة الفاصل الذي يفصل في GCaMP5 وفصل الأسفار متشيري إلى نصفين كاميرا سكموس أثناء إزالة الضوء برايتفيلد الأشعة تحت الحمراء. يتم نقل البيانات من كل من الكاميرات إلى جهاز كمبيوتر عبر كابلات USB3. تستخدم منافذ المشغل من الكاميرا سكموس الفلورية (أزرق) لإرسال + 5V TTL مشغلات نظام إضاءة LED وكاميرا CMOS برايتفيلد الأشعة تحت الحمراء، وجهاز اكتساب الرقمية (دق). (ب) الزناد 3 إخراج إشارات TTL يتم الكشف عنها بواسطة دق على رقمي دبوس #8 وإرسالها إلى جهاز الكمبيوتر عبر اتصال USB. تؤدي هذه المدخلات الرقمية 'حيث XY' الأمر المسلسل من نصي برمجيات بونساي (س-المرحلة النهائي) الذي يقرأ X و Y موقف لكل GCaMP5/مشري fluorescence/الأشعة تحت الحمراء صورة القبض على المرحلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
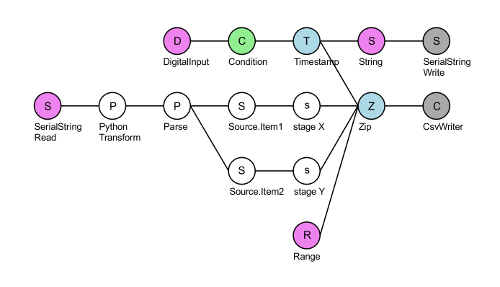
الشكل 3 : تخطيط البرنامج النصي الاتصال التسلسلي-المرحلة المنمنمات XY-المرحلة النهائي. أعلى العقدة ديجيتالينبوت (الوردي) يقرأ TTL المشغلات القادمة إلى دبوس #8 من دق. لكل إيجابية TTL الجهد (الأخضر)، دق يجعل الطابع زمني (الأزرق) وتكتب سلسلة '"حيث س وص"؟' (وردي) على وحدة تحكم المرحلة عبر المنفذ التسلسلي (رمادي). العقدة سيريالسترينجريد (الوردي) يقرأ X و Y تنسق استجابة من وحدة تحكم المرحلة. هذه السلسلة ثم يتم تحويلها إلى ميكرون وفصلها في X و Y إحداثيات المرحلة. وأخيراً، يتم الجمع بين هذه الجداول الأربعة باستخدام عقده الرمز بريدي (أزرق) وتتم كتابة ملف column.csv أربعة: عدد الإطارات TTL الإشارات الواردة (نطاق العقدة، وردي) واحداثيات X و Y، والفاصل الزمني بين تيميبوينتس اللاحقة (عادة ~ 50 مللي ثانية عندما تسجيل معدل 20 هرتز). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
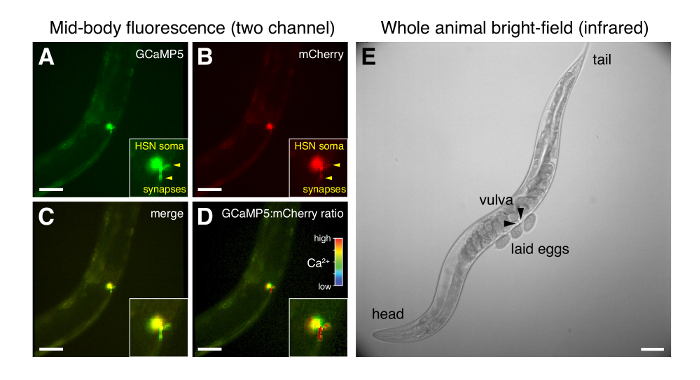
الشكل 4 : ميكروجرافس الممثل HSN الأسفار وبرايتفيلد كله الحيوان أثناء السلوك وضع البيض. (أ–د) تصوير راتيوميتريك واحد من GCaMP5 ومشري fluorescence في هسنس قبل الإفراج عن البيض. يتم الإشارة إلى HSN presynaptic تيرميني مع رؤوس الأسهم. (ج) دمج GCaMP5 ومشري fluorescence. (د) كثافة التضمين GCaMP5:mCherry نسبة؛ يشير إلى نسبة عالية (أحمر)-عالية داخل الخلية Ca2 + في المحطة بريسينابتيك (ﻫ) صورة برايتفيلد من دودة كاملة فقط بعد أن تم وضع البيض. تشير رؤوس الأسهم إلى النصفين الأمامي والخلفي للفرج من التي تزرع بيض. شريط مقياس لكل الصور هو 50 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 5 : تسجيل سرعة HSN Ca2 + والحركة خلال سلوك وضع البيض. (أ) آثار التغييرات نسبة GCaMP5:mCherry في الاستجابة إلى داخل الخلية Ca2 + العابرين (ΔR/R؛ الأحمر) جنبا إلى جنب مع سرعة لحظية دودة (ميكرومتر/s؛ الأزرق). يتم الإشارة إلى الأحداث وضع البيض برؤوس الأسهم. (ب) آثار مشري fluorescence (الأحمر؛ ΔF/F) ونسبة الأسفار GCaMP5:mCherry (أسود؛ ΔR/R)، الأسفار HSN GCaMP5 (الأخضر؛ ΔF/F) والدودة السرعة (الأزرق) حول لحظة الإفراج عن البيض. (ج) المكانية تنظيم سلوك وضع البيض والحركة أثناء تسجيل 10-دقيقة كاملة. تم الحصول على المسار دودة من المعلومات المرحلة XY الذي تمت إضافته إلى موقف centroid HSN التي تم الحصول عليها من تسجيل مشري fluorescence. يتم الإشارة إلى توقيت HSN العابرين (دوائر حمراء)، وأحداث وضع البيض (رؤوس سوداء)، وبداية ونهاية التسجيل (الماس الأخضر والأزرق). هو شريط مقياس 1 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
المتسلسلات:
لأن التعبير مشري قد تحسنت من خلال الإدراج كودون-التحسين وانترون (والأكثر توفرا جكامب الصحفيين لم) حقن ~ 4 × مقدار بلازميد معربا عن GCaMP5 لضمان مستويات مماثلة من الأسفار GCaMP5 خلال كاليفورنيا قوية 2 + العابرين. إنقاذ الطفرة lin-15(n765ts) يسمح لاسترداد السطحية من الحيوانات المحورة وراثيا بالحد الأدنى من الآثار على وضع البيض وغيره من السلوكيات35. وينبغي إدماج المتسلسلات لضمان تعبير موحد وتصوير الأوضاع بين الحيوانات المختلفة25. علامات الاختيار بما في ذلك مقاومة المضادات الحيوية36،37 والإنقاذ من ليثالس حساسة للحرارة38 ينبغي أن تعمل أيضا، ولكن، نظراً لأن الحيوانات غير المعدلة وراثيا ميتة، تأكيدا للتكامل التحوير و هوموزيجوسيتي أكثر صعوبة بالمقارنة مع علامات على أن هذا النمط الظاهري مرئية25. المهيمنة على علامات إعاقة الحركة الطبيعية وانخفاض اللياقة البدنية، مثل rol-6(dm)، ينبغي تجنب39. التصوير في لايت 1 خلفية متحولة أمر ضروري للحد استجابات الهروب الضوء الأزرق أثناء التصوير23،،من4041. كذلك قد تقليل طفرة إضافية ل غور-3، الذي يعمل بالتوازي مع آيت 1، السلوك المتبقية والتغيرات الفسيولوجية التي تسببها الضوء الأزرق42. مريح، غور-3، لايت 1، و لين-15 جميعا تقع في النصف الأيمن من كروموسوم إكس، التي ينبغي أن تبسط تشييد سلالات جديدة Ca2 + التصوير والتجارب أوبتوجينيتيك.
لأن التعرض لأوقات قصيرة، ويتم جمع الصور في 20 هرتز، يجب أن تكون إشارات GCaMP5 ومشري مشرق. والتفسير الأكثر احتمالاً صاخبة Ca2 + تسجيلات هو خافت fluorescence الناجمة عن التعبير مراسل ضعيفة. كما ينبغي أن المروجين معقولة محددة في المنطقة التي يجري تصويرها. لأن HSN خلايا الجسم ونهايات على عضلات فرجي في وسط الجسم، التعبير إضافية من المروج 3 البرمجة اللغوية العصبية في الرأس والذيل هو عادة خارج مجال الرؤية ويمكن استبعاد استخدام عوامل تصفية إضافية في برنامج "كوانتيتاتيون راتيوميتريك". للتأكد من أن يلاحظ التغيرات في GCaMP5 fluorescence نتيجة التغيرات الفعلية في كاليفورنيا داخل الخلية2 +والمتسلسلات التحكم معربا عن التجارة والنقل بدلاً من GCaMP5 ينبغي أن تكون مستعدة بشكل مستقل وحلل26. أحدث Ca2 + الصحفيين مع مختلف الحساسيات2 + Ca وحركية وألوان توسعت اختيار التصوير الأدوات المتاحة، ولكن ينبغي التصديق على كل مراسل جديد Ca2 +باستخدام--البديل الفلورسنت متحسسة14 ،16.
وسائل الإعلام:
وينبغي إعداد لوحات NGM للتصوير مع أجار عالية الجودة. انخفاض جودة أجار سوف لا تذوب تماما على التعقيم، تاركاً الجسيمات الصغيرة أن مبعثر الخفيفة أثناء التصوير، وتزايد الأسفار الخلفية. يمكن استخدام البيولوجيا الجزيئية الصف [اغروس] بدلاً من ذلك، ولكن ينبغي تخفيض المبلغ الذي أضيف إلى الحفاظ على ثبات لوحة يعادل.
مقارنات لتصاعد أساليب أخرى:
واستخدمت النهج السابقة للنشاط الصورة في حلبة سلوك وضع البيض الديدان المعطل تداولها مع الغراء لجهاز pad [اغروس]. تحت هذه الظروف، ونشاط الدائرة وسلوك وضع البيض لا يفضل دون تخفيض في وسائط الثقافة الاسموليه8،10،،من4445. تشير الدلائل الأخيرة إلى أن عدة دودة السلوكيات يتم التضمين بتحرك الدولة، مما يثير تساؤلات حول العلاقة من نشاط الخلايا التي لوحظت في الحيوانات المعطل تداولها إلى أن ينظر في التصرف بحرية الحيوانات. وقد أظهرنا مؤخرا أن نشاط الدائرة وضع البيض يتم تدريجيا بشكل غير متوقع مع الحركة26،27. وبالمثل، مجزأة Ca2 + إشارات في إينتيرنيورون ريا يدمج النشاط من الخلايا العصبية الحسية والخلايا العصبية الحركية الرأس أثناء جمع العلف حركات46. ويرافق السلوك التغوط أيضا تغيير دقة والنمطية في الحركة الذي يسمح للحيوانات إلى الابتعاد عن بقعة مساحات العلف قبل طرد النفايات47. معا، هذه النتائج تشير إلى أن التسجيلات موجزاً لنشاط الدائرة من الحيوانات المعطل تداولها قد تكون مختلفة جذريا عن تلك التي تم الحصول عليها في التصرف بحرية الحيوانات.
على الرغم من كونها مباشرة أسفل ساترة، السلوك للدودة يشبه ينظر في لوحات NGM القياسية. وضعت البيض سيتوجه إلى فتحه، وكمية صغيرة من المواد الغذائية التي أودعت يسمح L1 اليرقات أن تنمو لتصبح الكبار (البيانات لا تظهر). حجم القطعة أجار كبيرة تسمح بتبادل الغازات معقولة وتقاوم الجفاف، وعلى الرغم من أن الكثير من الطعام ستزيد fluorescence الخلفية. بينما يعمل هذا الأسلوب الأفضل للكبار، يمكن أيضا استخدام التقنية الصورة L4 الحيوانات. سمك الطبقة المائية بين القطعة وساترة غير أن هذه اليرقات أصغر يجدون صعوبة في الزحف، وغالباً ما يمكن الحصول على المحاصرين في أعقاب بالغ تتحرك.
وجود قيود على هذا الأسلوب المتصاعد أن التحفيز الميكانيكية أو الكيميائية مباشرة إلى مناطق محددة من الجسم صعبة. التطورات الأخيرة في تقنيات الإضاءة منقوشة تسمح للإثارة منفصلة من الرأس أو الذيل-أعرب عن أوبسينس الجرثومية مع إضاءة منفصلة والكشف عن جكامب/مشري fluorescence في ميدبودي48،49. كنتيجة لذلك، قد يكون من الممكن للتغلب على هذه المشكلة باستخدام النهج أوبتوجينيتيك.
مقارنات أخرى Ca 2 + التصوير النهج:
هذا الأسلوب يعمل بشكل جيد جداً لتسجيل التغييرات في هيولى Ca2 + من واحدة، تحل الخلايا ومناطقها متشابك. التصوير في الوقت الحقيقي، والحجمي للخلايا العصبية في الرأس قد حققت في الآونة الأخيرة استخدام موقف نويات الخلايا لتحديد الخلايا وكوانتيتاتي التغييرات في الكالسيوم نوكليوبلاسميك50،،من5152. العلاقة بين النووي ومتشابك Ca2 + لا يزال غير واضح. تشير البيانات المتوفرة لدينا تحدث التغييرات الأكثر بروزا في HSN داخل الخلية Ca2 + في تيرميني presynaptic بعيداً عن سوما الخلية (الشكل 4). تيرميني بريسينابتيك HSN والخلايا العصبية الرأسمالي تكمن في عضلات فرجي بوستسينابتيك26. ليس من الواضح ما إذا كان سيكون هناك قرار كافية في البعد Z حتى مع الغزل القرص أو تقنيات الورقة الخفيفة نسند presynaptic Ca2 + إشارات إلى الخلايا المحددة دون الاعتماد على نحو ما على الكالسيوم جسدية لتحديد الخلية . باستخدام التقنيات الموضحة هنا، من كل 10 دقيقة، و 256 × 256 بكسل 16 بت الصور TIFF ثنائي القناة التسجيل مع 12,001 ~ 4 غيغابايت. نسبة التضمين نسبة وكثافة القنوات مضاعفة حجم الملف إلى ~ 8 غيغابايت. تجربة نموذجية تسجيل الحيوانات 10 من كل واحد من اثنين من الأنماط الجينية (البرية من نوع والتجريبية) يولد ما يقرب من 150 غيغابايت من البيانات الأولية ويتطلب 20 ح لجمع وتحليل. التحليل الحجمي مع 10 شرائح زي كل تيميبوينت يتطلب أمر من حجم المزيد من البيانات والوقت التحليلية، تشرح لماذا عدد قليل جداً من هذه الدراسات قد اكتملت.
الأجهزة:
ونحن تسجيل وتحليل تسلسل الصور على محطات عمل معالج ثنائي مع الأداء العالي بطاقات الرسومات (مثل الألعاب)، 64 جيجابايت من ذاكرة الوصول العشوائي، ومحركات الأقراص الصلبة عالية الأداء (انظر الجدول للمواد). ينبغي أن البيانات المخزنة على الشبكة صفيف مكرر من الأقراص المستقلة (RAID) واحتياطيا إلى السحابة في مركز بيانات خارج الموقع.
ونحن نوصي باستخدام high-power وتحديدالمنطقه المصابيح للإثارة fluorescence نابض على هاليد معدني أو مصادر الضوء على أساس الزئبق. وتتوفر عدة نظم LED متعددة الألوان المتاحة تجارياً. بينما لبعض هذه الأنظمة LED ارتفاع تكلفة مقدما، لديهم حياة طويلة (> 20,000 ح)، ويمكن في نفس الوقت تثير fluorophores مختلفة أربعة أو أكثر، وعرض التحكم الزمني دقيقة باستخدام التسلسلي و/أو واجهة TTL مع الكمون المنخفض (10-300 المايكروثانيه التبديل الوقت). تحريك يضمن أن العينة هي مضيئة فقط عندما فعلا ويتم جمع البيانات. ونحن عادة استخدام تعرض 10 مللي ثانية كل 50 مللي (معدل واجب 20%). وهذا يقلل من الضيائية والضبابية أثناء التقاط الصورة، وكما ذكر سابقا43.
نحن نستخدم كاميرات سكموس للسرعة ومجموعة كبيرة صغيرة وحساسة بكسل. كاميرا CCD م بديلاً أكثر تكلفة، ولكن يمكن أن ينتج تأثيرات 'لوم' فوتوليكترونس القبض على تسرب في البيكسلات المتقابلة. جديدة مضيئة في الظهر سكموس الكاميرات لديها حساسية مماثلة لتوخي م تكلفة مخفضة إلى حد كبير. بغض النظر عن تستخدم فيها أجهزة الاستشعار، قنوات GCaMP5 ومشري يجب الحصول عليها في وقت واحد. التقاط متسلسلة في تحريك الديدان تؤدي إلى الصور المسجلة سيئة غير صالحة كوانتيتاتيون راتيوميتريك. يمكن إنجاز تصوير قناة مزدوجة على كاميرا واحدة بعد تقسيم القنوات مستخدماً صورة الخائن (الشكل 2) أو باستخدام اثنين من الكاميرات متطابقة. ويوصي بالنطاق الديناميكي لصور 16 بت أكثر صور 8-بت كوانتيتيشن راتيوميتريك دقيقة. لصور برايتفيلد لسلوك دودة، ونحن التقاط باستخدام كاميرا النائب تلبيتها 1، 4، 1 USB3 القريبة من الأشعة تحت حمراء لالتقاط إهمال تسلسل الصور 8-بت 1,024 x 1,024 2 × 2 كبيرة بعد ضغط JPEG. فوف الكبيرة المتاحة في أحدث مجهر نماذج يسمح دودة الكبار تصور في 20 x بعد ديماجنيفيكيشن 0.63 x مع التظليل طفيف فقط (4E الشكل).
نوصي باستخدام إشارات الجهد TTL القياسية لمزامنة الإضاءة والتقاط. بسبب احتمال الاختفاء في مختلف البرامج، نوصي المستخدمين تكوين الكاميرا الأسفار مع النواتج المشغل الرئيسي مع النواتج TTL قيادة كافة الأجهزة الأخرى. وبهذه الطريقة، سيتم جمع المعلومات موقف برايتفيلد والمرحلة لكل Ca2 + القياس.
الشق-أو رنانة مجاهر [كنفوكل] مسح نقطة توجد عادة في مرافق مشتركة [كنفوكل] أيضا تعطي أداء ممتاز خلال راتيوميتريك Ca2 + تصوير. يمكن استخدام هذه الأدوات للقبض على اثنين أو أكثر من القنوات fluorescence جنبا إلى جنب مع برايتفيلد24. وفي هذه الحالة، يجب فتح الثقب [كنفوكل] إلى قطرها الأقصى، وينبغي أن تستخدم جهاز كشف طيفية لفصل GCaMP5، مشري، وإشارات الأشعة تحت الحمراء برايتفيلد. وهذا يزيد من جمع الضوء من سميكة (~ 20 ميكرومتر) شريحة بينما لا يزال تسمح رفض الأسفار خارج نطاق التركيز. الجانب السلبي واحد هو أصغر فوف ومزيد من القيود للأجهزة وبرامج التخصيص.
البرمجيات:
معظم الشركات المصنعة للسفينة وتثبيت كاميرات، والمجاهر مع البرمجيات المسجلة الملكية، بما في ذلك تكوين التسبب في المدخلات والمخرجات. يمكن أن تختلف الميزات والأداء من هذا البرنامج أثناء التسجيل. لأن تتحرك بسرعة الديدان يمكن أن يكون تحديا لتعقب، صورة العرض أثناء التسجيل يجب أن يكون سلسا ومستقرا في 20 هرتز. لتحسين الأداء، حفظ تسلسل الصور يمكن يكون مؤقتاً في ذاكرة الوصول العشوائي مع المجموعات الفرعية ذات الصلة سلوكيا المحفوظة في نهاية التجربة. يمكن تحويل هذه الملفات تسلسل ثنائي القناة الصورة إلى تنسيق الصورة الخلوي القياسية المفتوحة (.ics) لاستيراد البرمجيات "كوانتيتيشن راتيوميتريك". OME-TIFF تنسيق صورة المصدر المفتوح أكثر حداثة، على الرغم من أن منشآت مختلفة قد تكون غير قادر على حفظ تسلسل الصور TIFF أكبر من 4 غيغا بايت.
هو سمة رئيسية لخط الأنابيب كوانتيتيشن الجيل من القناة نسبة، ومن ثم إجراء تجزئة صورة غير منحازة استخدام مشري fluorescence للبحث عن الخلايا ذات الاهتمام. من كل كائن تم العثور عليه، يعني حجم الكائن وموقف centroid س وص، والحد الأدنى، ويتم حساب قيم الكثافة الأسفار كحد أقصى لكل قناة (بما في ذلك القناة نسبة). معا، هذه القيم تستخدم كوانتيتاتي التغييرات في داخل الخلية Ca2 + في كل تيميبوينت في التسجيل. ثم يتم تصدير كائن قياسات لكل تيميبوينت كملف a.csv للتحاليل اللاحقة.
حد رئيسية بروتوكول الموصوفة هنا هو الاعتماد على نقل البيانات في أشكال مختلفة من خلال خليط من منتجات البرمجيات. تهيج إضافية أن بعض البرامج مفتوحة المصدر وحرة بينما الغير مغلقة ومكلفة وتحديث غير متكافئ. سيكون تحسنا كبيرا استخدام أو وضع قطعة واحدة من البرمجيات (ومن الناحية المثالية المفتوحة المصدر) التي توفر مستويات مماثلة من الأداء وسهولة الاستخدام من اقتناء للتحليل. وكما لوحظ أعلاه، تحليل راتيوميتريك الزوجي كل من حجم الملف والوقت المطلوب لإكمال تجربة. جيل من برامج تشغيل الكاميرا التي يمكن دمجها في أطر قابلة للتخصيص المستخدم مثل المنمنمات ستسمح الصور وأخرى دفق البيانات التي تم جمعها وتحليلها في الوقت الحقيقي، وإلى حد كبير تحسين الإنتاجية.
آفاق المستقبل:
في حين أننا عادة ما تتبع حركات الدودة يدوياً، تتبع centroid دودة الكشف بالأشعة تحت الحمراء مشرق--الظلام--حقل أو تسجيلات ينبغي أن تسمح بصورة إضافية معالجة العقد التي توفر حلقة مغلقة التكيف للموقف المرحلة والآلي تتبع (الشكل 3 والمعطيات غير معروضة). معظم التسجيلات الأسفار التي تم الحصول عليها بهذه الطريقة مظلمة وخالية من بيولوجيا للاهتمام البيانات. تقنيات أن المحاصيل تسلسل الصور للكائنات ذات الصلة معالجة الصور بعد الحصول على جهاز استشعار أو في الوقت الحقيقي تسمح بزيادة القرار المكانية والتعجيل بأنابيب تحليل البيانات، لا سيما إذا جمعت Z-شرائح إضافية لكل تيميبوينت تصور النشاط داخل جميع الخلايا السابقة وبوستسينابتيك في الدائرة.
Disclosures
الكتاب يعلن وجود لا تضارب في المصالح.
Acknowledgements
تم تمويل هذا العمل بمنحه من نيندس لل KMC (R01 NS086932). وأيد لمن على منحة من برنامج البعثة NIGMS (R25 GM076419). السلالات المستخدمة في هذه الدراسة C. ايليجانس مركز علم الوراثة، والذي يموله مكتب المعاهد الوطنية للصحة "برامج الهياكل الأساسية للبحوث" (P40 OD010440). ونحن نشكر جيمس بيكر وميسون كلاين لإجراء مناقشات مفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| C. elegans growth, cultivation, and mounting | |||
| Escherichia coli bacterial strain, OP50 | Caenorhabditis Genetic Center | OP50 | Food for C. elegans. Uracil auxotroph. E. coli B. Biosafety Level 1 |
| HSN GCaMP5+mCherry worm strain | Caenorhabditis Genetic Center | LX2004 | Integrated transgene using nlp-3 promoter to drive GCaMP5 and mCherry expression in HSN. Full genotype: vsIs183 [nlp-3p::GCaMP5::nlp-3 3'UTR + nlp-3p::mCherry::nlp-3 3'UTR + lin-15(+)], lite-1(ce314), lin-15(n765ts) X |
| lite-1(ce314), lin-15(n765ts) mutant strain for transgene preparation | author | LX1832 | Strain for recovery of high-copy transgenes after microinjection with pL15EK lin-15(n765ts) rescue plasmid. Also bears the linked lite-1(ce314) mutation which reduces blue-light sensitivity. Available from author by request |
| pL15EK lin-15a/b genomic rescue plasmid | author | pL15EK | Rescue plasmid for recovery of transgenic animals after injection into LX1832 lite-1(ce314), lin-15(n765ts) X strain. Available from author by request |
| pKMC299 plasmid | author | pKMC299 | Plasmid for expression of mCherry in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| pKMC300 plasmid | author | pKMC300 | Plasmid for expression of GCaMP5 in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| Potassium Phosphate Monobasic | Sigma | P8281 | For preparation of NGM plates |
| Potassium Phosphate Dibasic | Sigma | P5655 | For preparation of NGM plates |
| Magnesium Sulfate Heptahydrate | Amresco | 0662 | For preparation of NGM plates |
| Calcium Chloride Dihydrate | Alfa Aesar | 12312 | For preparation of NGM plates |
| Peptone | Becton Dickinson | 211820 | For preparation of NGM plates |
| Sodium Chloride | Amresco | 0241 | For preparation of NGM plates |
| Cholesterol | Alfa Aesar | A11470 | For preparation of NGM plates |
| Agar, Bacteriological Type A, Ultrapure | Affymetrix | 10906 | For preparation of NGM plates |
| 60 mm Petri dishes | VWR | 25384-164 | For preparation of NGM plates |
| 24 x 60 mm micro cover glasses, #1.5 | VWR | 48393-251 | Cover glass through which worms are imaged |
| 22 x 22 mm micro cover glasses, #1 | VWR | 48366-067 | Cover glass that covers the top of the agar chunk |
| Stereomicroscope with transmitted light base | Leica | M50 | Dissecting microscope for worm strain maintenance, staging, and mounting |
| Platinum iridium wire, (80:20), 0.2mm | ALFA AESAR | AA39526-BW | For worm transfer |
| Calcium imaging microscope | |||
| Anti-vibration air table | TMC | 63-544 | Micro-g' Lab Table 30" x 48" anti-vibration table with 4" CleanTop M6 on 25mm top |
| Inverted compound microscope | Zeiss | 431007-9902-000 | Axio Observer.Z1 inverted microscope |
| Sideport L80/R100 (3 position) | Zeiss | 425165-0000-000 | To divert 20% of output to brightfield (CMOS) camera, 80% to fluorescence (sCMOS) camera |
| Tilt Back Illumination Carrier | Zeiss | 423920-0000-000 | For infrared/behavior imaging |
| Lamphousing 12V/100W w/ Collector | Zeiss | 423000-9901-000 | For infrared/behavior imaging |
| Halogen lamp 12V/100W | Zeiss | 380059-1660-000 | For infrared/behavior imaging. White-light LEDs do not emit significant infrared light, so they will not allow brightfield imaging after the infrared bandpass filter |
| 32 mm Infrared bandpass filter (750-790 nm) for Halogen lamp | Zeiss | 447958-9000-000 | BP 750-790; DMR 32mm, for infrared illumination for brightfield and behavior |
| 6-filter Condenser Turret (LD 0.55 H/DIC/Ph), Motorized | Zeiss | 424244-0000-000 | For infrared/behavior imaging |
| Condenser & Shutter | Zeiss | 423921-0000-000 | For infrared/behavior imaging |
| Binocular eyepiece with phototube for infrared CMOS camera | Zeiss | 425536-0000-000 | For infrared/behavior imaging |
| Eyepiece 10x, 23mm | Zeiss | 444036-9000-000 | For worm localization on the agar chunk |
| C-Mount Adapter 2/3" 0.63x demagnifier | Zeiss | 426113-0000-000 | Mount for infrared CMOS camera |
| CMOS camera for infrared brightfield and behavior (1" sensor) | FLIR (formerly Point Grey Research) | GS3-U3-41C6NIR-C | Camera for brightfield imaging |
| USB 3.0 Host Controller Card | FLIR (formerly Point Grey Research) | ACC-01-1202 | Fresco FL1100, 4 Ports |
| 8 pins, 1m GPIO Cable, Hirose HR25 Circular Connector | FLIR (formerly Point Grey Research) | ACC-01-3000 | Cable for TTL triggering. The green wire connects to GPIO3 / Pin 4 and the brown wire connects to Ground / Pin 5 |
| Plan-Apochromat 20x/0.8 WD=0.55 M27 | Zeiss | 420650-9901-000 | Best combination of magnification, numerical aperture, and working distance |
| 6-cube Reflector Turret, Motorized | Zeiss | 424947-0000-000 | For fluorescence imaging |
| Fluorescence Light Train, Motorized | Zeiss | 423607-0000-000 | For fluorescence imaging |
| Fluorescence Shutter | Zeiss | 423625-0000-000 | For fluorescence imaging |
| GFP and mCherry dual excitation and emission filter cube (for microscope) | Zeiss | 489062-9901-000 | FL Filter Set 62 HE BFP+GFP+HcRed for fluorescence imaging |
| LED illumination system | Zeiss | 423052-9501-000 | Triggerable Colibri.2 LED system for fluorescent illumination |
| GFP LED module (470 nm) | Zeiss | 423052-9052-000 | Colibri.2 LED for GFP fluorescence excitation |
| mCherry LED module (590 nm) | Zeiss | 423052-9082-000 | Colibri.2 LED for mCherry fluorescence excitation |
| Iris stop slider for incident-light equipment | Zeiss | 000000-1062-360 | Field aperture iris to limit LED illumination to the camera field of view |
| C-Mount Adapter 1" 1.0x | Zeiss | 426114-0000-000 | Adapter for image-splitter and sCMOS fluorescence camera |
| Image splitter | Hamamatsu | A12801-01 | Gemini W-View, other image splitters may be used, but they may not be optimized for the large sensor size of the sCMOS cameras |
| GFP / mCherry dichroic mirror (image splitter) | Semrock | Di02-R594-25x36 | Splitting GCaMP5 from mCherry and infrared signals |
| GFP emission filter (image splitter) | Semrock | FF01-525/30-25 | Capturing GCaMP5 fluorescence |
| mCherry/ emission filter (image splitter) | Semrock | FF01-647/57-25 | This filter is necessary to exclude the infrared light used for brightfield imaging |
| sCMOS camera for fluorescence (1" sensor) | Hamamatsu | A12802-01 / C11440-22CU | Orca FLASH 4.0 V2. Newer models allow for separate image acquisition settings on separate halves of the sensor, allowing acquisition of two-channel images in combination with an image splitter |
| Motorized XY Stage | Märzhäuser | SCAN IM 130 x 100 | Stage movement; the XY resolution of this stage is 0.2µm per step |
| XY Stage controller with joystick | LUDL | MAC6000, XY joystick | Manual tracking of worms. MAC6000 controller should be connected to the PC through the serial (RS-232) port configured to 115200 baud |
| Digital Acquisition board (DAQ) | Arduino | Uno | Receiving TTL triggers from sCMOS camera. The Uno should be loaded with the standard Firmata package, and the computer USB port configured to 57600 baud |
| BNC Male to BNC Male Cable - 6 ft | Hosa Technology | HOBB6 | BNC connectors for TTL triggering |
| Gold-Plated BNC Male to SMA male coaxial cable (8.8") | uxcell | 608641773651 | To connect the fluorescence camera trigger outputs |
| BNC turn head adapter | Hantek | RRBNCTH21 | BNC to Banana Plug Adapter (4mm) |
| BNC female to female connector | Diageng | 20130530009 | Female to female BNC adapter to connect the BNC output from the camera to the Banana Plug |
| Solderless flexible breadboard jumper wires | Z&T | GK1212827 | To connect the BNC trigger outputs to the Arduiono DAQ. Male to male. |
| High performace workstation | HP | Z820 | Windows 7, 64GB RAM, Dual Xeon processor, solid state C: drive, serial (RS-232) port, multiple PCIe3 slots for ethernet connectivity, USB 3.0 cards, and additional solid state drives |
| M.2 Solid state drive | Samsung | MZ-V5P512BW | High-speed streaming and analysis of image data |
| M.2 Solid state drive adapter for workstations | Lycom | DT-120 | M.2 to PCIe 3.0 4-lane adapter |
| Network attached storage | Synology | DS-2415+ | Imaging data storage and analysis |
| Hard disk drives | Western Digital | WD80EFZX | RED 8 TB, 5400 RPM Class SATA 6 Gb/s 128MB Cache 3.5 Inch. Storage of imaging data (10 drives + 2 drive redundancy) |
| Software | |||
| Fluorescence Acquisition | Hamamatsu | HCImage DIA | Recording of two channel (GCaMP5 and mCherry) fluorescence image sequences at 20 fps |
| Brightfield Acquisition | FLIR (formerly Point Grey Research) | Flycapture | Recording of brightfield JPEG image sequences |
| Stage Serial Port Reader | Bonsai | https://bitbucket.org/horizongir/bonsai | Facilitates tracking of worms during behavior |
| LED controller software | Zeiss | Micro Toolbox Test 2011 | To set up the intensity and trigger inputs for the different LEDs in the Colibri.2 unit |
| ImageJ | NIH | https://imagej.net/Fiji/Downloads | Simple review of image sequences and formatting changes for import into Ratiometric Quantitation software |
| Excel | Microsoft | 2002984-001-000001 | For generating subsets of comma-separated value data from Volocity for MATLAB analysis |
| Peak Finding | MATLAB | R2017a | Script used for Ratio peak feature calculations |
| Ratiometric Quantitation | Perkin Elmer | Volocity 6.3 | Facilitates calculation of ratiometric image channels, image segmentation for object finding, and ratio measurement of found objects |
| Scripts | |||
| XY-stage-final.bonsai | Bonsai | TTL-triggered DAQ and stage position serial port reader | Records X and Y stage position (in microns) when the attached Arduino receives a positive TTL signal from sCMOS camera during frame exposure. Script writes a .csv file with four columns: frame number, X position (microns), Y position (microns), and the time elapsed between frames (typically ~50 msec when recording at 20 fps). X and Y stage position from this output (columns 2 and 3, respectively) are added to the X and Y centroid positions from the AnalyzeGCaMP_2017.m MATLAB script (columns 4 and 5, respectively), to give the final X and Y position of the fluorescent object for the recording. |
References
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Phil Trans R. Soc. 314, 1-340 (1986).
- Bargmann, C. I. Neurobiology of the Caenorhabditis elegans genome. Science. 282, 2028-2033 (1998).
- Piggott, B. J., Liu, J., Feng, Z., Wescott, S. A., Xu, X. Z. S. The neural circuits and synaptic mechanisms underlying motor initiation in C. elegans. Cell. 147, 922-933 (2011).
- Chung, S. H., Sun, L., Gabel, C. V. In vivo neuronal calcium imaging in C. elegans. J. Vis. Exp. JoVE. , (2013).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Desai, C., Garriga, G., McIntire, S. L., Horvitz, H. R. A genetic pathway for the development of the Caenorhabditis elegans HSN motor neurons. Nature. 336, 638-646 (1988).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21, 203-214 (1998).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C. elegans egg-laying behavior. Curr. Biol. CB. 18, 1445-1455 (2008).
- Shyn, S. I., Kerr, R., Schafer, W. R. Serotonin and Go modulate functional states of neurons and muscles controlling C. elegans egg-laying behavior. Curr. Biol. CB. 13, 1910-1915 (2003).
- Zhang, M., Schafer, W. R., Breitling, R. A circuit model of the temporal pattern generator of Caenorhabditis egg-laying behavior. BMC Syst. Biol. 4, 81 (2010).
- Kerr, R. A., Schafer, W. R. Intracellular Ca2+ imaging in C. elegans. Methods Mol. Biol. Clifton NJ. 351, 253-264 (2006).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. Off. J. Soc. Neurosci. 32, 13819-13840 (2012).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nat. Methods. 12, 64-70 (2015).
- Oheim, M., et al. New red-fluorescent calcium indicators for optogenetics, photoactivation and multi-color imaging. Biochim. Biophys. Acta. 1843, 2284-2306 (2014).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Kim, C. K., Adhikari, A., Deisseroth, K. Integration of optogenetics with complementary methodologies in systems neuroscience. Nat. Rev. Neurosci. 18, 222-235 (2017).
- Storace, D., et al. Toward Better Genetically Encoded Sensors of Membrane Potential. Trends Neurosci. 39, 277-289 (2016).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Mello, C., Fire, A. DNA transformation. Methods Cell Biol. 48, 451-482 (1995).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J. Vis. Exp. JoVE. , (2008).
- Clark, S. G., Lu, X., Horvitz, H. R. The Caenorhabditis elegans locus lin-15, a negative regulator of a tyrosine kinase signaling pathway, encodes two different proteins. Genetics. 137, 987-997 (1994).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6, 198 (2008).
- Thapaliya, E. R., et al. Bioimaging with Macromolecular Probes Incorporating Multiple BODIPY Fluorophores. Bioconjug. Chem. 28, 1519-1528 (2017).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. J. Vis. Exp. JoVE. , e50773 (2013).
- Collins, K. M., Koelle, M. R. Postsynaptic ERG Potassium Channels Limit Muscle Excitability to Allow Distinct Egg-Laying Behavior States in Caenorhabditis elegans. J. Neurosci. Off. J. Soc. Neurosci. 33, 761-775 (2013).
- Collins, K. M., et al. Activity of the C. elegans egg-laying behavior circuit is controlled by competing activation and feedback inhibition. eLife. 5, e21126 (2016).
- Li, P., Collins, K. M., Koelle, M. R., Shen, K. LIN-12/Notch signaling instructs postsynaptic muscle arm development by regulating UNC-40/DCC and MADD-2 in Caenorhabditis elegans. eLife. 2, 00378 (2013).
- Banerjee, N., Bhattacharya, R., Gorczyca, M., Collins, K. M., Francis, M. M. Local neuropeptide signaling modulates serotonergic transmission to shape the temporal organization of C. elegans egg-laying behavior. PLoS Genet. 13, 1006697 (2017).
- Lopes, G., et al. Bonsai: an event-based framework for processing and controlling data streams. Front. Neuroinformatics. 9, 7 (2015).
- Flavell, S. W., et al. Serotonin and the neuropeptide PDF initiate and extend opposing behavioral states in C. elegans. Cell. 154, 1023-1035 (2013).
- Hardaker, L. A., Singer, E., Kerr, R., Zhou, G., Schafer, W. R. Serotonin modulates locomotory behavior and coordinates egg-laying and movement in Caenorhabditis elegans. J. Neurobiol. 49, 303-313 (2001).
- Ringstad, N., Horvitz, H. R. FMRFamide neuropeptides and acetylcholine synergistically inhibit egg-laying by C. elegans. Nat. Neurosci. 11, 1168-1176 (2008).
- Hallem, E. A., et al. Receptor-type guanylate cyclase is required for carbon dioxide sensation by Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 108, 254-259 (2011).
- Tanis, J. E., Moresco, J. J., Lindquist, R. A., Koelle, M. R. Regulation of serotonin biosynthesis by the G proteins Galphao and Galphaq controls serotonin signaling in Caenorhabditis elegans. Genetics. 178, 157-169 (2008).
- Giordano-Santini, R., et al. An antibiotic selection marker for nematode transgenesis. Nat. Methods. 7, 721-723 (2010).
- Semple, J. I., Garcia-Verdugo, R., Lehner, B. Rapid selection of transgenic C. elegans using antibiotic resistance. Nat. Methods. 7, 725-727 (2010).
- Granato, M., Schnabel, H., Schnabel, R. pha-1, a selectable marker for gene transfer in C. elegans. Nucleic Acids Res. 22, 1762-1763 (1994).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C.elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10, 3959-3970 (1991).
- Gong, J., et al. The C. elegans Taste Receptor Homolog LITE-1 Is a Photoreceptor. Cell. 167, 1252-1263 (2016).
- Liu, J., et al. C. elegans phototransduction requires a G protein-dependent cGMP pathway and a taste receptor homolog. Nat. Neurosci. 13, 715-722 (2010).
- Bhatla, N., Horvitz, H. R. Light and hydrogen peroxide inhibit C. elegans Feeding through gustatory receptor orthologs and pharyngeal neurons. Neuron. 85, 804-818 (2015).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 110, 4266-4273 (2013).
- Zang, K. E., Ho, E., Ringstad, N. Inhibitory peptidergic modulation of C. elegans serotonin neurons is gated by T-type calcium channels. eLife. 6, (2017).
- Branicky, R., Miyazaki, H., Strange, K., Schafer, W. R. The voltage-gated anion channels encoded by clh-3 regulate egg laying in C. elegans by modulating motor neuron excitability. J. Neurosci. Off. J. Soc. Neurosci. 34, 764-775 (2014).
- Hendricks, M., Ha, H., Maffey, N., Zhang, Y. Compartmentalized calcium dynamics in a C. elegans interneuron encode head movement. Nature. 487, 99-103 (2012).
- Nagy, S., Huang, Y. -. C., Alkema, M. J., Biron, D. Caenorhabditis elegans exhibit a coupling between the defecation motor program and directed locomotion. Sci. Rep. 5, 17174 (2015).
- Leifer, A. M., Fang-Yen, C., Gershow, M., Alkema, M. J., Samuel, A. D. T. Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nat. Methods. 8, 147-152 (2011).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nat. Methods. 8, 153-158 (2011).
- Kato, S., et al. Global brain dynamics embed the motor command sequence of Caenorhabditis elegans. Cell. 163, 656-669 (2015).
- Nguyen, J. P., et al. Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 113, 1074-1081 (2016).
- Toyoshima, Y., et al. Accurate Automatic Detection of Densely Distributed Cell Nuclei in 3D Space. PLOS Comput. Biol. 12, 1004970 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved